氨基胍对白介素-1β损伤的离体大鼠胰岛细胞的保护作用
作者:陈宏 蔡德鸿 王梅△ 刘宏 叶仁青
单位:陈 宏 蔡德鸿 王 梅△ 刘 宏 叶仁青 第一军医大学附属珠江医院内分泌科 △呼吸科(广州 510282)
关键词:白细胞介素-1;一氧化氮;胰岛
氨基胍对白介素 摘 要 目的:观察氨基胍(AG)对白细胞介素-1β(IL-1β )诱导的胰岛细胞损害的作用。方法:应用体外单层培养的大鼠胰岛细胞, 分别检测IL-1β、AG及其联合对胰岛细胞亚硝酸盐生成、胰岛素分泌以及胞内DNA、胰岛素 含量和细胞活性的影响。结果:以IL-1β诱导,胰岛细胞亚硝酸盐生成量显著增加;同时胰岛素基 础分泌以及葡萄糖刺激的胰岛素释放均明显减少;胰岛细胞内DNA、胰岛素含量及细胞活性( MTT值)均显著下降(均P<0.01);AG能阻断这些抑制效应(均P<0.01)。 结论:IL-1β通过一 氧化氮(NO)介导对胰岛细胞有细胞活性抑制和毒性效 应。AG可能是一种有效的iNOS抑制剂,通过阻断NO生成起到细胞保护作用。
, 百拇医药
The protective effects of aminoguanidine against interleukin-1β -induced
destruction of isolated rat pancreatic islets of Langerhans
CHEN Hong, CAI De-Hong, WANG Mei, LIU Hong, YE Ren-Qing
Department of Endocrinology, Zhujiang Hospital, The First Military Medica l University, Guangzhou(510282)
Abstract AIM:The effects of aminoguanidine (AG) on interleuki n -1β-induced destruction of isolated rat pancreatic islets of Langerhans were ob seved. METHODS:Isolated pancreatic islet cells from SD rat were c u ltured in monolayer in vitro. Nitrite production, insulin release, islet cel l DNA and insulin content, and cell activity (MTT assay) in rat pancreatic islet cells incubated with IL-1β, AG, singly and in combination, were measured. RESULTS:IL-1β induced a significant increase in nitrite produtio n, inhibited the medium insulin accumulation and the glucose-stimulated insulin release, and decreased islet cell DNA and insulin content and MTT reduction ( P<0.01), which were blocked by AG(P<0.01). CONCLUSION: The cytotoxicity of IL-1β on pancreati c islets might be mediated by nitric oxide (NO), and that AG prevented IL-1β-in duced destruction of pancreatic islets as a inhibitor of NO formation.
, 百拇医药
MeSH Interleukin-1; Nitric oxide; Islets of Langerhans
胰岛素依赖型糖尿病(insulin-dependent diabetes mellitus, IDDM) 是一种胰岛β细胞选择性破坏的自身免疫性疾病。其病理表现为,大量免疫炎性细胞浸润胰 岛,并分泌细胞因子,逐渐导致胰岛β细胞的完全破坏。近 年来许多研究证实细胞因子对 胰岛β细胞有抑制和细胞毒作用。一些研究还表明,细胞因子可能是通过一 氧化氮(nitric oxide, NO)的介导而导致胰岛β细胞的损害[1]。本文应用体外培养的大鼠胰岛 细胞,观察IL-1β对胰岛细胞NO生成、胰岛素分泌以及胞内DNA、胰岛素含量和细胞活性 的影响,并进一步观察和探讨氨基胍(aminoguanidine, AG)的作用及其机制。
材料与方法
(一)材料:胶原酶(Ⅴ型)、氨基胍、二甲基亚砜购自Sigma公司。RPMI-1640培养液为Gibco 产品。人重组IL-1β、NO测试试剂盒购自军事医学科学院。胰岛素放免分析试剂盒购自3V公 司。MTT为Fluka公司产品。蛋白酶-K、RNase-A购自Bocheringer Mannheim公司。SD大鼠 购自中山大学生命科学中心。
, 百拇医药
(二)大鼠胰岛细胞的分离与培养:按胡远峰等的方法[2]略加改动。雄性健康SD大 鼠,重250~300 g,于无菌条件下取出胰腺,置Hanks液中洗净,剪成碎片。用Hanks液反复 洗涤3次,加入胶原酶Ⅴ(0.5 mg/mL, pH 7.6),置(38±1)℃水浴中逐级消化分离。收集分 离的细胞与细胞团洗涤,接种于含15%小牛血清的RPMI-1640培养液。将细胞浓度调整至1×1 09/L,置CO2培养箱(Napco)内,95%空气/5% CO2、37℃恒温培养。24 h后转入2 4孔培养板(Corning),每孔细胞数为1×106。8 h后用新鲜配制的2.5 μg/mL碘乙酸处 理5~6 h,以去除成纤维细胞。每2~3 d调换全部培养液1次。继续培养4 ~5 d,直至细胞 充分铺展形成良好的胰岛细胞单层。取同批单层培养细胞吸去原培养液后,分别加入含IL-1 β(20 U/mL),AG(1 mmol/L)及两者联合的培养液,同时设置对照组,置于95%空气/5% CO 2、37℃恒温培养24 h,同步留取培养液,分装,-20℃贮存,待测亚硝酸盐和胰岛素含量, 然后行葡萄糖刺激的胰岛素释放试验。并测定胞内DNA和胰岛素含量及细胞活性。
, 百拇医药
(三)NO含量测定:通过分光光度法测定培养液NO代谢产物亚硝酸盐累积量来反映一定时间内 NO的生成量。批内变异系数为3.3%,批间变异系数为6.4%。
(四)胰岛素水平测定:采用放射免疫双抗体法。批内变异系数为5.8%,批间变异系数为12 .5%。
(五)胞内DNA含量测定:DNA提取方法参照Sellins等的方法[3]加以改动。以0.25 mg/mL胰蛋白酶处理单层培养细胞,离心收集细胞,洗涤,加入500 μL细胞裂解液(含蛋白 酶-K 0.4 mg/mL),置50℃水浴3 h后,13 000 r/min,离心10 min,-4℃。取上清,加入2 mol/L NaCl溶液(终浓度0.2 mmol/L)和2倍体积的无水乙醇沉淀16 h,-20℃。同上离心, 弃上清,加入70%乙醇漂洗。同上离心,弃乙醇,待干燥后,加入50 μL含RNase-A的TE溶液 溶解沉淀,65℃水浴30 min。取TE溶液,采用紫外分光光度法测定。
, http://www.100md.com
(六)胞内胰岛素含量测定:收集单层培养细胞,用Hanks液洗涤3次,经反复冻融破碎,加入 酸化乙醇溶液(0.18 mmol/L HCl:无水乙醇=1∶3体积比),4℃孵育16 h,留取标本,待测 胰岛素含量。
(七)细胞活性测定:采用MTT比色分析法。
(八)葡萄糖刺激的胰岛素释放试验:取单层培养细胞,用KRBB液(含1.67 mmol/L葡萄糖)洗 涤3次,加入KRBB液(含1.67 mmol/L葡萄糖),培养1 h后,留取培养液。并用KRBB液(含16 .7 mmol/L葡萄糖)更换,继续培养1 h,留取培养液,待测胰岛素含量。
(九)统计方法:所有实验数据均标化成每106个胰岛细胞某物质的含量 。数据以均数±标准差(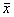 ±s)表示,组间差异显著性用t检验。
±s)表示,组间差异显著性用t检验。
, http://www.100md.com
结 果
一、AG对IL-1β诱导胰岛细胞亚硝酸盐生成的影响:
AG对基础条件下胰岛细胞亚硝酸盐的生成量无明显影响(P>0.05)。以IL-1β诱导,胰 岛细胞亚硝酸盐生成量显著增加(P<0.01)。AG对IL-1β诱导的亚硝酸盐生成有阻抑作 用(P<0.01),如表2所示。
二、AG对IL-1β抑制胰岛素分泌的影响:
与对NO生成的作用相对应,AG对胰岛素基础分泌也无明显影响(P>0.05)。改变培养液 葡萄糖浓度(1.67或16.70 mmol/L)结果无明显变化(P>0.05)。当用IL-1β诱导时, 在葡萄糖11.1 mmol/L(培养液所含葡萄糖浓度)、1.67 mmol/L、16.70 mmol/L条件下,均 致胰岛素分泌明显减少(P<0.01)。AG呈现对抑制的保护性效应(P<0.01),见表 1。
, 百拇医药
表1 AG对IL-1β抑制胰岛素分泌的作用
Tab 1 Effect of AG on IL-1β-induced inhibition of insulin
release (μU/106 cells,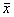 ±s, n=6)
±s, n=6)
Treatment
Glucose( mmol/L)
11.10
1.67
, http://www.100md.com
16.70
Control
1126.61±80.71
10.67±1.45
94.12±7.65
AG
1159.29±114.71
12.53±1.53
102.85±9.18
IL-1β
359.60±37.58
, 百拇医药
4.29±0.68
14.65±2.49
IL-1β+AG
919.46±48.24#
10.15±1.81#
99.54±8.49#
*P<0.01,vs control; #P<0.01, vs IL-1β group
三、AG对IL-1β诱导的胰岛细胞内DNA、胰岛素含量及细胞活性抑制作用的影响:
IL-1β作用后,胰岛细胞内DNA、胰岛素含量及细胞活性(MTT值)均显著下降(P<0.01) ;AG能阻断IL-1β对胰岛细胞内DNA、胰岛素含量及细胞活性的抑制作用,如表2、图1所示 。
, http://www.100md.com
表2 AG对IL-1β诱导的胰岛细胞亚硝酸盐生成量以及对胞内
DNA和胰岛素含量抑制作用的影响
Tab 2 Effect of AG on IL-1β-induced nitrite production and
decrease of islet cell DNA insulin content (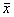 ±s, n=6)
±s, n=6)
Treatment
Nitrite
(nmol/106 cells)
, http://www.100md.com
DNA
(μg/106 cells)
Insulin
(μU/ 106 cells)
Control
6.87±1.65
6. 03±0.81
1118.53±93.82
AG
7.06±1.79
6.33±0.68
, 百拇医药
1004.63±108.76
IL-1β
20.35±1.93
3.78±0.50
810.76±73.27
IL-1β+AG
8.29±1.56#
5.87±0.50#
1000.75±106.07#
*P<0.01,vs control; #P<0.01, vs IL-1β group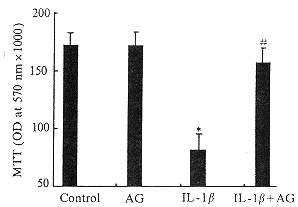
, http://www.100md.com
Fig 1 Effect of AG on IL-1β-ind uced inhibition of islet cell activity (MTT redu ction)(n=6) P<0.01, vs control; #P<0.01, vs IL-1β gr oup; MTT:thiazole blue
图1 AG对IL-1β诱导的胰岛细胞活性抑制作用的影响
讨 论
目前,NO在自身免疫性疾病中的作用越来越引起重视。体内的NO是L-精氨酸在一氧化氮合酶 (nitric oxide synthetase, NOS)催化下生成的。诱生型NOS(inducible NOS, iNOS),必 需经过细胞因子等刺激物诱导才能表达。其所生成的NO主要发挥细胞毒性作用。1990年以来 ,Southern等[4,5]先后报道,IL-1等细胞因子能诱导胰岛β细胞NO的生成,并 认为与IL-1抑制胰岛β细胞线粒体酶活性、DNA合成及葡萄糖刺激的胰岛素分必等生物学作 用有关。我们观察到IL-β能诱导大鼠胰岛细胞NO生成,同时显著抑制胰岛素分泌及葡 萄糖 刺激的胰岛素释放;并降低胰岛细胞内DNA、胰岛素含量,显著抑制胰岛细胞活性。这可能 与NO抑制线粒体内含铁硫中心的酶类活性以及致DNA链断裂有关[1,6]。有报道I L-1能够诱导胰岛细胞iNOS的表达[7]。这表明,NO可能是介导IL-1等细胞因子诱 导的胰岛细胞损害的效应分子。但其确切的机制仍未阐明。
, 百拇医药
氨基胍是胍基衍生物,与L-精氨酸结构相似。有文献报道,AG能有效地抑制胞内外结构蛋白 的非酶促糖基化,防止糖尿病血管病变和神经病变[8]。AG能明显延缓自发性糖尿 病BB大鼠糖尿病发病[9]。并发现AG能阻断IL-1β诱导的胰岛细胞NO生成[1 0]。我们的实验进一步观察到:AG不仅能明显抑制IL-1β诱导的NO生成,同时还能阻断 IL-1β对胰岛素分泌及葡萄糖刺激的胰岛素释放的抑制作用;并呈现对IL-1β诱导的胰岛细 胞DNA、胰岛素含量降低及细胞活性抑制的保护性效应。这可能与AG竞争性抑制iNOS,从而 阻抑NO生成有关。
参考文献
1 Corbett JA,Mcdaniel ML. Does nitric oxide mediate autoimmu ne destruc tion of β-cell Possible therapeutic interventions in IDDM. Diabetes, 1992, 41: 897.
, 百拇医药
2 胡远峰,王煜非,丁一明,等.人胎胰胰岛细胞单层培养的研究.中华器官移植 杂志,1990,11:158.
3 Sellins K, John Cohen J. Gene induction by γ-irradiation leads to DNA fragmentation in lymphocytes. J Immunol, 1987, 139:3199.
4 Southern C, Schulster D, Green IC, et al. Inhibition of insulin secret ion by interleukin-1β and tumor necrosis factor-α via an L-arg-dependent nitri c oxide generating mechanism. FEBS Lett, 1990,276:42.
5 Suarze-Pinaon WL, Strynadika K, Schulz R, et al. Mechanisms of cytokin e -induced destruction of rat insulinnoma cells: the role of nitric oxide. Endocri nology, 1994,134:1006.
, 百拇医药
6 Fehsel K, Jalowy A, Qi S, et al. Islet cell is a target of inflammator y attack by nitric oxide. Diabetes, 1993, 42:496.
7 Karlsen AE, Andersen Hu, Vissing H, et al. Cloning and expressing of c ytokine-inducible nitric oxide syntheses cDNA from rat islets of Langerhans. Dia betes, 1995, 44:753.
8 Brownlee M, Vlassara H, Kooney A, et al. Aminoguanidine prevents gluco se and sorbitol-induced vascular dysfunction in skin chamber granulation tissue. Diabetes, 1991, 40:210A.
, http://www.100md.com
9 Wu G. Nitric oxide syntheses and effect of aminoguanidine and N(G)-mon omethyl-L-arginie on the onset of diabetes in the spontaneously diabetic BB rat. Diabetes, 1995,44:360.
10 Corbett JA, Tilton RG, Chang K, et al. Aminoguanidine, a novel inhibi tor of nitric oxide formation, prevents diabetic vascular dysfunction. Diabetes, 1992,41:552.
(1997年12月18日收稿,1998年7月15日修回), 百拇医药
单位:陈 宏 蔡德鸿 王 梅△ 刘 宏 叶仁青 第一军医大学附属珠江医院内分泌科 △呼吸科(广州 510282)
关键词:白细胞介素-1;一氧化氮;胰岛
氨基胍对白介素 摘 要 目的:观察氨基胍(AG)对白细胞介素-1β(IL-1β )诱导的胰岛细胞损害的作用。方法:应用体外单层培养的大鼠胰岛细胞, 分别检测IL-1β、AG及其联合对胰岛细胞亚硝酸盐生成、胰岛素分泌以及胞内DNA、胰岛素 含量和细胞活性的影响。结果:以IL-1β诱导,胰岛细胞亚硝酸盐生成量显著增加;同时胰岛素基 础分泌以及葡萄糖刺激的胰岛素释放均明显减少;胰岛细胞内DNA、胰岛素含量及细胞活性( MTT值)均显著下降(均P<0.01);AG能阻断这些抑制效应(均P<0.01)。 结论:IL-1β通过一 氧化氮(NO)介导对胰岛细胞有细胞活性抑制和毒性效 应。AG可能是一种有效的iNOS抑制剂,通过阻断NO生成起到细胞保护作用。
, 百拇医药
The protective effects of aminoguanidine against interleukin-1β -induced
destruction of isolated rat pancreatic islets of Langerhans
CHEN Hong, CAI De-Hong, WANG Mei, LIU Hong, YE Ren-Qing
Department of Endocrinology, Zhujiang Hospital, The First Military Medica l University, Guangzhou(510282)
Abstract AIM:The effects of aminoguanidine (AG) on interleuki n -1β-induced destruction of isolated rat pancreatic islets of Langerhans were ob seved. METHODS:Isolated pancreatic islet cells from SD rat were c u ltured in monolayer in vitro. Nitrite production, insulin release, islet cel l DNA and insulin content, and cell activity (MTT assay) in rat pancreatic islet cells incubated with IL-1β, AG, singly and in combination, were measured. RESULTS:IL-1β induced a significant increase in nitrite produtio n, inhibited the medium insulin accumulation and the glucose-stimulated insulin release, and decreased islet cell DNA and insulin content and MTT reduction ( P<0.01), which were blocked by AG(P<0.01). CONCLUSION: The cytotoxicity of IL-1β on pancreati c islets might be mediated by nitric oxide (NO), and that AG prevented IL-1β-in duced destruction of pancreatic islets as a inhibitor of NO formation.
, 百拇医药
MeSH Interleukin-1; Nitric oxide; Islets of Langerhans
胰岛素依赖型糖尿病(insulin-dependent diabetes mellitus, IDDM) 是一种胰岛β细胞选择性破坏的自身免疫性疾病。其病理表现为,大量免疫炎性细胞浸润胰 岛,并分泌细胞因子,逐渐导致胰岛β细胞的完全破坏。近 年来许多研究证实细胞因子对 胰岛β细胞有抑制和细胞毒作用。一些研究还表明,细胞因子可能是通过一 氧化氮(nitric oxide, NO)的介导而导致胰岛β细胞的损害[1]。本文应用体外培养的大鼠胰岛 细胞,观察IL-1β对胰岛细胞NO生成、胰岛素分泌以及胞内DNA、胰岛素含量和细胞活性 的影响,并进一步观察和探讨氨基胍(aminoguanidine, AG)的作用及其机制。
材料与方法
(一)材料:胶原酶(Ⅴ型)、氨基胍、二甲基亚砜购自Sigma公司。RPMI-1640培养液为Gibco 产品。人重组IL-1β、NO测试试剂盒购自军事医学科学院。胰岛素放免分析试剂盒购自3V公 司。MTT为Fluka公司产品。蛋白酶-K、RNase-A购自Bocheringer Mannheim公司。SD大鼠 购自中山大学生命科学中心。
, 百拇医药
(二)大鼠胰岛细胞的分离与培养:按胡远峰等的方法[2]略加改动。雄性健康SD大 鼠,重250~300 g,于无菌条件下取出胰腺,置Hanks液中洗净,剪成碎片。用Hanks液反复 洗涤3次,加入胶原酶Ⅴ(0.5 mg/mL, pH 7.6),置(38±1)℃水浴中逐级消化分离。收集分 离的细胞与细胞团洗涤,接种于含15%小牛血清的RPMI-1640培养液。将细胞浓度调整至1×1 09/L,置CO2培养箱(Napco)内,95%空气/5% CO2、37℃恒温培养。24 h后转入2 4孔培养板(Corning),每孔细胞数为1×106。8 h后用新鲜配制的2.5 μg/mL碘乙酸处 理5~6 h,以去除成纤维细胞。每2~3 d调换全部培养液1次。继续培养4 ~5 d,直至细胞 充分铺展形成良好的胰岛细胞单层。取同批单层培养细胞吸去原培养液后,分别加入含IL-1 β(20 U/mL),AG(1 mmol/L)及两者联合的培养液,同时设置对照组,置于95%空气/5% CO 2、37℃恒温培养24 h,同步留取培养液,分装,-20℃贮存,待测亚硝酸盐和胰岛素含量, 然后行葡萄糖刺激的胰岛素释放试验。并测定胞内DNA和胰岛素含量及细胞活性。
, 百拇医药
(三)NO含量测定:通过分光光度法测定培养液NO代谢产物亚硝酸盐累积量来反映一定时间内 NO的生成量。批内变异系数为3.3%,批间变异系数为6.4%。
(四)胰岛素水平测定:采用放射免疫双抗体法。批内变异系数为5.8%,批间变异系数为12 .5%。
(五)胞内DNA含量测定:DNA提取方法参照Sellins等的方法[3]加以改动。以0.25 mg/mL胰蛋白酶处理单层培养细胞,离心收集细胞,洗涤,加入500 μL细胞裂解液(含蛋白 酶-K 0.4 mg/mL),置50℃水浴3 h后,13 000 r/min,离心10 min,-4℃。取上清,加入2 mol/L NaCl溶液(终浓度0.2 mmol/L)和2倍体积的无水乙醇沉淀16 h,-20℃。同上离心, 弃上清,加入70%乙醇漂洗。同上离心,弃乙醇,待干燥后,加入50 μL含RNase-A的TE溶液 溶解沉淀,65℃水浴30 min。取TE溶液,采用紫外分光光度法测定。
, http://www.100md.com
(六)胞内胰岛素含量测定:收集单层培养细胞,用Hanks液洗涤3次,经反复冻融破碎,加入 酸化乙醇溶液(0.18 mmol/L HCl:无水乙醇=1∶3体积比),4℃孵育16 h,留取标本,待测 胰岛素含量。
(七)细胞活性测定:采用MTT比色分析法。
(八)葡萄糖刺激的胰岛素释放试验:取单层培养细胞,用KRBB液(含1.67 mmol/L葡萄糖)洗 涤3次,加入KRBB液(含1.67 mmol/L葡萄糖),培养1 h后,留取培养液。并用KRBB液(含16 .7 mmol/L葡萄糖)更换,继续培养1 h,留取培养液,待测胰岛素含量。
(九)统计方法:所有实验数据均标化成每106个胰岛细胞某物质的含量 。数据以均数±标准差(
, http://www.100md.com
结 果
一、AG对IL-1β诱导胰岛细胞亚硝酸盐生成的影响:
AG对基础条件下胰岛细胞亚硝酸盐的生成量无明显影响(P>0.05)。以IL-1β诱导,胰 岛细胞亚硝酸盐生成量显著增加(P<0.01)。AG对IL-1β诱导的亚硝酸盐生成有阻抑作 用(P<0.01),如表2所示。
二、AG对IL-1β抑制胰岛素分泌的影响:
与对NO生成的作用相对应,AG对胰岛素基础分泌也无明显影响(P>0.05)。改变培养液 葡萄糖浓度(1.67或16.70 mmol/L)结果无明显变化(P>0.05)。当用IL-1β诱导时, 在葡萄糖11.1 mmol/L(培养液所含葡萄糖浓度)、1.67 mmol/L、16.70 mmol/L条件下,均 致胰岛素分泌明显减少(P<0.01)。AG呈现对抑制的保护性效应(P<0.01),见表 1。
, 百拇医药
表1 AG对IL-1β抑制胰岛素分泌的作用
Tab 1 Effect of AG on IL-1β-induced inhibition of insulin
release (μU/106 cells,
Treatment
Glucose( mmol/L)
11.10
1.67
, http://www.100md.com
16.70
Control
1126.61±80.71
10.67±1.45
94.12±7.65
AG
1159.29±114.71
12.53±1.53
102.85±9.18
IL-1β
359.60±37.58
, 百拇医药
4.29±0.68
14.65±2.49
IL-1β+AG
919.46±48.24#
10.15±1.81#
99.54±8.49#
*P<0.01,vs control; #P<0.01, vs IL-1β group
三、AG对IL-1β诱导的胰岛细胞内DNA、胰岛素含量及细胞活性抑制作用的影响:
IL-1β作用后,胰岛细胞内DNA、胰岛素含量及细胞活性(MTT值)均显著下降(P<0.01) ;AG能阻断IL-1β对胰岛细胞内DNA、胰岛素含量及细胞活性的抑制作用,如表2、图1所示 。
, http://www.100md.com
表2 AG对IL-1β诱导的胰岛细胞亚硝酸盐生成量以及对胞内
DNA和胰岛素含量抑制作用的影响
Tab 2 Effect of AG on IL-1β-induced nitrite production and
decrease of islet cell DNA insulin content (
Treatment
Nitrite
(nmol/106 cells)
, http://www.100md.com
DNA
(μg/106 cells)
Insulin
(μU/ 106 cells)
Control
6.87±1.65
6. 03±0.81
1118.53±93.82
AG
7.06±1.79
6.33±0.68
, 百拇医药
1004.63±108.76
IL-1β
20.35±1.93
3.78±0.50
810.76±73.27
IL-1β+AG
8.29±1.56#
5.87±0.50#
1000.75±106.07#
*P<0.01,vs control; #P<0.01, vs IL-1β group

, http://www.100md.com
Fig 1 Effect of AG on IL-1β-ind uced inhibition of islet cell activity (MTT redu ction)(n=6) P<0.01, vs control; #P<0.01, vs IL-1β gr oup; MTT:thiazole blue
图1 AG对IL-1β诱导的胰岛细胞活性抑制作用的影响
讨 论
目前,NO在自身免疫性疾病中的作用越来越引起重视。体内的NO是L-精氨酸在一氧化氮合酶 (nitric oxide synthetase, NOS)催化下生成的。诱生型NOS(inducible NOS, iNOS),必 需经过细胞因子等刺激物诱导才能表达。其所生成的NO主要发挥细胞毒性作用。1990年以来 ,Southern等[4,5]先后报道,IL-1等细胞因子能诱导胰岛β细胞NO的生成,并 认为与IL-1抑制胰岛β细胞线粒体酶活性、DNA合成及葡萄糖刺激的胰岛素分必等生物学作 用有关。我们观察到IL-β能诱导大鼠胰岛细胞NO生成,同时显著抑制胰岛素分泌及葡 萄糖 刺激的胰岛素释放;并降低胰岛细胞内DNA、胰岛素含量,显著抑制胰岛细胞活性。这可能 与NO抑制线粒体内含铁硫中心的酶类活性以及致DNA链断裂有关[1,6]。有报道I L-1能够诱导胰岛细胞iNOS的表达[7]。这表明,NO可能是介导IL-1等细胞因子诱 导的胰岛细胞损害的效应分子。但其确切的机制仍未阐明。
, 百拇医药
氨基胍是胍基衍生物,与L-精氨酸结构相似。有文献报道,AG能有效地抑制胞内外结构蛋白 的非酶促糖基化,防止糖尿病血管病变和神经病变[8]。AG能明显延缓自发性糖尿 病BB大鼠糖尿病发病[9]。并发现AG能阻断IL-1β诱导的胰岛细胞NO生成[1 0]。我们的实验进一步观察到:AG不仅能明显抑制IL-1β诱导的NO生成,同时还能阻断 IL-1β对胰岛素分泌及葡萄糖刺激的胰岛素释放的抑制作用;并呈现对IL-1β诱导的胰岛细 胞DNA、胰岛素含量降低及细胞活性抑制的保护性效应。这可能与AG竞争性抑制iNOS,从而 阻抑NO生成有关。
参考文献
1 Corbett JA,Mcdaniel ML. Does nitric oxide mediate autoimmu ne destruc tion of β-cell Possible therapeutic interventions in IDDM. Diabetes, 1992, 41: 897.
, 百拇医药
2 胡远峰,王煜非,丁一明,等.人胎胰胰岛细胞单层培养的研究.中华器官移植 杂志,1990,11:158.
3 Sellins K, John Cohen J. Gene induction by γ-irradiation leads to DNA fragmentation in lymphocytes. J Immunol, 1987, 139:3199.
4 Southern C, Schulster D, Green IC, et al. Inhibition of insulin secret ion by interleukin-1β and tumor necrosis factor-α via an L-arg-dependent nitri c oxide generating mechanism. FEBS Lett, 1990,276:42.
5 Suarze-Pinaon WL, Strynadika K, Schulz R, et al. Mechanisms of cytokin e -induced destruction of rat insulinnoma cells: the role of nitric oxide. Endocri nology, 1994,134:1006.
, 百拇医药
6 Fehsel K, Jalowy A, Qi S, et al. Islet cell is a target of inflammator y attack by nitric oxide. Diabetes, 1993, 42:496.
7 Karlsen AE, Andersen Hu, Vissing H, et al. Cloning and expressing of c ytokine-inducible nitric oxide syntheses cDNA from rat islets of Langerhans. Dia betes, 1995, 44:753.
8 Brownlee M, Vlassara H, Kooney A, et al. Aminoguanidine prevents gluco se and sorbitol-induced vascular dysfunction in skin chamber granulation tissue. Diabetes, 1991, 40:210A.
, http://www.100md.com
9 Wu G. Nitric oxide syntheses and effect of aminoguanidine and N(G)-mon omethyl-L-arginie on the onset of diabetes in the spontaneously diabetic BB rat. Diabetes, 1995,44:360.
10 Corbett JA, Tilton RG, Chang K, et al. Aminoguanidine, a novel inhibi tor of nitric oxide formation, prevents diabetic vascular dysfunction. Diabetes, 1992,41:552.
(1997年12月18日收稿,1998年7月15日修回), 百拇医药