小管间质肌成纤维细胞激活对大鼠残余肾硬化的影响*
作者:刘必成 John Haylor El Nahas A.M.
单位:南京铁道医学院附属医院肾脏科(南京 210009)
关键词:肌;成纤维细胞;肾;硬化
小管间质肌成纤维细胞激活对大鼠残余肾硬化的影响 摘 要 目的:本文研究5/6肾大部切除大鼠(SNx)肾小管间质肌成纤维细胞(myofibroblast,MFB)标记性抗原α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)免疫组化表达及其意义。方法:成年雄性Wistar大鼠(6~8周龄,200~250 g)随机分成两组:1.假手术(sham,n=5); 2.SNx组(n=5)。大鼠于5/6肾大部切除术后30 d处死,取肾组织固定供Masson Trichrom染色及免疫组化分析。同时记录体重、血压、蛋白尿及肾功能变化。结果:SNx组肾小管间质α-SMA表达明显高于对照组(P<0.01),α-SMA表达程度与肾小管间质损害程度、尿蛋白排泄量之间呈显著正相关(P分别<0.01),而与肌苷清除率(Ccr)呈显著负相关(P<0.01)。结论:提示SNx大鼠早期有肾小管间质MFB激活,后者可能参与肾脏硬化的发生。
, 百拇医药
Influence of the activation of tubulo-interstitial myofibroblast
on the renal scarring in rat remnant kidney
LIU Bi-Cheng
Renal Division, Afftiliated Hospital of Nanjing Railway Medical College,Nanjing (210009),John Haylor El Nahas A.M
Sheffield Kidney Institute
Northern General Hospital,University of Sheffield, Sheffield,U.K.
, 百拇医药
Abstract AIM:investigate the immunohistochemical expression of α-smooth muscle actin (α-SMA)in the tubulo-interstitium of rats with subtotal nephrectomy (SNx) and it's significance to the progression of renal scarring. METHOD:Adult male Wistar rats were randomly divided into two groups:Sham (n=5)and SNx (n=5).One month after the rats subjected to 5/6 subtotal nephrectomy, the remnant kidneys were taken out for Masson Trichrom staining and immunohistochemical staining (ABC method) for α-SMA by mouse anti-α-SMA monoclonal antibody.RESULTS: The tubulo-interstitial staining for α-SMA in SNx rats is significantly increased comparing with the sham group (P<0.01).The increase of α-SMA staining is positively correlated with the tubulo-interstitial scarring score and 24h proteinuria (P<0.01, respectively),and conversely correlated with the reduction of creatinine clearance (P<0.01). CONCLUSION: The earlier activation of tubulo-interstitial myofibroblast in the rat remnant kidney might be involved in the development of renal scarring.
, http://www.100md.com
MeSH Muscles; Fibroblasts; Kidney; Sclerosis
慢性肾脏疾病不可避免地进展为终末期肾衰的实质是由于肾脏过度纤维化(fibrosis)和硬化(scarring)。肾脏硬化的确切机制至今仍不十分清楚。近年研究提示肾脏小管间质性损害程度与慢性肾病的预后有着非常密切的关系[1]。更为有意义的是,我们及其他作者最近系列研究表明,肾脏固有细胞异化(transdifferentiation)为肌成纤维细胞(myofibroblast,MFB)在肾脏纤维化[2,3]发生中起着十分重要的作用。大鼠肾大部切除(subtotal nephrectomy,SNx)是肾脏纤维化的良好模型,本文报道SNx大鼠肾小管间质MFB标记性蛋白—α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)免疫组化表达及其与蛋白尿、小管间质性损害、肾功能之间的相关关系。
材料与方法
, http://www.100md.com
一、实验动物及分组:
成年雄性Wistar大鼠,6~8周龄,体重200~250 g,(由University of Sheffield提供)。大鼠分笼伺养于18℃,45%湿度,12 h/日光照环境下,自由饮水、进食(食物中含蛋白质18.3%,Cambridge,U.K.)。实验共分2组:1.假手术(sham)组(n=5); 2.SNx组(n=5)。
二、实验方法:
1.肾大部切除手术采用一期法。先切除右肾,随后结扎左肾上下两极并切除之,注意免伤两侧肾上腺。切除之肾组织称重。以右肾重量减去所切除的左肾肾组织重量来间接估算残余肾重量,并算出切除率。本实验组肾脏平均切除率为65%。假手术组只暴露双侧肾脏,但不作手术切除。大鼠清醒后即给予自由饮食和进自来水。实验持续30 d后处死大鼠,取出肾脏称重,并固定于4% Formal calcium (pH7.4)溶液供组织学检查。
, 百拇医药
2.免疫组化采用ABC (Avidin-Biotin Peroxidase)法,简述如下:石蜡包埋切片(3 μm)分别经二甲苯脱蜡、分级酒精水化后,于0.5%H2O2甲醇溶液中灭活内源性过氧化氢酶活性。切片经微波处理、无花果蛋白酶(ficin,ZYMED,San Francisco,California,USA)在37 ℃恒温箱中消化10 min后,再封闭非特异性抗原。单克隆鼠抗α-SMA(1:100,由日内瓦Gabbiani教授惠赠)4℃下孵育过夜。最后按ABC盒(Vector ABC Elite,Vector Lab.Peterborough,UK)说明进行,所形成的复合物与底物3-amino-9-ethyl-carbazol(AEC)反应产生红色阳性染色再经苏木紫复染固定。每次染色时同时设阴性对照。
3.免疫组化染色结果的半定量分析:采用经典双盲点计数法(point count)。标准25点(面积0.016mm2)方格经延伸管叠加于放大200的图像上,由肾皮质层至髓质层方向依次点数20个视野下阳性染色点并换算成百分比表示。
, http://www.100md.com
4.小管间质慢性损害程度评估:根据Masson's Trichrome染色切片按下列方法评级[4]:0级:小管间质无损害;1级:小管间质损害不超过25%;2级:小管间质损害达26%~50%;3级:小管间质损害达51%~75%; 4级:小管间质损害超过75%。小管间质损害是指小管细胞萎缩、小管扩张、管型形成、小管间质炎症细胞浸润、间质扩张和纤维化。
5.一般性指标:包括:体重(body weight,BW),清醒状态下大鼠尾动脉收缩压(systolic blood pressure SBP),24 h尿量(urine volume, UV),24 h尿蛋白排泄量(Upro,mg),肌酐清除率(creatinine clearance Ccr,mL/min.kg-1)等。上述指标分别于术前及术后30 d大鼠处死前收集,24 h尿量经代谢笼收集。
三、统计学处理:
, http://www.100md.com
各组数据均以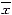 ±s表达,组间资料比较采用“t”检验或Mann-Whitney“U”检验。为了解MFB激活与小管间质性损害程度以及肾功能(以Ccr,mL/min来表示)、蛋白尿的关系,对有关数据进行了两两线性回归分析。P<0.05接受为有显著差异。
±s表达,组间资料比较采用“t”检验或Mann-Whitney“U”检验。为了解MFB激活与小管间质性损害程度以及肾功能(以Ccr,mL/min来表示)、蛋白尿的关系,对有关数据进行了两两线性回归分析。P<0.05接受为有显著差异。
结 果
一、肾大部切除大鼠积血压、尿量、蛋白尿及Ccr变化:
本实验中,大鼠肾大部切除(SNx) 1月后,体重(BW)、收缩压(SBP)与对照组(Sham)相比,两组之间无显著差异,BW:SNx(367±9) g,Sham (357±8) g,P>0.05;SBP:SNx(4.33±0.53) kPa, Sham(16.80±0.53) kPa, P>0.05。SNx组大鼠尿量明显高于对照组:SNx(22.9±1.7) mL,Sham(10.9±1.3) mL,P<0.01,24 h尿蛋白排泄量(Upro)亦较对照组明显增高:SNx(90.9±29.6) mg,Sham (11.2±1.1) mg,P<0.01。SNx组Ccr较对照组明显降低:SNx(3.26±0.18) mL/mg.kg-1,Sham(5.09±0.26) mL/min.kg-1,P<0.01。
, http://www.100md.com
二、SNx大鼠肾小管、间质α-SMA表达:
假手术组大鼠α-SMA表达主要局限于肾内小血管平滑肌细胞,小管、间质无特异性抗α-SMA阳性染色细胞(图1),本实验发现,术后30 d SNx大鼠小管间质α-SMA表达阳性细胞明显增加(图2)。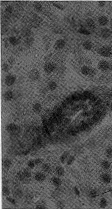
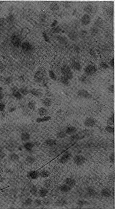
Fig 1 Microphotograph shows the immunohistochemical staining for α-SMA in the tubulo-interstitium of sham operated rats.The positive staining is only confined in the smooth muscle media of renal arteriols (×200)
, 百拇医药
图1 假手术组大鼠肾小管-间质α-SMA免疫组化染色

Fig 2 Microphotograph shows the immunohistochemical staining for α-SMA in the tubulo-interstitium (TI) of SNx rats.Beside the renal arteriols,there is an increasing expression of α-SMA within the TI(×400)
, http://www.100md.com
图2 肾大部分切除大鼠肾小管-间质α-SMA免疫组化染色
三、小管间质细胞α-SMA表达与小管间质损害程度、蛋白尿及Ccr之间的关系:
线性相关分析表明,小管间质细胞α-SMA表达与小管间质损害程度、蛋白尿呈显著正相关(r=0.977、0.833,分别P<0.01),而与Ccr之间呈显著负相关(r=-0.855,P<0.01)。
讨 论
大鼠5/6肾大部切除后肾脏特征性改变是肾脏早期代偿性肥大,肾小球高灌注、高滤过、高压力,继之出现肾小球硬化、小管间质性损害,后者表现为小管细胞萎缩、小管扩张、间质炎症细胞浸润、纤维化,最终发展为进行性的肾功能衰竭。它是目前公认的肾脏纤维化和硬化研究的良好模型。本研究证实,大鼠肾大部切除一月后,尿蛋白排泄增加,Ccr下降,病理学上可见局灶性肾脏硬化。
, http://www.100md.com
肾脏硬化的机制目前仍不十分清楚。近年研究表明,肾脏肌成纤维细胞(myofibroblast,MFB)激活可能参与肾脏硬化的形成[5]。MFB是一种特殊类型的细胞,它兼具平滑肌细胞和成纤维细胞的特性,既具有能够引起收缩的微丝样结构,又能产生胶原及细胞外基质成分,在创伤愈合过程中促进创面收缩和组织硬化[6]。α-SMA是一种肌动蛋白,正常情况下主要存在于血管平滑肌细胞。晚近人们发现,在硬化组织,包括纤维化的肾脏组织的肌成纤维细胞中有该抗原表达,并认为α-SMA是肌成纤维细胞活跃的标记性抗原。在组织纤维化形成过程中α-SMA表达增加,而一旦疤痕形成后,由于MFB的消失(可能通过细胞凋亡),组织中就不再有α-SMA表达。我们及其他作者以前工作表明,肾组织许多固有细胞(如小管上皮细胞、成纤维细胞、血管平滑肌细胞、系膜细胞)在肾脏纤维化形成过程中异化为MFB可能是肾脏硬化发生的重要机制,α-SMA表达多少与疾病预后有着密切关系[7,8]。
*本研究系作者在国外进修期间完成,并得到英国谢菲尔德大学Northern General Hospital及国际肾病协会资助
, http://www.100md.com
John Haylor El Nahas A.M. Sheffield Kidney Institute, University of Sheffield
参考文献
1 Bohle A,Muller GA,Wehrmann M,et al.Pathogenesis of chronic renal failure in the primary glomerulopathies,renal vasculopathies,and chronic interstitial nephritides.Kidney Int,1996,49:2.
2 Zhang G,Moorhead PJ,El Nahas AM.Myofibroblasts and the progression of experimental glomerulonephritis.Exp Nephrol, 1995,3:308.
, 百拇医药
3 El Nahas AM,Muchaneta-Kubara EC,Zhang G,et al.Phenotypic changes in the pathogenesis of renal scarring.Kidney Int,1996,49:23.
4 Kliem V,Johnson RJ,Alpers CE, et al.Mechanisms involved in the pathogenesis of tubulointerstitial fibrosis in 5/6 nephrectomized rats.Kidney Int,1996,49:666.
5 Muchaneta-Kubara EC,El Nahas AM.Myofibroblast phenotypes expression in experimental renal scarring.Nephrol Dial Transplant,1997,12(5):904.
, 百拇医药
6 Gabbiani G.The biology of the myofibroblast.Kidney Int,1992,41:530.
7 Goumenos DS,Brown CB,Shortland J, et al.Myofibroblasts,predictors of progression of mesangial IgA nephropathy?Nephrol Dial Transplant,1994,9:1 418.
8 Essawy M,Soylemezoglu O,Muchaneta-Kubara EC, et al.Myofibroblasts and the progression of diabetic nephropathy.Nephrol Dial Transplant,1997,12:43.
(1998年元月15日收稿,1998年8月28日修回), 百拇医药
单位:南京铁道医学院附属医院肾脏科(南京 210009)
关键词:肌;成纤维细胞;肾;硬化
小管间质肌成纤维细胞激活对大鼠残余肾硬化的影响 摘 要 目的:本文研究5/6肾大部切除大鼠(SNx)肾小管间质肌成纤维细胞(myofibroblast,MFB)标记性抗原α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)免疫组化表达及其意义。方法:成年雄性Wistar大鼠(6~8周龄,200~250 g)随机分成两组:1.假手术(sham,n=5); 2.SNx组(n=5)。大鼠于5/6肾大部切除术后30 d处死,取肾组织固定供Masson Trichrom染色及免疫组化分析。同时记录体重、血压、蛋白尿及肾功能变化。结果:SNx组肾小管间质α-SMA表达明显高于对照组(P<0.01),α-SMA表达程度与肾小管间质损害程度、尿蛋白排泄量之间呈显著正相关(P分别<0.01),而与肌苷清除率(Ccr)呈显著负相关(P<0.01)。结论:提示SNx大鼠早期有肾小管间质MFB激活,后者可能参与肾脏硬化的发生。
, 百拇医药
Influence of the activation of tubulo-interstitial myofibroblast
on the renal scarring in rat remnant kidney
LIU Bi-Cheng
Renal Division, Afftiliated Hospital of Nanjing Railway Medical College,Nanjing (210009),John Haylor El Nahas A.M
Sheffield Kidney Institute
Northern General Hospital,University of Sheffield, Sheffield,U.K.
, 百拇医药
Abstract AIM:investigate the immunohistochemical expression of α-smooth muscle actin (α-SMA)in the tubulo-interstitium of rats with subtotal nephrectomy (SNx) and it's significance to the progression of renal scarring. METHOD:Adult male Wistar rats were randomly divided into two groups:Sham (n=5)and SNx (n=5).One month after the rats subjected to 5/6 subtotal nephrectomy, the remnant kidneys were taken out for Masson Trichrom staining and immunohistochemical staining (ABC method) for α-SMA by mouse anti-α-SMA monoclonal antibody.RESULTS: The tubulo-interstitial staining for α-SMA in SNx rats is significantly increased comparing with the sham group (P<0.01).The increase of α-SMA staining is positively correlated with the tubulo-interstitial scarring score and 24h proteinuria (P<0.01, respectively),and conversely correlated with the reduction of creatinine clearance (P<0.01). CONCLUSION: The earlier activation of tubulo-interstitial myofibroblast in the rat remnant kidney might be involved in the development of renal scarring.
, http://www.100md.com
MeSH Muscles; Fibroblasts; Kidney; Sclerosis
慢性肾脏疾病不可避免地进展为终末期肾衰的实质是由于肾脏过度纤维化(fibrosis)和硬化(scarring)。肾脏硬化的确切机制至今仍不十分清楚。近年研究提示肾脏小管间质性损害程度与慢性肾病的预后有着非常密切的关系[1]。更为有意义的是,我们及其他作者最近系列研究表明,肾脏固有细胞异化(transdifferentiation)为肌成纤维细胞(myofibroblast,MFB)在肾脏纤维化[2,3]发生中起着十分重要的作用。大鼠肾大部切除(subtotal nephrectomy,SNx)是肾脏纤维化的良好模型,本文报道SNx大鼠肾小管间质MFB标记性蛋白—α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)免疫组化表达及其与蛋白尿、小管间质性损害、肾功能之间的相关关系。
材料与方法
, http://www.100md.com
一、实验动物及分组:
成年雄性Wistar大鼠,6~8周龄,体重200~250 g,(由University of Sheffield提供)。大鼠分笼伺养于18℃,45%湿度,12 h/日光照环境下,自由饮水、进食(食物中含蛋白质18.3%,Cambridge,U.K.)。实验共分2组:1.假手术(sham)组(n=5); 2.SNx组(n=5)。
二、实验方法:
1.肾大部切除手术采用一期法。先切除右肾,随后结扎左肾上下两极并切除之,注意免伤两侧肾上腺。切除之肾组织称重。以右肾重量减去所切除的左肾肾组织重量来间接估算残余肾重量,并算出切除率。本实验组肾脏平均切除率为65%。假手术组只暴露双侧肾脏,但不作手术切除。大鼠清醒后即给予自由饮食和进自来水。实验持续30 d后处死大鼠,取出肾脏称重,并固定于4% Formal calcium (pH7.4)溶液供组织学检查。
, 百拇医药
2.免疫组化采用ABC (Avidin-Biotin Peroxidase)法,简述如下:石蜡包埋切片(3 μm)分别经二甲苯脱蜡、分级酒精水化后,于0.5%H2O2甲醇溶液中灭活内源性过氧化氢酶活性。切片经微波处理、无花果蛋白酶(ficin,ZYMED,San Francisco,California,USA)在37 ℃恒温箱中消化10 min后,再封闭非特异性抗原。单克隆鼠抗α-SMA(1:100,由日内瓦Gabbiani教授惠赠)4℃下孵育过夜。最后按ABC盒(Vector ABC Elite,Vector Lab.Peterborough,UK)说明进行,所形成的复合物与底物3-amino-9-ethyl-carbazol(AEC)反应产生红色阳性染色再经苏木紫复染固定。每次染色时同时设阴性对照。
3.免疫组化染色结果的半定量分析:采用经典双盲点计数法(point count)。标准25点(面积0.016mm2)方格经延伸管叠加于放大200的图像上,由肾皮质层至髓质层方向依次点数20个视野下阳性染色点并换算成百分比表示。
, http://www.100md.com
4.小管间质慢性损害程度评估:根据Masson's Trichrome染色切片按下列方法评级[4]:0级:小管间质无损害;1级:小管间质损害不超过25%;2级:小管间质损害达26%~50%;3级:小管间质损害达51%~75%; 4级:小管间质损害超过75%。小管间质损害是指小管细胞萎缩、小管扩张、管型形成、小管间质炎症细胞浸润、间质扩张和纤维化。
5.一般性指标:包括:体重(body weight,BW),清醒状态下大鼠尾动脉收缩压(systolic blood pressure SBP),24 h尿量(urine volume, UV),24 h尿蛋白排泄量(Upro,mg),肌酐清除率(creatinine clearance Ccr,mL/min.kg-1)等。上述指标分别于术前及术后30 d大鼠处死前收集,24 h尿量经代谢笼收集。
三、统计学处理:
, http://www.100md.com
各组数据均以
结 果
一、肾大部切除大鼠积血压、尿量、蛋白尿及Ccr变化:
本实验中,大鼠肾大部切除(SNx) 1月后,体重(BW)、收缩压(SBP)与对照组(Sham)相比,两组之间无显著差异,BW:SNx(367±9) g,Sham (357±8) g,P>0.05;SBP:SNx(4.33±0.53) kPa, Sham(16.80±0.53) kPa, P>0.05。SNx组大鼠尿量明显高于对照组:SNx(22.9±1.7) mL,Sham(10.9±1.3) mL,P<0.01,24 h尿蛋白排泄量(Upro)亦较对照组明显增高:SNx(90.9±29.6) mg,Sham (11.2±1.1) mg,P<0.01。SNx组Ccr较对照组明显降低:SNx(3.26±0.18) mL/mg.kg-1,Sham(5.09±0.26) mL/min.kg-1,P<0.01。
, http://www.100md.com
二、SNx大鼠肾小管、间质α-SMA表达:
假手术组大鼠α-SMA表达主要局限于肾内小血管平滑肌细胞,小管、间质无特异性抗α-SMA阳性染色细胞(图1),本实验发现,术后30 d SNx大鼠小管间质α-SMA表达阳性细胞明显增加(图2)。


Fig 1 Microphotograph shows the immunohistochemical staining for α-SMA in the tubulo-interstitium of sham operated rats.The positive staining is only confined in the smooth muscle media of renal arteriols (×200)
, 百拇医药
图1 假手术组大鼠肾小管-间质α-SMA免疫组化染色


Fig 2 Microphotograph shows the immunohistochemical staining for α-SMA in the tubulo-interstitium (TI) of SNx rats.Beside the renal arteriols,there is an increasing expression of α-SMA within the TI(×400)
, http://www.100md.com
图2 肾大部分切除大鼠肾小管-间质α-SMA免疫组化染色
三、小管间质细胞α-SMA表达与小管间质损害程度、蛋白尿及Ccr之间的关系:
线性相关分析表明,小管间质细胞α-SMA表达与小管间质损害程度、蛋白尿呈显著正相关(r=0.977、0.833,分别P<0.01),而与Ccr之间呈显著负相关(r=-0.855,P<0.01)。
讨 论
大鼠5/6肾大部切除后肾脏特征性改变是肾脏早期代偿性肥大,肾小球高灌注、高滤过、高压力,继之出现肾小球硬化、小管间质性损害,后者表现为小管细胞萎缩、小管扩张、间质炎症细胞浸润、纤维化,最终发展为进行性的肾功能衰竭。它是目前公认的肾脏纤维化和硬化研究的良好模型。本研究证实,大鼠肾大部切除一月后,尿蛋白排泄增加,Ccr下降,病理学上可见局灶性肾脏硬化。
, http://www.100md.com
肾脏硬化的机制目前仍不十分清楚。近年研究表明,肾脏肌成纤维细胞(myofibroblast,MFB)激活可能参与肾脏硬化的形成[5]。MFB是一种特殊类型的细胞,它兼具平滑肌细胞和成纤维细胞的特性,既具有能够引起收缩的微丝样结构,又能产生胶原及细胞外基质成分,在创伤愈合过程中促进创面收缩和组织硬化[6]。α-SMA是一种肌动蛋白,正常情况下主要存在于血管平滑肌细胞。晚近人们发现,在硬化组织,包括纤维化的肾脏组织的肌成纤维细胞中有该抗原表达,并认为α-SMA是肌成纤维细胞活跃的标记性抗原。在组织纤维化形成过程中α-SMA表达增加,而一旦疤痕形成后,由于MFB的消失(可能通过细胞凋亡),组织中就不再有α-SMA表达。我们及其他作者以前工作表明,肾组织许多固有细胞(如小管上皮细胞、成纤维细胞、血管平滑肌细胞、系膜细胞)在肾脏纤维化形成过程中异化为MFB可能是肾脏硬化发生的重要机制,α-SMA表达多少与疾病预后有着密切关系[7,8]。
*本研究系作者在国外进修期间完成,并得到英国谢菲尔德大学Northern General Hospital及国际肾病协会资助
, http://www.100md.com
John Haylor El Nahas A.M. Sheffield Kidney Institute, University of Sheffield
参考文献
1 Bohle A,Muller GA,Wehrmann M,et al.Pathogenesis of chronic renal failure in the primary glomerulopathies,renal vasculopathies,and chronic interstitial nephritides.Kidney Int,1996,49:2.
2 Zhang G,Moorhead PJ,El Nahas AM.Myofibroblasts and the progression of experimental glomerulonephritis.Exp Nephrol, 1995,3:308.
, 百拇医药
3 El Nahas AM,Muchaneta-Kubara EC,Zhang G,et al.Phenotypic changes in the pathogenesis of renal scarring.Kidney Int,1996,49:23.
4 Kliem V,Johnson RJ,Alpers CE, et al.Mechanisms involved in the pathogenesis of tubulointerstitial fibrosis in 5/6 nephrectomized rats.Kidney Int,1996,49:666.
5 Muchaneta-Kubara EC,El Nahas AM.Myofibroblast phenotypes expression in experimental renal scarring.Nephrol Dial Transplant,1997,12(5):904.
, 百拇医药
6 Gabbiani G.The biology of the myofibroblast.Kidney Int,1992,41:530.
7 Goumenos DS,Brown CB,Shortland J, et al.Myofibroblasts,predictors of progression of mesangial IgA nephropathy?Nephrol Dial Transplant,1994,9:1 418.
8 Essawy M,Soylemezoglu O,Muchaneta-Kubara EC, et al.Myofibroblasts and the progression of diabetic nephropathy.Nephrol Dial Transplant,1997,12:43.
(1998年元月15日收稿,1998年8月28日修回), 百拇医药