急性肝功能衰竭时肠粘膜屏障损伤的研究
作者:段美丽 王彦军 韩德五
单位:段美丽 王彦军 :山西医科大学第一医院(太原 030001);韩德五:山西医科大学病理生理教研室
关键词:肝;内毒素类;肠粘膜;大黄
急性肝功能衰竭时肠粘膜屏障损伤的研究 摘要 目的:探讨急性肝功能衰竭(简称肝衰)时肠粘膜屏障损伤及其机制,并观察中药大黄对它的防治作用。方法:采用鲎试剂法作血浆内毒素定量,酚一次氯酸法测定谷氨酰胺浓度及荧光法测定谷氨酰胺酶活性和组胺含量,Evans蓝染色法测定肠粘膜通透性。结果:硫代乙酰胺(thioacetamide,TAA)引发大鼠急性肝衰,并伴有严重的肠源性内毒素血症(intestinal endotoxemia,IETM)。肠谷氨酰胺酶活性降低,肠粘膜对谷氨酰胺利用减少,肠粘膜通透性增加。组织细胞学显示,TAA组动物肝细胞发生严重变性坏死;肠粘膜淤血、水肿、糜烂,肠肥大细胞脱颗粒。电镜示肠微绒毛倒伏、脱落,细胞间紧密连接破坏。大黄组动物IETM与肝组织损伤明显减轻。结论:急性肝衰伴有肠粘膜屏障损伤,其发生机制与IETM及其介导的组胺增多有关。大黄对急性肝衰时肠粘膜屏障损伤有一定防治作用。
, http://www.100md.com
Studies on intestinal mucosa barrier injuries in acute hepatic failure
DUAN Mei-Li,WANG Yan-Jun,HAN De-Wu
Shan-Xi Medical University,Taiyuan(030001)
Abstract AIM:To elucidate the mechanism of intestinal mucosa injuries,as well as the preventive and cure effect of Chinese Medicine Rheum,in acute hepatic failure (AHF) induced by thioacetamide(TAA).METHODS:Endotoxin content by the Limulus test;glutamine content by phenol-hypochlorite method;glutaminase activity and histamine content by fluorescence method;intestinal mucosal permeability by Evans blue method.RESULTS:AHF induced by TAA resulted in intestinal endotoxemia (IETM),reduce of glutaminase activity and glutamine utilization,increase of intestinal mucosal permeability.Histological observation showed that degeneration,necrosis of liver cells,edema,extravasated blood,erosion and degranulation of the mast cells in intestine mucosa.Electron microscope displayed intestinal microvilli fell off,the tight junction damaged.In Rheum-treated group,the last changes alleviated.CONCLUSION:Intestinal mucosa injuries were important complication in AHF,its mechanism was related to IETM and hyperhistaminemia.Rheum was effective for the prevention and therapy of intestinal mucosa injuries in AHF.
, 百拇医药
MeSH Liver;Endotoxins;Intestinal mucosa;Rhubarb
近年来,对于急性肝衰时IETM产生机制的研究多侧重于研究枯否细胞功能障碍[1];对肠粘膜屏障功能衰竭在IETM发生中的作用多限于烧伤、失血性休克等情况[2]。为此,本文通过动物实验探讨急性肝衰时肠粘膜屏障变化及其机制,同时观察大黄(Rheum)的防治作用。
材料与方法
(一)动物模型:取Wistar大鼠30只,体重200~240 g,雌雄各半,随机分成3组:对照组、TAA组、Rheum+TAA组。实验第一日起,第3组动物每日皮下注射大黄2 mL(含生药1.0 g)1次。第3日起,后两组动物皮下注射TAA(600mg/kg)1次。对照组同样注射生理盐水2 mL。24 h后相同剂量TAA重复注射1次。然后三组动物全部禁食不禁水,次日在乙醚麻醉下进行生化指标测定和组织学观察。
, 百拇医药
(二)测定方法:1.内毒素定量采用鲎试剂法,鲎试剂盒由上海临床检验中心提供;2.谷氨酰胺含量采用酚一次氯酸法;3.荧光法测定谷氨酰胺酶活性和组胺含量,其中所用L-谷氨酸脱氢酶由北京生物化学试剂中心提供;4.肠粘膜及血管通透性测定采用Evans蓝染色法[3],Evans蓝由上海化学试剂采购供应站提供;5.肝脏、小肠组织行HE染色,小肠肥大细胞行甲苯胺蓝染色,且小肠粘膜经戊二醛固定进行透射电镜观察。
(三)全部数据用均数±标准差( ±s)表示,并采用方差分析、t检验或t′检验进行统计学处理。
±s)表示,并采用方差分析、t检验或t′检验进行统计学处理。
结果
(一)动物的一般状况:第一次给药12 h后,TAA组动物活动及觅食减少;第二次给药后,动物嗜睡,对外界刺激反应微弱。
, 百拇医药
(二)各组动物有关生化指标改变:见表1~4。
表1 各组动物血浆ALT,AST,TB和内毒素的变化
Tab 1 Variation of plasma ALT、AST、TB and endotoxin(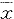 ±s)
±s)
Groups
n
ALT
(U/L)
AST
, 百拇医药 (U/L)
TB
(μmol/L)
Endotoxin
(×103 EU/6L)
Normal
8
20.28±4.32
41.25±13.41
19.66±0.69
0.20±0.06
TAA
, 百拇医药
10
1473.29±293.74*
692.46±148.97*
87.72±53.35*
0.68±0.14*
Rheum+TAA
8
643.80±131.78**
327.34±208.53**
37.10±18.81**
, 百拇医药
0.48±0.10**
*P<0.01,vs normal; **P<0.01,vs group TAA 表2 各组动物谷氨酰胺含量及谷氨酰胺酶活性比较
Tab 2 Comparison of glutamine content and glutaminase activity
in intestine and plasma (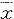 ±s)
±s)
Group
n
Glutaminase
, http://www.100md.com
activity(mmol.h-1.g-1
tissue)
Glutamine
Plasma
(mg/dL)
Intestine
(mg.g-1 tissue)
Normal
7
2.25±0.45
, http://www.100md.com
42.73±23.99
2.62±3.17
TAA
8
1.56±0.25*
204.53±95.61*
15.80±8.74*
Rheum+TAA
8
1.65±0.28**
141.17±85.75**
, 百拇医药
10.75±6.33**
*P<0.05,vs normal; **P<0.05,vs group TAA 表3 各组动物肠Evans蓝含量及通透指数δ的变化
Tab 3 Variation of Evans blue content and permeability index
in intestine (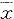 ±s)
±s)
Groups
n
Evans blue
, http://www.100md.com
(mg/dL)
δ
Normal
8
4.49±1.10
1.38±0.64
TAA
8
12.32±2.82*
4.42±0.86*
Rheum+TAA
10
, 百拇医药
5.35±1.88**
2.06±0.90**
*P<0.05,vs Normal;P<0.01,vs group TAA 表4 各组动物血浆内毒素、全血及肠组胺含量的变化
Tab 4 Variation of plasma endotoxin and histamine in blood
and intestine (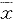 ±s,n=6)
±s,n=6)
Group
, 百拇医药 Endotoxin
(×103 EU/L)
Histamine
Blood
(μg/dL)
Intestine
(mg.g-1 tissue)
Normal
0.14±0.05
1.79±1.34
0.11±0.08
, 百拇医药
TAA
0.48±0.13*
12.52±2.96*
1.08±0.33*
Rheum+TAA
0.26±0.07△
10.80±2.26△
0.98±0.09△
*P<0.05,vs normal;△P<0.05,vs group TAA
, 百拇医药 (三)血浆内毒素含量与肠组胺含量相关分析:结果表明,肠组胺含量与血浆内毒素水平呈明显正相关r=0.81,P<0.01。
(四)组织学观察:光镜下,TAA组动物肝小叶中央静脉周围肝细胞变性、坏死,可有充血、炎性细胞浸润,其范围可达肝小叶的2/3左右;肠粘膜淤血、水肿、糜烂。对照组动物肠肥大细胞膜完整,紫红色颗粒清晰可见,而TAA组动物肠肥大细胞有明显脱颗粒现象。
电镜下,TAA组肠粘膜微绒毛减少、倒伏、脱落,细胞间紧密连接被破坏,可见线粒体肿胀。大黄组上述组织学改变减轻。
讨论
一、急性肝衰时肠粘膜屏障损害及其机制:
肠粘膜屏障指肠粘膜抵御肠道细菌及其毒素的吸收的功能。它由肠表面粘液、 肠粘膜上皮细胞及其间紧密连接、 基膜所组成。肠道内存在大量G细菌,菌体自溶后放出内毒素。正常情况下,肠粘膜是肠道内毒素的有效屏障。即便用小量吸收,经门脉入肝脏,也几乎被枯否细胞清除。
, 百拇医药
本研究发现,TAA引发急性肝衰时可发生肠粘膜淤血、 水肿、 糜烂,肠粘膜及其血管通透性增加,大量内毒素经门静脉或淋巴管入血,从而产生IETM。此外,急性肝衰时枯否细胞清除功能受到抑制;再有胆汁排泄受阻,肠道内胆盐减少也有利于内毒素吸收而促进IETM形成。
许多研究表明,IETM形成后,血中的内毒素可通过其直接或间接作用,破坏肠粘膜屏障的完整性,产生IETM[4]。内毒素可损伤肠粘膜上皮细胞线粒体和溶酶体膜;也可收缩肠粘膜小血管,并激活黄嘌呤氧化酶[5],产生氧自由基,导致肠粘膜缺血缺氧。内毒素也可以激活枯否细胞释放许多炎性介质和细胞因子[6],如组胺、TNF、IL-2,等等引起肠粘膜屏障损伤与其屏障功能减弱。
小肠是谷氨酰胺吸收的主要器官,谷氨酰胺是小肠的主要呼吸燃料。实验表明,急性肝衰时,血中谷氨酰胺并不降低,反而升高,这是急性肝衰时血浆氨基酸模式改变的结果。由于内毒素使谷氨酰胺酶活性降低[7],致使肠利用谷氨酰胺减少,造成肠能源不足。Souba等[7]的实验也得出类似结论。这就提示急性肝衰时发生IETM,它可干扰肠谷氨酰胺代谢,使肠组织利用谷氨酰胺减少。此外,小肠从血中摄取谷氨酰胺也减少[8],导致肠营养障碍,加重肠粘膜屏障功能衰竭。
, 百拇医药
本实验再次证明,IETM的形成除枯否细胞清除能力下降外,肠粘膜屏障功能衰竭所致的肠内毒素吸收增多也是重要原因。
二、大黄对急性肝衰合并肠粘膜损伤的防治作用:
药理研究证明,大黄具有泻下、抑菌、消炎、保肝等作用。上述结果表明,大黄可减轻TAA所致肝损伤。这可能与大黄减轻IETM有关。
有学者报道,大黄可改善肠道微循环,保护肠粘膜屏障,并降低肠粘膜的毛细血管通透性[9],从而减少肠道内毒素的吸收;大黄的泻下作用可促进肠道内毒素的排除,因而中药大黄可减轻IETM。
参考文献
1 韩德五.肝功能衰竭发病机制研究进展.中国病理生理杂志,1993,9:770.
2 Deith EA,Specian RD,Berg RD.Endotoxin-induced bacterial translocation and mucosal permeability.Crit Care Med,1991,19:785.
, 百拇医药
3 戴顺龄,薛全福,王树山,等.山莨菪碱及川芎嗪预防大鼠肺水肿的实验研究.中国病理生理杂志,1989,5:354.
4 Saadia R,Schein M,MacFarlane C,et al.Gut barrier function and the surgeon.Br J Surg,1990,77:487.
5 Koshi R,David S,Mathan VI,et al.Enteric vascular endothelial response to bacterial endotoxin.Int J Exp Path,1993,74:539.
6 Roland CR,COSS JA,Mangino MJ,et al.Autoregulation by eicosanoids of human Kupffer cell secretory products.Ann Surg,1994,219:389.
, 百拇医药
7 Souba WW,Herskowitz K,Klimberg VS,et al.The effects of sepsis and endotoxemia on gut glutamine metabolism. Ann Surg,1990,211:543.
8 Dudricr PS,Salloum RM,Copeland EM,et al.The early response of jejounal brush border glutamine transporter to endotoxemia.J Surg Res,1992,52:372.
9 陈德昌,杨建东,景炳文,等.大黄对大鼠肠粘膜及肠血管通透性的影响.中国危重病急救医学,1997,9:385.
(1998年3月17日收稿,1998年11月6日修回), http://www.100md.com
单位:段美丽 王彦军 :山西医科大学第一医院(太原 030001);韩德五:山西医科大学病理生理教研室
关键词:肝;内毒素类;肠粘膜;大黄
急性肝功能衰竭时肠粘膜屏障损伤的研究 摘要 目的:探讨急性肝功能衰竭(简称肝衰)时肠粘膜屏障损伤及其机制,并观察中药大黄对它的防治作用。方法:采用鲎试剂法作血浆内毒素定量,酚一次氯酸法测定谷氨酰胺浓度及荧光法测定谷氨酰胺酶活性和组胺含量,Evans蓝染色法测定肠粘膜通透性。结果:硫代乙酰胺(thioacetamide,TAA)引发大鼠急性肝衰,并伴有严重的肠源性内毒素血症(intestinal endotoxemia,IETM)。肠谷氨酰胺酶活性降低,肠粘膜对谷氨酰胺利用减少,肠粘膜通透性增加。组织细胞学显示,TAA组动物肝细胞发生严重变性坏死;肠粘膜淤血、水肿、糜烂,肠肥大细胞脱颗粒。电镜示肠微绒毛倒伏、脱落,细胞间紧密连接破坏。大黄组动物IETM与肝组织损伤明显减轻。结论:急性肝衰伴有肠粘膜屏障损伤,其发生机制与IETM及其介导的组胺增多有关。大黄对急性肝衰时肠粘膜屏障损伤有一定防治作用。
, http://www.100md.com
Studies on intestinal mucosa barrier injuries in acute hepatic failure
DUAN Mei-Li,WANG Yan-Jun,HAN De-Wu
Shan-Xi Medical University,Taiyuan(030001)
Abstract AIM:To elucidate the mechanism of intestinal mucosa injuries,as well as the preventive and cure effect of Chinese Medicine Rheum,in acute hepatic failure (AHF) induced by thioacetamide(TAA).METHODS:Endotoxin content by the Limulus test;glutamine content by phenol-hypochlorite method;glutaminase activity and histamine content by fluorescence method;intestinal mucosal permeability by Evans blue method.RESULTS:AHF induced by TAA resulted in intestinal endotoxemia (IETM),reduce of glutaminase activity and glutamine utilization,increase of intestinal mucosal permeability.Histological observation showed that degeneration,necrosis of liver cells,edema,extravasated blood,erosion and degranulation of the mast cells in intestine mucosa.Electron microscope displayed intestinal microvilli fell off,the tight junction damaged.In Rheum-treated group,the last changes alleviated.CONCLUSION:Intestinal mucosa injuries were important complication in AHF,its mechanism was related to IETM and hyperhistaminemia.Rheum was effective for the prevention and therapy of intestinal mucosa injuries in AHF.
, 百拇医药
MeSH Liver;Endotoxins;Intestinal mucosa;Rhubarb
近年来,对于急性肝衰时IETM产生机制的研究多侧重于研究枯否细胞功能障碍[1];对肠粘膜屏障功能衰竭在IETM发生中的作用多限于烧伤、失血性休克等情况[2]。为此,本文通过动物实验探讨急性肝衰时肠粘膜屏障变化及其机制,同时观察大黄(Rheum)的防治作用。
材料与方法
(一)动物模型:取Wistar大鼠30只,体重200~240 g,雌雄各半,随机分成3组:对照组、TAA组、Rheum+TAA组。实验第一日起,第3组动物每日皮下注射大黄2 mL(含生药1.0 g)1次。第3日起,后两组动物皮下注射TAA(600mg/kg)1次。对照组同样注射生理盐水2 mL。24 h后相同剂量TAA重复注射1次。然后三组动物全部禁食不禁水,次日在乙醚麻醉下进行生化指标测定和组织学观察。
, 百拇医药
(二)测定方法:1.内毒素定量采用鲎试剂法,鲎试剂盒由上海临床检验中心提供;2.谷氨酰胺含量采用酚一次氯酸法;3.荧光法测定谷氨酰胺酶活性和组胺含量,其中所用L-谷氨酸脱氢酶由北京生物化学试剂中心提供;4.肠粘膜及血管通透性测定采用Evans蓝染色法[3],Evans蓝由上海化学试剂采购供应站提供;5.肝脏、小肠组织行HE染色,小肠肥大细胞行甲苯胺蓝染色,且小肠粘膜经戊二醛固定进行透射电镜观察。
(三)全部数据用均数±标准差(
结果
(一)动物的一般状况:第一次给药12 h后,TAA组动物活动及觅食减少;第二次给药后,动物嗜睡,对外界刺激反应微弱。
, 百拇医药
(二)各组动物有关生化指标改变:见表1~4。
表1 各组动物血浆ALT,AST,TB和内毒素的变化
Tab 1 Variation of plasma ALT、AST、TB and endotoxin(
Groups
n
ALT
(U/L)
AST
, 百拇医药 (U/L)
TB
(μmol/L)
Endotoxin
(×103 EU/6L)
Normal
8
20.28±4.32
41.25±13.41
19.66±0.69
0.20±0.06
TAA
, 百拇医药
10
1473.29±293.74*
692.46±148.97*
87.72±53.35*
0.68±0.14*
Rheum+TAA
8
643.80±131.78**
327.34±208.53**
37.10±18.81**
, 百拇医药
0.48±0.10**
*P<0.01,vs normal; **P<0.01,vs group TAA 表2 各组动物谷氨酰胺含量及谷氨酰胺酶活性比较
Tab 2 Comparison of glutamine content and glutaminase activity
in intestine and plasma (
Group
n
Glutaminase
, http://www.100md.com
activity(mmol.h-1.g-1
tissue)
Glutamine
Plasma
(mg/dL)
Intestine
(mg.g-1 tissue)
Normal
7
2.25±0.45
, http://www.100md.com
42.73±23.99
2.62±3.17
TAA
8
1.56±0.25*
204.53±95.61*
15.80±8.74*
Rheum+TAA
8
1.65±0.28**
141.17±85.75**
, 百拇医药
10.75±6.33**
*P<0.05,vs normal; **P<0.05,vs group TAA 表3 各组动物肠Evans蓝含量及通透指数δ的变化
Tab 3 Variation of Evans blue content and permeability index
in intestine (
Groups
n
Evans blue
, http://www.100md.com
(mg/dL)
δ
Normal
8
4.49±1.10
1.38±0.64
TAA
8
12.32±2.82*
4.42±0.86*
Rheum+TAA
10
, 百拇医药
5.35±1.88**
2.06±0.90**
*P<0.05,vs Normal;P<0.01,vs group TAA 表4 各组动物血浆内毒素、全血及肠组胺含量的变化
Tab 4 Variation of plasma endotoxin and histamine in blood
and intestine (
Group
, 百拇医药 Endotoxin
(×103 EU/L)
Histamine
Blood
(μg/dL)
Intestine
(mg.g-1 tissue)
Normal
0.14±0.05
1.79±1.34
0.11±0.08
, 百拇医药
TAA
0.48±0.13*
12.52±2.96*
1.08±0.33*
Rheum+TAA
0.26±0.07△
10.80±2.26△
0.98±0.09△
*P<0.05,vs normal;△P<0.05,vs group TAA
, 百拇医药 (三)血浆内毒素含量与肠组胺含量相关分析:结果表明,肠组胺含量与血浆内毒素水平呈明显正相关r=0.81,P<0.01。
(四)组织学观察:光镜下,TAA组动物肝小叶中央静脉周围肝细胞变性、坏死,可有充血、炎性细胞浸润,其范围可达肝小叶的2/3左右;肠粘膜淤血、水肿、糜烂。对照组动物肠肥大细胞膜完整,紫红色颗粒清晰可见,而TAA组动物肠肥大细胞有明显脱颗粒现象。
电镜下,TAA组肠粘膜微绒毛减少、倒伏、脱落,细胞间紧密连接被破坏,可见线粒体肿胀。大黄组上述组织学改变减轻。
讨论
一、急性肝衰时肠粘膜屏障损害及其机制:
肠粘膜屏障指肠粘膜抵御肠道细菌及其毒素的吸收的功能。它由肠表面粘液、 肠粘膜上皮细胞及其间紧密连接、 基膜所组成。肠道内存在大量G细菌,菌体自溶后放出内毒素。正常情况下,肠粘膜是肠道内毒素的有效屏障。即便用小量吸收,经门脉入肝脏,也几乎被枯否细胞清除。
, 百拇医药
本研究发现,TAA引发急性肝衰时可发生肠粘膜淤血、 水肿、 糜烂,肠粘膜及其血管通透性增加,大量内毒素经门静脉或淋巴管入血,从而产生IETM。此外,急性肝衰时枯否细胞清除功能受到抑制;再有胆汁排泄受阻,肠道内胆盐减少也有利于内毒素吸收而促进IETM形成。
许多研究表明,IETM形成后,血中的内毒素可通过其直接或间接作用,破坏肠粘膜屏障的完整性,产生IETM[4]。内毒素可损伤肠粘膜上皮细胞线粒体和溶酶体膜;也可收缩肠粘膜小血管,并激活黄嘌呤氧化酶[5],产生氧自由基,导致肠粘膜缺血缺氧。内毒素也可以激活枯否细胞释放许多炎性介质和细胞因子[6],如组胺、TNF、IL-2,等等引起肠粘膜屏障损伤与其屏障功能减弱。
小肠是谷氨酰胺吸收的主要器官,谷氨酰胺是小肠的主要呼吸燃料。实验表明,急性肝衰时,血中谷氨酰胺并不降低,反而升高,这是急性肝衰时血浆氨基酸模式改变的结果。由于内毒素使谷氨酰胺酶活性降低[7],致使肠利用谷氨酰胺减少,造成肠能源不足。Souba等[7]的实验也得出类似结论。这就提示急性肝衰时发生IETM,它可干扰肠谷氨酰胺代谢,使肠组织利用谷氨酰胺减少。此外,小肠从血中摄取谷氨酰胺也减少[8],导致肠营养障碍,加重肠粘膜屏障功能衰竭。
, 百拇医药
本实验再次证明,IETM的形成除枯否细胞清除能力下降外,肠粘膜屏障功能衰竭所致的肠内毒素吸收增多也是重要原因。
二、大黄对急性肝衰合并肠粘膜损伤的防治作用:
药理研究证明,大黄具有泻下、抑菌、消炎、保肝等作用。上述结果表明,大黄可减轻TAA所致肝损伤。这可能与大黄减轻IETM有关。
有学者报道,大黄可改善肠道微循环,保护肠粘膜屏障,并降低肠粘膜的毛细血管通透性[9],从而减少肠道内毒素的吸收;大黄的泻下作用可促进肠道内毒素的排除,因而中药大黄可减轻IETM。
参考文献
1 韩德五.肝功能衰竭发病机制研究进展.中国病理生理杂志,1993,9:770.
2 Deith EA,Specian RD,Berg RD.Endotoxin-induced bacterial translocation and mucosal permeability.Crit Care Med,1991,19:785.
, 百拇医药
3 戴顺龄,薛全福,王树山,等.山莨菪碱及川芎嗪预防大鼠肺水肿的实验研究.中国病理生理杂志,1989,5:354.
4 Saadia R,Schein M,MacFarlane C,et al.Gut barrier function and the surgeon.Br J Surg,1990,77:487.
5 Koshi R,David S,Mathan VI,et al.Enteric vascular endothelial response to bacterial endotoxin.Int J Exp Path,1993,74:539.
6 Roland CR,COSS JA,Mangino MJ,et al.Autoregulation by eicosanoids of human Kupffer cell secretory products.Ann Surg,1994,219:389.
, 百拇医药
7 Souba WW,Herskowitz K,Klimberg VS,et al.The effects of sepsis and endotoxemia on gut glutamine metabolism. Ann Surg,1990,211:543.
8 Dudricr PS,Salloum RM,Copeland EM,et al.The early response of jejounal brush border glutamine transporter to endotoxemia.J Surg Res,1992,52:372.
9 陈德昌,杨建东,景炳文,等.大黄对大鼠肠粘膜及肠血管通透性的影响.中国危重病急救医学,1997,9:385.
(1998年3月17日收稿,1998年11月6日修回), http://www.100md.com