脂质体介导的VEGF基因对培养血管细胞增殖的影响*
作者:蒋学俊 魏炜 熊一力 陆再英
单位:同济医科大学附属同济医院心内科(武汉 430030)
关键词:内皮生长因子;脂质体;转染;肌;平滑
中国病理生理杂志991004 摘要 目的:观察脂质体介导转移的VEGF基因在血管平滑肌细胞(VSMC)中的表达,比较VEGF对血管内皮细胞(VEC)及VSMC增殖的影响。方法:将含血管内皮生长因子(VEGF)cDNA的真核表达载体pSVI21用脂质体介导的基因转移法导入血管平滑肌细胞(VSMC)中,取此VSMC条件培养液,再行血管内皮细胞(VEC)培养,用Northern blot杂交,Western印迹法及[3H]胸腺嘧啶核苷掺入法,观察了VEGF在VSMC及其条件培养液中的表达,比较了VEGF对VEC及VSMC增殖的影响。结果:转基因组VSMC中VEGF mRNA 呈稳定高表达,转基因组VSMC条件培养液中,VEGF抗原表达显著高于对照组(P均<0.01),加入此条件培养液的各组VEC的[3H]胸腺嘧啶核苷掺入量均显著高于对照组(P均<0.01),而在VSMC组无显著差异。结论:VEGF的转录和表达表明脂质体介导的血管细胞VEGF基因转移是成功的。VEGF具有促VEC增殖作用,但对VSMC无促增殖作用,有利于缺血性疾病及血管再狭窄的防治。
, 百拇医药
Effect of liposome-mediated vascular endothelial growth factor gene
on proliferation of cultured vascular cells
JIANG Xue-Jun,WEI Wei,XIONG Yi-Li,LU Zai-Ying
Department of Cardiology,Affiliated Tongji Hospital,Tongji Medical University,Wuhan (430030)
Abstract AIM: Observe the expression of liposome-mediated vascular endothelial growth factor (VEGF) gene of in vitro vascular smooth muscle cells(VSMC),and compare the effect of VEGF on proliferation of vessel endothelium cell and VSMC.METHODS: An eukaryotic expression vector pSVI21 containing VEGF cDNA was transferred into VSMC in vitro by lipofectamineTM reagent-mediated method.Vascular endothelial cells(VEC) were cultured with the above VSMC conditioned medium.In order to determine the expression of VEGF mRNA in VSMC and VEGF antigen in VSMC conditional medium,and compared the effect of VEGF on proliferation of VEC and VSMC,Northern blot,Western blot and [3 H]-thymidine ([3 H]TdR) incorporation were used.RESULTS: The expression of VEGF mRNA in transgene VSMC groups was higher.The expression of VEGF antigen in transgenic medium was significantly higher (P<0.01) than control group,[3 H]TdR data(counts.min-1) was significantly higher in VEC groups added transgenic medium than control group(P<0.01),but there was no significant difference between VSMC groups.CONCLUSION: The method of liposome-mediated VEGF gene transfer into VSMC is successful.VEGF might promote proliferation of VEC,but didn't cause proliferation of VSMC,which is favorable for preventing and treating ischemic disease and artery restenosis.
, 百拇医药
MeSH Endothelial growth factors;Liposomes;Transfection;Muscle,smooth
血管内皮生长因子(vascular endothelium growth factor,VEGF)是近年发现能高效、特异促血管内皮细胞(vascular endothelial cell,VEC)有丝分裂、继而促进血管形成的一种糖蛋白[1]。因而,VEGF或其基因有望在冠脉缺血和肢体缺血等疾病中发挥重要作用。本实验利用脂质体介导的基因转移法将含VEGFcDNA的真核表达载体pSVI21导入体外培养的血管平滑肌细胞(vascular smooth muscle cell,VSMC)中,并将转染后的条件培养液作用于培养的VEC,观察VEGF在VSMC及其条件培养液中的表达,比较其对VSMC和VEC 增殖的影响,探讨VEGF基因向血管细胞转移的可行性及其对细胞增殖的影响。
材料与方法
, 百拇医药
(一)质粒的提取与纯化:应用含人VEGF的真核表达载体pSVI21(美国Boston大学心血管研究所吴天根博士惠赠),经酶切鉴定后,用碱裂解法提取并纯化质粒[2],保存备用。
(二)细胞培养、基因转移及分组: 取兔主动脉,消化并分离内皮细胞,加入含10%胎牛血清的M199培养液(Gbico BRL公司)于37℃ 5% CO2 培养箱中培养,通过形态特征和Ⅷ因子相关抗原进行鉴定。同时用贴块法行VSMC培养,通过形态特征和(α-actin抗原进行鉴定[3]。基因转移采用脂质体介导法[4],每组于装有小盖玻片的培养皿中种入5×105VSMC,培养过夜,次日换无血清培养基,将质粒与脂质体(lipofectamineTM reagent,购自Life Technologies公司)混匀(含量见各组),室温下静置15 min后,加入培养皿并加入无血清培养基至10 mL,16 h后换液,继续培养48 h。将第2代对数生长期VSMC分6组分别为:VSMC1组pSVI21 15 μg+脂质体45 μg;VSMC2组pSVI21 30 μg+脂质体90 μg;VSMC3组pSVI21 60 μg+ 脂质体180 μg;VSMC4组加入不含VEGF cDNA的载体30 μg为空载体对照组;VSMC5组加入脂质体90μg为脂质体对照组;VSMC6仅加无血清培养基为空白对照组。
, 百拇医药
另外将第3代对数生长期的VEC分为4组,每组5×105接种于装有盖玻片的培养瓶培养过夜后,VEC1,VEC2及VEC3组分别换VEGF基因转染48 h后的VSMC1、VSMC2及VSMC3组的条件培养液各5 mL,加常规培养液至10 mL,VEC4组仅换等量常规培养液继续培养48 h,另外在剩有各种培养液5 mL的各组VSMC培养皿中也均加常规培养液至10 mL,继续培养48 h。
(三)Northern blot杂交:取各组VSMC制备成109/L的细胞悬液,加10 mL常规培养液,孵育24 h后,换无血清M199 24 h时收集细胞,按Gibco公司 BRLTRIZOLTM reagent使用说明,抽提细胞总RNA,每组总RNA用量10 μg。Northern blot杂交参照Sambrook方法[5]进行。[32P]dATP标记VEGF cDNA用随机引物法,操作步骤按试剂盒(Promega公司)说明进行,观察各组VSMC的VEGF mRNA的表达。
, 百拇医药
(四)Western印迹法分析:取各组VSMC条件培养液行蛋白质电转移与膜封闭,抗原抗体反应按《分子克隆实验指南》[6]方法进行。一抗为兔抗人VEGF(购自中山生物技术公司),二抗用辣根过氧化物酶标记的羊抗兔IgG(购自中山生物技术公司),显色程度用MPIAS-500多媒体图象分析系统分析以积分光密度表示VEGF含量。
(五)[3H]胸腺嘧啶核苷掺入量测定[7]:将VSMC 1~6组及VEC 1,2,3,4组细胞以5×104/孔接种于96孔培养板,12孔/组,常规培养24 h后换无血清培养液继续培养24 h收集标本,每次收样前6 h加[3H]TdR(购自上海核技术开发公司)37MBq/L,收样时弃培养基,洗涤,溶细胞后收至液闪瓶中,避光24 h,在液体闪烁计数仪(瑞典RACKBETA LKB1215)上行放射活性计数,以判断各组细胞的增殖情况。
, 百拇医药 (六)统计分析:数据均以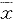 ±s表示,组间比较采用t检验。
±s表示,组间比较采用t检验。
结果
(一)VSMC中VEGF mRNA的表达:Northern杂交结果中VSMC1~3组中,VEGF mRNA表达明显强于VEGF 4~6组(见图1),说明3组转基因VSMC 中VEGF mRNA的表达丰度远高于3组对照组细胞。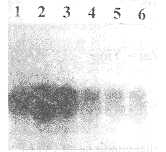
Fig 1 VEGF mRNA expression in VSMC1-6
图1 VSMC中VEGF mRNA的表达
(二) VEGF抗原在培养液中的表达:从Western结果看,VSMC 4~6组条件培养液中,VEGF抗原表达较弱(2.6±1.0,2.3±0.8,2.5±0.8),而VSMC 1~3组培养液中VEGF抗原表达较对照组显著增强(5.8±1.0,6.1±1.3,6.8±1.9),P值均<0.01,随pSVI21含量的增加VEGF抗原表达也逐渐增高。
, 百拇医药
(三)VEGF对VSMC及VEC增殖的作用:[3H]TdR掺入量在VSMC各组均很低,且各组之间均无显著差异(P>0.05),而在VEC1~3组均显著高于VEC4对照组(P<0.01),但VEC1~3组间差异无显著(见表1),说明转染pSVI21后的VSMC条件培养液对VSMC增殖无明显影响,但对VEC有非常显著的促增殖作用。
表1 各组细胞[3 H]-TdR掺入量(counts.min-1)
Tab 1 The [3H]-TdR incorporation data of each group( ±s,n=12) counts.min-1
±s,n=12) counts.min-1
, http://www.100md.com
Group
n
VEC
1
1283.5±142.6**
2
1440.1±189.7**
3
1709.8±201.3**
4
409.5±89.7
1
, 百拇医药
134.0±26.4
VSMC
2
122.9±16.8
3
122.4±17.5
4
131.9±23.1
5
132.5±23.3
6
134.7±25.6
, http://www.100md.com ** P<0.01,vs VEC4;There is no significant difference between VSMC 1~6
讨论
冠心病是死亡率最高的疾病之一,冠状动脉粥样硬化导致血管狭窄达到一定的程度,只有借助于循环重建,方能达到缺血心肌再灌注,70年代到80年代外科搭桥(bypass)手术挽救了大量的冠心病人,但手术的巨大创伤,吻合口狭窄及弥漫的病变等均限制了其临床应用价值。1977年兴起的经皮腔内血管成形术(percutaneous transluminal coronary angioplasty,PTCA)使部分冠心病患者的症状免除了开胸手术,重建有效循环,症状得以改善,但PTCA的远期疗效不能令人满意,术后6个月内的再狭窄率高达30%~50%,且至今尚无有效防治方法。因此,近年来冠心病的治疗方式已由单纯的被动扩张冠脉,人工建立新的血流通路进入了促进健康冠脉主动形成,建立丰富的侧枝循环,即所谓“血管再生治疗”阶段。血管生成需要血管生成因子的刺激,在已发现的血管生成因子中,VEGF的作用最强并具有高度特异性。VEGF可由VSMC产生,通过旁分泌途径特异性作用于VEC表面的VEGF受体,强烈促进新生血管形成[8]。
, 百拇医药
本研究表明,VSMC 1~3组中脂质体介导的基因转移在VSMC中有VEGF mRNA的转录,在VSMC培养液中能有效表达出VEGF蛋白,证明VEGF基因转移是成功的。在加有经VEGF cDNA转染的VSMC条件培养液的VEC 1-3组中,[3H]-TdR掺入量较对照组明显增多,说明VEGF对VEC有明显促增殖作用,有利于血管新生[9]。但随着VEGF含量的增加,VEC 1~3组之间[3H]TdR掺入量无明显差异,无明显的量效关系,这可能与VEC受体在VEGF表达一定量时已达饱和有关。另外,在相应的VSMC 1~6组中,[3H]TdR掺入量均无增高,每组间亦无差异,证实了VEGF仅特异作用于VEC,没有促VSMC增殖的作用,因而不会加重再狭窄的形成。VEC与VSMC都是冠脉的主要细胞成分,VEC损伤时,可由血小板聚集,血栓形成致VSMC增殖,这是血管成形术后再狭窄的主要病理机制[10],因此,VEGF加速VEC的修复,还可能对抑制VSMC增殖, 预防再狭窄有重要意义。
, http://www.100md.com
*湖北省重点科技发展项目(96B63)及中国博士后基金(1996)资助
参考文献
1 Ferrara A.Vascular endothelial growth factor.Trends Cardiovasc Med,1993, 3:244.
2 姜 泊,张亚历,周殿元,主编.分子生物学常用实验方法.第1版.北京:人民军医出版社,1996.3.
3 熊一力,赵华月.穿心莲成分API0134对猪主动脉平滑肌增殖的抑制作用.中华心血管病杂志,1995,23:214.
4 Itani T,Ariga H,Nobuo Y.A simple and effecient liposome method for transfection of DNA into mammalian cells growing suspension.Gene,1987, 56:267.
, 百拇医药
5 Sambrook J,Fritsch EF,Maniatis T.Molecular cloning,A laboratory manual.2nd ed.New York: Cold Spring Harbor Laboratory Press,1989,343.
6 金冬雁,黎孟枫译.分子克隆实验指南.第2版.科学出版社, 1995.888~898.
7 Xiong YiLi,Zhao Huayue.Effect of captopril on proliferation of aortic smooth muscle cells.Acta Phamacologica Sinica,1996,17(6):503.
8 Levy AP,Lery NS,Loscalzo J,et al.Regulation of vascular endothelial growth factor in cardiac myocytes.Circ Res,1995,76(5):758.
9 Cormolly DT,Olander JV,Heuvelmant D,et al.Human vascular permeability factor.J Biol Chem,1989,64: 20017.
10 Pickering JG,Jaclynn J,Weir L.Liposome-mediated gene transfer into human vascular smooth muscle cells.Circulation,1994,89(1):13.
(1997年10月6日收稿,1999年8月14日修回), 百拇医药
单位:同济医科大学附属同济医院心内科(武汉 430030)
关键词:内皮生长因子;脂质体;转染;肌;平滑
中国病理生理杂志991004 摘要 目的:观察脂质体介导转移的VEGF基因在血管平滑肌细胞(VSMC)中的表达,比较VEGF对血管内皮细胞(VEC)及VSMC增殖的影响。方法:将含血管内皮生长因子(VEGF)cDNA的真核表达载体pSVI21用脂质体介导的基因转移法导入血管平滑肌细胞(VSMC)中,取此VSMC条件培养液,再行血管内皮细胞(VEC)培养,用Northern blot杂交,Western印迹法及[3H]胸腺嘧啶核苷掺入法,观察了VEGF在VSMC及其条件培养液中的表达,比较了VEGF对VEC及VSMC增殖的影响。结果:转基因组VSMC中VEGF mRNA 呈稳定高表达,转基因组VSMC条件培养液中,VEGF抗原表达显著高于对照组(P均<0.01),加入此条件培养液的各组VEC的[3H]胸腺嘧啶核苷掺入量均显著高于对照组(P均<0.01),而在VSMC组无显著差异。结论:VEGF的转录和表达表明脂质体介导的血管细胞VEGF基因转移是成功的。VEGF具有促VEC增殖作用,但对VSMC无促增殖作用,有利于缺血性疾病及血管再狭窄的防治。
, 百拇医药
Effect of liposome-mediated vascular endothelial growth factor gene
on proliferation of cultured vascular cells
JIANG Xue-Jun,WEI Wei,XIONG Yi-Li,LU Zai-Ying
Department of Cardiology,Affiliated Tongji Hospital,Tongji Medical University,Wuhan (430030)
Abstract AIM: Observe the expression of liposome-mediated vascular endothelial growth factor (VEGF) gene of in vitro vascular smooth muscle cells(VSMC),and compare the effect of VEGF on proliferation of vessel endothelium cell and VSMC.METHODS: An eukaryotic expression vector pSVI21 containing VEGF cDNA was transferred into VSMC in vitro by lipofectamineTM reagent-mediated method.Vascular endothelial cells(VEC) were cultured with the above VSMC conditioned medium.In order to determine the expression of VEGF mRNA in VSMC and VEGF antigen in VSMC conditional medium,and compared the effect of VEGF on proliferation of VEC and VSMC,Northern blot,Western blot and [3 H]-thymidine ([3 H]TdR) incorporation were used.RESULTS: The expression of VEGF mRNA in transgene VSMC groups was higher.The expression of VEGF antigen in transgenic medium was significantly higher (P<0.01) than control group,[3 H]TdR data(counts.min-1) was significantly higher in VEC groups added transgenic medium than control group(P<0.01),but there was no significant difference between VSMC groups.CONCLUSION: The method of liposome-mediated VEGF gene transfer into VSMC is successful.VEGF might promote proliferation of VEC,but didn't cause proliferation of VSMC,which is favorable for preventing and treating ischemic disease and artery restenosis.
, 百拇医药
MeSH Endothelial growth factors;Liposomes;Transfection;Muscle,smooth
血管内皮生长因子(vascular endothelium growth factor,VEGF)是近年发现能高效、特异促血管内皮细胞(vascular endothelial cell,VEC)有丝分裂、继而促进血管形成的一种糖蛋白[1]。因而,VEGF或其基因有望在冠脉缺血和肢体缺血等疾病中发挥重要作用。本实验利用脂质体介导的基因转移法将含VEGFcDNA的真核表达载体pSVI21导入体外培养的血管平滑肌细胞(vascular smooth muscle cell,VSMC)中,并将转染后的条件培养液作用于培养的VEC,观察VEGF在VSMC及其条件培养液中的表达,比较其对VSMC和VEC 增殖的影响,探讨VEGF基因向血管细胞转移的可行性及其对细胞增殖的影响。
材料与方法
, 百拇医药
(一)质粒的提取与纯化:应用含人VEGF的真核表达载体pSVI21(美国Boston大学心血管研究所吴天根博士惠赠),经酶切鉴定后,用碱裂解法提取并纯化质粒[2],保存备用。
(二)细胞培养、基因转移及分组: 取兔主动脉,消化并分离内皮细胞,加入含10%胎牛血清的M199培养液(Gbico BRL公司)于37℃ 5% CO2 培养箱中培养,通过形态特征和Ⅷ因子相关抗原进行鉴定。同时用贴块法行VSMC培养,通过形态特征和(α-actin抗原进行鉴定[3]。基因转移采用脂质体介导法[4],每组于装有小盖玻片的培养皿中种入5×105VSMC,培养过夜,次日换无血清培养基,将质粒与脂质体(lipofectamineTM reagent,购自Life Technologies公司)混匀(含量见各组),室温下静置15 min后,加入培养皿并加入无血清培养基至10 mL,16 h后换液,继续培养48 h。将第2代对数生长期VSMC分6组分别为:VSMC1组pSVI21 15 μg+脂质体45 μg;VSMC2组pSVI21 30 μg+脂质体90 μg;VSMC3组pSVI21 60 μg+ 脂质体180 μg;VSMC4组加入不含VEGF cDNA的载体30 μg为空载体对照组;VSMC5组加入脂质体90μg为脂质体对照组;VSMC6仅加无血清培养基为空白对照组。
, 百拇医药
另外将第3代对数生长期的VEC分为4组,每组5×105接种于装有盖玻片的培养瓶培养过夜后,VEC1,VEC2及VEC3组分别换VEGF基因转染48 h后的VSMC1、VSMC2及VSMC3组的条件培养液各5 mL,加常规培养液至10 mL,VEC4组仅换等量常规培养液继续培养48 h,另外在剩有各种培养液5 mL的各组VSMC培养皿中也均加常规培养液至10 mL,继续培养48 h。
(三)Northern blot杂交:取各组VSMC制备成109/L的细胞悬液,加10 mL常规培养液,孵育24 h后,换无血清M199 24 h时收集细胞,按Gibco公司 BRLTRIZOLTM reagent使用说明,抽提细胞总RNA,每组总RNA用量10 μg。Northern blot杂交参照Sambrook方法[5]进行。[32P]dATP标记VEGF cDNA用随机引物法,操作步骤按试剂盒(Promega公司)说明进行,观察各组VSMC的VEGF mRNA的表达。
, 百拇医药
(四)Western印迹法分析:取各组VSMC条件培养液行蛋白质电转移与膜封闭,抗原抗体反应按《分子克隆实验指南》[6]方法进行。一抗为兔抗人VEGF(购自中山生物技术公司),二抗用辣根过氧化物酶标记的羊抗兔IgG(购自中山生物技术公司),显色程度用MPIAS-500多媒体图象分析系统分析以积分光密度表示VEGF含量。
(五)[3H]胸腺嘧啶核苷掺入量测定[7]:将VSMC 1~6组及VEC 1,2,3,4组细胞以5×104/孔接种于96孔培养板,12孔/组,常规培养24 h后换无血清培养液继续培养24 h收集标本,每次收样前6 h加[3H]TdR(购自上海核技术开发公司)37MBq/L,收样时弃培养基,洗涤,溶细胞后收至液闪瓶中,避光24 h,在液体闪烁计数仪(瑞典RACKBETA LKB1215)上行放射活性计数,以判断各组细胞的增殖情况。
, 百拇医药 (六)统计分析:数据均以
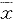 ±s表示,组间比较采用t检验。
±s表示,组间比较采用t检验。结果
(一)VSMC中VEGF mRNA的表达:Northern杂交结果中VSMC1~3组中,VEGF mRNA表达明显强于VEGF 4~6组(见图1),说明3组转基因VSMC 中VEGF mRNA的表达丰度远高于3组对照组细胞。

Fig 1 VEGF mRNA expression in VSMC1-6
图1 VSMC中VEGF mRNA的表达
(二) VEGF抗原在培养液中的表达:从Western结果看,VSMC 4~6组条件培养液中,VEGF抗原表达较弱(2.6±1.0,2.3±0.8,2.5±0.8),而VSMC 1~3组培养液中VEGF抗原表达较对照组显著增强(5.8±1.0,6.1±1.3,6.8±1.9),P值均<0.01,随pSVI21含量的增加VEGF抗原表达也逐渐增高。
, 百拇医药
(三)VEGF对VSMC及VEC增殖的作用:[3H]TdR掺入量在VSMC各组均很低,且各组之间均无显著差异(P>0.05),而在VEC1~3组均显著高于VEC4对照组(P<0.01),但VEC1~3组间差异无显著(见表1),说明转染pSVI21后的VSMC条件培养液对VSMC增殖无明显影响,但对VEC有非常显著的促增殖作用。
表1 各组细胞[3 H]-TdR掺入量(counts.min-1)
Tab 1 The [3H]-TdR incorporation data of each group(
 ±s,n=12) counts.min-1
±s,n=12) counts.min-1, http://www.100md.com
Group
n
VEC
1
1283.5±142.6**
2
1440.1±189.7**
3
1709.8±201.3**
4
409.5±89.7
1
, 百拇医药
134.0±26.4
VSMC
2
122.9±16.8
3
122.4±17.5
4
131.9±23.1
5
132.5±23.3
6
134.7±25.6
, http://www.100md.com ** P<0.01,vs VEC4;There is no significant difference between VSMC 1~6
讨论
冠心病是死亡率最高的疾病之一,冠状动脉粥样硬化导致血管狭窄达到一定的程度,只有借助于循环重建,方能达到缺血心肌再灌注,70年代到80年代外科搭桥(bypass)手术挽救了大量的冠心病人,但手术的巨大创伤,吻合口狭窄及弥漫的病变等均限制了其临床应用价值。1977年兴起的经皮腔内血管成形术(percutaneous transluminal coronary angioplasty,PTCA)使部分冠心病患者的症状免除了开胸手术,重建有效循环,症状得以改善,但PTCA的远期疗效不能令人满意,术后6个月内的再狭窄率高达30%~50%,且至今尚无有效防治方法。因此,近年来冠心病的治疗方式已由单纯的被动扩张冠脉,人工建立新的血流通路进入了促进健康冠脉主动形成,建立丰富的侧枝循环,即所谓“血管再生治疗”阶段。血管生成需要血管生成因子的刺激,在已发现的血管生成因子中,VEGF的作用最强并具有高度特异性。VEGF可由VSMC产生,通过旁分泌途径特异性作用于VEC表面的VEGF受体,强烈促进新生血管形成[8]。
, 百拇医药
本研究表明,VSMC 1~3组中脂质体介导的基因转移在VSMC中有VEGF mRNA的转录,在VSMC培养液中能有效表达出VEGF蛋白,证明VEGF基因转移是成功的。在加有经VEGF cDNA转染的VSMC条件培养液的VEC 1-3组中,[3H]-TdR掺入量较对照组明显增多,说明VEGF对VEC有明显促增殖作用,有利于血管新生[9]。但随着VEGF含量的增加,VEC 1~3组之间[3H]TdR掺入量无明显差异,无明显的量效关系,这可能与VEC受体在VEGF表达一定量时已达饱和有关。另外,在相应的VSMC 1~6组中,[3H]TdR掺入量均无增高,每组间亦无差异,证实了VEGF仅特异作用于VEC,没有促VSMC增殖的作用,因而不会加重再狭窄的形成。VEC与VSMC都是冠脉的主要细胞成分,VEC损伤时,可由血小板聚集,血栓形成致VSMC增殖,这是血管成形术后再狭窄的主要病理机制[10],因此,VEGF加速VEC的修复,还可能对抑制VSMC增殖, 预防再狭窄有重要意义。
, http://www.100md.com
*湖北省重点科技发展项目(96B63)及中国博士后基金(1996)资助
参考文献
1 Ferrara A.Vascular endothelial growth factor.Trends Cardiovasc Med,1993, 3:244.
2 姜 泊,张亚历,周殿元,主编.分子生物学常用实验方法.第1版.北京:人民军医出版社,1996.3.
3 熊一力,赵华月.穿心莲成分API0134对猪主动脉平滑肌增殖的抑制作用.中华心血管病杂志,1995,23:214.
4 Itani T,Ariga H,Nobuo Y.A simple and effecient liposome method for transfection of DNA into mammalian cells growing suspension.Gene,1987, 56:267.
, 百拇医药
5 Sambrook J,Fritsch EF,Maniatis T.Molecular cloning,A laboratory manual.2nd ed.New York: Cold Spring Harbor Laboratory Press,1989,343.
6 金冬雁,黎孟枫译.分子克隆实验指南.第2版.科学出版社, 1995.888~898.
7 Xiong YiLi,Zhao Huayue.Effect of captopril on proliferation of aortic smooth muscle cells.Acta Phamacologica Sinica,1996,17(6):503.
8 Levy AP,Lery NS,Loscalzo J,et al.Regulation of vascular endothelial growth factor in cardiac myocytes.Circ Res,1995,76(5):758.
9 Cormolly DT,Olander JV,Heuvelmant D,et al.Human vascular permeability factor.J Biol Chem,1989,64: 20017.
10 Pickering JG,Jaclynn J,Weir L.Liposome-mediated gene transfer into human vascular smooth muscle cells.Circulation,1994,89(1):13.
(1997年10月6日收稿,1999年8月14日修回), 百拇医药