血小板源生长因子可促进低氧的牛肺动脉平滑肌细胞核内NF-κB表达
作者:黄群华 孙仁宇
单位:(中国医学科学院基础医学研究所 中国协和医科大学基础医学院 病理生理研究室,北京 100005)
关键词:血小板源生长因子;过氧化氢;NF-κB;肺动脉;肌,平滑
中国病理生理杂志000513
[摘 要] 目的:为探讨血小板源生长因子(platelet-derived growth factor,PDGF)受体信号转导途径的介质分子之一过氧化氢( H2O2 )在低氧的肺动脉平滑肌细胞(pulmonary artery smooth muscle cell,PASMC )增殖中是否起作用。方法:应用共聚焦显微镜、细胞免疫组织化学及Western印迹杂交等方法,检测了低氧的PASMC PDGF受体途径中的H2O2的变化及PDGF和H2O2对细胞核内与增殖作用相关的核转录因子NF-κB表达量的影响。 结果:PDGF可使常氧的PASMC中H2O2浓度增高,但明显降低低氧的PASMC中H2O2的量;同一浓度的H2O2,作用于常氧的PASMC,则引起核NF-κB的表达量增加,但对低氧的PASMC核NF-κB有明显的抑制作用;同时加入PDGF和H2O2的低氧的PASMC较仅以H2O2作用的低氧的PASMC,核NF-κB的量显著增加。结论:PDGF受体的信号转导途径在低氧的PASMC同常氧的PASMC相反,H2O2为抑制因子,对细胞可能产生损伤作用,PDGF可抑制低氧的PASMC产生H2O2并达到促进NF-κB表达增强的目的,从而使胞内与增殖相关的基因表达增强,最终达到低氧条件下表达增强的PDGF对低氧性PASMC过度增殖的正反馈调节作用。
, http://www.100md.com
[中图分类号] Q786 [文献标识码] A
[文章编号] 1000-4718(2000)05-0428-04
Platelet-derived growth factor stimulate the increase of NF-κB expression in the nuclei of hypoxic bovine pulmonary artery smooth muscle cells
HUANG Qun-hua, SUN Ren-yu
(Institute of Basic Medical Sciences, CAMS&PUMC, Beijing 100005, China)
[Abstract] AIM: To reveal whether H2O2, a kind of platelet-derived growth factor (PDGF) signaling molecule, involved in the proliferation of hypoxic pulmonary artery smooth muscle cells (PASMCs) and expression of transcription factor NF-κB. METHODS: Laser confocal scanning microscopy, immunocytochemistry and Western blot analysis were used. RESULTS: PDGF (30 ng/mL) elevated the intracellular H2O2 in normoxic PASMCs, but decreased that of hypoxic PASMCs significantly. When 100μmol/L H2O2 was added, NF-κB expression were inhibited markedly in hypoxic PASMCs, while the same concentration H2O2 resulted in increase of NF-κB expression in control cells. CONCLUSION: H2O2, a mediator molecule of PDGF signal transduction, act as an inhibitor in hypoxic PASMCs which is quiet different from that in normoxic PASMCs.It may effect on the expression of transcription factor NF-κB. NF-κB induce various gene expression that involving in the proliferation of vascular smooth muscle cells. One mechanism by which PDGF-induced hypoxic PASMC proliferation might be through PDGF alleviating H2O2 inhibition.
, 百拇医药
[MeSH] Platelet-derived growth factor; Hydrogen peroxide; NF-kappa B; Pulmonary artery; Muscle, smooth
H2O2为血管平滑肌细胞血小板源生长因子(PDGF)受体信号转导途径中的介质之一,且特异性地增强血管平滑肌细胞DNA的合成,促进细胞增殖[1~2]。我们以往的实验结果显示,低氧性肺血管平滑肌细胞增殖作用与PDGF及其受体的表达增强有关[3],未见报道H2O2是否参与此作用。本实验通过观察PDGF对低氧的肺动脉平滑肌细胞H2O2的影响以及PDGF和H2O2两者对核转录因子NF-κB表达的影响,进一步明确了受体途径中的有关作用环节。
, http://www.100md.com 材 料 和 方 法
一、肺动脉平滑肌细胞(PASMC)贴块法培养及传代
新生乳牛(北郊农场)开胸后,无菌取肺外肺动脉,洗净,浸入D-Hanks 液中,冰浴带回实验室。在超净工作台内,将肺动脉置于平皿中,剪开血管腔,轻刮去内膜面的内皮细胞,并平行划开内膜面浅层,用小手术镊撕下内膜平滑肌层,按贴块法进行细胞原代培养。培养液为含10%胎牛血清的DMEM。待8~10 d后,观察到组织块周缘滋长出的PASMC已铺满组织块周围,用0.25%胰酶消化传代。实验用3~6代细胞。
二、细胞低氧模型的复制
采用自制的缺氧小室复制低氧模型。12 h低氧组细胞(H)置于缺氧小室中。可通过气体流量控制阀将此小室内的气体氧分压调置在一个恒定水平。向小室内通入10倍容积的95% N2-5%CO2混合气,3 min后置换出小室内的空气,再以0.5 L/min继续通入混合气,于密闭状态下取培养瓶内的培养液,血液气体分析仪的血气分析结果表明3h后培养液中的氧分压达6.67 kPa,控制混合气通入量,使培养液中的氧分压维持在6.67 kPa 左右。常氧对照组(N)仍置于5%CO2-95%空气的细胞培养箱中。
, 百拇医药
三、PASMC H2O2的检测[4]
分组:N+30 ng/mL PDGF[5],N+100 U/mL过氧化氢酶[1]+30 ng/mL PDGF,H+30 ng/mL PDGF,H+100 U/mL过氧化氢酶+30 ng/mL PDGF。注:N为常氧、H为低氧12 h处理,下同。
将PASMC接种于3.5 mm的细胞培养皿中,待贴壁细胞长势良好时,复制低氧细胞模型。倾去培养液,用HBSS液(不含酚红,下同)稍加冲洗后,每皿加1 mmol/L二氯荧光素(DCF,一种可被H2O2氧化的荧光染料,用HBSS稀释)1 mL,37℃,染色30 min。HBSS液洗去未结合的DCF染液,并每皿中加入1 mL HBSS,于共聚焦显微镜下,观察N组和H组以及以100 U/mL过氧化氢酶预孵育的N组和H组共4组细胞分别加30 ng/mL PDGF后荧光强度的变化,以反应PASMC H2O2的变化。
, 百拇医药
四、NF-κB的细胞免疫组化分析(分组:N、N+100μmol/L H2O2[4]、H、H+100μmol/L H2O2)
PASMC接种于35mm培养皿中,10%血清DMEM培养72 h,PBS过洗后用PBS配制的1%多聚甲醛(pH 7.0),室温固定30 min。再以PBS配制的0.1% Triton-100(pH 7.0),室温固定5 min。PBS洗两次后,加3%H2O2 处理5 min以消除内源性过氧化物酶的活性。蒸馏水冲洗及PBS浸泡后,经10%正常羊血清室温封闭10 min,再用1∶50稀释的抗NF-κB(P65)抗体(中山公司),4℃过夜。一抗作用完成后,滴加生物素标记的二抗,37℃孵育30 min。用PBS洗去未结合的二抗,加辣根过氧化物酶标记的链霉卵白素,37℃孵育30 min。PBS 稍加冲洗后,DAB显色剂显色,封片,照相。
, http://www.100md.com
五、Western印迹法检测PASMC核NF-κB的表达(分组:N、N+100μmol/L H2O2、H、H+100μmol/L H2O2)
(一)样品收集(即PASMC核抽提物制备)[6] 细胞培养至108个,分组低氧实验结束后,室温下用PBS清洗培养瓶中贴壁生长的PASMC以清除培养基。胰酶消化,1200 r/min离心5 min,再用PBS洗涤细胞两次×5 min,均2000 r/min离心收集细胞。以下步骤在冰上进行。将细胞悬浮于5倍体积Buffer A中,冰浴中溶胀15 min,2000 r/min离心收集细胞,再将细胞悬浮于2倍体积Buffer A中,用玻璃匀浆器将细胞匀浆至90%破裂,随时以台盼兰染细胞,镜下观察破膜效果。4℃,4000 r/min离心10 min,去上清。重复离心一次,去上清。重悬沉淀于1 mL Buffer C中,用玻璃匀浆器匀浆10次左右,于冰上轻柔搅拌30 min进行核抽提。4℃,15 500 r/min离心30 min后收集上清,于低温条件下用Buffer D透析3 h。经4℃,15 500 r/min离心20 min,收集上清并分装,保存于-70℃备用。[Buffer A:含mmol/L*HEPES(pH 7.9) 10, KCl 10, EDTA(pH 8.0) 0.2, *PMSF 0.5, *DTT 0.5和25%甘油(v/v);Buffer C:含mmol/L *HEPES(pH 7.9) 20,MgCl2 420,EDTA(pH 8.0) 0.2, *PMSF 0.5,*DTT 0.5和25% 甘油(v/v);Buffer D:含mmol/L *HEPES(pH 7.9) 20,KCl 0.1, EDTA(pH 8.0) 0.2, *PMSF 0.5,*DTT 0.5和20% 甘油(v/v)。注意带*使用前加入]。
, http://www.100md.com
(二)SDS-PAGE电泳 核抽提物经蛋白定量,等体积的2×电泳加样缓冲液混合后,煮沸5 min,于每泳道上样20μg。根据蛋白质分子量的大小,用于检测核P65的聚丙烯酰胺分离胶的浓度为10%。标准方法走电泳。电转:按电转仪使用说明将蛋白质转移到硝酸纤维素膜上,为观察蛋白质转移情况并对蛋白质分子量标准参照物进行定位,对滤膜进行丽春红染色,观察完毕用去离子水漂洗净染液再进行免疫染色。
(三)免疫显色反应 10 mL封闭液(用0.01 mol/L PBS配制5%脱脂奶),室温1 h。 抗NF-κB(P65)抗体用封闭液按1∶100稀释,孵育膜4℃过夜。PBS洗膜5 min×2次,将膜移入生物素标记二抗工作液,37℃孵育30 min,PBS冲洗,5 min×3次。将膜移入辣根酶标记链霉卵白素工作液,37℃孵育1 h,TBS冲洗,5 min×3次,DAB显色剂显色,待显色适度时,用水漂洗终止显色反应,拍摄滤膜照片,并通过图片扫描对显示的蛋白电泳条带进行数据统计分析。
, http://www.100md.com
六、统计处理
实验数据以均数±标准差(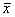 ±s)表示。用t检验判断均数差异显著性。
±s)表示。用t检验判断均数差异显著性。
结 果
一、PASMC H2O2的检测(分组:N+30 ng/mL PDGF,N+100 U/mL过氧化氢酶+30 ng/mL PDGF;H+30 ng/mL PDGF,H+100 U/mL过氧化氢酶+30 ng/mL PDGF)
PDGF可促进常氧组的PASMC H2O2的增加(图1A),但使低氧组的PASMC H2O2降低(图1C)。常氧和低氧的PASMC且分别经过氧化氢酶预孵育12 h的两组细胞,在加入30 ng/mL PDGF后,未见H2O2量的改变(图1B和图1D)。
, http://www.100md.com
Fig 1 The changes of intracellular H2O2 concentration stomulated by PDGF
A:N+PDGF;B:N+Catalase+PDGF;C:H+PDGF;D:H+Catalase+PDGF.(N:normoxia;H:hupoxia)PDGF was added;hH2O2 of normoxic groupincreased,but that of hypoxic group decreased significantly.After incubating with catalase,no change in intracellular H2O2 of both normoxicand hypoxic PASMCs was observed when PDGF was added
, http://www.100md.com
图1 经PDGF作用后,PASMC胞内的H2O2变化
二、PASMC核转录因子NF-κB(p65)的免疫组化结果(分组:N、N+100μmol/L H2O2、H、H+100μmol/L H2O2)
浓度为100μmol/L的H2O2促进常氧条件下的PASMC核转录因子NF-κB在细胞核内的表达量增加,但对低氧的PASMC核NF-κB有明显的抑制作用,见图2。
Fig 2 Immunohistochemical staining signal in the PASMC
, 百拇医药
nucleus with anti-p65 antibodies(±s,n=20)
** P<0.01, vs normoxia group; ΔΔP<0.01, vs
hypoxic 12h group
图2 PASMC核p65的免疫组化结果
三、核抽提物的Western印迹杂交检测PASMC核NF-κB(p65)
(一)分组(N、N+100μmol/L H2O2、H和H+100μmol/L H2O2 4组) Western印迹杂交结果与免疫细胞化学实验结果基本一致。H2O2促进常氧条件下PASMC核p65的表达,但明显抑制低氧的PASMC核p65的表达。 N+100μmol/L H2O2及H+100μmol/L H2O2两组p65的量较各自的对照组分别明显的升高和降低, 见图3A。
, 百拇医药
Fig 3A Scanning analysis of Western blot for NF-κB binding protein(p65) in nuclear extract from PASMCs
图 3A PASMC核抽提物中p65的Western印迹杂交结果扫描
(二)分组(N、H、H+100μmol/L H2O2和H+100μmol/L H2O2+30ng/ml PDGF) H组较N组有所增加。H+100μmol/L H2O2组较单纯低氧组(H)有显著降低,H+100μmol/L H2O2+30 ng/mL PDGF组较H+100μmol/L H2O2组有明显升高,见图3B。
, http://www.100md.com
Fig 3B Scanning analysis of Western blot for NF-κB
binding protein(p65) in nuclear extract from PASMCs
图 3B PASMC核抽提物中p65的Western 印迹杂交结果扫描
讨 论
在心血管疾病的发病及防御机制的研究中,H2O2所参与的生长因子PDGF受体信号转导途径日益受人注目。已有证据表明,H2O2行使第二信使的作用,介导PDGF诱导的血管平滑肌细胞的增殖,参与动脉粥样硬化过程。另外,H2O2还可作为核转录因子NF-κB的活化剂,调节多种细胞因子的表达[1]。高浓度的H2O2作为弥散性的O2反应中间体,在免疫反应中起作用。目前的许多研究结果表明内源性、低浓度的H2O2则具有丝分裂剂作用[1,4]。与平滑肌细胞增殖相关的细胞因子、生长因子,如PDGF-BB、bFGF、EGF、IGF-1,对核转录因子NF-κB有诱导作用,且PDGF-BB为诱导效应最强的生长因子之一,但生长抑制因子TGF-β和IFN-γ对NF-κB无此作用;PDGF作为刺激物可直接促NF-κB表达及活性增强[7~9]。H2O2作用于人内皮细胞,能诱导NF-κB(p65) 的移位。本实验的结果提示,低氧可活化肺动脉平滑肌细胞NF-κB,但H2O2对肺动脉平滑肌细胞NF-κB(p65) 的向核内移位有明显的抑制,免疫细胞化学实验和Western印迹杂交结果均显示低氧的肺动脉平滑肌细胞核内的p65极少。
, 百拇医药
我们已往的实验已证明,在低氧的条件下,表达增加的PDGF促进肺血管平滑肌细胞增殖,参与低氧性肺血管重建。本实验结果显示PDGF可使常氧的肺动脉平滑肌细胞 中H2O2浓度增高,但明显降低低氧的肺动脉平滑肌细胞中H2O2的量;同一浓度的H2O2,作用于常氧的肺动脉平滑肌细胞,则引起核NF-κB的表达增强,但对低氧的肺动脉平滑肌细胞核NF-κB的表达有明显的抑制作用。此结果表明,在低氧的肺血管平滑肌细胞中, H2O2所参与的PDGF受体信号传导机制较体循环系统明显不同,H2O2不是核转录因子NF-κB的活化剂,而是一种抑制剂,对细胞可能产生损伤作用,PDGF则可以降低H2O2的浓度,间接活化NF-κB,即PDGF可通过减轻低氧的肺动脉平滑肌细胞中H2O2对细胞造成的损伤而使核转录因子NF-κB在细胞核内达到足够的有效浓度,从而使胞内与增殖相关的基因表达增强,最终达到低氧条件下表达增强的PDGF对低氧性肺动脉平滑肌细胞过度增殖的正反馈调节作用。低氧的肺动脉平滑肌细胞在不仅加入H2O2而且同时加入PDGF时,缓解NF-κB表达的抑制。进一步证实了,PDGF对H2O2的逆转作用。
, 百拇医药
[基金项目] 国家自然科学基金资助(No.39470301)
[参 考 文 献]
[1] Sundaresan M,Yu ZX,Ferrans VJ,et al. Requirement for platelet-derived growth factor signal transduction[J]. Science,1995,270:296~299.
[2] Rao GN,Berk BC. Active oxygen species stimulate vascular smooth muscle cell growth and proto-oncogen expression [J]. Circ Res,1992,70:593~599.
[3] 黄群华,孙仁宇. 低氧大鼠肺组织中血小板源生长因子在低氧性肺动脉平滑肌细胞增殖中的作用 [J]. 基础医学与临床,1998,18:113~117.
, 百拇医药
[4] Montisano DF,Mann T,Spragg RG. H2O2 increases expression of pulmonary artery endothelial cell platelet-derived growth factor mRNA [J]. J Appl Physiol,1992,73(6):2255~2262.
[5] Castellot JJ,Pukac LA,Caleb BL,et al. Heparin selectively inhibits a PKC-dependent mechnism of cell cycle progression in calf aortic smooth muscle cells [J]. J Cell Biol,1989,109:3147~3155.
[6] Dignam DJ, Lebovitz RM, Roeder RG, et al. Accurate transcription initiation by RNA polymerase Ⅱ in a soluble extract from isolated mammalian nuclei [J]. Nucleic Acids Res,1983,101:582~598.
, 百拇医药
[7] Ohba M,Shibanumola M,Kuroki M,et al. Production of hydrogen peroxide by transforming growth factor-β1 and its involvement in induction of egr-1 in mouse osteoblastic cells [J]. J Cell Biol,1994,126:1079~1088.
[8] Obata H,Biro S,Arima N,et al. NF-κB is in the nuclei of cultured rat aortic smooth muscle cells by stimulation of various growth factors [J]. Biochem Biophys Res Commun,1996,224:27~32.
[9] Marumol T,Schioni-Kerth VB,Fisslthaler B,et al. Platelet-derived growth factor-stimulated superoxide anion production modulates activation of transcription factor NF-κB and expression of monocyte chemoattractant protein 1 in human aortic smooth muscle cells [J].Circulation,1997,96:2361~2367.
[收稿日期]1999-03-19 [修回日期]1999-07-24
, 百拇医药
单位:(中国医学科学院基础医学研究所 中国协和医科大学基础医学院 病理生理研究室,北京 100005)
关键词:血小板源生长因子;过氧化氢;NF-κB;肺动脉;肌,平滑
中国病理生理杂志000513
[摘 要] 目的:为探讨血小板源生长因子(platelet-derived growth factor,PDGF)受体信号转导途径的介质分子之一过氧化氢( H2O2 )在低氧的肺动脉平滑肌细胞(pulmonary artery smooth muscle cell,PASMC )增殖中是否起作用。方法:应用共聚焦显微镜、细胞免疫组织化学及Western印迹杂交等方法,检测了低氧的PASMC PDGF受体途径中的H2O2的变化及PDGF和H2O2对细胞核内与增殖作用相关的核转录因子NF-κB表达量的影响。 结果:PDGF可使常氧的PASMC中H2O2浓度增高,但明显降低低氧的PASMC中H2O2的量;同一浓度的H2O2,作用于常氧的PASMC,则引起核NF-κB的表达量增加,但对低氧的PASMC核NF-κB有明显的抑制作用;同时加入PDGF和H2O2的低氧的PASMC较仅以H2O2作用的低氧的PASMC,核NF-κB的量显著增加。结论:PDGF受体的信号转导途径在低氧的PASMC同常氧的PASMC相反,H2O2为抑制因子,对细胞可能产生损伤作用,PDGF可抑制低氧的PASMC产生H2O2并达到促进NF-κB表达增强的目的,从而使胞内与增殖相关的基因表达增强,最终达到低氧条件下表达增强的PDGF对低氧性PASMC过度增殖的正反馈调节作用。
, http://www.100md.com
[中图分类号] Q786 [文献标识码] A
[文章编号] 1000-4718(2000)05-0428-04
Platelet-derived growth factor stimulate the increase of NF-κB expression in the nuclei of hypoxic bovine pulmonary artery smooth muscle cells
HUANG Qun-hua, SUN Ren-yu
(Institute of Basic Medical Sciences, CAMS&PUMC, Beijing 100005, China)
[Abstract] AIM: To reveal whether H2O2, a kind of platelet-derived growth factor (PDGF) signaling molecule, involved in the proliferation of hypoxic pulmonary artery smooth muscle cells (PASMCs) and expression of transcription factor NF-κB. METHODS: Laser confocal scanning microscopy, immunocytochemistry and Western blot analysis were used. RESULTS: PDGF (30 ng/mL) elevated the intracellular H2O2 in normoxic PASMCs, but decreased that of hypoxic PASMCs significantly. When 100μmol/L H2O2 was added, NF-κB expression were inhibited markedly in hypoxic PASMCs, while the same concentration H2O2 resulted in increase of NF-κB expression in control cells. CONCLUSION: H2O2, a mediator molecule of PDGF signal transduction, act as an inhibitor in hypoxic PASMCs which is quiet different from that in normoxic PASMCs.It may effect on the expression of transcription factor NF-κB. NF-κB induce various gene expression that involving in the proliferation of vascular smooth muscle cells. One mechanism by which PDGF-induced hypoxic PASMC proliferation might be through PDGF alleviating H2O2 inhibition.
, 百拇医药
[MeSH] Platelet-derived growth factor; Hydrogen peroxide; NF-kappa B; Pulmonary artery; Muscle, smooth
H2O2为血管平滑肌细胞血小板源生长因子(PDGF)受体信号转导途径中的介质之一,且特异性地增强血管平滑肌细胞DNA的合成,促进细胞增殖[1~2]。我们以往的实验结果显示,低氧性肺血管平滑肌细胞增殖作用与PDGF及其受体的表达增强有关[3],未见报道H2O2是否参与此作用。本实验通过观察PDGF对低氧的肺动脉平滑肌细胞H2O2的影响以及PDGF和H2O2两者对核转录因子NF-κB表达的影响,进一步明确了受体途径中的有关作用环节。
, http://www.100md.com 材 料 和 方 法
一、肺动脉平滑肌细胞(PASMC)贴块法培养及传代
新生乳牛(北郊农场)开胸后,无菌取肺外肺动脉,洗净,浸入D-Hanks 液中,冰浴带回实验室。在超净工作台内,将肺动脉置于平皿中,剪开血管腔,轻刮去内膜面的内皮细胞,并平行划开内膜面浅层,用小手术镊撕下内膜平滑肌层,按贴块法进行细胞原代培养。培养液为含10%胎牛血清的DMEM。待8~10 d后,观察到组织块周缘滋长出的PASMC已铺满组织块周围,用0.25%胰酶消化传代。实验用3~6代细胞。
二、细胞低氧模型的复制
采用自制的缺氧小室复制低氧模型。12 h低氧组细胞(H)置于缺氧小室中。可通过气体流量控制阀将此小室内的气体氧分压调置在一个恒定水平。向小室内通入10倍容积的95% N2-5%CO2混合气,3 min后置换出小室内的空气,再以0.5 L/min继续通入混合气,于密闭状态下取培养瓶内的培养液,血液气体分析仪的血气分析结果表明3h后培养液中的氧分压达6.67 kPa,控制混合气通入量,使培养液中的氧分压维持在6.67 kPa 左右。常氧对照组(N)仍置于5%CO2-95%空气的细胞培养箱中。
, 百拇医药
三、PASMC H2O2的检测[4]
分组:N+30 ng/mL PDGF[5],N+100 U/mL过氧化氢酶[1]+30 ng/mL PDGF,H+30 ng/mL PDGF,H+100 U/mL过氧化氢酶+30 ng/mL PDGF。注:N为常氧、H为低氧12 h处理,下同。
将PASMC接种于3.5 mm的细胞培养皿中,待贴壁细胞长势良好时,复制低氧细胞模型。倾去培养液,用HBSS液(不含酚红,下同)稍加冲洗后,每皿加1 mmol/L二氯荧光素(DCF,一种可被H2O2氧化的荧光染料,用HBSS稀释)1 mL,37℃,染色30 min。HBSS液洗去未结合的DCF染液,并每皿中加入1 mL HBSS,于共聚焦显微镜下,观察N组和H组以及以100 U/mL过氧化氢酶预孵育的N组和H组共4组细胞分别加30 ng/mL PDGF后荧光强度的变化,以反应PASMC H2O2的变化。
, 百拇医药
四、NF-κB的细胞免疫组化分析(分组:N、N+100μmol/L H2O2[4]、H、H+100μmol/L H2O2)
PASMC接种于35mm培养皿中,10%血清DMEM培养72 h,PBS过洗后用PBS配制的1%多聚甲醛(pH 7.0),室温固定30 min。再以PBS配制的0.1% Triton-100(pH 7.0),室温固定5 min。PBS洗两次后,加3%H2O2 处理5 min以消除内源性过氧化物酶的活性。蒸馏水冲洗及PBS浸泡后,经10%正常羊血清室温封闭10 min,再用1∶50稀释的抗NF-κB(P65)抗体(中山公司),4℃过夜。一抗作用完成后,滴加生物素标记的二抗,37℃孵育30 min。用PBS洗去未结合的二抗,加辣根过氧化物酶标记的链霉卵白素,37℃孵育30 min。PBS 稍加冲洗后,DAB显色剂显色,封片,照相。
, http://www.100md.com
五、Western印迹法检测PASMC核NF-κB的表达(分组:N、N+100μmol/L H2O2、H、H+100μmol/L H2O2)
(一)样品收集(即PASMC核抽提物制备)[6] 细胞培养至108个,分组低氧实验结束后,室温下用PBS清洗培养瓶中贴壁生长的PASMC以清除培养基。胰酶消化,1200 r/min离心5 min,再用PBS洗涤细胞两次×5 min,均2000 r/min离心收集细胞。以下步骤在冰上进行。将细胞悬浮于5倍体积Buffer A中,冰浴中溶胀15 min,2000 r/min离心收集细胞,再将细胞悬浮于2倍体积Buffer A中,用玻璃匀浆器将细胞匀浆至90%破裂,随时以台盼兰染细胞,镜下观察破膜效果。4℃,4000 r/min离心10 min,去上清。重复离心一次,去上清。重悬沉淀于1 mL Buffer C中,用玻璃匀浆器匀浆10次左右,于冰上轻柔搅拌30 min进行核抽提。4℃,15 500 r/min离心30 min后收集上清,于低温条件下用Buffer D透析3 h。经4℃,15 500 r/min离心20 min,收集上清并分装,保存于-70℃备用。[Buffer A:含mmol/L*HEPES(pH 7.9) 10, KCl 10, EDTA(pH 8.0) 0.2, *PMSF 0.5, *DTT 0.5和25%甘油(v/v);Buffer C:含mmol/L *HEPES(pH 7.9) 20,MgCl2 420,EDTA(pH 8.0) 0.2, *PMSF 0.5,*DTT 0.5和25% 甘油(v/v);Buffer D:含mmol/L *HEPES(pH 7.9) 20,KCl 0.1, EDTA(pH 8.0) 0.2, *PMSF 0.5,*DTT 0.5和20% 甘油(v/v)。注意带*使用前加入]。
, http://www.100md.com
(二)SDS-PAGE电泳 核抽提物经蛋白定量,等体积的2×电泳加样缓冲液混合后,煮沸5 min,于每泳道上样20μg。根据蛋白质分子量的大小,用于检测核P65的聚丙烯酰胺分离胶的浓度为10%。标准方法走电泳。电转:按电转仪使用说明将蛋白质转移到硝酸纤维素膜上,为观察蛋白质转移情况并对蛋白质分子量标准参照物进行定位,对滤膜进行丽春红染色,观察完毕用去离子水漂洗净染液再进行免疫染色。
(三)免疫显色反应 10 mL封闭液(用0.01 mol/L PBS配制5%脱脂奶),室温1 h。 抗NF-κB(P65)抗体用封闭液按1∶100稀释,孵育膜4℃过夜。PBS洗膜5 min×2次,将膜移入生物素标记二抗工作液,37℃孵育30 min,PBS冲洗,5 min×3次。将膜移入辣根酶标记链霉卵白素工作液,37℃孵育1 h,TBS冲洗,5 min×3次,DAB显色剂显色,待显色适度时,用水漂洗终止显色反应,拍摄滤膜照片,并通过图片扫描对显示的蛋白电泳条带进行数据统计分析。
, http://www.100md.com
六、统计处理
实验数据以均数±标准差(
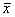 ±s)表示。用t检验判断均数差异显著性。
±s)表示。用t检验判断均数差异显著性。结 果
一、PASMC H2O2的检测(分组:N+30 ng/mL PDGF,N+100 U/mL过氧化氢酶+30 ng/mL PDGF;H+30 ng/mL PDGF,H+100 U/mL过氧化氢酶+30 ng/mL PDGF)
PDGF可促进常氧组的PASMC H2O2的增加(图1A),但使低氧组的PASMC H2O2降低(图1C)。常氧和低氧的PASMC且分别经过氧化氢酶预孵育12 h的两组细胞,在加入30 ng/mL PDGF后,未见H2O2量的改变(图1B和图1D)。

, http://www.100md.com
Fig 1 The changes of intracellular H2O2 concentration stomulated by PDGF
A:N+PDGF;B:N+Catalase+PDGF;C:H+PDGF;D:H+Catalase+PDGF.(N:normoxia;H:hupoxia)PDGF was added;hH2O2 of normoxic groupincreased,but that of hypoxic group decreased significantly.After incubating with catalase,no change in intracellular H2O2 of both normoxicand hypoxic PASMCs was observed when PDGF was added
, http://www.100md.com
图1 经PDGF作用后,PASMC胞内的H2O2变化
二、PASMC核转录因子NF-κB(p65)的免疫组化结果(分组:N、N+100μmol/L H2O2、H、H+100μmol/L H2O2)
浓度为100μmol/L的H2O2促进常氧条件下的PASMC核转录因子NF-κB在细胞核内的表达量增加,但对低氧的PASMC核NF-κB有明显的抑制作用,见图2。

Fig 2 Immunohistochemical staining signal in the PASMC
, 百拇医药
nucleus with anti-p65 antibodies(±s,n=20)
** P<0.01, vs normoxia group; ΔΔP<0.01, vs
hypoxic 12h group
图2 PASMC核p65的免疫组化结果
三、核抽提物的Western印迹杂交检测PASMC核NF-κB(p65)
(一)分组(N、N+100μmol/L H2O2、H和H+100μmol/L H2O2 4组) Western印迹杂交结果与免疫细胞化学实验结果基本一致。H2O2促进常氧条件下PASMC核p65的表达,但明显抑制低氧的PASMC核p65的表达。 N+100μmol/L H2O2及H+100μmol/L H2O2两组p65的量较各自的对照组分别明显的升高和降低, 见图3A。

, 百拇医药
Fig 3A Scanning analysis of Western blot for NF-κB binding protein(p65) in nuclear extract from PASMCs
图 3A PASMC核抽提物中p65的Western印迹杂交结果扫描
(二)分组(N、H、H+100μmol/L H2O2和H+100μmol/L H2O2+30ng/ml PDGF) H组较N组有所增加。H+100μmol/L H2O2组较单纯低氧组(H)有显著降低,H+100μmol/L H2O2+30 ng/mL PDGF组较H+100μmol/L H2O2组有明显升高,见图3B。

, http://www.100md.com
Fig 3B Scanning analysis of Western blot for NF-κB
binding protein(p65) in nuclear extract from PASMCs
图 3B PASMC核抽提物中p65的Western 印迹杂交结果扫描
讨 论
在心血管疾病的发病及防御机制的研究中,H2O2所参与的生长因子PDGF受体信号转导途径日益受人注目。已有证据表明,H2O2行使第二信使的作用,介导PDGF诱导的血管平滑肌细胞的增殖,参与动脉粥样硬化过程。另外,H2O2还可作为核转录因子NF-κB的活化剂,调节多种细胞因子的表达[1]。高浓度的H2O2作为弥散性的O2反应中间体,在免疫反应中起作用。目前的许多研究结果表明内源性、低浓度的H2O2则具有丝分裂剂作用[1,4]。与平滑肌细胞增殖相关的细胞因子、生长因子,如PDGF-BB、bFGF、EGF、IGF-1,对核转录因子NF-κB有诱导作用,且PDGF-BB为诱导效应最强的生长因子之一,但生长抑制因子TGF-β和IFN-γ对NF-κB无此作用;PDGF作为刺激物可直接促NF-κB表达及活性增强[7~9]。H2O2作用于人内皮细胞,能诱导NF-κB(p65) 的移位。本实验的结果提示,低氧可活化肺动脉平滑肌细胞NF-κB,但H2O2对肺动脉平滑肌细胞NF-κB(p65) 的向核内移位有明显的抑制,免疫细胞化学实验和Western印迹杂交结果均显示低氧的肺动脉平滑肌细胞核内的p65极少。
, 百拇医药
我们已往的实验已证明,在低氧的条件下,表达增加的PDGF促进肺血管平滑肌细胞增殖,参与低氧性肺血管重建。本实验结果显示PDGF可使常氧的肺动脉平滑肌细胞 中H2O2浓度增高,但明显降低低氧的肺动脉平滑肌细胞中H2O2的量;同一浓度的H2O2,作用于常氧的肺动脉平滑肌细胞,则引起核NF-κB的表达增强,但对低氧的肺动脉平滑肌细胞核NF-κB的表达有明显的抑制作用。此结果表明,在低氧的肺血管平滑肌细胞中, H2O2所参与的PDGF受体信号传导机制较体循环系统明显不同,H2O2不是核转录因子NF-κB的活化剂,而是一种抑制剂,对细胞可能产生损伤作用,PDGF则可以降低H2O2的浓度,间接活化NF-κB,即PDGF可通过减轻低氧的肺动脉平滑肌细胞中H2O2对细胞造成的损伤而使核转录因子NF-κB在细胞核内达到足够的有效浓度,从而使胞内与增殖相关的基因表达增强,最终达到低氧条件下表达增强的PDGF对低氧性肺动脉平滑肌细胞过度增殖的正反馈调节作用。低氧的肺动脉平滑肌细胞在不仅加入H2O2而且同时加入PDGF时,缓解NF-κB表达的抑制。进一步证实了,PDGF对H2O2的逆转作用。
, 百拇医药
[基金项目] 国家自然科学基金资助(No.39470301)
[参 考 文 献]
[1] Sundaresan M,Yu ZX,Ferrans VJ,et al. Requirement for platelet-derived growth factor signal transduction[J]. Science,1995,270:296~299.
[2] Rao GN,Berk BC. Active oxygen species stimulate vascular smooth muscle cell growth and proto-oncogen expression [J]. Circ Res,1992,70:593~599.
[3] 黄群华,孙仁宇. 低氧大鼠肺组织中血小板源生长因子在低氧性肺动脉平滑肌细胞增殖中的作用 [J]. 基础医学与临床,1998,18:113~117.
, 百拇医药
[4] Montisano DF,Mann T,Spragg RG. H2O2 increases expression of pulmonary artery endothelial cell platelet-derived growth factor mRNA [J]. J Appl Physiol,1992,73(6):2255~2262.
[5] Castellot JJ,Pukac LA,Caleb BL,et al. Heparin selectively inhibits a PKC-dependent mechnism of cell cycle progression in calf aortic smooth muscle cells [J]. J Cell Biol,1989,109:3147~3155.
[6] Dignam DJ, Lebovitz RM, Roeder RG, et al. Accurate transcription initiation by RNA polymerase Ⅱ in a soluble extract from isolated mammalian nuclei [J]. Nucleic Acids Res,1983,101:582~598.
, 百拇医药
[7] Ohba M,Shibanumola M,Kuroki M,et al. Production of hydrogen peroxide by transforming growth factor-β1 and its involvement in induction of egr-1 in mouse osteoblastic cells [J]. J Cell Biol,1994,126:1079~1088.
[8] Obata H,Biro S,Arima N,et al. NF-κB is in the nuclei of cultured rat aortic smooth muscle cells by stimulation of various growth factors [J]. Biochem Biophys Res Commun,1996,224:27~32.
[9] Marumol T,Schioni-Kerth VB,Fisslthaler B,et al. Platelet-derived growth factor-stimulated superoxide anion production modulates activation of transcription factor NF-κB and expression of monocyte chemoattractant protein 1 in human aortic smooth muscle cells [J].Circulation,1997,96:2361~2367.
[收稿日期]1999-03-19 [修回日期]1999-07-24
, 百拇医药