实验性糖尿病肺形态学及氧自由基研究
作者:沈兴平 舒昌达 张佐才 何军
单位:沈兴平(重庆医科大学附属第二医院内分泌科,重庆 400010);舒昌达 张佐才(重庆医科大学法医学教研室);何军(重庆医科大学附属第一医院内分泌科)
关键词:糖尿病,实验性;肺;超氧化物歧化酶;丙二醛
中国病理生理杂志000619
[摘 要] 目的:了解早期糖尿病肺形态学及氧化应激的变化。方法:应用体视学方法对四氧嘧啶诱导的糖尿病28 d大鼠肺进行定量研究、观察超微结构变化并测定血清和肺组织的超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量。结果:糖尿病大鼠肺泡体密度和平均截线长度减少,肺泡壁体密度、肺泡表面积密度、肺泡数密度、肺泡面数密度和肺泡比表面增加。糖尿病大鼠Ⅱ型肺泡细胞粗面内质网扩张,其体密度、面密度、平均截面积和平均周长增加,而比表面减少。肺上皮和毛细血管基底膜增厚。糖尿病大鼠血清SOD活性下降,MDA含量增加;肺组织MDA含量明显升高。结论:糖尿病早期大鼠肺已发生形态学变化且受到氧化应激的危害,提示肺脏是糖尿病损害的“靶器官”之一。
, 百拇医药
[中图分类号] R563.1; R587.1 [文献标识码] A
[文章编号] 1000-4718(2000)06-0552-05
Study of lung morphologic features and oxygen free radicals in experimental diabetic rats
SHEN Xing-ping, SHU Chang-da, ZHANG Zuo-cai, HE Jun
(Department of Endocrinology, The Second College of Clinical Medicine,Chongqing University of Medical Sciences, Chongqing 400010, China)
, 百拇医药
[Abstract] AIM:To evaluate the changes of lung morphologic features and oxidative stress in experimental diabetic rats. METHODS: The pulmonary structure of alloxan-induced diabetic rats were quantitatively studied with stereological methods. Changes of ultrastructure, activities of superoxide dismutase (SOD) and contents of malondialdehyde(MDA) of diabetic lung and serum were observed. RESULTS: The volume proportion of alveolar air and mean linear intercept of diabetic rats decreased remarkably in comparison with controls while the volume proportion of alveolar wall, the surface density of alveolar, the numerical density of alveolic area, the numerical density of alveolar and specific surface of alveolar increased significantly. The major change of the type II pneumocyte of diabetic rats was dilation of the rough endoplasmic reticulum (RER). The other findings in diabetic rats had included the presence of thickened alveolar epithelial, pulmonary capillary basal laminae and blood- air barrier, the volume density, the surface density, the mean profile area and the mean perimeter of RER in type Ⅱ pneumocyte of diabetic rats increased remarkably. And the specific surface of RER was significantly lower as compared with controls. SOD activity decreased and MDA content increased significantly in serum of diabetic rats as compared with the control group. SOD activity in the diabetic lung was not different from that of the control lung. However, the content of MDA obviously increased in diabetic lung. CONCLUSION: The morphologic features and oxidative stress in early diabetic rats are abnormal thus the lung should be considered as one of the “target organ”in diabetes mellitus.
, http://www.100md.com
[MeSH] Diabetes mellitus, experimental; Lung; Superoxide dismutase; Malondialdehyde
目前认为,糖尿病(diabetes mellitus,DM)微血管病变和组织蛋白质非酶糖基化(nonenzymatic glycation)可能是其慢性并发症的主要发病机制。肺脏是一个具有丰富的微循环和结缔组织的器官。近年来关于DM对肺脏的损害尚未引起足够的重视。本文应用光镜及电镜方法对四氧嘧啶诱导的DM 28 d大鼠肺形态进行定性及体视学计量研究,同时,测定血清和肺组织超氧化物歧化酶(superoxide dismutase, SOD) 活性及丙二醛(malondialdehyde,MDA)含量,旨在探讨DM肺病变的发病机制。
材 料 和 方 法
一、动物模型复制及取材
, http://www.100md.com
雄性Wistar大鼠20只(本校实验动物中心提供),体重150~180 g, 随机分为DM组与对照组。每组10只大鼠。DM组大鼠给予四氧嘧啶(本校临床学院人工细胞室提供)一次性腹腔内(按200 mg/kg体重)注射,对照组注射等量生理盐水。注射药物后第3 d测空腹血糖(邻甲苯胺法)>13.90 mmol/L为DM模型成立。所有大鼠均自由饮水、进食。在DM模型成立28 d时,测空腹血糖,其值仍>13.90 mmol/L。DM组与对照组大鼠称重后,用1%戊巴比妥钠腹腔注射麻醉大鼠,心腔内采血,速取肺脏。观察肺大体改变,称肺湿重,并计算肺系数(肺湿重(g)/体重(g)×100)。右肺制成匀浆,用于生化检查,左肺用于光镜和电镜观察。分离血清测定SOD活性、MDA含量。
二、光镜观察
左肺速取电镜标本后,剩余肺组织用10%中性缓冲福尔马林固定48~72 h,逐级脱水,常温石蜡包埋,用Reichert切片机切片(5 μm厚切片),每例肺进行连续切片,每隔5张等距离选取切片一张,共选5张切片,H.E染色,进行定性、定量观察。每张切片观察5个视野,即肺尖、肺底各两个固定视野,肺中部一个视野。在OLYMPUS BH-2型显微镜下,放大400倍,用5 mm×5 mm网格目测微尺以点计数法测算下列参数,计算公式来自文献[1]。
, http://www.100md.com
(一) 肺泡体密度(volume proportion of alveolar air, Vva)、肺泡管体密度(volume proportion of alveolar duct air, Vvd)、肺泡壁体密度(volume proportion of alveolar wall, Vvw)和传导气道体密度(volume proportion of conducting airway, Vvb)。计算公式如下: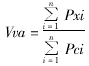
Pxi表示测试点落在第i幅图像肺泡上的点数,Pci表示测试点落在第i幅图像所定参照系上的点数,n表示图像数。
(二) 肺泡平均截线长度(mean linear intercept, Lm)、肺泡表面积密度(surface density of alveoli, Sva)、肺泡数密度(numerical density of alveoli, Nv)、肺泡面数密度(numerical density on area of alveoli, NA)、肺泡比表面(specific surface of alveoli, Rsv(a))和肺泡管比表面(specific surface of alveolar duct air, Rsv(d))。计算公式如下:
, 百拇医药
Lm:测试线穿过肺泡截面时,在截面内的平均长度。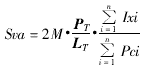
PT、LT 分别为所用测试系统的测试点数和测试线长度,Ixi为测试线与肺泡界面的交点,Pci为包容空间的测试点数,M为放大倍数,单位为:μm2μm-3。
NX为测试肺泡截面数,PX为击中测试肺泡截面的点数,PC为参照系内的测试点数,α为每个测试点所代表的面积,β为形状常数(β=1.55), 单位为:个/μm3。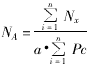
, 百拇医药
NX为测试肺泡截面数,PC为参照系内的测试点数,α为每个测试点所代表的面积,单位为:个/μm2。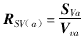
单位为:μm2μm-3。
三、电镜观察
每例左肺取3块肺组织,迅速以4%戊二醛固定2 h,1%四氧化锇后固定(4℃) 2 h,乙醇逐级脱水,环氧树脂618浸透、包埋。半薄切片0.5~1 μm厚,甲苯胺蓝染色,光镜下定位。超薄切片500~700 A°, 醋酸双氧铀和铅盐双重染色,在H-600型透射电镜下观察及照相。
四、Ⅱ型肺泡细胞形态计量
电镜下以10 000倍随机拍摄Ⅱ型肺泡细胞。其中对照组和DM组各30个细胞,每只动物2~4个。底片光学放大2倍,采用正方格测试系统,印有测试系统的底片与电镜底片叠印成照片,总放大倍数20 000倍。采用点计数法测算下列参数,计算公式来自文献[2]。
, http://www.100md.com
(一) 粗面内质网(rough endoplasmic reticulum, RER)、体密度(volume density, Vv)、面密度(surface density, Sv)、比表面(specific surface,δ)、平均截面积(mean profile area,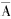 x)和平均周长(mean perimeter,x)。计算公式如下:
x)和平均周长(mean perimeter,x)。计算公式如下: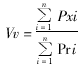
Pxi代表第i张照片上落在某结构范围内的测试点数,Pri代表同一张照片落在参照系截面内的测试点数。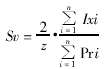
Ixi代表第i张照片上膜截线与测试线的交叉点数,Pri代表同一张照片落在参照系截面内的测试点数,z等于小正方格边长的2倍,单位为: μm-1。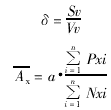
, 百拇医药
a为一个测试点所代表的面积,Pxi代表第i张照片上落在某结构范围内的测试点数,Nxi代表在测试面积内有某种结构截面数, 单位为μm2。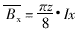
z意义同前,Ix代表纵横两组平行线与曲线交叉点,单位为:μm。
(二) 线粒体 体密度(Vv)、面密度(Sv)、比表面(δ)和面数密度(numerical density on area, NA)。计算公式如下: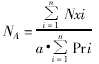
Nxi、Pri和a的意义同前,单位为:μm-2。
(三)高尔基体 体密度(Vv)、面密度(Sv)和比表面(δ)。
, 百拇医药
(四)板层体 体密度(Vv)、面数密度(NA)、数密度(numerical density, Nv)、平均截面积(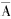 x) 和平均周长(
x) 和平均周长( x)。计算公式如下:
x)。计算公式如下: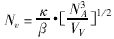
κ为大小分布系数,β为形状系数,NA为面数密度,VV为体密度,单位为:μm-3。
五、SOD活性、MDA含量测定
(一)肺组织匀浆制备 肺组织用预冷的生理盐水洗净残血,吸干水分,称1 g湿重肺组织,剪碎置于玻璃匀浆器中研磨5 min,加入9 mL 1.15%氯化钾溶液制成匀浆,用于MDA含量测定,匀浆液经6 000×g离心30 min,取上清液作SOD活性测定。
, 百拇医药
(二)血清、肺组织SOD活性测定 按邻苯三酚自氧化法,采用SOD试剂盒(四川省医学试剂研究开发中心提供)测定,依照说明书操作。
(三)血清、肺组织MDA含量测定 按硫代巴比妥酸法,采用MDA试剂盒(四川省医学试剂研究开发中心提供)测定,依照说明书操作。
六、统计分析
实验数据以均数±标准差( ±s)表示,两组间比较采用t检验。
±s)表示,两组间比较采用t检验。
结 果
一、DM大鼠血糖及肺系数变化
DM28d大鼠血糖显著高于对照组。DM组大鼠肺湿重和肺系数分别与对照组比较,差异无显著(P>0.05)。
, http://www.100md.com
二、大体及光镜观察
两组大鼠肺脏体积无差异,肺膜表面光滑,呈淡红色,但DM大鼠肺组织质地稍硬。光镜下,DM大鼠肺泡腔缩小,肺泡数量增多(图1)。
Fig 1 Diabetic rat lung (panel A). Alveolar size smaller than that of the control lung (panel B).Hematoxylin-eosin stain; Original megnification ×200
图1 对照组与DM组大鼠肺形态变化
三、肺泡形态计量
DM大鼠Vva和Lm显著低于对照组(P<0.05,P<0.01);Vvw、Sva、 Nv、NA及Rsv(a)显著高于对照组(P<0.01);Vvd、Vvb及Rsv(d)与对照组无显著差异(P>0.05)(见表1)。
, http://www.100md.com
表1 两组大鼠肺定量测定结果
Tab 1 Results of lung quantity in control
and diabetic rats( ±s,n=10)
±s,n=10)
Control group
Diabetic group
Vva
0.590±0.055
0.530±0.029*
Vvd
, http://www.100md.com
0.238±0.038
0.231±0.033
Vvw
0.148±0.041
0.233±0.052**
Vvb
0.024±0.006
0.024±0.006
Sva(μm2μm-3)
28.420±4.135
34.780±4.203**
, http://www.100md.com
Nv(×10-4,μm-3)
5.573±1.572
9.984±1.704**
NA(×10-4,μm-2)
4.751±1.576
7.455±1.640**
Rsv(a)(μm2μm-3)
48.491±4.496
65.123±4.440**
, http://www.100md.com
Rsv(d)(μm2μm-3)
29.186±3.489
31.498±3.675
Lm(μm)
102.266±4.109
85.279±4.597**
* P<0.05,** P<0.01, vs control group
四、电镜观察
DM大鼠Ⅰ型肺泡细胞形态正常。Ⅱ型肺泡细胞游离面微绒毛正常,核园形,核周间隙轻度扩大,RER明显扩张,部分有脱颗粒, 扩张网池内颗粒物质电子密度低于周围胞质。部分高尔基体小囊轻度扩张,部分线粒体肿胀、扩张及空泡化。肺上皮细胞和毛细血管基底膜不同程度增厚。肺泡巨噬细胞表面伪足减少,毛细血管内皮细胞、间质细胞形态正常(图2,3)。
, http://www.100md.com
Fig 2 Both capillary and epithelial basal laminae of the lung of a diabetic rat are of variable thickness (TEM,×35 000)
图2 DM大鼠肺基底膜增厚
Fig 3 Massively dilated rough endoplasmic reticulum(dRER)in a typeⅡpneumocyte from the lung of a diabetic rat(TEM, ×10 000)
图3 DM大鼠Ⅱ型肺泡细胞RER明显扩张
表2 两组大鼠Ⅱ型肺泡细胞RER、线粒体、高尔基体和板层体形态计量测定
, 百拇医药
Tab 2 Morphometric study of RER,mitochondria, Golgi's complex and lamellar body of type Ⅱ pneumocyte in control and diabetic rats ( ±s,n=10)
±s,n=10)
Control group
Diabetic group
RER
Vv
0.014±0.009
0.133±0.120**
, http://www.100md.com
Sv(μm-1)
0.253±0.164
0.559±0.308**
δ(μm-1)
20.807±10.614
12.543±9.204**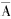 x(μm2)
x(μm2)
1 148±620
26 459±8 458** x(μm)
x(μm)
, 百拇医药
3.839±1.467
9.671±6.100**
Mitochondria
Vv
0.123±0.052
0.117±0.035
Sv(μm-1)
0.994±0.306
0.852±0.338
δ(μm-1)
9.401±2.806
, http://www.100md.com
8.480±1.520
NA(×10-5,μm-2)
5.149±1.174
5.068±1.423
Golg's complex
Vv
0.017±0.023
0.012±0.009
Sv(μm-1)
0.373±0.197
, http://www.100md.com
0.236±0.160*
δ(μm-1)
25.977±8.649
20.064±9.018*
Lamellar body
Vv
0.139±0.054
0.110±0.070
NA(×10-5,μm-2)
5.670±1.216
, 百拇医药
4.643±1.865
Nv(×10-7,μm-3)
8.289±3.239
6.944±2.293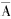 x(μm2)
x(μm2)
4 608±1 741
4 523±1 625 x(μm)
x(μm)
19.014±8.408
14.942±8.731
, 百拇医药
* P<0.05, ** P<0.01, vs control group
五、Ⅱ型肺泡细胞形态计量
DM大鼠Ⅱ型肺泡细胞RER的Vv、Sv、x、x均显著大于对照组(P<0.01),而δ低于对照组(P<0.01);高尔基体的Sv和δ均低于对照组(P<0.05)(见表2)。
六、DM组与对照组血清、肺组织SOD活性、MDA含量测定
DM组大鼠血清SOD活性显著低于对照组(P<0.01),而MDA含量高于对照组(P<0.01);DM组大鼠肺组织SOD活性与对照组无显著差异(P>0.05),但MDA含量高于对照组(P<0.01)(见表3)。
表3 两组大鼠血清和肺组织匀浆SOD和MDA水平的比较
, 百拇医药
Tab 3 Comparison of SOD activity and MDA content in serum and lung homogenate in two groups( ±s,n=10)
±s,n=10)
Control group
Diabetic group
Serum SOD(U/mL)
22.93±3.56
15.04±4.67**
Lung SOD(U/100 mg)
20.57±3.62
, 百拇医药
19.49±4.85
Serum MDA(nmol/mL)
11.59±4.26
18.89±5.43**
Lung MDA(nmol/100mg)
17.21±3.43
21.65±1.78**
** P<0.01, vs control group 讨 论
四氧嘧啶是酰脲酸衍生物,在国内外被广泛应用于诱导建立与人类1型DM近似的动物模型,它主要损伤大鼠胰腺、肾、肾上腺、甲状腺、垂体和肝脏,而对肺脏无明显的影响。因此,我们采用四氧嘧啶复制的早期DM大鼠模型,了解DM肺脏变化。
, http://www.100md.com
从表1及图1可以看出DM大鼠肺病变以肺泡数量增多为其特征。其原因可能是DM时肺胶原和弹性蛋白增加[3],促进胶原、弹性蛋白交联形成的赖氨酰氧化酶活性增强[4], 增加了胶原-弹性蛋白交联和结缔组织网的再改造,同时,胰岛素缺乏可致肺表面活性物质减少,肺泡内气腔体积变小,使每单位体积肺泡数量增加。但DM肺泡数量增加的病理生理学意义目前仍不清楚,尚需进一步研究。
Ⅱ型肺泡细胞对于维持肺泡结构的功能和稳定具有重要作用。表2和图3可以看出RER存在明显扩张与肿胀,提示Ⅱ型肺泡细胞内蛋白质合成、分泌及氧化磷酸化过程受损。这与DM时胰岛素缺乏,使Ⅱ型肺泡细胞核核糖核蛋白体对mRNA的翻译能力降低,减低蛋白质合成速率;同时,糖原合成减少,分解加强,葡萄糖利用受阻抑,蛋白质动员加强,使来自氨基酸的葡萄糖异生作用加强等因素有关,进而引起DM肺代谢紊乱。DM大鼠Ⅱ型肺泡细胞高尔基体的Sv和δ下降与高尔基体小囊扩张干扰细胞内生物合成有关。DM 28d大鼠肺上皮细胞和毛细血管基底膜不同程度增厚,表明DM早期肺已存在微血管病变,其原因在于DM时肺结缔组织蛋白质合成增加,而降解率下降,使肺胶原和弹性蛋白含量升高[5],致基底膜增厚,肺弥散量下降,影响肺功能。另外,可见 DM肺泡巨噬细胞伪足减少,可能与高血糖状态有关[6]。
, http://www.100md.com
大量的基础与临床研究显示,DM存在明显的氧化应激 ( oxidative stress),其自由基增加与DM并发症明显相关[7]。DM 28d大鼠血清SOD活性降低,可明显削弱机体清除自由基的能力,从而参与DM慢性并发症的发生。而肺组织SOD 活性无变化,推测在DM早期,虽然自由基增加,但肺的代偿适应能力增强,以维持机体生理功能的相对平衡,使SOD活性无明显下降,具体机制有待进一步研究。DM血清及肺组织MDA含量均增加,表明DM状态下脂质过氧化增强,其产生的MDA具有强交联性质,能与含游离氨基的蛋白质、 核酸等交联,形成Schiff氏碱,以致干扰蛋白质、核酸及细胞功能[8],导致DM 大鼠肺毛细血管基底膜脂质过氧化,膜通透性增加,基底膜增厚,肺弥散功能受损。本实验电镜观察证实了基底膜增厚的形态学基础。
总之,DM早期肺脏不仅存在微血管病变,而且受到氧化应激的危害,提示肺脏是DM损害的“靶器官”之一。
[参 考 文 献 ]
, http://www.100md.com
[1] 申 洪, 沈忠英. 实用生物体视学技术[M]. 第1版,广州:中山大学出版社,1991, 26~134.
[2] 郑富盛. 细胞形态立体计量学[M]. 第1版.北京:北京医科大学. 中国协和医科大学联合出版社,1990,6~44, 85~103.
[3] 沈兴平,舒昌达,何军.实验性糖尿病肺细胞外基质免疫组织化学研究[J].中国糖尿病杂志. (待发表)
[4] Madia AM, Rozovski SJ, Kogam HIM. Changes in lung lysyl oxidase activity in streptozotocin-diabetes and in starvation[J]. Biochim Biophys Acta, 1979,585:481~487.
[5] Lange P, Groth S, Mortensen T, et al. Diabetes mellitus and ventilatory capacity: a five year follow-up study[J]. Eur Respir J,1990,3: 288~292.
, http://www.100md.com
[6] 沈兴平,舒昌达,何 军. 高糖及高胰岛素对肺泡巨噬细胞吞噬功能和超微结构的影响[J]. 中国病理生理杂志, 2000,16(4):357~361.
[7] Baynes JH. Role of oxidative stress in development of complications in diabetes[J]. Diabetes, 1991,40:405~412.
[8] Bloomgarden ZT. Autoxidants and diabetes[J]. Diabetes Care,1997,20:670~673.
[收稿日期] 1999-06-14 [修回日期] 1999-10-27
, http://www.100md.com
单位:沈兴平(重庆医科大学附属第二医院内分泌科,重庆 400010);舒昌达 张佐才(重庆医科大学法医学教研室);何军(重庆医科大学附属第一医院内分泌科)
关键词:糖尿病,实验性;肺;超氧化物歧化酶;丙二醛
中国病理生理杂志000619
[摘 要] 目的:了解早期糖尿病肺形态学及氧化应激的变化。方法:应用体视学方法对四氧嘧啶诱导的糖尿病28 d大鼠肺进行定量研究、观察超微结构变化并测定血清和肺组织的超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量。结果:糖尿病大鼠肺泡体密度和平均截线长度减少,肺泡壁体密度、肺泡表面积密度、肺泡数密度、肺泡面数密度和肺泡比表面增加。糖尿病大鼠Ⅱ型肺泡细胞粗面内质网扩张,其体密度、面密度、平均截面积和平均周长增加,而比表面减少。肺上皮和毛细血管基底膜增厚。糖尿病大鼠血清SOD活性下降,MDA含量增加;肺组织MDA含量明显升高。结论:糖尿病早期大鼠肺已发生形态学变化且受到氧化应激的危害,提示肺脏是糖尿病损害的“靶器官”之一。
, 百拇医药
[中图分类号] R563.1; R587.1 [文献标识码] A
[文章编号] 1000-4718(2000)06-0552-05
Study of lung morphologic features and oxygen free radicals in experimental diabetic rats
SHEN Xing-ping, SHU Chang-da, ZHANG Zuo-cai, HE Jun
(Department of Endocrinology, The Second College of Clinical Medicine,Chongqing University of Medical Sciences, Chongqing 400010, China)
, 百拇医药
[Abstract] AIM:To evaluate the changes of lung morphologic features and oxidative stress in experimental diabetic rats. METHODS: The pulmonary structure of alloxan-induced diabetic rats were quantitatively studied with stereological methods. Changes of ultrastructure, activities of superoxide dismutase (SOD) and contents of malondialdehyde(MDA) of diabetic lung and serum were observed. RESULTS: The volume proportion of alveolar air and mean linear intercept of diabetic rats decreased remarkably in comparison with controls while the volume proportion of alveolar wall, the surface density of alveolar, the numerical density of alveolic area, the numerical density of alveolar and specific surface of alveolar increased significantly. The major change of the type II pneumocyte of diabetic rats was dilation of the rough endoplasmic reticulum (RER). The other findings in diabetic rats had included the presence of thickened alveolar epithelial, pulmonary capillary basal laminae and blood- air barrier, the volume density, the surface density, the mean profile area and the mean perimeter of RER in type Ⅱ pneumocyte of diabetic rats increased remarkably. And the specific surface of RER was significantly lower as compared with controls. SOD activity decreased and MDA content increased significantly in serum of diabetic rats as compared with the control group. SOD activity in the diabetic lung was not different from that of the control lung. However, the content of MDA obviously increased in diabetic lung. CONCLUSION: The morphologic features and oxidative stress in early diabetic rats are abnormal thus the lung should be considered as one of the “target organ”in diabetes mellitus.
, http://www.100md.com
[MeSH] Diabetes mellitus, experimental; Lung; Superoxide dismutase; Malondialdehyde
目前认为,糖尿病(diabetes mellitus,DM)微血管病变和组织蛋白质非酶糖基化(nonenzymatic glycation)可能是其慢性并发症的主要发病机制。肺脏是一个具有丰富的微循环和结缔组织的器官。近年来关于DM对肺脏的损害尚未引起足够的重视。本文应用光镜及电镜方法对四氧嘧啶诱导的DM 28 d大鼠肺形态进行定性及体视学计量研究,同时,测定血清和肺组织超氧化物歧化酶(superoxide dismutase, SOD) 活性及丙二醛(malondialdehyde,MDA)含量,旨在探讨DM肺病变的发病机制。
材 料 和 方 法
一、动物模型复制及取材
, http://www.100md.com
雄性Wistar大鼠20只(本校实验动物中心提供),体重150~180 g, 随机分为DM组与对照组。每组10只大鼠。DM组大鼠给予四氧嘧啶(本校临床学院人工细胞室提供)一次性腹腔内(按200 mg/kg体重)注射,对照组注射等量生理盐水。注射药物后第3 d测空腹血糖(邻甲苯胺法)>13.90 mmol/L为DM模型成立。所有大鼠均自由饮水、进食。在DM模型成立28 d时,测空腹血糖,其值仍>13.90 mmol/L。DM组与对照组大鼠称重后,用1%戊巴比妥钠腹腔注射麻醉大鼠,心腔内采血,速取肺脏。观察肺大体改变,称肺湿重,并计算肺系数(肺湿重(g)/体重(g)×100)。右肺制成匀浆,用于生化检查,左肺用于光镜和电镜观察。分离血清测定SOD活性、MDA含量。
二、光镜观察
左肺速取电镜标本后,剩余肺组织用10%中性缓冲福尔马林固定48~72 h,逐级脱水,常温石蜡包埋,用Reichert切片机切片(5 μm厚切片),每例肺进行连续切片,每隔5张等距离选取切片一张,共选5张切片,H.E染色,进行定性、定量观察。每张切片观察5个视野,即肺尖、肺底各两个固定视野,肺中部一个视野。在OLYMPUS BH-2型显微镜下,放大400倍,用5 mm×5 mm网格目测微尺以点计数法测算下列参数,计算公式来自文献[1]。
, http://www.100md.com
(一) 肺泡体密度(volume proportion of alveolar air, Vva)、肺泡管体密度(volume proportion of alveolar duct air, Vvd)、肺泡壁体密度(volume proportion of alveolar wall, Vvw)和传导气道体密度(volume proportion of conducting airway, Vvb)。计算公式如下:
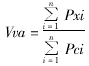
Pxi表示测试点落在第i幅图像肺泡上的点数,Pci表示测试点落在第i幅图像所定参照系上的点数,n表示图像数。
(二) 肺泡平均截线长度(mean linear intercept, Lm)、肺泡表面积密度(surface density of alveoli, Sva)、肺泡数密度(numerical density of alveoli, Nv)、肺泡面数密度(numerical density on area of alveoli, NA)、肺泡比表面(specific surface of alveoli, Rsv(a))和肺泡管比表面(specific surface of alveolar duct air, Rsv(d))。计算公式如下:
, 百拇医药
Lm:测试线穿过肺泡截面时,在截面内的平均长度。
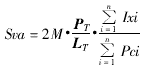
PT、LT 分别为所用测试系统的测试点数和测试线长度,Ixi为测试线与肺泡界面的交点,Pci为包容空间的测试点数,M为放大倍数,单位为:μm2μm-3。

NX为测试肺泡截面数,PX为击中测试肺泡截面的点数,PC为参照系内的测试点数,α为每个测试点所代表的面积,β为形状常数(β=1.55), 单位为:个/μm3。
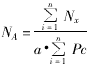
, 百拇医药
NX为测试肺泡截面数,PC为参照系内的测试点数,α为每个测试点所代表的面积,单位为:个/μm2。
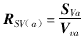
单位为:μm2μm-3。
三、电镜观察
每例左肺取3块肺组织,迅速以4%戊二醛固定2 h,1%四氧化锇后固定(4℃) 2 h,乙醇逐级脱水,环氧树脂618浸透、包埋。半薄切片0.5~1 μm厚,甲苯胺蓝染色,光镜下定位。超薄切片500~700 A°, 醋酸双氧铀和铅盐双重染色,在H-600型透射电镜下观察及照相。
四、Ⅱ型肺泡细胞形态计量
电镜下以10 000倍随机拍摄Ⅱ型肺泡细胞。其中对照组和DM组各30个细胞,每只动物2~4个。底片光学放大2倍,采用正方格测试系统,印有测试系统的底片与电镜底片叠印成照片,总放大倍数20 000倍。采用点计数法测算下列参数,计算公式来自文献[2]。
, http://www.100md.com
(一) 粗面内质网(rough endoplasmic reticulum, RER)、体密度(volume density, Vv)、面密度(surface density, Sv)、比表面(specific surface,δ)、平均截面积(mean profile area,
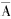 x)和平均周长(mean perimeter,x)。计算公式如下:
x)和平均周长(mean perimeter,x)。计算公式如下: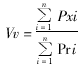
Pxi代表第i张照片上落在某结构范围内的测试点数,Pri代表同一张照片落在参照系截面内的测试点数。
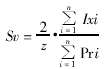
Ixi代表第i张照片上膜截线与测试线的交叉点数,Pri代表同一张照片落在参照系截面内的测试点数,z等于小正方格边长的2倍,单位为: μm-1。
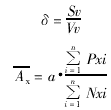
, 百拇医药
a为一个测试点所代表的面积,Pxi代表第i张照片上落在某结构范围内的测试点数,Nxi代表在测试面积内有某种结构截面数, 单位为μm2。
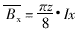
z意义同前,Ix代表纵横两组平行线与曲线交叉点,单位为:μm。
(二) 线粒体 体密度(Vv)、面密度(Sv)、比表面(δ)和面数密度(numerical density on area, NA)。计算公式如下:
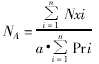
Nxi、Pri和a的意义同前,单位为:μm-2。
(三)高尔基体 体密度(Vv)、面密度(Sv)和比表面(δ)。
, 百拇医药
(四)板层体 体密度(Vv)、面数密度(NA)、数密度(numerical density, Nv)、平均截面积(
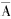 x) 和平均周长(
x) 和平均周长( x)。计算公式如下:
x)。计算公式如下: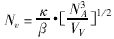
κ为大小分布系数,β为形状系数,NA为面数密度,VV为体密度,单位为:μm-3。
五、SOD活性、MDA含量测定
(一)肺组织匀浆制备 肺组织用预冷的生理盐水洗净残血,吸干水分,称1 g湿重肺组织,剪碎置于玻璃匀浆器中研磨5 min,加入9 mL 1.15%氯化钾溶液制成匀浆,用于MDA含量测定,匀浆液经6 000×g离心30 min,取上清液作SOD活性测定。
, 百拇医药
(二)血清、肺组织SOD活性测定 按邻苯三酚自氧化法,采用SOD试剂盒(四川省医学试剂研究开发中心提供)测定,依照说明书操作。
(三)血清、肺组织MDA含量测定 按硫代巴比妥酸法,采用MDA试剂盒(四川省医学试剂研究开发中心提供)测定,依照说明书操作。
六、统计分析
实验数据以均数±标准差(
 ±s)表示,两组间比较采用t检验。
±s)表示,两组间比较采用t检验。结 果
一、DM大鼠血糖及肺系数变化
DM28d大鼠血糖显著高于对照组。DM组大鼠肺湿重和肺系数分别与对照组比较,差异无显著(P>0.05)。
, http://www.100md.com
二、大体及光镜观察
两组大鼠肺脏体积无差异,肺膜表面光滑,呈淡红色,但DM大鼠肺组织质地稍硬。光镜下,DM大鼠肺泡腔缩小,肺泡数量增多(图1)。

Fig 1 Diabetic rat lung (panel A). Alveolar size smaller than that of the control lung (panel B).Hematoxylin-eosin stain; Original megnification ×200
图1 对照组与DM组大鼠肺形态变化
三、肺泡形态计量
DM大鼠Vva和Lm显著低于对照组(P<0.05,P<0.01);Vvw、Sva、 Nv、NA及Rsv(a)显著高于对照组(P<0.01);Vvd、Vvb及Rsv(d)与对照组无显著差异(P>0.05)(见表1)。
, http://www.100md.com
表1 两组大鼠肺定量测定结果
Tab 1 Results of lung quantity in control
and diabetic rats(
 ±s,n=10)
±s,n=10)Control group
Diabetic group
Vva
0.590±0.055
0.530±0.029*
Vvd
, http://www.100md.com
0.238±0.038
0.231±0.033
Vvw
0.148±0.041
0.233±0.052**
Vvb
0.024±0.006
0.024±0.006
Sva(μm2μm-3)
28.420±4.135
34.780±4.203**
, http://www.100md.com
Nv(×10-4,μm-3)
5.573±1.572
9.984±1.704**
NA(×10-4,μm-2)
4.751±1.576
7.455±1.640**
Rsv(a)(μm2μm-3)
48.491±4.496
65.123±4.440**
, http://www.100md.com
Rsv(d)(μm2μm-3)
29.186±3.489
31.498±3.675
Lm(μm)
102.266±4.109
85.279±4.597**
* P<0.05,** P<0.01, vs control group
四、电镜观察
DM大鼠Ⅰ型肺泡细胞形态正常。Ⅱ型肺泡细胞游离面微绒毛正常,核园形,核周间隙轻度扩大,RER明显扩张,部分有脱颗粒, 扩张网池内颗粒物质电子密度低于周围胞质。部分高尔基体小囊轻度扩张,部分线粒体肿胀、扩张及空泡化。肺上皮细胞和毛细血管基底膜不同程度增厚。肺泡巨噬细胞表面伪足减少,毛细血管内皮细胞、间质细胞形态正常(图2,3)。

, http://www.100md.com
Fig 2 Both capillary and epithelial basal laminae of the lung of a diabetic rat are of variable thickness (TEM,×35 000)
图2 DM大鼠肺基底膜增厚

Fig 3 Massively dilated rough endoplasmic reticulum(dRER)in a typeⅡpneumocyte from the lung of a diabetic rat(TEM, ×10 000)
图3 DM大鼠Ⅱ型肺泡细胞RER明显扩张
表2 两组大鼠Ⅱ型肺泡细胞RER、线粒体、高尔基体和板层体形态计量测定
, 百拇医药
Tab 2 Morphometric study of RER,mitochondria, Golgi's complex and lamellar body of type Ⅱ pneumocyte in control and diabetic rats (
 ±s,n=10)
±s,n=10)Control group
Diabetic group
RER
Vv
0.014±0.009
0.133±0.120**
, http://www.100md.com
Sv(μm-1)
0.253±0.164
0.559±0.308**
δ(μm-1)
20.807±10.614
12.543±9.204**
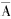 x(μm2)
x(μm2)1 148±620
26 459±8 458**
 x(μm)
x(μm), 百拇医药
3.839±1.467
9.671±6.100**
Mitochondria
Vv
0.123±0.052
0.117±0.035
Sv(μm-1)
0.994±0.306
0.852±0.338
δ(μm-1)
9.401±2.806
, http://www.100md.com
8.480±1.520
NA(×10-5,μm-2)
5.149±1.174
5.068±1.423
Golg's complex
Vv
0.017±0.023
0.012±0.009
Sv(μm-1)
0.373±0.197
, http://www.100md.com
0.236±0.160*
δ(μm-1)
25.977±8.649
20.064±9.018*
Lamellar body
Vv
0.139±0.054
0.110±0.070
NA(×10-5,μm-2)
5.670±1.216
, 百拇医药
4.643±1.865
Nv(×10-7,μm-3)
8.289±3.239
6.944±2.293
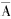 x(μm2)
x(μm2)4 608±1 741
4 523±1 625
 x(μm)
x(μm)19.014±8.408
14.942±8.731
, 百拇医药
* P<0.05, ** P<0.01, vs control group
五、Ⅱ型肺泡细胞形态计量
DM大鼠Ⅱ型肺泡细胞RER的Vv、Sv、x、x均显著大于对照组(P<0.01),而δ低于对照组(P<0.01);高尔基体的Sv和δ均低于对照组(P<0.05)(见表2)。
六、DM组与对照组血清、肺组织SOD活性、MDA含量测定
DM组大鼠血清SOD活性显著低于对照组(P<0.01),而MDA含量高于对照组(P<0.01);DM组大鼠肺组织SOD活性与对照组无显著差异(P>0.05),但MDA含量高于对照组(P<0.01)(见表3)。
表3 两组大鼠血清和肺组织匀浆SOD和MDA水平的比较
, 百拇医药
Tab 3 Comparison of SOD activity and MDA content in serum and lung homogenate in two groups(
 ±s,n=10)
±s,n=10)Control group
Diabetic group
Serum SOD(U/mL)
22.93±3.56
15.04±4.67**
Lung SOD(U/100 mg)
20.57±3.62
, 百拇医药
19.49±4.85
Serum MDA(nmol/mL)
11.59±4.26
18.89±5.43**
Lung MDA(nmol/100mg)
17.21±3.43
21.65±1.78**
** P<0.01, vs control group 讨 论
四氧嘧啶是酰脲酸衍生物,在国内外被广泛应用于诱导建立与人类1型DM近似的动物模型,它主要损伤大鼠胰腺、肾、肾上腺、甲状腺、垂体和肝脏,而对肺脏无明显的影响。因此,我们采用四氧嘧啶复制的早期DM大鼠模型,了解DM肺脏变化。
, http://www.100md.com
从表1及图1可以看出DM大鼠肺病变以肺泡数量增多为其特征。其原因可能是DM时肺胶原和弹性蛋白增加[3],促进胶原、弹性蛋白交联形成的赖氨酰氧化酶活性增强[4], 增加了胶原-弹性蛋白交联和结缔组织网的再改造,同时,胰岛素缺乏可致肺表面活性物质减少,肺泡内气腔体积变小,使每单位体积肺泡数量增加。但DM肺泡数量增加的病理生理学意义目前仍不清楚,尚需进一步研究。
Ⅱ型肺泡细胞对于维持肺泡结构的功能和稳定具有重要作用。表2和图3可以看出RER存在明显扩张与肿胀,提示Ⅱ型肺泡细胞内蛋白质合成、分泌及氧化磷酸化过程受损。这与DM时胰岛素缺乏,使Ⅱ型肺泡细胞核核糖核蛋白体对mRNA的翻译能力降低,减低蛋白质合成速率;同时,糖原合成减少,分解加强,葡萄糖利用受阻抑,蛋白质动员加强,使来自氨基酸的葡萄糖异生作用加强等因素有关,进而引起DM肺代谢紊乱。DM大鼠Ⅱ型肺泡细胞高尔基体的Sv和δ下降与高尔基体小囊扩张干扰细胞内生物合成有关。DM 28d大鼠肺上皮细胞和毛细血管基底膜不同程度增厚,表明DM早期肺已存在微血管病变,其原因在于DM时肺结缔组织蛋白质合成增加,而降解率下降,使肺胶原和弹性蛋白含量升高[5],致基底膜增厚,肺弥散量下降,影响肺功能。另外,可见 DM肺泡巨噬细胞伪足减少,可能与高血糖状态有关[6]。
, http://www.100md.com
大量的基础与临床研究显示,DM存在明显的氧化应激 ( oxidative stress),其自由基增加与DM并发症明显相关[7]。DM 28d大鼠血清SOD活性降低,可明显削弱机体清除自由基的能力,从而参与DM慢性并发症的发生。而肺组织SOD 活性无变化,推测在DM早期,虽然自由基增加,但肺的代偿适应能力增强,以维持机体生理功能的相对平衡,使SOD活性无明显下降,具体机制有待进一步研究。DM血清及肺组织MDA含量均增加,表明DM状态下脂质过氧化增强,其产生的MDA具有强交联性质,能与含游离氨基的蛋白质、 核酸等交联,形成Schiff氏碱,以致干扰蛋白质、核酸及细胞功能[8],导致DM 大鼠肺毛细血管基底膜脂质过氧化,膜通透性增加,基底膜增厚,肺弥散功能受损。本实验电镜观察证实了基底膜增厚的形态学基础。
总之,DM早期肺脏不仅存在微血管病变,而且受到氧化应激的危害,提示肺脏是DM损害的“靶器官”之一。
[参 考 文 献 ]
, http://www.100md.com
[1] 申 洪, 沈忠英. 实用生物体视学技术[M]. 第1版,广州:中山大学出版社,1991, 26~134.
[2] 郑富盛. 细胞形态立体计量学[M]. 第1版.北京:北京医科大学. 中国协和医科大学联合出版社,1990,6~44, 85~103.
[3] 沈兴平,舒昌达,何军.实验性糖尿病肺细胞外基质免疫组织化学研究[J].中国糖尿病杂志. (待发表)
[4] Madia AM, Rozovski SJ, Kogam HIM. Changes in lung lysyl oxidase activity in streptozotocin-diabetes and in starvation[J]. Biochim Biophys Acta, 1979,585:481~487.
[5] Lange P, Groth S, Mortensen T, et al. Diabetes mellitus and ventilatory capacity: a five year follow-up study[J]. Eur Respir J,1990,3: 288~292.
, http://www.100md.com
[6] 沈兴平,舒昌达,何 军. 高糖及高胰岛素对肺泡巨噬细胞吞噬功能和超微结构的影响[J]. 中国病理生理杂志, 2000,16(4):357~361.
[7] Baynes JH. Role of oxidative stress in development of complications in diabetes[J]. Diabetes, 1991,40:405~412.
[8] Bloomgarden ZT. Autoxidants and diabetes[J]. Diabetes Care,1997,20:670~673.
[收稿日期] 1999-06-14 [修回日期] 1999-10-27
, http://www.100md.com