一种检测肿瘤细胞凋亡的新方法
作者:何维敬 张庆殷 张芬 张建
单位:何维敬 张庆殷(山东医科大学 附属医院);张芬 张建业(山东医科大学, 山东 济南 250012)
关键词:肿瘤;细胞;细胞凋亡;抗肿瘤药
中国病理生理杂志001013
[中图分类号] Q813.5 R979.1 [文献标识码] A
[文章编号] 1000-4718(2000)10-0917-02
[MeSH] Neoplasms; Cells; Apoptosis; Antineoplastic agent
细胞凋亡(apoptosis)检测方法有多种,但大多操作复杂且需贵重试剂或仪器。我们根据MTT试验及台盼蓝试验的原理,设计了一种由二者计算细胞凋亡率的简单方法,并以此方法分析了白血病细胞株HL-60受抗癌药物VP-16诱导时的凋亡情况。
, 百拇医药
材 料 和 方 法
一、细胞培养
HL-60细胞株(本院血液病研究室提供),常规1640(Gbico)培养,隔天换液,取对数生长期的细胞实验。
二、细胞处理
调整细胞浓度至109/L,加入VP-16(Sigma)至所需浓度12h后收获细胞备用,药物浓度依次为0、 5、 10、 20、 40 mg/L。
三、凋亡细胞分离
参照文献[1]的方法,按从下往上1.08×103 g/L(1 mL)、1.078×103 g/L(2 mL)、 1.076×103 g/L(2 mL)、1.074×103 g/L(2 mL)、1.072×103 g/L(2 mL)、1.07×103 g/L(2 mL)的密度制备Percoll不连续密度梯度液。用1.06×103 g/L Percoll液调整各处理组细胞至109/L,取1 mL此细胞悬液加入至上述梯度液上层,400 g离心30 min,收集1.08×103 g/L富含凋亡细胞层细胞备用。
, http://www.100md.com
四、MTT计算法测定细胞凋亡率
(一) MTT试验 100 μL/孔细胞(5×108/L)中加入VP-16至所需浓度,培养12 h。终止培养前4 h加入MTT 10 μL/孔(5 g/L),培养板离心后弃上清,每孔加入100 μL DMSO溶解甲月 赞结晶,酶标仪测定各孔OD570值。死细胞%=(1-OD实验/OD对照)×100%。
(二) 台盼蓝试验 各处理组收获细胞,常规台盼蓝(0.5%)染色,镜检200个细胞,计数死细胞百分率。
(三) 细胞凋亡率计算 凋亡细胞%=死细胞%(MTT法)-死细胞%(台盼蓝法)
五、流式细胞术(FCM)检测
约106细胞,70%冷乙醇4 ℃固定过夜,PI(Sigma)染色,激发光波长488 nm,流式细胞仪测定凋亡细胞百分数。
, 百拇医药
六、核酸电泳
参照文献[2]的方法进行。
七、统计方法
实验重复3次取均值,数据以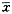 ±s表示,采用student’s t检验判定均数差异显著性。
±s表示,采用student’s t检验判定均数差异显著性。
结 果
一、VP-16处理HL-60细胞的凋亡表现
经VP-16处理的HL-60细胞体积变小,染色质浓缩致密,形成不同形状的核形;核酸电泳图谱显示VP-16可使HL-60细胞出现典型的梯状DNA条带(DNA Ladder);在FCM DNA直方图上,实验组G0/G1峰前有明显的亚二倍体峰(凋亡峰)。
, 百拇医药
二、两种方法测得不同浓度VP-16诱导HL-60细胞凋亡结果
见图1,随着VP-16浓度的增加,两种方法测得的细胞凋亡率都逐渐增加,各处理组间结果二者对比均无明显差别(P>0.05)。
三、两种方法分离提取凋亡细胞的测试结果(4个处理组总平均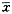 ±s. n=12)
±s. n=12)
死细胞%(MTT法)为94.1±2.62,死细胞%(台盼蓝法)为3.9±1.03。由此计算出的调亡细胞百分率90.2±2.53与FCM法测得的凋亡细胞百分率92.9±1.93相比无明显差别(P>0.05)。
讨 论
细胞凋亡的检测方法主要有核酸电泳、电镜观察、FCM分析等,但前者的“梯形结构”很难定量检测,后二者仪器昂贵,其它一些方法往往操作复杂。
, 百拇医药
Fig 1 The percent of apoptosis cells measured by two different methods.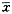 ±s. n=3.
±s. n=3.
■MTT calculated method □FCM method
图1 两种方法测得各处理组细胞凋亡率比较
凋亡细胞的细胞膜仍完整,拒染台盼蓝,而活细胞亦拒染台盼蓝[3],说明只通过台盼蓝染色不能确认凋亡细胞;而MTT试验是通过检查线粒体中琥珀酸脱氢酶转变MTT的能力来判定线粒体功能,从而提示细胞的存活与否。根据上述实验原理,我们认为把二者结合起来可区分坏死还是凋亡:坏死和凋亡细胞的线粒体功能都丧失,由MTT试验反映出来;而只有坏死的细胞胞膜完整性受损,由台盼蓝拒染试验反映出来,二者的差值部分可代表细胞凋亡部分。初步实验结果表明其与FCM法结果基本一致(图1)。但近来有学者提出凋亡小体是有生命活动的[4],而凋亡小体中可含有线粒体等细胞器,说明凋亡小体中的线粒体仍具功能,这样MTT试验就把凋亡小体归为活细胞,由本法测得的细胞凋亡率就会偏低。为证实MTT试验是否把部分凋亡细胞归入活细胞,凋亡细胞是否拒染台盼蓝,从而进一步证实本法的可靠性,我们用Percoll不连续密度梯度法对各处理组细胞进行了凋亡细胞的提取,并对其对行了凋亡分析。结果表明只有约4%的凋亡细胞不拒染台盼蓝,MTT试验只把约6%的细胞归入活细胞。我们认为这种交叉反应一方面可能由于凋亡细胞分离不纯而掺入部分坏死细胞或正常细胞引起,Martin等[1]用这种方法对凋亡细胞的分离率只有90%;另一方面可能晚期的凋亡细胞的确不拒染台盼蓝,部分凋亡细胞(含线粒体的凋亡小体)的确具有活细胞的功能。只不过最后计算凋亡率时,由于上述结果相减,误差缩小,最后结果与FCM法基本一致(P>0.05)。
, 百拇医药
我们用此法测得VP-16诱导HL-60细胞凋亡情况与文献报道基本一致[2,5]。由此可见,该法简单易行,特别适合一般实验室开展,当然该法尚需在不同的肿瘤细胞中进行广泛的试验加以探讨。
[基金项目] 山东省科委资助项目
Tel: 0531-6921941-3143
[参 考 文 献]
[1] Martin SJ, Bradley JG, Cotter TG. HL- 60 cells induced to differentiate towards neutrophils subsequently die via apoptosis[J]. Clin Exp Immunol, 1990, 79:448-453.
[2] 何维敬,张建业,张庆殷,等.VP-16诱导HL-60细胞凋亡的研究[J].山东医科大学学报, 2000, 38(1): 13-16.
, 百拇医药
[3] 李德玲,王会信,周廷冲.细胞程序性死亡的判定方法[J]. 生物化学与生物物理进展, 1996, 23:322-325.
[4] 陈协群,黄高升,王文亮.细胞凋零小体是有生命活动的[J].第四军医大学学报,1995, 16:69.
[5] Solary E.Apoptosis induced by DNA topoisomerase Ⅰand Ⅱ inhibitors in human leukemic HL-60 cells[J]. Leuk Lymph,1994, 15:21-32.
[收稿日期] 1999-06-17
[修回日期] 1999-12-21
, 百拇医药
单位:何维敬 张庆殷(山东医科大学 附属医院);张芬 张建业(山东医科大学, 山东 济南 250012)
关键词:肿瘤;细胞;细胞凋亡;抗肿瘤药
中国病理生理杂志001013
[中图分类号] Q813.5 R979.1 [文献标识码] A
[文章编号] 1000-4718(2000)10-0917-02
[MeSH] Neoplasms; Cells; Apoptosis; Antineoplastic agent
细胞凋亡(apoptosis)检测方法有多种,但大多操作复杂且需贵重试剂或仪器。我们根据MTT试验及台盼蓝试验的原理,设计了一种由二者计算细胞凋亡率的简单方法,并以此方法分析了白血病细胞株HL-60受抗癌药物VP-16诱导时的凋亡情况。
, 百拇医药
材 料 和 方 法
一、细胞培养
HL-60细胞株(本院血液病研究室提供),常规1640(Gbico)培养,隔天换液,取对数生长期的细胞实验。
二、细胞处理
调整细胞浓度至109/L,加入VP-16(Sigma)至所需浓度12h后收获细胞备用,药物浓度依次为0、 5、 10、 20、 40 mg/L。
三、凋亡细胞分离
参照文献[1]的方法,按从下往上1.08×103 g/L(1 mL)、1.078×103 g/L(2 mL)、 1.076×103 g/L(2 mL)、1.074×103 g/L(2 mL)、1.072×103 g/L(2 mL)、1.07×103 g/L(2 mL)的密度制备Percoll不连续密度梯度液。用1.06×103 g/L Percoll液调整各处理组细胞至109/L,取1 mL此细胞悬液加入至上述梯度液上层,400 g离心30 min,收集1.08×103 g/L富含凋亡细胞层细胞备用。
, http://www.100md.com
四、MTT计算法测定细胞凋亡率
(一) MTT试验 100 μL/孔细胞(5×108/L)中加入VP-16至所需浓度,培养12 h。终止培养前4 h加入MTT 10 μL/孔(5 g/L),培养板离心后弃上清,每孔加入100 μL DMSO溶解甲月 赞结晶,酶标仪测定各孔OD570值。死细胞%=(1-OD实验/OD对照)×100%。
(二) 台盼蓝试验 各处理组收获细胞,常规台盼蓝(0.5%)染色,镜检200个细胞,计数死细胞百分率。
(三) 细胞凋亡率计算 凋亡细胞%=死细胞%(MTT法)-死细胞%(台盼蓝法)
五、流式细胞术(FCM)检测
约106细胞,70%冷乙醇4 ℃固定过夜,PI(Sigma)染色,激发光波长488 nm,流式细胞仪测定凋亡细胞百分数。
, 百拇医药
六、核酸电泳
参照文献[2]的方法进行。
七、统计方法
实验重复3次取均值,数据以
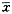 ±s表示,采用student’s t检验判定均数差异显著性。
±s表示,采用student’s t检验判定均数差异显著性。结 果
一、VP-16处理HL-60细胞的凋亡表现
经VP-16处理的HL-60细胞体积变小,染色质浓缩致密,形成不同形状的核形;核酸电泳图谱显示VP-16可使HL-60细胞出现典型的梯状DNA条带(DNA Ladder);在FCM DNA直方图上,实验组G0/G1峰前有明显的亚二倍体峰(凋亡峰)。
, 百拇医药
二、两种方法测得不同浓度VP-16诱导HL-60细胞凋亡结果
见图1,随着VP-16浓度的增加,两种方法测得的细胞凋亡率都逐渐增加,各处理组间结果二者对比均无明显差别(P>0.05)。
三、两种方法分离提取凋亡细胞的测试结果(4个处理组总平均
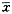 ±s. n=12)
±s. n=12)死细胞%(MTT法)为94.1±2.62,死细胞%(台盼蓝法)为3.9±1.03。由此计算出的调亡细胞百分率90.2±2.53与FCM法测得的凋亡细胞百分率92.9±1.93相比无明显差别(P>0.05)。
讨 论
细胞凋亡的检测方法主要有核酸电泳、电镜观察、FCM分析等,但前者的“梯形结构”很难定量检测,后二者仪器昂贵,其它一些方法往往操作复杂。

, 百拇医药
Fig 1 The percent of apoptosis cells measured by two different methods.
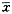 ±s. n=3.
±s. n=3.■MTT calculated method □FCM method
图1 两种方法测得各处理组细胞凋亡率比较
凋亡细胞的细胞膜仍完整,拒染台盼蓝,而活细胞亦拒染台盼蓝[3],说明只通过台盼蓝染色不能确认凋亡细胞;而MTT试验是通过检查线粒体中琥珀酸脱氢酶转变MTT的能力来判定线粒体功能,从而提示细胞的存活与否。根据上述实验原理,我们认为把二者结合起来可区分坏死还是凋亡:坏死和凋亡细胞的线粒体功能都丧失,由MTT试验反映出来;而只有坏死的细胞胞膜完整性受损,由台盼蓝拒染试验反映出来,二者的差值部分可代表细胞凋亡部分。初步实验结果表明其与FCM法结果基本一致(图1)。但近来有学者提出凋亡小体是有生命活动的[4],而凋亡小体中可含有线粒体等细胞器,说明凋亡小体中的线粒体仍具功能,这样MTT试验就把凋亡小体归为活细胞,由本法测得的细胞凋亡率就会偏低。为证实MTT试验是否把部分凋亡细胞归入活细胞,凋亡细胞是否拒染台盼蓝,从而进一步证实本法的可靠性,我们用Percoll不连续密度梯度法对各处理组细胞进行了凋亡细胞的提取,并对其对行了凋亡分析。结果表明只有约4%的凋亡细胞不拒染台盼蓝,MTT试验只把约6%的细胞归入活细胞。我们认为这种交叉反应一方面可能由于凋亡细胞分离不纯而掺入部分坏死细胞或正常细胞引起,Martin等[1]用这种方法对凋亡细胞的分离率只有90%;另一方面可能晚期的凋亡细胞的确不拒染台盼蓝,部分凋亡细胞(含线粒体的凋亡小体)的确具有活细胞的功能。只不过最后计算凋亡率时,由于上述结果相减,误差缩小,最后结果与FCM法基本一致(P>0.05)。
, 百拇医药
我们用此法测得VP-16诱导HL-60细胞凋亡情况与文献报道基本一致[2,5]。由此可见,该法简单易行,特别适合一般实验室开展,当然该法尚需在不同的肿瘤细胞中进行广泛的试验加以探讨。
[基金项目] 山东省科委资助项目
Tel: 0531-6921941-3143
[参 考 文 献]
[1] Martin SJ, Bradley JG, Cotter TG. HL- 60 cells induced to differentiate towards neutrophils subsequently die via apoptosis[J]. Clin Exp Immunol, 1990, 79:448-453.
[2] 何维敬,张建业,张庆殷,等.VP-16诱导HL-60细胞凋亡的研究[J].山东医科大学学报, 2000, 38(1): 13-16.
, 百拇医药
[3] 李德玲,王会信,周廷冲.细胞程序性死亡的判定方法[J]. 生物化学与生物物理进展, 1996, 23:322-325.
[4] 陈协群,黄高升,王文亮.细胞凋零小体是有生命活动的[J].第四军医大学学报,1995, 16:69.
[5] Solary E.Apoptosis induced by DNA topoisomerase Ⅰand Ⅱ inhibitors in human leukemic HL-60 cells[J]. Leuk Lymph,1994, 15:21-32.
[收稿日期] 1999-06-17
[修回日期] 1999-12-21
, 百拇医药