肝缺血预处理保护作用与一氧化氮/内皮素-1系统有关
作者:吕平 陈道达 田源 张景辉 吴毅华
单位:吕平 陈道达(华中科技大学同济医学院附属协和医院 普外科);田源 张景辉 吴毅华(普外科实验室,湖北 武汉 430022)
关键词:肝;再灌注损伤;局部缺血;一氧化氮;内皮缩血管肽类
中国病理生理杂志00108
[摘 要] 目的:研究一氧化氮/内皮素-1(NO/ET-1)失衡与肝缺血再灌注(I/R)损伤的关系以及肝缺血预处理(IPC)对NO/ET-1系统的调节作用。方法:采用鼠肝I/R模型,比较I/R组和IPC+I/R组NO/ET-1系统的变化情况及其与肝I/R损伤的关系。用RT-PCR检测再灌注2h内肝组织中是否有诱生性一氧化氮合酶(iNOS)mRNA表达。结果:再灌注急性期血浆NO代谢产物(NO-2/NO-3)降低、ET-1升高致NO/ET-1比值降低,血浆ALT、AST、LDH、TNF-α含量及肝组织丙二醛(MDA)含量增高,而肝组织ATP含量降低,肝损伤加重;肝IPC的保护作用与其升高NO-2/NO-3、降低ET-1,升高NO/ET-1比值有关;在上述肝组织中未测出有iNOS mRNA表达。结论:肝I/R损伤与NO/ET-1失衡有关,IPC对I/R急性期肝的保护作用可能是通过对NO/ET-1系统的调节作用而介导的,此时NO来源于原生性一氧化氮合酶(cNOS)而非iNOS。
, 百拇医药
[中图分类号] R364.1; R333.4 [文献标识码] A
[文章编号] 1000-4718(2000)10-0901-05
The protection of the hepatic ischemic preconditioning is concerned
with the NO/ET-1 system
LU Ping
(Department of General Surgery, Laboratory of General Surgery, Union Hospital, Tongji Medical Institute,)
CHEN Dao-da
, http://www.100md.com
(Department of General Surgery, Laboratory of General Surgery, Union Hospital, Tongji Medical Institute,)
TIAN Yuan
(Huazhong University of Science and Technology, Wuhan 430022, China)
ZHANG Jing-hui
(Huazhong University of Science and Technology, Wuhan 430022, China)
WU Yi-hua
(Huazhong University of Science and Technology, Wuhan 430022, China)
, http://www.100md.com
[Abstract] AIM: To study the relationship between the disturbance of nitric oxide/endothelin-1(NO/ET-1) and hepatic ischemia/reperfusion(I/R) injury as well as the regulation of NO/ET-1 system by hepatic ischemic preconditioning(IPC). METHODS: The changes of NO/ET-1 system and their relationship with hepatic I/R injury were compared between I/R group and IPC+I/R group in a rat hepatic I/R model. Two hours after reperfusion, the liver tissues were detected by RT-PCR to see whether there was inducible nitric oxide synthase (iNOS) mRNA expression. RESULTS:In the acute phase of hepatic reperfusion, the ratio of NO/ET-1 was reduced, which was due to a significant reduction of NO-2/NO-3 (the metabolic product of NO) and significant elevation of ET-1 in the blood plasma. The content of ALT, AST, LDH and TNF-α in blood plasma, and of MDA in liver tissue were increased but ATP in liver tissue was reduced, the hepatic damage was deteriorated. The protection of the hepatic IPC was concerned with the elevation of the ratio of NO/ET-1 caused by the elevation of NO-2/NO-3, and reduction of ET-1 as well. There was no iNOS mRNA detected in the liver tissues.CONCLUSION: Hepatic I/R injury is related to the disturbance of NO/ET-1. The protection of the hepatic IPC in the acute phase might be conducted by its regulation of NO/ET-1 system. The cNOS rather than the iNOS generated the NO in this situation.
, 百拇医药
[MeSH] Liver; Reperfusion injury; Ischemia; Nitric oxide; Endothelins
近年研究发现一氧化氮/内皮素(nitric oxide/endothelins, NO/ETs)这一对最强烈的血管舒缩因子在肝缺血再灌注(ischemia/reperfusion,I/R)中发挥重要作用[1],并有研究认为肝缺血预处理(ischemic preconditioning,IPC)的保护机制与NO有关[2]。但对肝I/R急性期NO与内皮素-1(endothelin-1, ET-1)之间平衡关系的动态改变及其与肝I/R损伤的关系以及IPC对肝的保护作用是否与其对NO/ET-1系统的调节作用有关却研究得不多。本实验在鼠肝I/R模型 (Pringle's maneuver)上对此进行观察和研究。
材 料 和 方 法
, http://www.100md.com
一、动物分组及模型复制
Wistar大鼠共分3大组,即:假手术(sham operation)对照组(S组)(n=6)、肝缺血再灌注组(I/R组)及肝缺血预处理+肝缺血再灌注组(IPC+I/R组),I/R组及IPC+I/R组根据肝再灌注时间不同又分为A、C、D 3组(n=6),分别代表肝缺血40 min再灌注5 min(I40 min/R5 min)、I40 min/R60 min、I40 min/R120 min 3个时点。动物用1%戊巴比妥钠50 mg/kg腹腔注射麻醉,为缓解实验所致血容量不足,开腹前30 min所有动物由股静脉缓慢注入林格氏液(6 mL/kg)。取腹正中切口进腹,S组仅解剖肝十二指肠韧带而不阻断,I/R组解剖肝十二指肠韧带后用无损伤血管夹夹闭肝十二指肠韧带(Pringle's maneuver)以阻断肝动脉、门静脉血流40 min,再灌注时移去血管夹,恢复肝动脉、门静脉血流。IPC+I/R组先予以缺血预处理,即阻断肝十二指肠韧带5 min,放开5 min,反复3回,然后模型复制同I/R组,I/R组及IPC+I/R组均于再灌注不同时间结束实验。所有动物术前禁食12 h,自由饮水。
, 百拇医药
二、样品的采集
各组动物于实验结束时,经肝下下腔静脉穿刺至近肝静脉处抽血用于NO-2/NO-3、ET-1、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、乳酸脱氢酶(lactate dehydrogenase, LDH)水平的测定,分别取肝右叶组织两块,各约100mg用于肝组织三磷酸腺苷(adenosine triphosphate, ATP)及丙二醛(malondialdehyde, MDA)含量测定,取部分肝组织固定于10%福尔马林溶液中。另取S组、I/R-D组 、IPC+I/R-D组大鼠肝组织(>100 mg)迅速置液氮中保存,用于逆转录聚合酶链式反应(reverse-transcriptase polymerase chain reaction, RT-PCR)检测是否有诱生性一氧化氮合酶(inducible nitric oxide synthase, iNOS)mRNA表达。
, 百拇医药
三、样品的检测及观察
(一)血浆NO-2/NO-3含量的测定 采用硝酸还原酶法,试剂盒购自南京建成生物工程研究所。
(二)血浆ET-1含量的测定 采用放射免疫法,试剂盒购自北京东亚免疫技术研究所。
(三)血浆ALT、AST、LDH含量的测定 用HITACHI 7170A自动分析仪测定。
(四)血浆TNF-α含量的测定 采用液相竞争法,试剂盒购自北京东亚免疫技术研究所。
(五)肝组织ATP含量的测定 采用生物发光法,荧光素酶购于中科院上海植物研究所,ATP-Na2为德国BM公司产品,发光仪为LKB [125I]-Luminometer (Finland)。
, 百拇医药
(六)肝组织MDA含量的测定 采用硫代巴比妥酸(TBA)法,试剂盒购自南京建成生物工程研究所。
(七)肝组织学观察 福尔马林固定肝组织标本送本院病理科,石蜡包埋,HE染色,光镜下观察并摄片。
(八)RT-PCR测定S组、I/R-D组及IPC+I/R-D组肝组织内是否有 iNOS mRNA表达。
1.试剂与仪器:iNOS引物由美国Promega公司合成,序列如下:iNOS:上游引物PE: 5′-ATG GCT TGC CCT GGA AGT TTC TC-3′,下游引物PR:5′-CCT CTG ATG GTG CCA TCG GGC ATC TG-3′,PCR产物的大小为856 bp。内对照G3PDH引物由GIBCOBRL公司合成,序列如下:G3PDH:上游引物PE:5′-TCC CTC AAG ATT GTC AGC AA-3′,下游引物PR:5′-AGA TCC ACA ACG GAT ACA TT-3′,PCR产物的大小为309 bp。Taq DNA合成酶(德国BM公司);逆转录酶(德国BM公司);dNTP(美国Promega公司);oligo(dT)(美国Promega公司);PCR扩增仪(美国PE公司,9600型)。
, http://www.100md.com
2.RT-PCR测定上述肝组织中是否有iNOS mRNA表达。肝组织mRNA的提取采用异硫氰酸胍法,取提取的mRNA 1 μL逆转录成cDNA,将逆转录获得的cDNA 5 μL进行DNA扩增,具体条件为:94℃ 2 min后,94℃ 10 s-65℃ 30 s-68℃ 45 s,共35个循环。所获得的PCR扩增产物作1.5%琼脂糖凝胶电泳,肉眼观察并照相。将上述照片在计算机上扫描并判断是否有iNOS mRNA表达。
四、统计处理
实验数据以平均值±标准差( ±s)表示,数据在Legend959P电脑上用Excel 97分析,组间比较采用t检验。
±s)表示,数据在Legend959P电脑上用Excel 97分析,组间比较采用t检验。
结 果
一、血浆及肝组织检测指标变化情况(见表1及表2)
, http://www.100md.com
表1 肝缺血再灌注后血浆ALT、AST、LDH、TNF-α、肝组织ATP及MDA含量变化情况
Tab 1 Changes of content of ALT, AST, LDH and TNF-α in blood plasma, and of content of ATP
and MDA in liver tissue after hepatic I/R( ±s. n=6)
±s. n=6)
S
A(I40 min R5 min)
C(I40 min R60 min)
D(I40 min R 120 min)
, 百拇医药
I/R
IPC+I/R
I/R
IPC+I/R
I/R
IPC+I/R
ALT(U/L)
48.4±5.3
105.0±11.8* *
70.5±9.6▲
277.3±43.4 # #
, 百拇医药
124.1±18.9▲ ▲
510.1±91.1 # #
466.8±85.3
AST(U/L)
265.0±58.3
482.9±77.6*
457.0±85.6
880.5±110.3 #
580.5±75.2▲
1 467.7±299.1 # #
, 百拇医药
913.2±163.6
LDH(U/L)
872.1±166.3
2 098.9±318.1* *
2 146.3±327.8
3 830.7±452.3 #
2 517.9±372.7▲
3 940.9±589.3 #
3 635.2±449.9
ATP(μmol/g)
, 百拇医药
5.07±0.21
0.85±0.10* *
0.81±0.11
2.68±0.37 # #
2.91±0.36
3.46±0.31 # #
4.02±0.58
MDA(μmol/g)
0.25±0.04
0.27±0.04
, http://www.100md.com 0.30±0.04
0.52±0.09 #
0.31±0.04▲
0.64±0.12 #
0.58±0.09
TNF-α(μg/L)
0.47±0.08
0.52±0.07
0.56±0.05
1.32±0.25 #
, http://www.100md.com 1.14±0.17
1.53±0.28 # #
1.36±0.23
*P<0.05,* * P<0.01 vs S group;#P<0.05, ## P<0.01 vs I/R group at A time point;
▲P<0.05,▲▲P<0.01 vs I/R group at the same time point.
I/R组肝I/R后血浆NO-2/NO-3含量显著低于 S组(P<0.05、P<0.01)而ET-1含量显著高于S组(P<0.01 ),NO/ET-1比值显著低于 S组(P<0.01),血浆ALT、AST、LDH含量随再灌注时间延长显著高于S组(P<0.05,P<0.01 ),上述变化在C组及D组最显著,除NO-2/NO-3外,其它指标C组、D组与A组相比也均存在显著性差异(P<0.05或P<0.01),肝组织MDA及血浆TNF-α含量在C组及D组显著高于S组及A组(P<0.05或P<0.01),缺血再灌注后肝组织ATP含量极显著低于S组(P<0.01)。
, http://www.100md.com
表2 肝缺血再灌注后血浆NO-2/NO-3(μmol/L)、ET-1(ng/L)含量及NO/ET-1比值变化情况
Tab 2 Changes of content of NO-2/NO-3, ET-1 and the ratio of NO/ET-1
in blood plasma after hepatic I/R( ±s. n=6)
±s. n=6)
S
A(I40 min R5 min)
, 百拇医药 C(I40 min R60 min)
D(I40 min R120 min)
I/R
IPC+I/R
I/R
IPC+I/R
I/R
IPC+I/R
NO-2/NO-3(μmol/L)
63.8±2.56
50.1±3.13* *
, http://www.100md.com
80.3±9.31▲
46.0±5.34
71.2±9.85▲
38.1±5.16
43.8±6.41
ET-1(ng/L)
43.1±4.57
72.6±7.93* *
62.5±2.39
116.7±13.1 #
, 百拇医药
77.5±2.36▲
135.4±5.24 # #
141.5±5.44
NO/ET-1比值
1.58±0.20
0.74±0.11* *
1.28±0.13▲
0.43±0.08 #
0.91±0.11▲ ▲
0.29±0.05 # #
, http://www.100md.com
0.31±0.04
*P<0.05,**P<0.01 vs S group;# P<0.05,## P<0.01 vs I/R group at A time point;
▲P<0.05,▲▲P<0.01 vs I/R group at the same time point.
在I40 min/R5 min,IPC+I/R组血浆NO-2/NO-3含量及NO/ET-1比值显著高于I/R组(P<0.05),ET-1含量两组间无显著差异(P>0.05),此时点IPC+I/R组仅血浆ALT含量显著低于I/R组(P<0.05),其它指标两组间无显著性差异(P>0.05)。在I40 min/R60 min,IPC+I/R组血浆NO-2/NO-3含量显著高于I/R组(P<0.05),而ET-1含量显著低于I/R组(P<0.05),IPC+I/R组血浆NO/ET-1比值显著高于I/R组(P<0.01),此时IPC+I/R组血浆ALT、AST、LDH含量显著低于I/R组(P<0.05或P<0.01),肝组织MDA含量也显著低于I/R组(P<0.05),肝组织ATP及血浆TNF-α含量两组间无显著差异(P>0.05)。在I40 min/R120 min时,两组间各指标无显著差异(P>0.05)。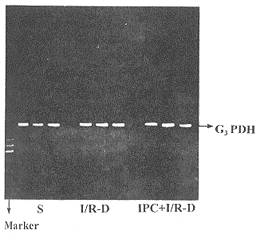
, 百拇医药
Fig 1 There was no iNOS mRNA detected in rat liver
of the S group, I/R-D group and IPC+I/R-D group
图1 在S、I/R-D及IPC+I/R-D组肝脏组织
中未测出有iNOS mRNA表达
二、肝组织学观察
正常对照组:肝小叶、肝细胞、肝窦内皮、枯否细胞及血管形态或结构均正常;I40 min/R5 min时:I/R组肝细胞、内皮细胞出现浊肿,肝窦有淤血表现;I40 min/R60 min时:I/R组肝细胞浊肿明显,肝窦明显淤血;I40 min/R120 min时:I/R组肝细胞严重变性而肝窦淤血严重。
, 百拇医药
在I40 min/R60 min时,IPC+I/R组肝细胞变性、肝窦淤血轻于I/R组,在I40 min/R5 min及I40 min/R120 min两时点,两组间肝组织学变化差别不显著。
三、RT-PCR检测结果
S组、I/R-D组及IPC+I/R-D组肝组织RT-PCR产物行1.5%琼脂糖凝胶电泳后,经肉眼观察及照片计算机扫描均未发现有iNOS mRNA表达(见图1)。
讨 论
我们在S组及I/R-D组肝组织中未测出有iNOS mRNA表达,说明肝I/R急性期NO来源于原生性一氧化氮合酶(constitutive nitric oxide synthase, cNOS),NO分子虽简单而功能却相当复杂,一般认为cNOS来源的NO起保护作用[3],我们还发现肝I/R急性期血浆NO-2/NO-3含量显著降低的同时,ET-1含量却升高,这是由于再灌注早期肝内皮细胞受损或功能障碍导致NO产生或释放减少[4],同时I/R引起肝内皮细胞增加ET-1释放,与NO的作用相拮抗,ET-1是一种强效及长效的血管收缩肽,它可通过ETA、ETB受体收缩窦周贮脂细胞及窦前、窦后血管[5],ET-1还可激活中性粒细胞,增加内皮细胞粘附分子的表达,促进中性粒细胞与内皮细胞的粘附等,另外NO与ET-1在生物合成上也相互协调。本研究还表明肝I/R后NO与ET-1正常平衡关系被破坏,血浆NO/ET-1比值进行性降低并能较好地反映肝I/R损伤的程度。微循环功能障碍必然导致能量代谢障碍,I/R后肝组织ATP含量显著降低,另外血浆TNF-α含量在I40min/R60min后显著升高,TNF-α作为一种早期反应细胞因子在肝I/R急性期表达增加,在随后的再灌注进程中,诱导其它促炎症介质的产生和释放,并最终导致肝脏损伤加重[6]。
, http://www.100md.com
IPC对心脏的保护作用出现在两个时段(或称为“窗口”),人们发现IPC现象是普遍存在的,在对肝的IPC研究中,Yoshizumi等报告10 min IPC可以对鼠肝起到明显的保护作用[7]。从实验结果来看我们也发现IPC在再灌注1h内对肝有保护作用,这种保护作用的机制之一可能是由于IPC提高了NO水平,同时降低了ET-1水平,从而改善了NO/ET-1的平衡关系,提高了肝对I/R的耐受力。
长时间缺血导致NO生成减少,而IPC使NO生成释放增加,那么这种增加的NO是否来源于iNOS呢?文献中未见明确答案,我们在IPC+I/R-D组肝组织中亦未检测出有iNOS mRNA表达,这说明IPC过程中增加的NO仍然来源于cNOS,而非iNOS,在理论上iNOS的表达也不会这么快。另外Peralta等在肝IPC后即刻即测到有NO生成增加,他们认为肝IPC时细胞对ATP的消耗导致腺苷的聚积,而腺苷通过激活腺苷A2受体刺激内皮细胞释放NO来对抗肝I/R损伤[2]。另外,本研究发现I40min/R60min时IPC+I/R组血浆ET-1含量低于I/R组,这可能是由于NO对ETs的直接抑制作用所致[8]。
, 百拇医药
有研究发现肝IPC能明显抑制TNF-α水平升高[9] ,另有研究表明NO能抑制TNF-α诱导的细胞凋亡[10],但我们未发现血浆TNF-α含量在IPC+I/R组和I/R组之间存在显著性差异。在I40 min/R120 min时,IPC+I/R组血浆NO/ET-1比值与I/R组无显著性差异,IPC在“第一窗口”的保护作用已消失,至于IPC对肝I/R的“第二窗口”是否有保护作用,本实验未作研究,Deng-Ping等在肝保存再灌注损伤模型中发现IPC在“第二窗口”的保护作用已显著减弱[9]。
本研究表明肝I/R损伤与NO/ET-1失衡有关,IPC对肝I/R急性期的保护作用可能是通过对NO/ET-1系统的调节作用来介导的,此时NO来源于cNOS而非iNOS。
Tel:027-85726689; E-mail:luliu @ public.wh.hb.cn
, http://www.100md.com
[参 考 文 献]
[1] Benedikt H.J.Pannen, Ferid Al-Adili, Michael Bauer, et al. Role of endothelins and nitric oxide in hepatic reperfusion injury in the rat[J]. Hepatology, 1998, 27(3): 755-764.
[2] Peralta C, Hotter G, Closa D, et al. The protective role of adenosine in inducing nitric oxide synthesis in rat liver ischemia preconditioning is mediated by activation of adenosine A2 receptors[J]. Hepatology, 1999, 29(1): 126-132.
, http://www.100md.com
[3] Cottart CH, Do L, Blanc MC, et al. Hepatoprotective effect of endogenous nitric oxide during ischemia-reperfusion in the rat[J]. Hepatology, 1999, 29(3): 809-813.
[4] Wang P, Ba ZF, Chaudry IH. Endothelial cell dysfunction occurs very early following trauma-hemorrhage and persists despite fluid resuscitation[J]. Am J Physiol, 1993, 265: H973-H979.
[5] Zhang J X, Bauer M, Clemens MG. Vessel-and target cell-specific actions of endothelin-1 and endothelin-3 in rat liver[J]. Am J Physiol, 1995, 269: G269-G277.
, http://www.100md.com
[6] Lisa M Colletti, Steven L Kunkel, Alfred Walz, et al. The role of cytokine networks in the local liver injury following hepatic ischemia/reperfusion in the rat[J]. Hepatology, 1996, 23(3): 506-514.
[7] Yoshizumi T, Yanaga K, Soejima Y, et al. Amelioration of liver injury by ischaemic preconditioning[J]. Br J Surg, 1998, 85(12): 1636-1640.
[8] Gee MH, Albertine KH. Neutrophil-endothelial cell interactions in the lung[J]. Annu Rev Physiol, 1993, 55:227-238.
, 百拇医药
[9] Deng-Ping Yin, Howard N Sankary, Anita S F Chong, et al. Protective effect of ischemic preconditioning on liver preservation-reperfusion injury in rats[J]. Transplantation, 1998, 66(2): 152-157.
[10] Saavedra JE, Billiar TR, Williams D, et al. Targeting nitric oxide (NO) delivery in vivo: design of a liver-selective NO donor prodrug that blocks tumor necrosis factor-α-induced apoptosis and toxicity in the liver[J]. J Med Chem, 1997, 40:1947-1954.
[收稿日期]1999-07-19
[修回日期]1999-12-22
, 百拇医药
单位:吕平 陈道达(华中科技大学同济医学院附属协和医院 普外科);田源 张景辉 吴毅华(普外科实验室,湖北 武汉 430022)
关键词:肝;再灌注损伤;局部缺血;一氧化氮;内皮缩血管肽类
中国病理生理杂志00108
[摘 要] 目的:研究一氧化氮/内皮素-1(NO/ET-1)失衡与肝缺血再灌注(I/R)损伤的关系以及肝缺血预处理(IPC)对NO/ET-1系统的调节作用。方法:采用鼠肝I/R模型,比较I/R组和IPC+I/R组NO/ET-1系统的变化情况及其与肝I/R损伤的关系。用RT-PCR检测再灌注2h内肝组织中是否有诱生性一氧化氮合酶(iNOS)mRNA表达。结果:再灌注急性期血浆NO代谢产物(NO-2/NO-3)降低、ET-1升高致NO/ET-1比值降低,血浆ALT、AST、LDH、TNF-α含量及肝组织丙二醛(MDA)含量增高,而肝组织ATP含量降低,肝损伤加重;肝IPC的保护作用与其升高NO-2/NO-3、降低ET-1,升高NO/ET-1比值有关;在上述肝组织中未测出有iNOS mRNA表达。结论:肝I/R损伤与NO/ET-1失衡有关,IPC对I/R急性期肝的保护作用可能是通过对NO/ET-1系统的调节作用而介导的,此时NO来源于原生性一氧化氮合酶(cNOS)而非iNOS。
, 百拇医药
[中图分类号] R364.1; R333.4 [文献标识码] A
[文章编号] 1000-4718(2000)10-0901-05
The protection of the hepatic ischemic preconditioning is concerned
with the NO/ET-1 system
LU Ping
(Department of General Surgery, Laboratory of General Surgery, Union Hospital, Tongji Medical Institute,)
CHEN Dao-da
, http://www.100md.com
(Department of General Surgery, Laboratory of General Surgery, Union Hospital, Tongji Medical Institute,)
TIAN Yuan
(Huazhong University of Science and Technology, Wuhan 430022, China)
ZHANG Jing-hui
(Huazhong University of Science and Technology, Wuhan 430022, China)
WU Yi-hua
(Huazhong University of Science and Technology, Wuhan 430022, China)
, http://www.100md.com
[Abstract] AIM: To study the relationship between the disturbance of nitric oxide/endothelin-1(NO/ET-1) and hepatic ischemia/reperfusion(I/R) injury as well as the regulation of NO/ET-1 system by hepatic ischemic preconditioning(IPC). METHODS: The changes of NO/ET-1 system and their relationship with hepatic I/R injury were compared between I/R group and IPC+I/R group in a rat hepatic I/R model. Two hours after reperfusion, the liver tissues were detected by RT-PCR to see whether there was inducible nitric oxide synthase (iNOS) mRNA expression. RESULTS:In the acute phase of hepatic reperfusion, the ratio of NO/ET-1 was reduced, which was due to a significant reduction of NO-2/NO-3 (the metabolic product of NO) and significant elevation of ET-1 in the blood plasma. The content of ALT, AST, LDH and TNF-α in blood plasma, and of MDA in liver tissue were increased but ATP in liver tissue was reduced, the hepatic damage was deteriorated. The protection of the hepatic IPC was concerned with the elevation of the ratio of NO/ET-1 caused by the elevation of NO-2/NO-3, and reduction of ET-1 as well. There was no iNOS mRNA detected in the liver tissues.CONCLUSION: Hepatic I/R injury is related to the disturbance of NO/ET-1. The protection of the hepatic IPC in the acute phase might be conducted by its regulation of NO/ET-1 system. The cNOS rather than the iNOS generated the NO in this situation.
, 百拇医药
[MeSH] Liver; Reperfusion injury; Ischemia; Nitric oxide; Endothelins
近年研究发现一氧化氮/内皮素(nitric oxide/endothelins, NO/ETs)这一对最强烈的血管舒缩因子在肝缺血再灌注(ischemia/reperfusion,I/R)中发挥重要作用[1],并有研究认为肝缺血预处理(ischemic preconditioning,IPC)的保护机制与NO有关[2]。但对肝I/R急性期NO与内皮素-1(endothelin-1, ET-1)之间平衡关系的动态改变及其与肝I/R损伤的关系以及IPC对肝的保护作用是否与其对NO/ET-1系统的调节作用有关却研究得不多。本实验在鼠肝I/R模型 (Pringle's maneuver)上对此进行观察和研究。
材 料 和 方 法
, http://www.100md.com
一、动物分组及模型复制
Wistar大鼠共分3大组,即:假手术(sham operation)对照组(S组)(n=6)、肝缺血再灌注组(I/R组)及肝缺血预处理+肝缺血再灌注组(IPC+I/R组),I/R组及IPC+I/R组根据肝再灌注时间不同又分为A、C、D 3组(n=6),分别代表肝缺血40 min再灌注5 min(I40 min/R5 min)、I40 min/R60 min、I40 min/R120 min 3个时点。动物用1%戊巴比妥钠50 mg/kg腹腔注射麻醉,为缓解实验所致血容量不足,开腹前30 min所有动物由股静脉缓慢注入林格氏液(6 mL/kg)。取腹正中切口进腹,S组仅解剖肝十二指肠韧带而不阻断,I/R组解剖肝十二指肠韧带后用无损伤血管夹夹闭肝十二指肠韧带(Pringle's maneuver)以阻断肝动脉、门静脉血流40 min,再灌注时移去血管夹,恢复肝动脉、门静脉血流。IPC+I/R组先予以缺血预处理,即阻断肝十二指肠韧带5 min,放开5 min,反复3回,然后模型复制同I/R组,I/R组及IPC+I/R组均于再灌注不同时间结束实验。所有动物术前禁食12 h,自由饮水。
, 百拇医药
二、样品的采集
各组动物于实验结束时,经肝下下腔静脉穿刺至近肝静脉处抽血用于NO-2/NO-3、ET-1、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、乳酸脱氢酶(lactate dehydrogenase, LDH)水平的测定,分别取肝右叶组织两块,各约100mg用于肝组织三磷酸腺苷(adenosine triphosphate, ATP)及丙二醛(malondialdehyde, MDA)含量测定,取部分肝组织固定于10%福尔马林溶液中。另取S组、I/R-D组 、IPC+I/R-D组大鼠肝组织(>100 mg)迅速置液氮中保存,用于逆转录聚合酶链式反应(reverse-transcriptase polymerase chain reaction, RT-PCR)检测是否有诱生性一氧化氮合酶(inducible nitric oxide synthase, iNOS)mRNA表达。
, 百拇医药
三、样品的检测及观察
(一)血浆NO-2/NO-3含量的测定 采用硝酸还原酶法,试剂盒购自南京建成生物工程研究所。
(二)血浆ET-1含量的测定 采用放射免疫法,试剂盒购自北京东亚免疫技术研究所。
(三)血浆ALT、AST、LDH含量的测定 用HITACHI 7170A自动分析仪测定。
(四)血浆TNF-α含量的测定 采用液相竞争法,试剂盒购自北京东亚免疫技术研究所。
(五)肝组织ATP含量的测定 采用生物发光法,荧光素酶购于中科院上海植物研究所,ATP-Na2为德国BM公司产品,发光仪为LKB [125I]-Luminometer (Finland)。
, 百拇医药
(六)肝组织MDA含量的测定 采用硫代巴比妥酸(TBA)法,试剂盒购自南京建成生物工程研究所。
(七)肝组织学观察 福尔马林固定肝组织标本送本院病理科,石蜡包埋,HE染色,光镜下观察并摄片。
(八)RT-PCR测定S组、I/R-D组及IPC+I/R-D组肝组织内是否有 iNOS mRNA表达。
1.试剂与仪器:iNOS引物由美国Promega公司合成,序列如下:iNOS:上游引物PE: 5′-ATG GCT TGC CCT GGA AGT TTC TC-3′,下游引物PR:5′-CCT CTG ATG GTG CCA TCG GGC ATC TG-3′,PCR产物的大小为856 bp。内对照G3PDH引物由GIBCOBRL公司合成,序列如下:G3PDH:上游引物PE:5′-TCC CTC AAG ATT GTC AGC AA-3′,下游引物PR:5′-AGA TCC ACA ACG GAT ACA TT-3′,PCR产物的大小为309 bp。Taq DNA合成酶(德国BM公司);逆转录酶(德国BM公司);dNTP(美国Promega公司);oligo(dT)(美国Promega公司);PCR扩增仪(美国PE公司,9600型)。
, http://www.100md.com
2.RT-PCR测定上述肝组织中是否有iNOS mRNA表达。肝组织mRNA的提取采用异硫氰酸胍法,取提取的mRNA 1 μL逆转录成cDNA,将逆转录获得的cDNA 5 μL进行DNA扩增,具体条件为:94℃ 2 min后,94℃ 10 s-65℃ 30 s-68℃ 45 s,共35个循环。所获得的PCR扩增产物作1.5%琼脂糖凝胶电泳,肉眼观察并照相。将上述照片在计算机上扫描并判断是否有iNOS mRNA表达。
四、统计处理
实验数据以平均值±标准差(
 ±s)表示,数据在Legend959P电脑上用Excel 97分析,组间比较采用t检验。
±s)表示,数据在Legend959P电脑上用Excel 97分析,组间比较采用t检验。结 果
一、血浆及肝组织检测指标变化情况(见表1及表2)
, http://www.100md.com
表1 肝缺血再灌注后血浆ALT、AST、LDH、TNF-α、肝组织ATP及MDA含量变化情况
Tab 1 Changes of content of ALT, AST, LDH and TNF-α in blood plasma, and of content of ATP
and MDA in liver tissue after hepatic I/R(
 ±s. n=6)
±s. n=6)S
A(I40 min R5 min)
C(I40 min R60 min)
D(I40 min R 120 min)
, 百拇医药
I/R
IPC+I/R
I/R
IPC+I/R
I/R
IPC+I/R
ALT(U/L)
48.4±5.3
105.0±11.8* *
70.5±9.6▲
277.3±43.4 # #
, 百拇医药
124.1±18.9▲ ▲
510.1±91.1 # #
466.8±85.3
AST(U/L)
265.0±58.3
482.9±77.6*
457.0±85.6
880.5±110.3 #
580.5±75.2▲
1 467.7±299.1 # #
, 百拇医药
913.2±163.6
LDH(U/L)
872.1±166.3
2 098.9±318.1* *
2 146.3±327.8
3 830.7±452.3 #
2 517.9±372.7▲
3 940.9±589.3 #
3 635.2±449.9
ATP(μmol/g)
, 百拇医药
5.07±0.21
0.85±0.10* *
0.81±0.11
2.68±0.37 # #
2.91±0.36
3.46±0.31 # #
4.02±0.58
MDA(μmol/g)
0.25±0.04
0.27±0.04
, http://www.100md.com 0.30±0.04
0.52±0.09 #
0.31±0.04▲
0.64±0.12 #
0.58±0.09
TNF-α(μg/L)
0.47±0.08
0.52±0.07
0.56±0.05
1.32±0.25 #
, http://www.100md.com 1.14±0.17
1.53±0.28 # #
1.36±0.23
*P<0.05,* * P<0.01 vs S group;#P<0.05, ## P<0.01 vs I/R group at A time point;
▲P<0.05,▲▲P<0.01 vs I/R group at the same time point.
I/R组肝I/R后血浆NO-2/NO-3含量显著低于 S组(P<0.05、P<0.01)而ET-1含量显著高于S组(P<0.01 ),NO/ET-1比值显著低于 S组(P<0.01),血浆ALT、AST、LDH含量随再灌注时间延长显著高于S组(P<0.05,P<0.01 ),上述变化在C组及D组最显著,除NO-2/NO-3外,其它指标C组、D组与A组相比也均存在显著性差异(P<0.05或P<0.01),肝组织MDA及血浆TNF-α含量在C组及D组显著高于S组及A组(P<0.05或P<0.01),缺血再灌注后肝组织ATP含量极显著低于S组(P<0.01)。
, http://www.100md.com
表2 肝缺血再灌注后血浆NO-2/NO-3(μmol/L)、ET-1(ng/L)含量及NO/ET-1比值变化情况
Tab 2 Changes of content of NO-2/NO-3, ET-1 and the ratio of NO/ET-1
in blood plasma after hepatic I/R(
 ±s. n=6)
±s. n=6)S
A(I40 min R5 min)
, 百拇医药 C(I40 min R60 min)
D(I40 min R120 min)
I/R
IPC+I/R
I/R
IPC+I/R
I/R
IPC+I/R
NO-2/NO-3(μmol/L)
63.8±2.56
50.1±3.13* *
, http://www.100md.com
80.3±9.31▲
46.0±5.34
71.2±9.85▲
38.1±5.16
43.8±6.41
ET-1(ng/L)
43.1±4.57
72.6±7.93* *
62.5±2.39
116.7±13.1 #
, 百拇医药
77.5±2.36▲
135.4±5.24 # #
141.5±5.44
NO/ET-1比值
1.58±0.20
0.74±0.11* *
1.28±0.13▲
0.43±0.08 #
0.91±0.11▲ ▲
0.29±0.05 # #
, http://www.100md.com
0.31±0.04
*P<0.05,**P<0.01 vs S group;# P<0.05,## P<0.01 vs I/R group at A time point;
▲P<0.05,▲▲P<0.01 vs I/R group at the same time point.
在I40 min/R5 min,IPC+I/R组血浆NO-2/NO-3含量及NO/ET-1比值显著高于I/R组(P<0.05),ET-1含量两组间无显著差异(P>0.05),此时点IPC+I/R组仅血浆ALT含量显著低于I/R组(P<0.05),其它指标两组间无显著性差异(P>0.05)。在I40 min/R60 min,IPC+I/R组血浆NO-2/NO-3含量显著高于I/R组(P<0.05),而ET-1含量显著低于I/R组(P<0.05),IPC+I/R组血浆NO/ET-1比值显著高于I/R组(P<0.01),此时IPC+I/R组血浆ALT、AST、LDH含量显著低于I/R组(P<0.05或P<0.01),肝组织MDA含量也显著低于I/R组(P<0.05),肝组织ATP及血浆TNF-α含量两组间无显著差异(P>0.05)。在I40 min/R120 min时,两组间各指标无显著差异(P>0.05)。

, 百拇医药
Fig 1 There was no iNOS mRNA detected in rat liver
of the S group, I/R-D group and IPC+I/R-D group
图1 在S、I/R-D及IPC+I/R-D组肝脏组织
中未测出有iNOS mRNA表达
二、肝组织学观察
正常对照组:肝小叶、肝细胞、肝窦内皮、枯否细胞及血管形态或结构均正常;I40 min/R5 min时:I/R组肝细胞、内皮细胞出现浊肿,肝窦有淤血表现;I40 min/R60 min时:I/R组肝细胞浊肿明显,肝窦明显淤血;I40 min/R120 min时:I/R组肝细胞严重变性而肝窦淤血严重。
, 百拇医药
在I40 min/R60 min时,IPC+I/R组肝细胞变性、肝窦淤血轻于I/R组,在I40 min/R5 min及I40 min/R120 min两时点,两组间肝组织学变化差别不显著。
三、RT-PCR检测结果
S组、I/R-D组及IPC+I/R-D组肝组织RT-PCR产物行1.5%琼脂糖凝胶电泳后,经肉眼观察及照片计算机扫描均未发现有iNOS mRNA表达(见图1)。
讨 论
我们在S组及I/R-D组肝组织中未测出有iNOS mRNA表达,说明肝I/R急性期NO来源于原生性一氧化氮合酶(constitutive nitric oxide synthase, cNOS),NO分子虽简单而功能却相当复杂,一般认为cNOS来源的NO起保护作用[3],我们还发现肝I/R急性期血浆NO-2/NO-3含量显著降低的同时,ET-1含量却升高,这是由于再灌注早期肝内皮细胞受损或功能障碍导致NO产生或释放减少[4],同时I/R引起肝内皮细胞增加ET-1释放,与NO的作用相拮抗,ET-1是一种强效及长效的血管收缩肽,它可通过ETA、ETB受体收缩窦周贮脂细胞及窦前、窦后血管[5],ET-1还可激活中性粒细胞,增加内皮细胞粘附分子的表达,促进中性粒细胞与内皮细胞的粘附等,另外NO与ET-1在生物合成上也相互协调。本研究还表明肝I/R后NO与ET-1正常平衡关系被破坏,血浆NO/ET-1比值进行性降低并能较好地反映肝I/R损伤的程度。微循环功能障碍必然导致能量代谢障碍,I/R后肝组织ATP含量显著降低,另外血浆TNF-α含量在I40min/R60min后显著升高,TNF-α作为一种早期反应细胞因子在肝I/R急性期表达增加,在随后的再灌注进程中,诱导其它促炎症介质的产生和释放,并最终导致肝脏损伤加重[6]。
, http://www.100md.com
IPC对心脏的保护作用出现在两个时段(或称为“窗口”),人们发现IPC现象是普遍存在的,在对肝的IPC研究中,Yoshizumi等报告10 min IPC可以对鼠肝起到明显的保护作用[7]。从实验结果来看我们也发现IPC在再灌注1h内对肝有保护作用,这种保护作用的机制之一可能是由于IPC提高了NO水平,同时降低了ET-1水平,从而改善了NO/ET-1的平衡关系,提高了肝对I/R的耐受力。
长时间缺血导致NO生成减少,而IPC使NO生成释放增加,那么这种增加的NO是否来源于iNOS呢?文献中未见明确答案,我们在IPC+I/R-D组肝组织中亦未检测出有iNOS mRNA表达,这说明IPC过程中增加的NO仍然来源于cNOS,而非iNOS,在理论上iNOS的表达也不会这么快。另外Peralta等在肝IPC后即刻即测到有NO生成增加,他们认为肝IPC时细胞对ATP的消耗导致腺苷的聚积,而腺苷通过激活腺苷A2受体刺激内皮细胞释放NO来对抗肝I/R损伤[2]。另外,本研究发现I40min/R60min时IPC+I/R组血浆ET-1含量低于I/R组,这可能是由于NO对ETs的直接抑制作用所致[8]。
, 百拇医药
有研究发现肝IPC能明显抑制TNF-α水平升高[9] ,另有研究表明NO能抑制TNF-α诱导的细胞凋亡[10],但我们未发现血浆TNF-α含量在IPC+I/R组和I/R组之间存在显著性差异。在I40 min/R120 min时,IPC+I/R组血浆NO/ET-1比值与I/R组无显著性差异,IPC在“第一窗口”的保护作用已消失,至于IPC对肝I/R的“第二窗口”是否有保护作用,本实验未作研究,Deng-Ping等在肝保存再灌注损伤模型中发现IPC在“第二窗口”的保护作用已显著减弱[9]。
本研究表明肝I/R损伤与NO/ET-1失衡有关,IPC对肝I/R急性期的保护作用可能是通过对NO/ET-1系统的调节作用来介导的,此时NO来源于cNOS而非iNOS。
Tel:027-85726689; E-mail:luliu @ public.wh.hb.cn
, http://www.100md.com
[参 考 文 献]
[1] Benedikt H.J.Pannen, Ferid Al-Adili, Michael Bauer, et al. Role of endothelins and nitric oxide in hepatic reperfusion injury in the rat[J]. Hepatology, 1998, 27(3): 755-764.
[2] Peralta C, Hotter G, Closa D, et al. The protective role of adenosine in inducing nitric oxide synthesis in rat liver ischemia preconditioning is mediated by activation of adenosine A2 receptors[J]. Hepatology, 1999, 29(1): 126-132.
, http://www.100md.com
[3] Cottart CH, Do L, Blanc MC, et al. Hepatoprotective effect of endogenous nitric oxide during ischemia-reperfusion in the rat[J]. Hepatology, 1999, 29(3): 809-813.
[4] Wang P, Ba ZF, Chaudry IH. Endothelial cell dysfunction occurs very early following trauma-hemorrhage and persists despite fluid resuscitation[J]. Am J Physiol, 1993, 265: H973-H979.
[5] Zhang J X, Bauer M, Clemens MG. Vessel-and target cell-specific actions of endothelin-1 and endothelin-3 in rat liver[J]. Am J Physiol, 1995, 269: G269-G277.
, http://www.100md.com
[6] Lisa M Colletti, Steven L Kunkel, Alfred Walz, et al. The role of cytokine networks in the local liver injury following hepatic ischemia/reperfusion in the rat[J]. Hepatology, 1996, 23(3): 506-514.
[7] Yoshizumi T, Yanaga K, Soejima Y, et al. Amelioration of liver injury by ischaemic preconditioning[J]. Br J Surg, 1998, 85(12): 1636-1640.
[8] Gee MH, Albertine KH. Neutrophil-endothelial cell interactions in the lung[J]. Annu Rev Physiol, 1993, 55:227-238.
, 百拇医药
[9] Deng-Ping Yin, Howard N Sankary, Anita S F Chong, et al. Protective effect of ischemic preconditioning on liver preservation-reperfusion injury in rats[J]. Transplantation, 1998, 66(2): 152-157.
[10] Saavedra JE, Billiar TR, Williams D, et al. Targeting nitric oxide (NO) delivery in vivo: design of a liver-selective NO donor prodrug that blocks tumor necrosis factor-α-induced apoptosis and toxicity in the liver[J]. J Med Chem, 1997, 40:1947-1954.
[收稿日期]1999-07-19
[修回日期]1999-12-22
, 百拇医药