端粒酶在人发育骨与软骨中的原位表达
作者: 裴 明 曲绵域 于长隆 张 波
单位:裴 明 曲绵城 于长隆 (北京医科大学第三医院运动医学研究所 北京 100083);张 波 北京医科大学病理系肿瘤分子生物学教研室
关键词:骨发育;端粒酶;原位杂交
中国运动医学杂志990104 提要 为观察端粒酶在人发育骨与软骨组织中的表达及分布,认识端粒酶在关节软骨发育中的作用,用组织学及原位杂交技术,对临床经过石蜡包埋的人发育关节软骨组织进行定位定性检测,结果显示,3月龄胚胎软骨端粒酶高表达,随着进一步发育,端粒酶的活性明显降低,结果表明端粒酶可能在关节软骨的发育中起重要作用。
In Situ Hybridization Study on Expression of Telomerase
during Endochondral Bone Development
, 百拇医药
Pei Ming,Qu Mianyu,Yu Changlong,et al
Institute of Sports Medicine,Beijing Medical University,Beijing 100083 China
To investigate the expression and localization of telomerase in developing human long bones,and understand the function of telomerase in the development of joint cartilage,developing human long bones were used to detect telomerase expression by histology and in situ hybridization.The result showed that high level of telomerase expression appeared in cartilage of 3 month_old human embryo,and telomerase activity obviously lowered with the developing of bone.The author concluded that telomerase may play an important role in the development of joint cartilage.
, 百拇医药
Key words:Bone development,Telomerase,In situ hybridization
软骨内化骨是一种重要的骨形成方式。以往的研究发现端粒酶在许多组织的发育中有表达,尚未见国内外有关端粒酶在人胚胎及胎儿软骨中表达的研究报道。本研究旨在观察端粒酶在不同发育时期的胚胎及胎儿骨与软骨中的表达,进一步认识端粒酶在骨与软骨生长发育中的作用。
1 材料和方法
1.1 主要试剂
琼脂糖、鲑精DNA、硫酸葡聚糖、甲酰胺、TaqDNA聚合酶等购自GIBCO公司,L-多聚赖氨酸、RNase酶等购自Sigma公司,蛋白酶K、Sal Ⅰ等限制性核酸内切酶购自华美公司。
1.2 探针制备及标记
, http://www.100md.com
pGRN83/h TRmRNA质粒为北京医科大学病理学系肿瘤分子生物学教研室张波博士惠赠,其质粒中的插入片段为580bp的端粒酶mRNA片段,插入位点为Mlul(2847)及Sall(3426),分别对应于SP6(正义)和T7(反义)转录启动子。具体制备步骤如下:(1)感受态细胞的制备和转化;(2)质粒DNA的碱裂解法提取和鉴定;(3)Sal Ⅰ限制性内切酶进行酶切,然后纯化;(4)体外转录法进行转录,生物素标记。
1.3 标本的收集和处理
3~6月龄胚胎及胎儿关节软骨标本取自北京医科大学附属第三医院妇产科因保胎不成功而引产的孕妇。3月龄左右胚胎取其下肢,置4%多聚甲醛(新配制)中4℃固定,而4~6月龄胎儿,取胫骨上段,将标本修成0.2cm左右厚度,置上述固定液中,4℃固定20~24小时,然后置入经DEPC处理的15%EDTA中脱钙2周[1],常规脱水,二甲苯透明,石蜡包埋,以上操作注意防止RNase污染,将5μm切片进行如下处理:(1)HE染色,常规组织学检查;(2)1%甲苯胺蓝染色,检查基质中硫酸软骨素的含量变化;(3)端粒酶mRNA探针的原位杂交。
, http://www.100md.com
1.4 原位杂交
(1)石蜡切片60℃烘烤3小时;(2)二甲苯脱蜡过夜;(3)乙醇梯度入水;(4)0.3%过氧化氢室温1小时,1×PBS洗2次×2分钟;(5)0.1mol/L盐酸10分钟,PBS洗2次;(6)100μg/ml蛋白酶K 37℃×20分钟,PBS冲洗;(7)4%多聚甲醛固定10分钟,PBS洗3次×5分钟;(8)90%乙醇-20℃×2分钟;(9)滴杂交液[变性鲑精DNA+mRNA探针+去离子甲酰胺+DTT+Denhardt液+硫酸葡聚糖+SSC],封口膜封片,37℃湿盒过夜;(10)揭去封口膜,置于[50%甲酰胺+2×SSC]溶液中,湿盒37℃×30分钟;(11)2×SSC 37℃温育15分钟×2,PBS冲洗;(12)1∶100血清封闭30分钟;(13)1∶100ABC室温孵育,PBS冲洗;(14)DAB显色;(15)水洗终止,苏木精复染;(16)脱水,透明,封片。原位杂交阳性对照为已知的阳性切片,阴性对照为实验时不加变性探针。
2 结果
, http://www.100md.com
2.1 组织学观察
组织切片经HE及甲苯胺蓝染色后,光镜下观察,3月龄胚胎长干骨软骨中段,软骨细胞呈肥大样改变,软骨内无血管,可观察到软骨外营养血管;4~6月龄胎儿,长干骨的干骺端关节软骨内可观察到血管,次级骨化中心尚未形成。原发骨化中心可观察到生长板软骨结构及矿化组织。
2.2 原位杂交结果观察
3月龄胚胎,hTRmRNA定位于胚胎软骨肥大样改变的软骨细胞,以及周围软骨膜的软骨母细胞和间充质细胞(封三彩图1),空泡样陷窝中则无染色(封三彩图2),在干骺端主要位于外骨膜的骨祖细胞及内骨膜的成骨细胞,骨髓腔内骨小梁表面的成骨细胞染色阳性,而分化成熟的骨细胞染色阴性(封三彩图3),在4~6月龄胎儿,hTRmRNA定位于长骨干骺段生长板软骨细胞中(封三彩图4)。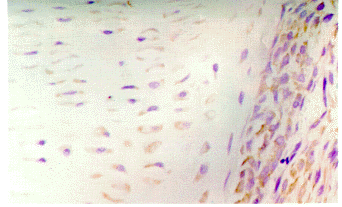
, 百拇医药
图1 3月胚胎,端粒酶mRNA在胚胎软骨“模型”肥大样软骨细胞,以及周围软骨膜的软骨母细胞中表达(DAB染色,×200)
Fig.1Telemerase mRNA expression in the hypertrophic chondrocytes in cartilage"model"
of 3-month-old human embryo and chondroblast around perichondrium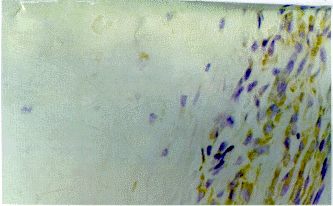
图2 3月胚胎软骨,端粒酶mRNA在空泡样陷窝中未见表达(DAB染色,×200)
Fig.2 No telemerase mRNA expression in the vacuolar lacunes of cartilage "model"
, 百拇医药
of 3-month-old human embryo
图3 3月胚胎,端粒酶mRNA在关节软骨内新生髓腔周围软骨细胞中的表达(DAB染色,×200)
Fig.3 Telemerase mRNA expression in the osteoblasts around neonatal marrow
cavity in cartilage"model"of 3-month-old human embryo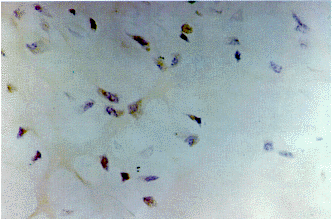
图4 6月胎儿,端粒酶mRNA在生长板肥大样软骨细胞中的表达(DAB染色,×200)
, http://www.100md.com
Fig.4 Telemerase mRNA expression in growth plate chondrocytes in
long bone of 6-month-old human fetus
3 讨论
长骨的发育是以软骨内化骨方式进行,伴随胚胎发育,在骨发生部位由软骨细胞形成软骨“模型”,同时软骨膜转化为外骨膜,外骨膜内层细胞分化为成骨细胞,并绕着软骨“模型”形成围领,软骨“模型”中特定部位的软骨细胞进一步分化,合成细胞外基质成分,形态发生肥大样改变,接着软骨基质发生矿化,血管侵入,带入破骨细胞及间质祖细胞,破骨细胞吸收矿化的软骨基质,而间质祖细胞可分化为成骨细胞,并由成骨细胞分泌骨基质形成编织骨,经过重建形成板状骨,标志原发骨化中心形成,同时,软骨内化骨的形成不断向长骨的两极扩展,生长板软骨形成,经不断增殖分化,使骨生长[2]。
, 百拇医药
本实验采用组织学及原位杂交技术,首次研究了端粒酶在人胚胎及胎儿发育的骨与软骨中的表达,结果显示3月龄胚胎,端粒酶mRNA定位于胚胎软骨肥大样改变的软骨细胞、周围软骨膜的软骨母细胞及间充质细胞,而空泡样陷窝中则无染色,在干骺端主要位于外骨膜的骨祖细胞及内骨膜的成骨细胞,骨髓腔内骨小梁表面的成骨细胞染色阳性,而分化成熟的骨细胞染色阴性;在4~6月龄胎儿,端粒酶mRNA定位于长骨干骺段生长板软骨细胞中。
染色体DNA复制是细胞分裂增殖的分子基础,保持遗传信息的完整才能维持细胞的生存。染色体末端的端粒结构在DNA复制时不断丢失,使细胞具有一定的分裂寿命,因此端粒的长度可作为细胞的分裂时钟,反应细胞的分裂能力[3]。而端粒酶活性的高表达,可以使细胞发展为永生化细胞或肿瘤细胞。1993年,Larsen等[4]研究发现,胚胎16周时组织发生完成,胎儿组织中存在端粒酶活性,许多组织特异性的干细胞表达端粒酶。1995年,Sommerfeld等[5]在研究中观察到,成年个体中存在高活性端粒酶的干细胞可能性极小。同年,Feng等[6]用端粒酶部分纯化和差异杂交的方法,分离并克隆了Hela细胞的端粒酶RNA,命名为hTR,其中5'_CUAACCUAAC_3'作为模板,合成互补的端粒结构5'_TTAGGG_3'。在干细胞和肿瘤细胞中,hTR比正常细胞高表达,模板区的突变导致端粒结构的异常,用反义hTR转化的细胞可发生凋亡或分化。
, 百拇医药
因此,依靠激活端粒酶或其它一些途径,减缓或根除端粒的缩短,用来治疗退行性老年病也许更有效。端粒酶在发育的晚期阶段受抑制,许多肿瘤细胞通过激活端粒酶而具有不死性,理解其分子机制,将有助于在老年病学和肿瘤学的治疗中提供新的方法。
4 参考文献
[1]Ausuber FM,Kinston RE,Moore DD.Short protocols in Molecular biology.Publish by Greene Publishing Associates and John Wiley & Sons.Second Edition. USA.
[2]杨克勤.脊柱疾患的临床与研究.北京出版社.1993年,第1版,683-684.
[3]Allsopp RC,Vaziri H,Patterson C,et al.Telomere length predicts replicative capacity of human fibroblasts.Proc.Natl.Acad.Sci.USA 1992,89:10114_10118.
, 百拇医药
[4]Larsen WJ.Human Embroyology.New York:Churchill Livingstone,1993.
[5]Sommerfeld HJ,Meeker AK,Posadas EM,et al.Frontiers in prostate cancer:Telomeres and chaos.Cancer(Suppl) 1995,75:2027_2035.
[6]Feng J,Funk WD,Wang SS,et al.The RNA component of human telomerase. Science 1995,269(5228):1236_1241.
(第一作者:裴明,男,30岁,博士研究生,主治医师)
(1998.05.29收稿), http://www.100md.com
单位:裴 明 曲绵城 于长隆 (北京医科大学第三医院运动医学研究所 北京 100083);张 波 北京医科大学病理系肿瘤分子生物学教研室
关键词:骨发育;端粒酶;原位杂交
中国运动医学杂志990104 提要 为观察端粒酶在人发育骨与软骨组织中的表达及分布,认识端粒酶在关节软骨发育中的作用,用组织学及原位杂交技术,对临床经过石蜡包埋的人发育关节软骨组织进行定位定性检测,结果显示,3月龄胚胎软骨端粒酶高表达,随着进一步发育,端粒酶的活性明显降低,结果表明端粒酶可能在关节软骨的发育中起重要作用。
In Situ Hybridization Study on Expression of Telomerase
during Endochondral Bone Development
, 百拇医药
Pei Ming,Qu Mianyu,Yu Changlong,et al
Institute of Sports Medicine,Beijing Medical University,Beijing 100083 China
To investigate the expression and localization of telomerase in developing human long bones,and understand the function of telomerase in the development of joint cartilage,developing human long bones were used to detect telomerase expression by histology and in situ hybridization.The result showed that high level of telomerase expression appeared in cartilage of 3 month_old human embryo,and telomerase activity obviously lowered with the developing of bone.The author concluded that telomerase may play an important role in the development of joint cartilage.
, 百拇医药
Key words:Bone development,Telomerase,In situ hybridization
软骨内化骨是一种重要的骨形成方式。以往的研究发现端粒酶在许多组织的发育中有表达,尚未见国内外有关端粒酶在人胚胎及胎儿软骨中表达的研究报道。本研究旨在观察端粒酶在不同发育时期的胚胎及胎儿骨与软骨中的表达,进一步认识端粒酶在骨与软骨生长发育中的作用。
1 材料和方法
1.1 主要试剂
琼脂糖、鲑精DNA、硫酸葡聚糖、甲酰胺、TaqDNA聚合酶等购自GIBCO公司,L-多聚赖氨酸、RNase酶等购自Sigma公司,蛋白酶K、Sal Ⅰ等限制性核酸内切酶购自华美公司。
1.2 探针制备及标记
, http://www.100md.com
pGRN83/h TRmRNA质粒为北京医科大学病理学系肿瘤分子生物学教研室张波博士惠赠,其质粒中的插入片段为580bp的端粒酶mRNA片段,插入位点为Mlul(2847)及Sall(3426),分别对应于SP6(正义)和T7(反义)转录启动子。具体制备步骤如下:(1)感受态细胞的制备和转化;(2)质粒DNA的碱裂解法提取和鉴定;(3)Sal Ⅰ限制性内切酶进行酶切,然后纯化;(4)体外转录法进行转录,生物素标记。
1.3 标本的收集和处理
3~6月龄胚胎及胎儿关节软骨标本取自北京医科大学附属第三医院妇产科因保胎不成功而引产的孕妇。3月龄左右胚胎取其下肢,置4%多聚甲醛(新配制)中4℃固定,而4~6月龄胎儿,取胫骨上段,将标本修成0.2cm左右厚度,置上述固定液中,4℃固定20~24小时,然后置入经DEPC处理的15%EDTA中脱钙2周[1],常规脱水,二甲苯透明,石蜡包埋,以上操作注意防止RNase污染,将5μm切片进行如下处理:(1)HE染色,常规组织学检查;(2)1%甲苯胺蓝染色,检查基质中硫酸软骨素的含量变化;(3)端粒酶mRNA探针的原位杂交。
, http://www.100md.com
1.4 原位杂交
(1)石蜡切片60℃烘烤3小时;(2)二甲苯脱蜡过夜;(3)乙醇梯度入水;(4)0.3%过氧化氢室温1小时,1×PBS洗2次×2分钟;(5)0.1mol/L盐酸10分钟,PBS洗2次;(6)100μg/ml蛋白酶K 37℃×20分钟,PBS冲洗;(7)4%多聚甲醛固定10分钟,PBS洗3次×5分钟;(8)90%乙醇-20℃×2分钟;(9)滴杂交液[变性鲑精DNA+mRNA探针+去离子甲酰胺+DTT+Denhardt液+硫酸葡聚糖+SSC],封口膜封片,37℃湿盒过夜;(10)揭去封口膜,置于[50%甲酰胺+2×SSC]溶液中,湿盒37℃×30分钟;(11)2×SSC 37℃温育15分钟×2,PBS冲洗;(12)1∶100血清封闭30分钟;(13)1∶100ABC室温孵育,PBS冲洗;(14)DAB显色;(15)水洗终止,苏木精复染;(16)脱水,透明,封片。原位杂交阳性对照为已知的阳性切片,阴性对照为实验时不加变性探针。
2 结果
, http://www.100md.com
2.1 组织学观察
组织切片经HE及甲苯胺蓝染色后,光镜下观察,3月龄胚胎长干骨软骨中段,软骨细胞呈肥大样改变,软骨内无血管,可观察到软骨外营养血管;4~6月龄胎儿,长干骨的干骺端关节软骨内可观察到血管,次级骨化中心尚未形成。原发骨化中心可观察到生长板软骨结构及矿化组织。
2.2 原位杂交结果观察
3月龄胚胎,hTRmRNA定位于胚胎软骨肥大样改变的软骨细胞,以及周围软骨膜的软骨母细胞和间充质细胞(封三彩图1),空泡样陷窝中则无染色(封三彩图2),在干骺端主要位于外骨膜的骨祖细胞及内骨膜的成骨细胞,骨髓腔内骨小梁表面的成骨细胞染色阳性,而分化成熟的骨细胞染色阴性(封三彩图3),在4~6月龄胎儿,hTRmRNA定位于长骨干骺段生长板软骨细胞中(封三彩图4)。

, 百拇医药
图1 3月胚胎,端粒酶mRNA在胚胎软骨“模型”肥大样软骨细胞,以及周围软骨膜的软骨母细胞中表达(DAB染色,×200)
Fig.1Telemerase mRNA expression in the hypertrophic chondrocytes in cartilage"model"
of 3-month-old human embryo and chondroblast around perichondrium

图2 3月胚胎软骨,端粒酶mRNA在空泡样陷窝中未见表达(DAB染色,×200)
Fig.2 No telemerase mRNA expression in the vacuolar lacunes of cartilage "model"
, 百拇医药
of 3-month-old human embryo

图3 3月胚胎,端粒酶mRNA在关节软骨内新生髓腔周围软骨细胞中的表达(DAB染色,×200)
Fig.3 Telemerase mRNA expression in the osteoblasts around neonatal marrow
cavity in cartilage"model"of 3-month-old human embryo

图4 6月胎儿,端粒酶mRNA在生长板肥大样软骨细胞中的表达(DAB染色,×200)
, http://www.100md.com
Fig.4 Telemerase mRNA expression in growth plate chondrocytes in
long bone of 6-month-old human fetus
3 讨论
长骨的发育是以软骨内化骨方式进行,伴随胚胎发育,在骨发生部位由软骨细胞形成软骨“模型”,同时软骨膜转化为外骨膜,外骨膜内层细胞分化为成骨细胞,并绕着软骨“模型”形成围领,软骨“模型”中特定部位的软骨细胞进一步分化,合成细胞外基质成分,形态发生肥大样改变,接着软骨基质发生矿化,血管侵入,带入破骨细胞及间质祖细胞,破骨细胞吸收矿化的软骨基质,而间质祖细胞可分化为成骨细胞,并由成骨细胞分泌骨基质形成编织骨,经过重建形成板状骨,标志原发骨化中心形成,同时,软骨内化骨的形成不断向长骨的两极扩展,生长板软骨形成,经不断增殖分化,使骨生长[2]。
, 百拇医药
本实验采用组织学及原位杂交技术,首次研究了端粒酶在人胚胎及胎儿发育的骨与软骨中的表达,结果显示3月龄胚胎,端粒酶mRNA定位于胚胎软骨肥大样改变的软骨细胞、周围软骨膜的软骨母细胞及间充质细胞,而空泡样陷窝中则无染色,在干骺端主要位于外骨膜的骨祖细胞及内骨膜的成骨细胞,骨髓腔内骨小梁表面的成骨细胞染色阳性,而分化成熟的骨细胞染色阴性;在4~6月龄胎儿,端粒酶mRNA定位于长骨干骺段生长板软骨细胞中。
染色体DNA复制是细胞分裂增殖的分子基础,保持遗传信息的完整才能维持细胞的生存。染色体末端的端粒结构在DNA复制时不断丢失,使细胞具有一定的分裂寿命,因此端粒的长度可作为细胞的分裂时钟,反应细胞的分裂能力[3]。而端粒酶活性的高表达,可以使细胞发展为永生化细胞或肿瘤细胞。1993年,Larsen等[4]研究发现,胚胎16周时组织发生完成,胎儿组织中存在端粒酶活性,许多组织特异性的干细胞表达端粒酶。1995年,Sommerfeld等[5]在研究中观察到,成年个体中存在高活性端粒酶的干细胞可能性极小。同年,Feng等[6]用端粒酶部分纯化和差异杂交的方法,分离并克隆了Hela细胞的端粒酶RNA,命名为hTR,其中5'_CUAACCUAAC_3'作为模板,合成互补的端粒结构5'_TTAGGG_3'。在干细胞和肿瘤细胞中,hTR比正常细胞高表达,模板区的突变导致端粒结构的异常,用反义hTR转化的细胞可发生凋亡或分化。
, 百拇医药
因此,依靠激活端粒酶或其它一些途径,减缓或根除端粒的缩短,用来治疗退行性老年病也许更有效。端粒酶在发育的晚期阶段受抑制,许多肿瘤细胞通过激活端粒酶而具有不死性,理解其分子机制,将有助于在老年病学和肿瘤学的治疗中提供新的方法。
4 参考文献
[1]Ausuber FM,Kinston RE,Moore DD.Short protocols in Molecular biology.Publish by Greene Publishing Associates and John Wiley & Sons.Second Edition. USA.
[2]杨克勤.脊柱疾患的临床与研究.北京出版社.1993年,第1版,683-684.
[3]Allsopp RC,Vaziri H,Patterson C,et al.Telomere length predicts replicative capacity of human fibroblasts.Proc.Natl.Acad.Sci.USA 1992,89:10114_10118.
, 百拇医药
[4]Larsen WJ.Human Embroyology.New York:Churchill Livingstone,1993.
[5]Sommerfeld HJ,Meeker AK,Posadas EM,et al.Frontiers in prostate cancer:Telomeres and chaos.Cancer(Suppl) 1995,75:2027_2035.
[6]Feng J,Funk WD,Wang SS,et al.The RNA component of human telomerase. Science 1995,269(5228):1236_1241.
(第一作者:裴明,男,30岁,博士研究生,主治医师)
(1998.05.29收稿), http://www.100md.com