贮存时间对天然提取骨形态发生蛋白活性及抗原性的影响
作者:桑宏勋 李丹 胡蕴玉 吕荣 孙梁 白建萍 马生兵
单位:710032 西安,第四军医大学西京医院全军骨科研究所
关键词:骨形态发生蛋白质类;免疫活性;骨生成
中华骨科杂志000907
【摘要】目的观察贮存时间对天然牛骨形态发生蛋白(bBMP)诱导成骨活性及抗原性的影响。方法取1989~1998年提取并于4℃贮存的6个批次的bBMP,以SDS-PAGE凝胶电泳法测定其相对分子质量。108只Balb/c雄性小鼠被分为6组,每组18只,按Urist方法于每只鼠股部肌间隙肌袋内植入2mgbBMP,术后第7、第14及第28d取材,以间接免疫荧光染色法分别测定抗体滴度及阳性染色率;以酶动力学方法测定碱性磷酸酶(ALP)活性,并观察bBMP诱导成骨活性。结果(1)SDS-PAGE凝胶电泳显示,8条电泳带均为多肽片段,6个批次bBMP的相对分子质量集中在14×103、18×103、25×103、30×103和40×103,各批次区带分布基本一致。(2)间接免疫荧光染色测定显示,bBMP可刺激小鼠产生弱的荧光抗体,抗体滴度1∶2~1∶4,随着贮存时间的增加荧光抗体的阳性染色率有所下降,但差异无显著性意义(P>0.05)。(3)植入bBMP后第7、第14及第28d各批次ALP活性明显高于对照组(均P<0.01),但各批次间差异无显著性意义(P>0.05)。(4)组织学观察,在bBMP植入第7d即可见大量间充质细胞分化,并向软骨细胞转化;第14d,有大量骨软骨形成;第28d,见成熟板层骨,并有骨髓形成。结论于4℃贮存10年的bBMP仍具有良好的诱导成骨活性,植入鼠体内后产生的低滴度循环抗体,并不影响bBMP的诱导成骨活性。
, http://www.100md.com
Bone inducing activity and antigenicity of native bone morphogenetic protein after various storage times
SANG Hongxun, LI Dan, HU Yunyu, et al.
(Institute of Orthopaedics, Xijing Hospital, the Fourth Military Medical University, Xi'an 710032, China )
【Abstract】Objective To observe the effects of storage times (1- 10 years) on the bone induction activity and antigenicity of bovine bone mophogenetic protein (bBMP). Methods Six batches of bBMP stored at 4 ℃ from 1989 to 1998 year were obtained to exam the relative molecular weight by SDS- PAGE. 108 Balb/c mice were divided into 6 groups, then 2 mg bBMP of each batch was implanted separately into the thigh muscle pouches of Balb/c mice according to the methods of Urist-s. Indirect immunofluorescence test was used to determine the host serum antibodies. Bone inducing activity was measured by histological evaluation and alkaline phosphatase (ALP) assay. Results 1)bBMP contained polypeptide fragments with MW at 14× 10 3 ,18× 10 3,25× 10 3,30× 10 3 and 40× 10 3 as shown in SDS-PAGE, and the electrophoresis results of the six batches of bBMP had the same pattern as that reported. 2)Indirect immunofluorescence assay showed that bBMP implantation led to weak positive staining in some of the recipient mice, with the dilution of the blood sera of the mice at 1/2 to 1/4, and it seems that the positive staining rates decreased after the long term storage of bBMP, but there was no statistical significant difference(P >0.05). 3)ALP assay showed that the 7th,14th and 28th day of bBMP implantation, the ALP activities of bBMP in implantation groups were relatively higher than that of the control group (P<0.01), while there were no significant differences among the six batches of bBMP groups (P>0.05). 4)Histologically,after the 7th day implantation, a large quantity of mesenchymal cells differentiated with active chondrogenesis. The 14th day later, a large amount of cartilage and woven bone formed, and laminar bone and bone marrow were seen on day 28 after implantation. Conclusion The bBMP possesses active bone induction properties even after 10 years storage in 4℃ . The low- level antibodies of the recipient mice can be detected after implanted with bBMP, but the bone inducing activities are not affected. This may be a reference data for purification and clinical application of native BMP.
, 百拇医药
【Key words】Bone morphogenetic proteins; Immunocompetence; Osteogenesis
自1982年Urist等[1]首次成功地提取出牛骨形态发生蛋白(bovine bone morphogenetic protein,bBMP)以来,bBMP已成功地用于治疗骨不连和骨缺损的修复,疗效满意[2]。BMP的作用主要是诱导两类成骨前体细胞向成骨系细胞转化:一类即骨髓基质细胞、骨膜成骨细胞等定向骨祖细胞(determined osteoprogenitor cell,DOPC);另一类为成纤维细胞、间充质细胞等可诱导骨祖细胞(inducible osteoprogenitor cell,IOPC),其成骨过程主要为软骨内化骨。成骨过程一经启动,BMP则可通过反馈机制促进多种细胞自分泌和旁分泌BMP,形成放大的“瀑布”效应,在多种生长因子的协同作用下,促进和完成骨折的修复过程[3-5]。BMP一般无种属特异性,具有跨种属诱导成骨能力,因而BMP的临床应用前景广阔。但有关贮存时间对BMP诱导活性和免疫原性影响的研究尚少有报道,笔者对我所10年内所提取的不同批次的bBMP,进行相对分子质量、生物活性和免疫原性分析,旨在为其今后的大量生产制备、贮存和应用提供参考。
, http://www.100md.com
材料与方法
一、bBMP的提取与贮存
按照Urist方法[1]并加以改进提取bBMP[2]。将5kg小牛皮质骨粉用1∶1等体积比的氯仿/甲醇(分析纯)混合液室温脱脂4h,0.6mol/LHCl4°C脱钙60h。具体步骤如下:分别以2mol/LCaCl2、0.5mol/LEDTA及8mol/LLiCl溶液于4℃系列脱蛋白24、4和24h,再以含6mol/L尿素及0.5mol/LCaCl2的混合蛋白抽提液室温抽提48h,抽提液内含10mmol/L的蛋白酶抑制剂N-乙基顺丁烯二酰亚胺(N-ethylmaleimide,NEMI),取上清液,经18000r/min离心25min,所得沉淀物即为bBMP粗提物。对bBMP粗提物进行纯化,先用含4mol/L盐酸胍(GuHCl)及0.05mol/LCaCl2的混合液溶解沉淀物,经3500r/min离心30min,去除沉淀,上清液再以18000r/min离心1h,沉淀物经1∶1等体积比的氯仿/甲醇混合液表面洗涤10min后倾去上清液,即获得bBMP。于干燥塔内自然干燥10d后,玻璃瓶内密封,于4℃贮存。
, 百拇医药
二、bBMPSDS-PAGE电泳
取1989、1990、1992、1994、1996及1998年共6个批次的bBMP各5mg,溶解于1ml6mol/L的尿素溶液中,溶解液与样品缓冲液按1∶1混合,进行SDS-PAGE垂直板电泳(美国Biored公司),4h后对bBMP凝胶行考马斯亮蓝R250染色及脱色液脱色,双层玻璃纸包裹,干燥后测定各批次bBMP的相对分子质量。
三、bBMP活性实验及标本制作
108只3~4周龄、雄性Balb/c小鼠,每组(每批次)18只,体重18~22g,经乙醚气体麻醉后,于小鼠大腿后内侧做0.5cm长皮肤切口,于股部肌间隙内以止血钳钝性分离,制成肌袋模型。随即于每组小鼠肌袋内分别植入上述6个批次bBMP2mg,对侧肢体肌袋空置作为空白对照。术后各批次以相同颗粒饲料分笼饲养,分别于术后第7、第14及第28d摘除眼球放血处死动物。每次每组处死6只,切取bBMP植入部周围的肌肉组织,双面刀片正中剖开,其中一半组织称重后匀浆,上清液以酶动力学法行碱性磷酸酶(alkaline phosphatase,ALP)活性测定(日本Hitachi 7500全自动生化分析系统),结果换算为每克湿重组织中ALP活性国际单位(u/gww);另一半组织以体积分数为10%的福尔马林液固定,石蜡包埋,切片,HE及Masson三色染色,进行组织形态学观察。
, http://www.100md.com
四、循环抗体免疫荧光测定
108只小鼠取材时摘除眼球放血,1000r/min离心10min分离血清,于-80℃冻存备用。取新鲜牛皮质骨以冰冻切片机(美国Leica公司)制成5~10μm厚不脱钙冰冻切片300张,上述抗血清倍比稀释后作为一抗,荧光标记兔-抗鼠IgG作为二抗(华美公司),常规免疫荧光染色,荧光显微镜下观察各抗体滴度的阳性染色率。
五、统计学处理方法
采用SPLM统计软件(第四军医大学统计学教研室)对实验数据进行分析,骨软骨生成率和免疫荧光阳性染色率以χ2检验分析;ALP活性测定结果用方差分析,组间两两循环比较行q检验。
结果
一、bBMP相对分子质量测定结果
, http://www.100md.com
SDS-PAGE电泳结果显示(图1),各批次bBMP的相对分子质量集中在14×103、18×103、25×103、30×103和40×103,均为多肽片段。各批次间区带分布相同,与Urist等[1]所报告的结果一致。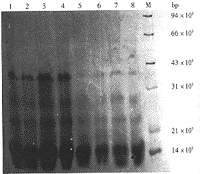
1 1989年批 2 1990年批 3 1992年批
4 1994年批 5、6 1996年批
7、8 1998年批 M 标准带
图1 各批次bBMP的SDS-PAGE电泳结果
二、bBMP活性实验结果
, http://www.100md.com
(一)由表1可见,在同一观察时限,各组ALP活性差异有显著性意义(均P<0.01);而且各组与阴性对照组比较差异均有显著性意义(P<0.01);但各组之间差异无显著性意义(P>0.05)。对同一组在不同观察时限所测得的ALP活性进行比较显示,1994年和1998年组,第7d与第28d测得的ALP活性差异有显著性意义(P<0.01或P<0.05);1996年组及阴性对照组,第7dALP活性与第14d和第28d比较,差异有显著性意义(均P<0.01);1996年组第14d与第28d之间的ALP活性,差异亦有显著性意义(P<0.01)。其余各组组间差异均无显著性意义(P>0.05)。
表1 不同批次bBMP植入后ALP活性测定
结果( ±s,u/gww)
±s,u/gww)
批次(年)
, 百拇医药
动物数(只)
处死动物时间(d)
F值
7
14
28
1989
18
2.074±0.872
2.053±0.812
1.577±0.390
2.71
1990
, http://www.100md.com
18
2.088±0.850
2.060±0.809
1.604±0.413
2.58
1992
18
1.958±0.541
1.805±0.555
1.572±0.338
2.85
1994
, http://www.100md.com
18
1.824±0.565
1.499±0.572
1.201±0.412
6.42*
1996
18
1.852±0.377
1.427±0.281
1.125±0.308
22.80*
, 百拇医药 1998
18
1.970±0.681
1.603±0.670
1.034±0.179
12.71*
阴性对照
18
0.366±0.101
0.208±0.055
0.199±0.045
31.24*
, 百拇医药
F值
17.35*
20.27*
42.19*
注:P<0.01
(二)组织学观察及成骨率计量结果HE及Masson三色染色结果显示,当bBMP植入小鼠股部肌袋后第7d,在bBMP植入部位的周围组织中可见由其诱导的大量间充质细胞分化,并向成骨细胞转化(图2);第14d,有大量软骨细胞形成并向小梁状骨转化(图3);第28d,形成大量成熟骨组织,有骨髓形成(图4)。各批次成骨过程相似,均未见明显的炎性细胞浸润或纤维组织包裹形成等病理变化。对各组骨软骨生成率进行χ2检验,差异无显著性意义(P>0.05,表2)。
, 百拇医药
表2 bBMP植入小鼠股部肌袋后不同时间的
骨软骨生成率(%)
批次(年)
动物数(只)
处死动物时间(d)
χ2值
7
14
28
1989
18
83(5/6)
, 百拇医药
100(6/6)
100(6/6)
2.117 6
1990
18
100(6/6)
100(6/6)
100(6/6)
2.117 6
1992
18
83(5/6)
, 百拇医药
83(5/6)
100(6/6)
1.125 0
1994
18
67(4/6)
83(5/6)
100(6/6)
2.400 0
1996
18
100(6/6)
, http://www.100md.com 100(6/6)
83(5/6)
2.1176
1998
18
83(5/6)
83(5/6)
100(6/6)
1.125 0
χ2值
3.948 0
3.272 7
, http://www.100md.com
4.235 3
注:括号内为实际频数,如(5/6)表明6只动物中有5只为阳性。表3同
图2 bBMP植入第7d,大量间充质细胞及软骨细胞诱导分化形成 HE染色×80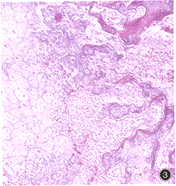
图3 第14d,大量软骨细胞形成并向小梁状骨转化Masson三色染色 ×80
图4 第28d,较成熟的板层骨伴骨髓组织形成 HE染色×80
三、间接免疫荧光染色结果
, 百拇医药
在bBMP植入小鼠体内第7~14d,部分鼠可产生低滴度循环抗体,抗体滴度1∶2~1∶4,其阳性着色部位主要位于骨细胞及哈佛管周围系统,而骨基质呈阴性着色(图5,6)。由表3可见,免疫荧光染色阳性率随着bBMP贮存时间的增加而有所降低,但各组间比较差异无显著性意义(P>0.05)。
表3 循环抗体免疫荧光测定结果(%)
批次(年)
动物数(只)
处死动物时间(d)
χ2值
7
14
28
, 百拇医药
1989
18
17(1/6)
50(3/6)
17(1/6)
2.215 4
1990
18
17(1/6)
50(3/6)
17(1/6)
2.215 4
, 百拇医药 1992
18
17(1/6)
50(3/6)
33(2/6)
1.500 0
1994
18
33(2/6)
67(4/6)
17(1/6)
3.272 7
1996
, 百拇医药
18
33(2/6)
67(4/6)
33(2/6)
1.800 0
1998
18
50(3/6)
67(4/6)
33(2/6)
1.333 0
χ2值
, 百拇医药
2.769 2
1.028 6
1.333 0
图5 术后第14d,骨细胞呈阳性着色,骨基质阴性 免疫荧光染色 ×80
图6 哈佛管系统呈阳性着色 免疫荧光染色 ×80
讨论
1965年Urist[3]发现脱钙骨基质具有异位诱导成骨作用,80年代BMP被成功提取、克隆并确定了其骨诱导的理论。迄今它已是作用最为肯定和强大的骨诱导成骨因子之一。BMP能够诱导定向骨祖细胞(DOPC)及可诱导骨祖细胞(IOPC)向成骨系细胞转化[4],以软骨内化骨参与并完成骨修复过程。BMP为种属非特异性多肽成分,不同种属的BMP之间具有高度同源性,免疫原性低,一般不引起免疫排斥反应,而只有轻微的免疫刺激能力[5],这种低免疫属性使BMP的跨种属应用成为可能。
, 百拇医药
Urist等[6]在1986年首先报告,将50mg人BMP植入因指骨内生软骨瘤刮除后遗留的骨缺损内,获满意愈合,但他认为BMP应与合适的载体结合以发挥其缓释效应。Johnson等[7]1988年将人BMP与明胶或聚乳酸(poly-lactic acid,PLA)复合,治愈12例难治性股骨骨折不愈合患者。最近有人将基因重组人BMP-2与低分子左旋PLA(poly D.L lacticacid,PDLLA)复合,治疗35例儿童先天性或创伤性骨病获得成功[8]。国内近年对骨诱导与BMP的研究亦十分活跃,陆续有报道成功提取动物及人BMP或骨基质明胶,并与煅石膏、磷酸钙陶瓷及生物性载体等复合,修复外伤或肿瘤引起的骨缺损,均已获得满意疗效[9-11]。胡蕴玉[4]将bBMP与去抗原牛松质骨载体真空复合,制成重组合异种骨(reconstituted bone xenograft,RBX),已治疗100余例骨不连、骨缺损及矫形植骨患者,随访疗效优良。术后除个别患者局部轻度肿胀外,均无其他不良反应,而且淋巴细胞转化率、T淋巴细胞亚群及可溶性白细胞介素2受体等均无明显异常表现,表明含bBMP的RBX移植后不引起明显的免疫排斥反应。
, 百拇医药
本研究结果表明,经天然提取的bBMP植入小鼠股部肌袋后,具有强大的异位诱导成骨能力,而且在4℃下贮存10年活性无明显丧失。相反,其刺激机体产生循环抗体的能力有所降低,说明bBMP经4℃长期贮存后抗原性有所减弱。有研究显示,BMP不仅是骨诱导生长因子,而且还是一种免疫调节剂,它可抑制多克隆刺激剂诱导T细胞的表达和增殖[12]。进一步的研究证明,BMP植入小鼠体内后,可使小鼠淋巴细胞亚群中的Lyt2明显增高,而不增加L3T4,使Th/Ts比值下降[13],这可能与BMP跨种属应用后不产生明显的免疫排斥反应有关。
在本研究中,随着贮存时间的增加各批次bBMP的荧光抗体阳性染色率有所下降,但经统计学分析差异无显著性意义。关于经4°C贮存后,bBMP免疫原性发生变化的确切机制,尚需进一步深入探讨。
参考文献
, 百拇医药
1,Urist MR, Lietze A, Mizutani H, et al. A bovine low molecular weight bone morphogenetic protein (BMP) fraction. Clin Orthop, 1982, (162):219- 232.
2,胡蕴玉,陆裕朴,刘玮,等.重组合异种骨的实验研究与临床应用.中华外科杂志,1993,31:709-713.
3,Urist MR. Bone formation by autoinduction. Science, 1965, 150:893-899.
4,胡蕴玉.骨诱导及BMP的研究现状与展望.中华外科杂志,1996,34:579-580.
5,Bessho K, Tagawa T, Murata M. Comparison of bone matrix- derived bone morphogenetic proteins from various animals. J Oral Maxillofac Surg, 1992, 50:496- 501.
, 百拇医药
6,Urist MR, Kovacs S, Yates KA. Regeneration of an enchondroma defect under the influence of an implant of human bone morphogenetic protein. J Hand Surg(Am), 1986, 11:417-419.
7,Johnson EE, Urist MR, Finerman GA. Bone morphogenetic protein augmentation grafting of resistant femoral nonunions:a preliminary report. Clin Orthop, 1988, (230): 257-265.
8Illi OE, Feldmann CP. Stimulation of fracture healing by local application of humoral factors integrated in biodegradable implants. Eur J Pediatr Surg, 1998, 8:251-255.
, 百拇医药
9,郑启新,朱通伯,杜靖远,等.多孔磷酸钙陶瓷人工骨修复骨缺损的实验研究和临床应用.中华骨科杂志,1992,12:11-13.
10,白梦海,葛宝丰,杨超,等.牛骨形态发生蛋白复合物的临床应用.中华骨科杂志,1995, 15:20- 22.
11,姚伦龙,陈剑飞,胡晓波,等.复合异种骨载体治疗肿瘤性骨缺损(附46例报告).中国矫形外科杂 志,1999,6:573-574.
12,黄传书,金伯泉,杨连甲,等.骨形成蛋白抑制多克隆刺激诱导T淋巴细胞增殖及其机理的研究.中华微生物学和免疫学杂志,1991,11:373-377.
13,桑宏勋,胡蕴玉,夏海滨,等.异种骨移植时T淋巴细胞总数及亚群的变化.中华外科杂志,1996,34:453-456.
(收稿日期:1999-08-10), 百拇医药
单位:710032 西安,第四军医大学西京医院全军骨科研究所
关键词:骨形态发生蛋白质类;免疫活性;骨生成
中华骨科杂志000907
【摘要】目的观察贮存时间对天然牛骨形态发生蛋白(bBMP)诱导成骨活性及抗原性的影响。方法取1989~1998年提取并于4℃贮存的6个批次的bBMP,以SDS-PAGE凝胶电泳法测定其相对分子质量。108只Balb/c雄性小鼠被分为6组,每组18只,按Urist方法于每只鼠股部肌间隙肌袋内植入2mgbBMP,术后第7、第14及第28d取材,以间接免疫荧光染色法分别测定抗体滴度及阳性染色率;以酶动力学方法测定碱性磷酸酶(ALP)活性,并观察bBMP诱导成骨活性。结果(1)SDS-PAGE凝胶电泳显示,8条电泳带均为多肽片段,6个批次bBMP的相对分子质量集中在14×103、18×103、25×103、30×103和40×103,各批次区带分布基本一致。(2)间接免疫荧光染色测定显示,bBMP可刺激小鼠产生弱的荧光抗体,抗体滴度1∶2~1∶4,随着贮存时间的增加荧光抗体的阳性染色率有所下降,但差异无显著性意义(P>0.05)。(3)植入bBMP后第7、第14及第28d各批次ALP活性明显高于对照组(均P<0.01),但各批次间差异无显著性意义(P>0.05)。(4)组织学观察,在bBMP植入第7d即可见大量间充质细胞分化,并向软骨细胞转化;第14d,有大量骨软骨形成;第28d,见成熟板层骨,并有骨髓形成。结论于4℃贮存10年的bBMP仍具有良好的诱导成骨活性,植入鼠体内后产生的低滴度循环抗体,并不影响bBMP的诱导成骨活性。
, http://www.100md.com
Bone inducing activity and antigenicity of native bone morphogenetic protein after various storage times
SANG Hongxun, LI Dan, HU Yunyu, et al.
(Institute of Orthopaedics, Xijing Hospital, the Fourth Military Medical University, Xi'an 710032, China )
【Abstract】Objective To observe the effects of storage times (1- 10 years) on the bone induction activity and antigenicity of bovine bone mophogenetic protein (bBMP). Methods Six batches of bBMP stored at 4 ℃ from 1989 to 1998 year were obtained to exam the relative molecular weight by SDS- PAGE. 108 Balb/c mice were divided into 6 groups, then 2 mg bBMP of each batch was implanted separately into the thigh muscle pouches of Balb/c mice according to the methods of Urist-s. Indirect immunofluorescence test was used to determine the host serum antibodies. Bone inducing activity was measured by histological evaluation and alkaline phosphatase (ALP) assay. Results 1)bBMP contained polypeptide fragments with MW at 14× 10 3 ,18× 10 3,25× 10 3,30× 10 3 and 40× 10 3 as shown in SDS-PAGE, and the electrophoresis results of the six batches of bBMP had the same pattern as that reported. 2)Indirect immunofluorescence assay showed that bBMP implantation led to weak positive staining in some of the recipient mice, with the dilution of the blood sera of the mice at 1/2 to 1/4, and it seems that the positive staining rates decreased after the long term storage of bBMP, but there was no statistical significant difference(P >0.05). 3)ALP assay showed that the 7th,14th and 28th day of bBMP implantation, the ALP activities of bBMP in implantation groups were relatively higher than that of the control group (P<0.01), while there were no significant differences among the six batches of bBMP groups (P>0.05). 4)Histologically,after the 7th day implantation, a large quantity of mesenchymal cells differentiated with active chondrogenesis. The 14th day later, a large amount of cartilage and woven bone formed, and laminar bone and bone marrow were seen on day 28 after implantation. Conclusion The bBMP possesses active bone induction properties even after 10 years storage in 4℃ . The low- level antibodies of the recipient mice can be detected after implanted with bBMP, but the bone inducing activities are not affected. This may be a reference data for purification and clinical application of native BMP.
, 百拇医药
【Key words】Bone morphogenetic proteins; Immunocompetence; Osteogenesis
自1982年Urist等[1]首次成功地提取出牛骨形态发生蛋白(bovine bone morphogenetic protein,bBMP)以来,bBMP已成功地用于治疗骨不连和骨缺损的修复,疗效满意[2]。BMP的作用主要是诱导两类成骨前体细胞向成骨系细胞转化:一类即骨髓基质细胞、骨膜成骨细胞等定向骨祖细胞(determined osteoprogenitor cell,DOPC);另一类为成纤维细胞、间充质细胞等可诱导骨祖细胞(inducible osteoprogenitor cell,IOPC),其成骨过程主要为软骨内化骨。成骨过程一经启动,BMP则可通过反馈机制促进多种细胞自分泌和旁分泌BMP,形成放大的“瀑布”效应,在多种生长因子的协同作用下,促进和完成骨折的修复过程[3-5]。BMP一般无种属特异性,具有跨种属诱导成骨能力,因而BMP的临床应用前景广阔。但有关贮存时间对BMP诱导活性和免疫原性影响的研究尚少有报道,笔者对我所10年内所提取的不同批次的bBMP,进行相对分子质量、生物活性和免疫原性分析,旨在为其今后的大量生产制备、贮存和应用提供参考。
, http://www.100md.com
材料与方法
一、bBMP的提取与贮存
按照Urist方法[1]并加以改进提取bBMP[2]。将5kg小牛皮质骨粉用1∶1等体积比的氯仿/甲醇(分析纯)混合液室温脱脂4h,0.6mol/LHCl4°C脱钙60h。具体步骤如下:分别以2mol/LCaCl2、0.5mol/LEDTA及8mol/LLiCl溶液于4℃系列脱蛋白24、4和24h,再以含6mol/L尿素及0.5mol/LCaCl2的混合蛋白抽提液室温抽提48h,抽提液内含10mmol/L的蛋白酶抑制剂N-乙基顺丁烯二酰亚胺(N-ethylmaleimide,NEMI),取上清液,经18000r/min离心25min,所得沉淀物即为bBMP粗提物。对bBMP粗提物进行纯化,先用含4mol/L盐酸胍(GuHCl)及0.05mol/LCaCl2的混合液溶解沉淀物,经3500r/min离心30min,去除沉淀,上清液再以18000r/min离心1h,沉淀物经1∶1等体积比的氯仿/甲醇混合液表面洗涤10min后倾去上清液,即获得bBMP。于干燥塔内自然干燥10d后,玻璃瓶内密封,于4℃贮存。
, 百拇医药
二、bBMPSDS-PAGE电泳
取1989、1990、1992、1994、1996及1998年共6个批次的bBMP各5mg,溶解于1ml6mol/L的尿素溶液中,溶解液与样品缓冲液按1∶1混合,进行SDS-PAGE垂直板电泳(美国Biored公司),4h后对bBMP凝胶行考马斯亮蓝R250染色及脱色液脱色,双层玻璃纸包裹,干燥后测定各批次bBMP的相对分子质量。
三、bBMP活性实验及标本制作
108只3~4周龄、雄性Balb/c小鼠,每组(每批次)18只,体重18~22g,经乙醚气体麻醉后,于小鼠大腿后内侧做0.5cm长皮肤切口,于股部肌间隙内以止血钳钝性分离,制成肌袋模型。随即于每组小鼠肌袋内分别植入上述6个批次bBMP2mg,对侧肢体肌袋空置作为空白对照。术后各批次以相同颗粒饲料分笼饲养,分别于术后第7、第14及第28d摘除眼球放血处死动物。每次每组处死6只,切取bBMP植入部周围的肌肉组织,双面刀片正中剖开,其中一半组织称重后匀浆,上清液以酶动力学法行碱性磷酸酶(alkaline phosphatase,ALP)活性测定(日本Hitachi 7500全自动生化分析系统),结果换算为每克湿重组织中ALP活性国际单位(u/gww);另一半组织以体积分数为10%的福尔马林液固定,石蜡包埋,切片,HE及Masson三色染色,进行组织形态学观察。
, http://www.100md.com
四、循环抗体免疫荧光测定
108只小鼠取材时摘除眼球放血,1000r/min离心10min分离血清,于-80℃冻存备用。取新鲜牛皮质骨以冰冻切片机(美国Leica公司)制成5~10μm厚不脱钙冰冻切片300张,上述抗血清倍比稀释后作为一抗,荧光标记兔-抗鼠IgG作为二抗(华美公司),常规免疫荧光染色,荧光显微镜下观察各抗体滴度的阳性染色率。
五、统计学处理方法
采用SPLM统计软件(第四军医大学统计学教研室)对实验数据进行分析,骨软骨生成率和免疫荧光阳性染色率以χ2检验分析;ALP活性测定结果用方差分析,组间两两循环比较行q检验。
结果
一、bBMP相对分子质量测定结果
, http://www.100md.com
SDS-PAGE电泳结果显示(图1),各批次bBMP的相对分子质量集中在14×103、18×103、25×103、30×103和40×103,均为多肽片段。各批次间区带分布相同,与Urist等[1]所报告的结果一致。

1 1989年批 2 1990年批 3 1992年批
4 1994年批 5、6 1996年批
7、8 1998年批 M 标准带
图1 各批次bBMP的SDS-PAGE电泳结果
二、bBMP活性实验结果
, http://www.100md.com
(一)由表1可见,在同一观察时限,各组ALP活性差异有显著性意义(均P<0.01);而且各组与阴性对照组比较差异均有显著性意义(P<0.01);但各组之间差异无显著性意义(P>0.05)。对同一组在不同观察时限所测得的ALP活性进行比较显示,1994年和1998年组,第7d与第28d测得的ALP活性差异有显著性意义(P<0.01或P<0.05);1996年组及阴性对照组,第7dALP活性与第14d和第28d比较,差异有显著性意义(均P<0.01);1996年组第14d与第28d之间的ALP活性,差异亦有显著性意义(P<0.01)。其余各组组间差异均无显著性意义(P>0.05)。
表1 不同批次bBMP植入后ALP活性测定
结果(
 ±s,u/gww)
±s,u/gww)批次(年)
, 百拇医药
动物数(只)
处死动物时间(d)
F值
7
14
28
1989
18
2.074±0.872
2.053±0.812
1.577±0.390
2.71
1990
, http://www.100md.com
18
2.088±0.850
2.060±0.809
1.604±0.413
2.58
1992
18
1.958±0.541
1.805±0.555
1.572±0.338
2.85
1994
, http://www.100md.com
18
1.824±0.565
1.499±0.572
1.201±0.412
6.42*
1996
18
1.852±0.377
1.427±0.281
1.125±0.308
22.80*
, 百拇医药 1998
18
1.970±0.681
1.603±0.670
1.034±0.179
12.71*
阴性对照
18
0.366±0.101
0.208±0.055
0.199±0.045
31.24*
, 百拇医药
F值
17.35*
20.27*
42.19*
注:P<0.01
(二)组织学观察及成骨率计量结果HE及Masson三色染色结果显示,当bBMP植入小鼠股部肌袋后第7d,在bBMP植入部位的周围组织中可见由其诱导的大量间充质细胞分化,并向成骨细胞转化(图2);第14d,有大量软骨细胞形成并向小梁状骨转化(图3);第28d,形成大量成熟骨组织,有骨髓形成(图4)。各批次成骨过程相似,均未见明显的炎性细胞浸润或纤维组织包裹形成等病理变化。对各组骨软骨生成率进行χ2检验,差异无显著性意义(P>0.05,表2)。
, 百拇医药
表2 bBMP植入小鼠股部肌袋后不同时间的
骨软骨生成率(%)
批次(年)
动物数(只)
处死动物时间(d)
χ2值
7
14
28
1989
18
83(5/6)
, 百拇医药
100(6/6)
100(6/6)
2.117 6
1990
18
100(6/6)
100(6/6)
100(6/6)
2.117 6
1992
18
83(5/6)
, 百拇医药
83(5/6)
100(6/6)
1.125 0
1994
18
67(4/6)
83(5/6)
100(6/6)
2.400 0
1996
18
100(6/6)
, http://www.100md.com 100(6/6)
83(5/6)
2.1176
1998
18
83(5/6)
83(5/6)
100(6/6)
1.125 0
χ2值
3.948 0
3.272 7
, http://www.100md.com
4.235 3
注:括号内为实际频数,如(5/6)表明6只动物中有5只为阳性。表3同

图2 bBMP植入第7d,大量间充质细胞及软骨细胞诱导分化形成 HE染色×80

图3 第14d,大量软骨细胞形成并向小梁状骨转化Masson三色染色 ×80

图4 第28d,较成熟的板层骨伴骨髓组织形成 HE染色×80
三、间接免疫荧光染色结果
, 百拇医药
在bBMP植入小鼠体内第7~14d,部分鼠可产生低滴度循环抗体,抗体滴度1∶2~1∶4,其阳性着色部位主要位于骨细胞及哈佛管周围系统,而骨基质呈阴性着色(图5,6)。由表3可见,免疫荧光染色阳性率随着bBMP贮存时间的增加而有所降低,但各组间比较差异无显著性意义(P>0.05)。
表3 循环抗体免疫荧光测定结果(%)
批次(年)
动物数(只)
处死动物时间(d)
χ2值
7
14
28
, 百拇医药
1989
18
17(1/6)
50(3/6)
17(1/6)
2.215 4
1990
18
17(1/6)
50(3/6)
17(1/6)
2.215 4
, 百拇医药 1992
18
17(1/6)
50(3/6)
33(2/6)
1.500 0
1994
18
33(2/6)
67(4/6)
17(1/6)
3.272 7
1996
, 百拇医药
18
33(2/6)
67(4/6)
33(2/6)
1.800 0
1998
18
50(3/6)
67(4/6)
33(2/6)
1.333 0
χ2值
, 百拇医药
2.769 2
1.028 6
1.333 0

图5 术后第14d,骨细胞呈阳性着色,骨基质阴性 免疫荧光染色 ×80

图6 哈佛管系统呈阳性着色 免疫荧光染色 ×80
讨论
1965年Urist[3]发现脱钙骨基质具有异位诱导成骨作用,80年代BMP被成功提取、克隆并确定了其骨诱导的理论。迄今它已是作用最为肯定和强大的骨诱导成骨因子之一。BMP能够诱导定向骨祖细胞(DOPC)及可诱导骨祖细胞(IOPC)向成骨系细胞转化[4],以软骨内化骨参与并完成骨修复过程。BMP为种属非特异性多肽成分,不同种属的BMP之间具有高度同源性,免疫原性低,一般不引起免疫排斥反应,而只有轻微的免疫刺激能力[5],这种低免疫属性使BMP的跨种属应用成为可能。
, 百拇医药
Urist等[6]在1986年首先报告,将50mg人BMP植入因指骨内生软骨瘤刮除后遗留的骨缺损内,获满意愈合,但他认为BMP应与合适的载体结合以发挥其缓释效应。Johnson等[7]1988年将人BMP与明胶或聚乳酸(poly-lactic acid,PLA)复合,治愈12例难治性股骨骨折不愈合患者。最近有人将基因重组人BMP-2与低分子左旋PLA(poly D.L lacticacid,PDLLA)复合,治疗35例儿童先天性或创伤性骨病获得成功[8]。国内近年对骨诱导与BMP的研究亦十分活跃,陆续有报道成功提取动物及人BMP或骨基质明胶,并与煅石膏、磷酸钙陶瓷及生物性载体等复合,修复外伤或肿瘤引起的骨缺损,均已获得满意疗效[9-11]。胡蕴玉[4]将bBMP与去抗原牛松质骨载体真空复合,制成重组合异种骨(reconstituted bone xenograft,RBX),已治疗100余例骨不连、骨缺损及矫形植骨患者,随访疗效优良。术后除个别患者局部轻度肿胀外,均无其他不良反应,而且淋巴细胞转化率、T淋巴细胞亚群及可溶性白细胞介素2受体等均无明显异常表现,表明含bBMP的RBX移植后不引起明显的免疫排斥反应。
, 百拇医药
本研究结果表明,经天然提取的bBMP植入小鼠股部肌袋后,具有强大的异位诱导成骨能力,而且在4℃下贮存10年活性无明显丧失。相反,其刺激机体产生循环抗体的能力有所降低,说明bBMP经4℃长期贮存后抗原性有所减弱。有研究显示,BMP不仅是骨诱导生长因子,而且还是一种免疫调节剂,它可抑制多克隆刺激剂诱导T细胞的表达和增殖[12]。进一步的研究证明,BMP植入小鼠体内后,可使小鼠淋巴细胞亚群中的Lyt2明显增高,而不增加L3T4,使Th/Ts比值下降[13],这可能与BMP跨种属应用后不产生明显的免疫排斥反应有关。
在本研究中,随着贮存时间的增加各批次bBMP的荧光抗体阳性染色率有所下降,但经统计学分析差异无显著性意义。关于经4°C贮存后,bBMP免疫原性发生变化的确切机制,尚需进一步深入探讨。
参考文献
, 百拇医药
1,Urist MR, Lietze A, Mizutani H, et al. A bovine low molecular weight bone morphogenetic protein (BMP) fraction. Clin Orthop, 1982, (162):219- 232.
2,胡蕴玉,陆裕朴,刘玮,等.重组合异种骨的实验研究与临床应用.中华外科杂志,1993,31:709-713.
3,Urist MR. Bone formation by autoinduction. Science, 1965, 150:893-899.
4,胡蕴玉.骨诱导及BMP的研究现状与展望.中华外科杂志,1996,34:579-580.
5,Bessho K, Tagawa T, Murata M. Comparison of bone matrix- derived bone morphogenetic proteins from various animals. J Oral Maxillofac Surg, 1992, 50:496- 501.
, 百拇医药
6,Urist MR, Kovacs S, Yates KA. Regeneration of an enchondroma defect under the influence of an implant of human bone morphogenetic protein. J Hand Surg(Am), 1986, 11:417-419.
7,Johnson EE, Urist MR, Finerman GA. Bone morphogenetic protein augmentation grafting of resistant femoral nonunions:a preliminary report. Clin Orthop, 1988, (230): 257-265.
8Illi OE, Feldmann CP. Stimulation of fracture healing by local application of humoral factors integrated in biodegradable implants. Eur J Pediatr Surg, 1998, 8:251-255.
, 百拇医药
9,郑启新,朱通伯,杜靖远,等.多孔磷酸钙陶瓷人工骨修复骨缺损的实验研究和临床应用.中华骨科杂志,1992,12:11-13.
10,白梦海,葛宝丰,杨超,等.牛骨形态发生蛋白复合物的临床应用.中华骨科杂志,1995, 15:20- 22.
11,姚伦龙,陈剑飞,胡晓波,等.复合异种骨载体治疗肿瘤性骨缺损(附46例报告).中国矫形外科杂 志,1999,6:573-574.
12,黄传书,金伯泉,杨连甲,等.骨形成蛋白抑制多克隆刺激诱导T淋巴细胞增殖及其机理的研究.中华微生物学和免疫学杂志,1991,11:373-377.
13,桑宏勋,胡蕴玉,夏海滨,等.异种骨移植时T淋巴细胞总数及亚群的变化.中华外科杂志,1996,34:453-456.
(收稿日期:1999-08-10), 百拇医药