N-邻香草醛氨基葡萄糖希夫碱配合物对和DNA的作用
作者:刘小琴 乐芝凤 张香才
单位:刘小琴 乐芝凤(三峡大学医学院医用化学教研室 宜昌 443003);张香才(华中师范大学化学系)
关键词:N-邻香划醛氨基葡萄糖希夫碱;配合物;超氧阴离子自由基;DNA
实用医学进修杂志000307
摘 要 目的:探讨防止超氧离子对组织细胞的损伤,开发能与肿瘤细胞染色体DNA作用的药物。方法:采用比色法、荧光和吸收光谱法研究了N-邻香草醛氨基葡萄糖糖希夫碱(VG)的(Ⅱ)、锌(Ⅱ)、钴(Ⅲ)配合物(MVG)对超氧阴离子自由基和DNA的作用。结果与结论:CuVG,ZnVG和CoVG能抑制超氧离子自由基的生成,抑制能力最强的是CuVG。此外,配合物CoVG可与DNA有效结合,结合常数(Ko)值为5.26×104mol-1L,每100个核苷酸的片段可提供结合位点数是3.8。
, 百拇医药
Effects of N-O-vanillin Aminoglucose
Schiff Base Complexes On and DNA
and DNA
Liu Xiaoqin
(Sanxia University Medical College,Yichang 443003)
Le Zhifen Zhang Xiangcai
(Department of Chemisty,Central China Normal University)
Abstract Objective:To prevent superoxid ion radical damgael tissue call,to develope newly reliable medicine to treat DNA in chromosme of tumoral cell.Methods::The effects of VG schiff base complexes with Cu(Ⅱ),Zn(Ⅱ),Co(Ⅲ) on and were studied.Result and Conclusion:That CuVG,ZVG and CoVG can inhibit the synthesis of
and were studied.Result and Conclusion:That CuVG,ZVG and CoVG can inhibit the synthesis of  markedly.The inhibition ability best was CuVG.In the meantime,complexes CoVG could combine with the salmon sperm DNA.The intrinsic association contant (Ko) for CoVG were estimated to be 5.26×104M-1.The number of binding sites per 100 nucleotides (n) was 3.8.
markedly.The inhibition ability best was CuVG.In the meantime,complexes CoVG could combine with the salmon sperm DNA.The intrinsic association contant (Ko) for CoVG were estimated to be 5.26×104M-1.The number of binding sites per 100 nucleotides (n) was 3.8.
, 百拇医药
Key Words N-O-vanillin aminoglucose schiff base;complexes;superoxide ion radical;DNA
当前医学界研究抑制自由基的生成和抗癌药物十分活跃。本实验采用比色法、荧光和吸收光谱法研究了N-邻香草醛氨基葡萄糖希夫碱(VG)和铜(Ⅱ)、锌(Ⅱ)、钴(Ⅲ)配合物(MVG)对超氧离子自由基的抑制作用以及与DNA的结合能力。
1 材料和方法
1.1 试剂与仪器
三羟甲基氨基甲烷(C.P),聚乙二醇辛基苯甲醚(C.P),二甲胂酸钠(C.P),氯化硝基四氮唑兰(B.P),鱼精DNA(B.P),焦性没食子酸,溴化乙锭等均为A.R级。
本实验所用化合物全部由华中师范大学配位化学科研组提供,均为一步合成产物:N-邻香草氨基葡萄糖合铜(Ⅱ)(简称CuVG)为灰绿色固体,分子式:C14H27O12NCu。N-邻香草醛氨基萄萄糖合锌(Ⅱ)(简称ZnVG)为浅黄色固体,分子式:C28H54O16N2Zn。N-邻香草醛氨基葡萄糖合钴(Ⅲ)(简称CoVG)为浅褐色固体,分子式:C16H31O14NCo。
, 百拇医药
岛津RF-540型荧光分光光度计:岛津265型UV/vis光谱仪;pH-25型酸度计;721型分光光度计;501型超级恒温水槽。
1.2 比色法
采用Pyrogallol-NBT比色法[1]在721型分光光度计于540mm处测定体系加入不同浓度化合物后的吸光度,并设参比对照。化合物对超氧离子自由基的平均抑制率可用下列公式计算:
1.3 荧光光谱法
在10ml容量瓶中,依次加入4.00×10-4mol/L溴化乙锭,1.00×10-5鱼精DNA各1.00ml,再加入不同浓度的化合物,并用pH=7.40内含0.01mol/LTris-HCl缓冲液稀释定容。
, 百拇医药
在激发波长525nm,发射波长590nm,激发和发射狭缝都是5nm处,记录荧光强度,并利用下列公式计算相对荧光强度:
试剂:溴化乙锭,DNA,化合物以及化合物与溴化乙锭的混合物的荧光强度都很小,均可忽略不计。
1.4 吸收光谱法
选取荧光实验中配合物与DNA浓度之比在100以内,而相对荧光强度降至50%以下的CoVG进行吸收光谱研究[2~5]。
1.4.1 固定CoVG0.049mmol/L,用0.000~0.024mmol/LDNA滴定,并分别在500~280nm范围内扫描。在此范围内DNA无吸收。
以不加DNA的金属配合物为空白,固定金属配合物的浓度,测定500~280nm范围范围内,CoVG0.049mmol/L用DNA0.006~0.024mmol/L滴定的吸光度△A。以各种DNA浓度的倒数对△A的倒数作图。横坐标上的截距的倒数为△Amax。
, http://www.100md.com
1.4.2 固定DNA的浓度为0.075mmol/L,用CoVG0.003~0.021mmol/L滴定,用不加DNA的金属配合物浓度作空白,测定CoDG在386.2nm,处的光吸收△A,这金属配合物与DNA的成键浓度Cb可以根据下列方程式计算[6]:
求出Cb后,可解Scatchard方程:
方程中:K表示金属配合物的结合常数,r是金属配合物的成键浓度(Cb)与总DNA浓度之比,C是游离的金属配合物的浓度,n是每个核苷酸片段可提供的结合位置数。
2 结果和讨论
, http://www.100md.com
表1列出了各种不同浓度的配合物对超氧离子自由基的平均抑制率,并由些得到了平均抑制与浓度的依赖关系(见图1)。
表1 配合物对超氧离子自由基平均抑制率的数据 -LGC
(ZnVG)
Average
inhibition rate(%)
-lgC
(CoVG)
Average
inhibition rate(%)
-lgC
, 百拇医药
(CuVG)
Average
inhibition rate(%)
3.29
3.59
3.99
4.29
41.42
32.31
20.24
11.83
3.02
, http://www.100md.com 3.32
3.27
4.02
42.50
33.80
27.50
23.10
4.39
4.69
5.09
5.39
73.29
60.35
, 百拇医药
49.94
41.54
C:配合物的浓度(molL-1);3次结果的平均值
实验结果表明上3种配合物均可抑制超氧离子自由基的生成,其抑制率随配合物的浓度成正相关,而且抑制能力最强的是CuVG(图1)。CuVG具有较有较好的清除超氧离子自由基的能力,与近年来研究者发现Cu(Ⅱ)及其小分子配合物具有一定的SOD样活性相一致[7]。其它配合物的作用机制目前尚不清楚,有待进一步研究。

图1 VG系列化合物对超氧阴离子
, http://www.100md.com 自由基的平均抑制率平均抑制率(%)
图2 化合物与DNA摩尔浓度之比
与相对荧光强度之间的关系
一般认为DNA是抗癌药物在体内发生作用的主要靶标,现已证明在体外对DNA发生作用的药物在体内DNA也有作用[8]。如果MVG系列化合物与DNA 有作用,则化合物就会与溴化乙锭竞争DNA,使相对荧光强度值降低。表2列出了化合物与DNA摩尔浓度之比与相对荧光强度之间的关系。表2 化合物与DNA摩尔浓度之比与相对荧光强度之间关系的数据
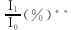




, 百拇医药
20.4
40.9
61.5
81.8
102
96.28
95.54
94.50
92.72
92.57
20.3
40.6
60.9
, http://www.100md.com
81.2
101.5
97.18
92.72
89.30
87.52
85.74
21.2
42.5
63.7
84.9
99.6
84.99
, 百拇医药
74.59
61.37
52.89
44.89
化合物与DNA摩尔浓度之比;相对荧光强度
如果用化合物与DNA的摩尔浓度之比为横坐标,相对荧光强度作纵坐标就可得到图2。图2说明了化合物与DNA作用的相对强弱。据文献报道[9],如果摩尔浓度比Ccomp/CDNA不超过100为浓度限制,就可以用荧光值减弱到50%作为一个化合物与DNA作用的判据。MVG系列化合物的荧光实验表明,CoVG在上述条件下,荧光值均减弱到50%以下(图2),这说明这种化合物与DNA发生了某种作用。
通过紫外可见分光光度实验得到了CoVG与DNA作用的吸收光谱图(图3)。
, 百拇医药
在CoVG386.2nm处,利用r/c对r作图可得Scatchard曲线(图4)
图3 CoVG(0.049mM)与鱼精DNA
(0.000~0.024mM)作用的吸收光谱图
图4 鱼精DNA(0.075mM)与CoVG
(0.003~0.021mM)作用的Scatchard曲线
从图3中可以看出,CoVG吸收峰值随着DNA浓度的增加而降低。CoVG在304nm和432nm处有等吸收点存在。这些等吸收点表明了DNA,DNA成键金属配合物,游离金属配合物三者之间存在平衡[2]。在CoVG386.2nm处,利用r/c对r作图可得Scatchard曲线(图4),其斜率Ko[3.4]是金属配合物与DNA的结合常数,对CoVG其值为5.26×104mol-1L。每100个核苷酸片段可提供的结合位置数(n)CoVG为3.8,但其结合方式有待进一步研究。
, http://www.100md.com
以上研究结果表明,N-邻香草醛氨基葡萄糖希夫碱的铜(Ⅱ),锌(Ⅱ),和钴(Ⅲ)配合物对超氧阴离子自由基的生成具有显著的抑制作用,抑制能力最强的是CuVG。由于人体在代谢过程中也能不断产生有毒性的超氧离子,它们的聚积和长期作用将导致组织细胞的损伤和衰老,因此,上述3种配合物有作为抗氧化性损伤和衰老的药品或食品添加剂的实际应用前景。
恶性肿瘤为当今世界首位的致死病因,研究开发新的化学治疗药物有重要的医学临床价值。由于这类药物多通过与细胞的染色体DNA相互作用而发挥治疗作用,因而对候选药物进行DNA结合分析就成为筛选该类药物的前期研究内容。本研究发现CoVG具有DNA结合功能,结合常数分别为5.26×104 mol-1L,提示可将这种配合物作为抗肿瘤候选药物作进一步的深入研究。
参考文献
1,蓝开蔚,黄建鸣,谢之荣,等.超氧化物歧化酶活性测定-Pyrogallol)NBA比色法与化学法的比较[J].生物化学与生物物理进展,1988;15(2):138
, 百拇医药
2,Torshizi H M. Srivastava T A. Parekh H K, et al. Synthesis, spectroscopic, cytotoxic ,and DNA binding srudies of binuclear 2,2` bipyridine-platinum(Ⅱ) and platinum(Ⅱ) complexes of meso-α,α` diaminoadipic and meso-α,α` diaminosuberic acids[J], J Inorg Biochem, 1992; 45:135
3,Mital R, Ray K S, Srivastava T S, et al. Study of binding of some amino acid derivativers of 2, 2` bipyridineplatinum(Ⅱ) to calf thymus DNA[J]. J Inorg Biochem, 1986;27:133
, http://www.100md.com
4,Jain N,Mittal R,Srivatava T S,et al.Synthesis,Characterization,DNA binding,and cytotoxic studies of dinuclear complexes of palladium(Ⅱ) and platinum(Ⅱ) with 2.2'-bipyridine and α,ω-diaminoalkane-N,N'-diaceticd[J].J Inorg Biochem,1994;53:79
5,Mital R,Jian N,Srivastava T S. Synthesis characterization and cytotoxic studies of diamine and diimine palladium(Ⅱ) complexes of diethyldithiocarbamate and binding of these and analogous platinum(Ⅱ) complexes with DNA[J].Inorg Chem Acta,1989;166:135
, 百拇医药
6,Gravina A,Pasini A,Pinciroli E,et al.Synthesis and evaluation of biological activity of binuclear cisplatin analogues with polyoxypropylenc α,ω-diamines as the bridging groups[J].Inorg Chem Acta,1989;157:165
7,Amar C.Catalytic activity study of some copper(Ⅱ) histidine-contaiting dipetide complexes on aqueous superoxide ion dismutation[J].J Inorg Biochem,1982;17:325
8,齐树民编.药理学进展[M].北京:人民卫生出版社,1985:12,319
9,Ong C W.Antitumor antibiotics drug design.Part 1:Synthesis α,o-chloro-2-methoxy-9-triethylenetetraa-mino-acridine iron complexes which binds to DNA and causes strand scissioring in vitro[J].Inorg chem Acta,1986;123:221
(2000-05-20 收稿), 百拇医药
单位:刘小琴 乐芝凤(三峡大学医学院医用化学教研室 宜昌 443003);张香才(华中师范大学化学系)
关键词:N-邻香划醛氨基葡萄糖希夫碱;配合物;超氧阴离子自由基;DNA
实用医学进修杂志000307
摘 要 目的:探讨防止超氧离子对组织细胞的损伤,开发能与肿瘤细胞染色体DNA作用的药物。方法:采用比色法、荧光和吸收光谱法研究了N-邻香草醛氨基葡萄糖糖希夫碱(VG)的(Ⅱ)、锌(Ⅱ)、钴(Ⅲ)配合物(MVG)对超氧阴离子自由基和DNA的作用。结果与结论:CuVG,ZnVG和CoVG能抑制超氧离子自由基的生成,抑制能力最强的是CuVG。此外,配合物CoVG可与DNA有效结合,结合常数(Ko)值为5.26×104mol-1L,每100个核苷酸的片段可提供结合位点数是3.8。
, 百拇医药
Effects of N-O-vanillin Aminoglucose
Schiff Base Complexes On
 and DNA
and DNALiu Xiaoqin
(Sanxia University Medical College,Yichang 443003)
Le Zhifen Zhang Xiangcai
(Department of Chemisty,Central China Normal University)
Abstract Objective:To prevent superoxid ion radical damgael tissue call,to develope newly reliable medicine to treat DNA in chromosme of tumoral cell.Methods::The effects of VG schiff base complexes with Cu(Ⅱ),Zn(Ⅱ),Co(Ⅲ) on
 and were studied.Result and Conclusion:That CuVG,ZVG and CoVG can inhibit the synthesis of
and were studied.Result and Conclusion:That CuVG,ZVG and CoVG can inhibit the synthesis of  markedly.The inhibition ability best was CuVG.In the meantime,complexes CoVG could combine with the salmon sperm DNA.The intrinsic association contant (Ko) for CoVG were estimated to be 5.26×104M-1.The number of binding sites per 100 nucleotides (n) was 3.8.
markedly.The inhibition ability best was CuVG.In the meantime,complexes CoVG could combine with the salmon sperm DNA.The intrinsic association contant (Ko) for CoVG were estimated to be 5.26×104M-1.The number of binding sites per 100 nucleotides (n) was 3.8., 百拇医药
Key Words N-O-vanillin aminoglucose schiff base;complexes;superoxide ion radical;DNA
当前医学界研究抑制自由基的生成和抗癌药物十分活跃。本实验采用比色法、荧光和吸收光谱法研究了N-邻香草醛氨基葡萄糖希夫碱(VG)和铜(Ⅱ)、锌(Ⅱ)、钴(Ⅲ)配合物(MVG)对超氧离子自由基的抑制作用以及与DNA的结合能力。
1 材料和方法
1.1 试剂与仪器
三羟甲基氨基甲烷(C.P),聚乙二醇辛基苯甲醚(C.P),二甲胂酸钠(C.P),氯化硝基四氮唑兰(B.P),鱼精DNA(B.P),焦性没食子酸,溴化乙锭等均为A.R级。
本实验所用化合物全部由华中师范大学配位化学科研组提供,均为一步合成产物:N-邻香草氨基葡萄糖合铜(Ⅱ)(简称CuVG)为灰绿色固体,分子式:C14H27O12NCu。N-邻香草醛氨基萄萄糖合锌(Ⅱ)(简称ZnVG)为浅黄色固体,分子式:C28H54O16N2Zn。N-邻香草醛氨基葡萄糖合钴(Ⅲ)(简称CoVG)为浅褐色固体,分子式:C16H31O14NCo。
, 百拇医药
岛津RF-540型荧光分光光度计:岛津265型UV/vis光谱仪;pH-25型酸度计;721型分光光度计;501型超级恒温水槽。
1.2 比色法
采用Pyrogallol-NBT比色法[1]在721型分光光度计于540mm处测定体系加入不同浓度化合物后的吸光度,并设参比对照。化合物对超氧离子自由基的平均抑制率可用下列公式计算:

1.3 荧光光谱法
在10ml容量瓶中,依次加入4.00×10-4mol/L溴化乙锭,1.00×10-5鱼精DNA各1.00ml,再加入不同浓度的化合物,并用pH=7.40内含0.01mol/LTris-HCl缓冲液稀释定容。
, 百拇医药
在激发波长525nm,发射波长590nm,激发和发射狭缝都是5nm处,记录荧光强度,并利用下列公式计算相对荧光强度:

试剂:溴化乙锭,DNA,化合物以及化合物与溴化乙锭的混合物的荧光强度都很小,均可忽略不计。
1.4 吸收光谱法
选取荧光实验中配合物与DNA浓度之比在100以内,而相对荧光强度降至50%以下的CoVG进行吸收光谱研究[2~5]。
1.4.1 固定CoVG0.049mmol/L,用0.000~0.024mmol/LDNA滴定,并分别在500~280nm范围内扫描。在此范围内DNA无吸收。
以不加DNA的金属配合物为空白,固定金属配合物的浓度,测定500~280nm范围范围内,CoVG0.049mmol/L用DNA0.006~0.024mmol/L滴定的吸光度△A。以各种DNA浓度的倒数对△A的倒数作图。横坐标上的截距的倒数为△Amax。
, http://www.100md.com
1.4.2 固定DNA的浓度为0.075mmol/L,用CoVG0.003~0.021mmol/L滴定,用不加DNA的金属配合物浓度作空白,测定CoDG在386.2nm,处的光吸收△A,这金属配合物与DNA的成键浓度Cb可以根据下列方程式计算[6]:

求出Cb后,可解Scatchard方程:

方程中:K表示金属配合物的结合常数,r是金属配合物的成键浓度(Cb)与总DNA浓度之比,C是游离的金属配合物的浓度,n是每个核苷酸片段可提供的结合位置数。
2 结果和讨论
, http://www.100md.com
表1列出了各种不同浓度的配合物对超氧离子自由基的平均抑制率,并由些得到了平均抑制与浓度的依赖关系(见图1)。
表1 配合物对超氧离子自由基平均抑制率的数据 -LGC
(ZnVG)
Average
inhibition rate(%)
-lgC
(CoVG)
Average
inhibition rate(%)
-lgC
, 百拇医药
(CuVG)
Average
inhibition rate(%)
3.29
3.59
3.99
4.29
41.42
32.31
20.24
11.83
3.02
, http://www.100md.com 3.32
3.27
4.02
42.50
33.80
27.50
23.10
4.39
4.69
5.09
5.39
73.29
60.35
, 百拇医药
49.94
41.54
C:配合物的浓度(molL-1);3次结果的平均值
实验结果表明上3种配合物均可抑制超氧离子自由基的生成,其抑制率随配合物的浓度成正相关,而且抑制能力最强的是CuVG(图1)。CuVG具有较有较好的清除超氧离子自由基的能力,与近年来研究者发现Cu(Ⅱ)及其小分子配合物具有一定的SOD样活性相一致[7]。其它配合物的作用机制目前尚不清楚,有待进一步研究。


图1 VG系列化合物对超氧阴离子
, http://www.100md.com 自由基的平均抑制率平均抑制率(%)
图2 化合物与DNA摩尔浓度之比
与相对荧光强度之间的关系
一般认为DNA是抗癌药物在体内发生作用的主要靶标,现已证明在体外对DNA发生作用的药物在体内DNA也有作用[8]。如果MVG系列化合物与DNA 有作用,则化合物就会与溴化乙锭竞争DNA,使相对荧光强度值降低。表2列出了化合物与DNA摩尔浓度之比与相对荧光强度之间的关系。表2 化合物与DNA摩尔浓度之比与相对荧光强度之间关系的数据

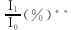




, 百拇医药
20.4
40.9
61.5
81.8
102
96.28
95.54
94.50
92.72
92.57
20.3
40.6
60.9
, http://www.100md.com
81.2
101.5
97.18
92.72
89.30
87.52
85.74
21.2
42.5
63.7
84.9
99.6
84.99
, 百拇医药
74.59
61.37
52.89
44.89
化合物与DNA摩尔浓度之比;相对荧光强度
如果用化合物与DNA的摩尔浓度之比为横坐标,相对荧光强度作纵坐标就可得到图2。图2说明了化合物与DNA作用的相对强弱。据文献报道[9],如果摩尔浓度比Ccomp/CDNA不超过100为浓度限制,就可以用荧光值减弱到50%作为一个化合物与DNA作用的判据。MVG系列化合物的荧光实验表明,CoVG在上述条件下,荧光值均减弱到50%以下(图2),这说明这种化合物与DNA发生了某种作用。
通过紫外可见分光光度实验得到了CoVG与DNA作用的吸收光谱图(图3)。
, 百拇医药
在CoVG386.2nm处,利用r/c对r作图可得Scatchard曲线(图4)

图3 CoVG(0.049mM)与鱼精DNA
(0.000~0.024mM)作用的吸收光谱图

图4 鱼精DNA(0.075mM)与CoVG
(0.003~0.021mM)作用的Scatchard曲线
从图3中可以看出,CoVG吸收峰值随着DNA浓度的增加而降低。CoVG在304nm和432nm处有等吸收点存在。这些等吸收点表明了DNA,DNA成键金属配合物,游离金属配合物三者之间存在平衡[2]。在CoVG386.2nm处,利用r/c对r作图可得Scatchard曲线(图4),其斜率Ko[3.4]是金属配合物与DNA的结合常数,对CoVG其值为5.26×104mol-1L。每100个核苷酸片段可提供的结合位置数(n)CoVG为3.8,但其结合方式有待进一步研究。
, http://www.100md.com
以上研究结果表明,N-邻香草醛氨基葡萄糖希夫碱的铜(Ⅱ),锌(Ⅱ),和钴(Ⅲ)配合物对超氧阴离子自由基的生成具有显著的抑制作用,抑制能力最强的是CuVG。由于人体在代谢过程中也能不断产生有毒性的超氧离子,它们的聚积和长期作用将导致组织细胞的损伤和衰老,因此,上述3种配合物有作为抗氧化性损伤和衰老的药品或食品添加剂的实际应用前景。
恶性肿瘤为当今世界首位的致死病因,研究开发新的化学治疗药物有重要的医学临床价值。由于这类药物多通过与细胞的染色体DNA相互作用而发挥治疗作用,因而对候选药物进行DNA结合分析就成为筛选该类药物的前期研究内容。本研究发现CoVG具有DNA结合功能,结合常数分别为5.26×104 mol-1L,提示可将这种配合物作为抗肿瘤候选药物作进一步的深入研究。
参考文献
1,蓝开蔚,黄建鸣,谢之荣,等.超氧化物歧化酶活性测定-Pyrogallol)NBA比色法与化学法的比较[J].生物化学与生物物理进展,1988;15(2):138
, 百拇医药
2,Torshizi H M. Srivastava T A. Parekh H K, et al. Synthesis, spectroscopic, cytotoxic ,and DNA binding srudies of binuclear 2,2` bipyridine-platinum(Ⅱ) and platinum(Ⅱ) complexes of meso-α,α` diaminoadipic and meso-α,α` diaminosuberic acids[J], J Inorg Biochem, 1992; 45:135
3,Mital R, Ray K S, Srivastava T S, et al. Study of binding of some amino acid derivativers of 2, 2` bipyridineplatinum(Ⅱ) to calf thymus DNA[J]. J Inorg Biochem, 1986;27:133
, http://www.100md.com
4,Jain N,Mittal R,Srivatava T S,et al.Synthesis,Characterization,DNA binding,and cytotoxic studies of dinuclear complexes of palladium(Ⅱ) and platinum(Ⅱ) with 2.2'-bipyridine and α,ω-diaminoalkane-N,N'-diaceticd[J].J Inorg Biochem,1994;53:79
5,Mital R,Jian N,Srivastava T S. Synthesis characterization and cytotoxic studies of diamine and diimine palladium(Ⅱ) complexes of diethyldithiocarbamate and binding of these and analogous platinum(Ⅱ) complexes with DNA[J].Inorg Chem Acta,1989;166:135
, 百拇医药
6,Gravina A,Pasini A,Pinciroli E,et al.Synthesis and evaluation of biological activity of binuclear cisplatin analogues with polyoxypropylenc α,ω-diamines as the bridging groups[J].Inorg Chem Acta,1989;157:165
7,Amar C.Catalytic activity study of some copper(Ⅱ) histidine-contaiting dipetide complexes on aqueous superoxide ion dismutation[J].J Inorg Biochem,1982;17:325
8,齐树民编.药理学进展[M].北京:人民卫生出版社,1985:12,319
9,Ong C W.Antitumor antibiotics drug design.Part 1:Synthesis α,o-chloro-2-methoxy-9-triethylenetetraa-mino-acridine iron complexes which binds to DNA and causes strand scissioring in vitro[J].Inorg chem Acta,1986;123:221
(2000-05-20 收稿), 百拇医药