二甲基亚砜和右旋糖酐对脐血造血细胞的低温保护作用
作者:许遵鹏 廖灿 刘斌 辜少玲
单位:广州市妇婴医院 广州脐血库 广州,510180
关键词:脐带血;造血细胞;低温保存;二甲基亚砜;右旋糖酐
临床血液学杂志000602 摘要 目的:探讨液氮保存中联合低温保护剂二甲基亚砜和右旋糖酐对造血细胞的保护作用和不同冻存时间对造血细胞活力的影响。方法:通过测定冻存前后总有核细胞数(TNC)、细胞活率、造血祖细胞集落生成情况,反映冻存后造血细胞损失情况及增殖能力。结果:40例脐血冻存后细胞活率平均为91.5%,TNC、粒-巨噬细胞集落形成单位、红系爆增式集落形成单位、混合集落生成单位平均回收率分别为95.0%、86.7%、81.8%、84.4%。不同保存时间细胞活率,TNC、祖细胞回收率差异均无显著性意义(P>0.05)。结论:联合保护剂对造血细胞有良好保护作用,适合于建立脐血库长期低温保存造血细胞。长期冻存造血细胞的效果与冻存时间无密切关系。
, http://www.100md.com
The cryoprotective effect of cord blood hematopoietic
cells with Dimethyl Sulfoxide and Dextran
XU Zun-peng LIAO Can LIU Bin GU Shao-ling
(Guangzhou Maternal Neonatal Hospital,Guangzhou 510180)
Abstract Objective:To study the protection of combined cryoprotectant (Dimethyl Sulfoxide and Dextran) to cord blood(CB)hematopoietic cells stored in liquid nitrogen and the change of viability of hematopoietic cells in different cryopreserved time.Method:The number of total nucleated cells(TNC),progenitor cell colony-forming and the viability of cells were tested before and after cryopreservation.Result:The average viability of 40 cryopreserved CB was 91.5%.The recovery rate of TNC,granulocyte-macrophage colony-forming units(CFU-GM),erythroid burst-forming units(BFU-E),granulocyte-erythroid-macrophage-megakaryocyte colony-forming units(CFU-GEMM) was respectively 95.0%,86.7%,81.8%,84.4%.The viability of cells and the recovery rate of TNC,CFU-GM,BFU-E,CFU-GEMM were nonsignificant(P>0.05) in different cryopreserved time.Conclusion:It proved that the combined cryoprotectant (Dimethyl Sulfoxide and Dextran) has a good effect on cryopreserved cord blood hematopoietic cells and is suitable to establish CB bank and cryopreserve hematopoietic cells for long-term.The effect of hematopoietic cells cryopreservation is not related to cryopreserved time.
, 百拇医药
Key words Cord blood Hematopoietic cells Cryopreservation Dimethyl Sulfoxide Dextran
为更广泛地开展脐血造血干细胞移植及建立脐血库,需长期低温保存脐血造血干、祖细胞。脐血低温冻存是为了保持造血干、祖细胞活性,使脐血干、祖细胞移植能长期重建患者造血及免疫功能〔1〕。使用有效的低温保护剂是低温冷冻的一个关键方面。本文探讨二甲基亚砜(DMSO)与右旋糖酐(Dextran)组成的联合保护剂,在脐血造血细胞低温保存中的效用和不同冻存时间对造血细胞活性的影响。
1 材料与方法
1.1 材料来源
40例脐血标本均来自本院产科健康产妇,均足月分娩且无并发症。采用ACD-B抗凝采血袋(上海
, 百拇医药
本课题为广东省科委、广州市科委、省卫生厅“五个一工程”重点课题(No 96-Z-64-1和99-Z-008-01)血液中心提供)按文献〔1〕方法采集。
1.2 保存方法
有核细胞计数采用Coulter-JT血细胞计数仪检测。脐血分离方法〔2〕按1∶4加入6%的HES(美国Dupont、pharma)经两步离心分离后,收集剩余白膜层脐血于冷冻袋中,测定细胞活率、总有核细胞数(TNC)和祖细胞产率,分离后脐血终体积为22~40 ml。
液氮保存方法〔2〕采用联合低温保护剂,由DMSO(Sigma)与10%Dextran(ABBOTT)等体积混匀放4℃备用。低温保护剂与分离后脐血按1∶4(DMSO终浓度为10%)在冷冻袋内混匀放4℃平衡10~20 min后上程序降温仪(PLANER KRYO 10)降温,以-1℃/min从4℃降至-40℃,再以-5℃/min从-40℃降至-100℃,取出放入液氮中长期保存。
, 百拇医药
样本冻存3个月、6个月、9个月和12个月后,每个时间点各抽10例样本复温,42℃水浴,2 min内解冻完毕。解冻后立即抽3 ml脐血,1 ml测定细胞活率和有核细胞计数,2 ml加入1∶2体积的5%白蛋白和等体积的10%Dextran离心10 min(1 400 r/min)洗去DMSO,然后用10%Dextran调至2 ml,测定祖细胞产率。
祖细胞培养采用甲基纤维素半固体培养法〔3〕,体系包括干细胞因子(SCF,50 μg/L,Pepro Tech)、粒系集落刺激因子(G-CSF,200 μg/L,日本麒麟)、促红细胞生成素(EPO,1 000 U/L,日本麒麟)、白介素-3(IL-3,10 μg/L,PeproTech)、30%马血清、1%甲基纤维素(Sigma)。在2 ml培养体系中加入2×105有核细胞后放37℃、5%CO2及饱和湿度条件下培养14 d,计数粒-巨噬细胞集落形成单位(CFU-GM),红系爆增式集落形成单位(BFU-E),混合集落生成单位(CFU-GEMM)。
, http://www.100md.com
细胞活率测定以台盼蓝拒染率试验。
1.3 统计学方法
不同冻存时间各指标回收率及细胞活率比较经反正弦转换后用方差分析。
2 结果
40例脐血冻存前后有关参数见表1。
不同保存时间细胞活率、TNC、CFU-GM、BFU-E、CFU-GEMM回收率见表2。
表1 40例脐血冻存前后有关活力指标 活力指标
冷冻前(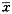 ±s)
±s)
复温后(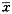 ±s)
±s)
, http://www.100md.com
回收率(%)
细胞活率(%)
97.4±1.9
91.5±6.0
TNC(×109)
1.150±0.310
1.092±0.222
95.0
CFU-GM(×105)
10.607±5.431
9.196±6.698
, 百拇医药
86.7
BFU-E(×105)
7.322±5.968
5.989±3.768
81.8
CFU-GEMM(×105)
0.806±0.778
0.680±0.870
84.4
表2 不同保存时间的细胞活率及TNC、祖细胞平均回收率测值%,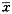 ±s 时间(月)
±s 时间(月)
, http://www.100md.com
例数
细胞活率
TNC回收率
祖细胞回收率
CFU-GM
BFU-E
CFU-GEMM
3
10
94.1±3.4
96.8±3.0
89.4±9.0
82.1±10.5
, http://www.100md.com
89.5±7.2
6
10
90.7±5.0
93.2±4.5
86.8±10.4
84.2±9.0
82.3±12.5
9
10
91.2±6.1
95.9±4.0
, 百拇医药 87.1±8.4
80.7±8.0
85.2±9.9
12
10
90.2±6.8
94.1±5.0
83.4±7.4
80.1±9.4
80.5±10.0
表2可见,不同保存时间的细胞活率、TNC、CFU-GM、BFU-E、CFU-GEMM回收率比较P>0.05。
, 百拇医药
3 讨论
脐血液氮保存使用的低温保护剂有多种,国内研究报道多采用DMSO、HES、RPMI1640、AB型血清或人白蛋白等组成的联合低温保护剂〔4,5〕。此联合保护剂与脐血按1∶1混合,用量大,使冻存体积增加1倍,占用空间大,增加贮存费用,且操作烦琐,也可能增加造血细胞的损失。低温保存剂DMSO有毒性〔6〕,移植时回输大量DMSO将对患者造成不良反应,尤其对婴幼儿更为突出。本文采用DMSO和Dextran组成的联合保护剂冻存脐血造血细胞,保护剂用量少(1/4),冻存体积小,节省贮存费用;操作简便,便于快速冷冻及复温,有利于降低冷冻与复温过程造成造血细胞的损伤。回输DMSO量少,可降低低温保护剂对患者造成的不良反应。
Dextran是一种非穿透性低温保护剂,在冷冻过程中可减少细胞内冰晶的形成,复温时还可以减轻由于渗透压改变而引起的细胞肿胀,Dextran和DMSO的联合使用能发挥相加或协同低温保护作用。40例脐血低温冻存后细胞活率平均为91.5%。TNC、CFU-GM、BFU-E、CFU-GEMM平均回收率分别为95.0%、86.7%、81.8%、84.4%。此法冻存脐血保持高的细胞活率和增殖能力,保护剂对造血细胞具有良好的保护作用。
, 百拇医药
Broxmeyer等〔7〕的研究显示,保存数周与10年的脐血的CFU-GM、BFU-E、CFU-GEMM回收率差别无显著意义。笔者将脐血保存3个月、6个月、9个月、12个月后复温,不同保存时间细胞活率、TNC、CFU-GM、BFU-E、CFU-GEMM回收率5项检测指标差异均无显著性意义。此联合保护剂保存脐血造血细胞效果稳定,脐血造血细胞长期保存的效果与冻存时间无密切关系。这种保护剂在脐血液氮保存中对造血细胞有良好的保护作用,用量少,节省开支,操作简便,适合于建立脐血库批量冻存造血细胞。
参考文献
1,Campos L,Roubi N,Guyotat D,et al.Definition of optimal conditions for collection and cryopreservation of umbilical cord blood hematopoietic cells.Cryobiology,1995,32:511~515
, http://www.100md.com
2,Rubinstein P,Dobrila L,Rosenfield R E,et al.Processing and cryopreservation of placental/umbilical cord blood for unrelated bone marrow reconstitution.Proc Natl Acad Sci USA,1995,92:10119~10122
3,裴雪涛,王立生,徐黎,等.造血生长因子对脐血CD34+细胞的体外扩增作用.中华血液学杂志,1996,17:304~307
4,朱为国,邢献志,吴霭,等.人脐血造血干细胞深低温保存效果观察.中华血液学杂志,1994,15:201~202
5,张林生,陆道培.脐血造血细胞分离和冻存的研究.第三军医大学学报,1996,18:495~497
, 百拇医药
6,Newton I,Charbord P,Schaal J P,et al.Toward cord blood banking:Density separation and cryopreservation of cord blood progenitors.Exp Hematol,1993,21:671~674
7,Broxmeyer H E,Cooper S.High-efficieny recovery of immature hematopoietic progenitor cells with extensive proliferative capacity from human cord blood cryopreserved for 10 years.Clin Exp Immunol,1997,107(Suppl 1):45~53
(收稿 2000-03-05), 百拇医药
单位:广州市妇婴医院 广州脐血库 广州,510180
关键词:脐带血;造血细胞;低温保存;二甲基亚砜;右旋糖酐
临床血液学杂志000602 摘要 目的:探讨液氮保存中联合低温保护剂二甲基亚砜和右旋糖酐对造血细胞的保护作用和不同冻存时间对造血细胞活力的影响。方法:通过测定冻存前后总有核细胞数(TNC)、细胞活率、造血祖细胞集落生成情况,反映冻存后造血细胞损失情况及增殖能力。结果:40例脐血冻存后细胞活率平均为91.5%,TNC、粒-巨噬细胞集落形成单位、红系爆增式集落形成单位、混合集落生成单位平均回收率分别为95.0%、86.7%、81.8%、84.4%。不同保存时间细胞活率,TNC、祖细胞回收率差异均无显著性意义(P>0.05)。结论:联合保护剂对造血细胞有良好保护作用,适合于建立脐血库长期低温保存造血细胞。长期冻存造血细胞的效果与冻存时间无密切关系。
, http://www.100md.com
The cryoprotective effect of cord blood hematopoietic
cells with Dimethyl Sulfoxide and Dextran
XU Zun-peng LIAO Can LIU Bin GU Shao-ling
(Guangzhou Maternal Neonatal Hospital,Guangzhou 510180)
Abstract Objective:To study the protection of combined cryoprotectant (Dimethyl Sulfoxide and Dextran) to cord blood(CB)hematopoietic cells stored in liquid nitrogen and the change of viability of hematopoietic cells in different cryopreserved time.Method:The number of total nucleated cells(TNC),progenitor cell colony-forming and the viability of cells were tested before and after cryopreservation.Result:The average viability of 40 cryopreserved CB was 91.5%.The recovery rate of TNC,granulocyte-macrophage colony-forming units(CFU-GM),erythroid burst-forming units(BFU-E),granulocyte-erythroid-macrophage-megakaryocyte colony-forming units(CFU-GEMM) was respectively 95.0%,86.7%,81.8%,84.4%.The viability of cells and the recovery rate of TNC,CFU-GM,BFU-E,CFU-GEMM were nonsignificant(P>0.05) in different cryopreserved time.Conclusion:It proved that the combined cryoprotectant (Dimethyl Sulfoxide and Dextran) has a good effect on cryopreserved cord blood hematopoietic cells and is suitable to establish CB bank and cryopreserve hematopoietic cells for long-term.The effect of hematopoietic cells cryopreservation is not related to cryopreserved time.
, 百拇医药
Key words Cord blood Hematopoietic cells Cryopreservation Dimethyl Sulfoxide Dextran
为更广泛地开展脐血造血干细胞移植及建立脐血库,需长期低温保存脐血造血干、祖细胞。脐血低温冻存是为了保持造血干、祖细胞活性,使脐血干、祖细胞移植能长期重建患者造血及免疫功能〔1〕。使用有效的低温保护剂是低温冷冻的一个关键方面。本文探讨二甲基亚砜(DMSO)与右旋糖酐(Dextran)组成的联合保护剂,在脐血造血细胞低温保存中的效用和不同冻存时间对造血细胞活性的影响。
1 材料与方法
1.1 材料来源
40例脐血标本均来自本院产科健康产妇,均足月分娩且无并发症。采用ACD-B抗凝采血袋(上海
, 百拇医药
本课题为广东省科委、广州市科委、省卫生厅“五个一工程”重点课题(No 96-Z-64-1和99-Z-008-01)血液中心提供)按文献〔1〕方法采集。
1.2 保存方法
有核细胞计数采用Coulter-JT血细胞计数仪检测。脐血分离方法〔2〕按1∶4加入6%的HES(美国Dupont、pharma)经两步离心分离后,收集剩余白膜层脐血于冷冻袋中,测定细胞活率、总有核细胞数(TNC)和祖细胞产率,分离后脐血终体积为22~40 ml。
液氮保存方法〔2〕采用联合低温保护剂,由DMSO(Sigma)与10%Dextran(ABBOTT)等体积混匀放4℃备用。低温保护剂与分离后脐血按1∶4(DMSO终浓度为10%)在冷冻袋内混匀放4℃平衡10~20 min后上程序降温仪(PLANER KRYO 10)降温,以-1℃/min从4℃降至-40℃,再以-5℃/min从-40℃降至-100℃,取出放入液氮中长期保存。
, 百拇医药
样本冻存3个月、6个月、9个月和12个月后,每个时间点各抽10例样本复温,42℃水浴,2 min内解冻完毕。解冻后立即抽3 ml脐血,1 ml测定细胞活率和有核细胞计数,2 ml加入1∶2体积的5%白蛋白和等体积的10%Dextran离心10 min(1 400 r/min)洗去DMSO,然后用10%Dextran调至2 ml,测定祖细胞产率。
祖细胞培养采用甲基纤维素半固体培养法〔3〕,体系包括干细胞因子(SCF,50 μg/L,Pepro Tech)、粒系集落刺激因子(G-CSF,200 μg/L,日本麒麟)、促红细胞生成素(EPO,1 000 U/L,日本麒麟)、白介素-3(IL-3,10 μg/L,PeproTech)、30%马血清、1%甲基纤维素(Sigma)。在2 ml培养体系中加入2×105有核细胞后放37℃、5%CO2及饱和湿度条件下培养14 d,计数粒-巨噬细胞集落形成单位(CFU-GM),红系爆增式集落形成单位(BFU-E),混合集落生成单位(CFU-GEMM)。
, http://www.100md.com
细胞活率测定以台盼蓝拒染率试验。
1.3 统计学方法
不同冻存时间各指标回收率及细胞活率比较经反正弦转换后用方差分析。
2 结果
40例脐血冻存前后有关参数见表1。
不同保存时间细胞活率、TNC、CFU-GM、BFU-E、CFU-GEMM回收率见表2。
表1 40例脐血冻存前后有关活力指标 活力指标
冷冻前(
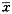 ±s)
±s)复温后(
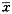 ±s)
±s), http://www.100md.com
回收率(%)
细胞活率(%)
97.4±1.9
91.5±6.0
TNC(×109)
1.150±0.310
1.092±0.222
95.0
CFU-GM(×105)
10.607±5.431
9.196±6.698
, 百拇医药
86.7
BFU-E(×105)
7.322±5.968
5.989±3.768
81.8
CFU-GEMM(×105)
0.806±0.778
0.680±0.870
84.4
表2 不同保存时间的细胞活率及TNC、祖细胞平均回收率测值%,
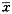 ±s 时间(月)
±s 时间(月), http://www.100md.com
例数
细胞活率
TNC回收率
祖细胞回收率
CFU-GM
BFU-E
CFU-GEMM
3
10
94.1±3.4
96.8±3.0
89.4±9.0
82.1±10.5
, http://www.100md.com
89.5±7.2
6
10
90.7±5.0
93.2±4.5
86.8±10.4
84.2±9.0
82.3±12.5
9
10
91.2±6.1
95.9±4.0
, 百拇医药 87.1±8.4
80.7±8.0
85.2±9.9
12
10
90.2±6.8
94.1±5.0
83.4±7.4
80.1±9.4
80.5±10.0
表2可见,不同保存时间的细胞活率、TNC、CFU-GM、BFU-E、CFU-GEMM回收率比较P>0.05。
, 百拇医药
3 讨论
脐血液氮保存使用的低温保护剂有多种,国内研究报道多采用DMSO、HES、RPMI1640、AB型血清或人白蛋白等组成的联合低温保护剂〔4,5〕。此联合保护剂与脐血按1∶1混合,用量大,使冻存体积增加1倍,占用空间大,增加贮存费用,且操作烦琐,也可能增加造血细胞的损失。低温保存剂DMSO有毒性〔6〕,移植时回输大量DMSO将对患者造成不良反应,尤其对婴幼儿更为突出。本文采用DMSO和Dextran组成的联合保护剂冻存脐血造血细胞,保护剂用量少(1/4),冻存体积小,节省贮存费用;操作简便,便于快速冷冻及复温,有利于降低冷冻与复温过程造成造血细胞的损伤。回输DMSO量少,可降低低温保护剂对患者造成的不良反应。
Dextran是一种非穿透性低温保护剂,在冷冻过程中可减少细胞内冰晶的形成,复温时还可以减轻由于渗透压改变而引起的细胞肿胀,Dextran和DMSO的联合使用能发挥相加或协同低温保护作用。40例脐血低温冻存后细胞活率平均为91.5%。TNC、CFU-GM、BFU-E、CFU-GEMM平均回收率分别为95.0%、86.7%、81.8%、84.4%。此法冻存脐血保持高的细胞活率和增殖能力,保护剂对造血细胞具有良好的保护作用。
, 百拇医药
Broxmeyer等〔7〕的研究显示,保存数周与10年的脐血的CFU-GM、BFU-E、CFU-GEMM回收率差别无显著意义。笔者将脐血保存3个月、6个月、9个月、12个月后复温,不同保存时间细胞活率、TNC、CFU-GM、BFU-E、CFU-GEMM回收率5项检测指标差异均无显著性意义。此联合保护剂保存脐血造血细胞效果稳定,脐血造血细胞长期保存的效果与冻存时间无密切关系。这种保护剂在脐血液氮保存中对造血细胞有良好的保护作用,用量少,节省开支,操作简便,适合于建立脐血库批量冻存造血细胞。
参考文献
1,Campos L,Roubi N,Guyotat D,et al.Definition of optimal conditions for collection and cryopreservation of umbilical cord blood hematopoietic cells.Cryobiology,1995,32:511~515
, http://www.100md.com
2,Rubinstein P,Dobrila L,Rosenfield R E,et al.Processing and cryopreservation of placental/umbilical cord blood for unrelated bone marrow reconstitution.Proc Natl Acad Sci USA,1995,92:10119~10122
3,裴雪涛,王立生,徐黎,等.造血生长因子对脐血CD34+细胞的体外扩增作用.中华血液学杂志,1996,17:304~307
4,朱为国,邢献志,吴霭,等.人脐血造血干细胞深低温保存效果观察.中华血液学杂志,1994,15:201~202
5,张林生,陆道培.脐血造血细胞分离和冻存的研究.第三军医大学学报,1996,18:495~497
, 百拇医药
6,Newton I,Charbord P,Schaal J P,et al.Toward cord blood banking:Density separation and cryopreservation of cord blood progenitors.Exp Hematol,1993,21:671~674
7,Broxmeyer H E,Cooper S.High-efficieny recovery of immature hematopoietic progenitor cells with extensive proliferative capacity from human cord blood cryopreserved for 10 years.Clin Exp Immunol,1997,107(Suppl 1):45~53
(收稿 2000-03-05), 百拇医药