hIL-3突变体在大肠杆菌中的表达及纯化
作者:王燕 毛琼国 万瑛 纪贤文 刘昕
单位:王燕(第三军医大学基础医学部分子遗传学教研室,重庆 400038);毛琼国(第三军医大学基础医学部分子遗传学教研室,重庆 400038);万瑛(第三军医大学基础医学部分子遗传学教研室,重庆 400038);纪贤文(第三军医大学基础医学部分子遗传学教研室,重庆 400038);刘昕(第三军医大学基础医学部分子遗传学教研室,重庆 400038)
关键词:hIL-3突变体;大肠杆菌;纯化
第三军医大学学报000110
提要 目的:将天然型hIL-3蛋白经定点突变为hIL-3突变体蛋白,并在大肠杆菌中表达及纯化。方法:超声破碎细菌得到包涵体,经DEAEFastFlow,SephaecrylS-200HR等层析步骤纯化。结果:经以上一系列纯化,得到的人IL-3突变体蛋白纯度达90%,比活性为7.3×104U/ml,总回收率为100%。结论:突变体hIL-3在大肠杆菌中得到高效表达,并获得高纯度、高活性的hIL-3蛋白。
, 百拇医药
中图法分类号 R378.21;R394 文献标识码 A
文章编号:1000-5404(2000)01-0033-03
Purification of hIL-3 mutant highly expressed in E.coli
WANG Yan,MAO Qiong-guo,WAN Yin,JI Xian-wen,LIU Xin
(Department of Molecular Biology,Faculty of Basic Medical Sciences,Third Military Medical University,Chongqing 400038)
Abstract Objective:To purify hIL-3 mutant from E.coli.Methods:Inclusion bodies were collected after the breakage of bacteria.Then the pure hIL-3 mutant was obtained by DEAE sepharose fast flow and sephacry1S-200HR.Results:The purity of the product was about 90%.In vitro test of the TF-1 cells showed the relative activity of hIL-3 mutant was 7.3× 104 unit/ml.The total recovery of this protocol was approximately 100%.Conclusion:hIL-3 mutant is highly expressed in E.coli.hIL-3 protein with high purity and activity is obtained.
, 百拇医药
Key words human IL-3 mutant; E.coli;purification
IL-3是由活化T细胞产生的一种多集落刺激因子,具有刺激造血细胞增殖分化和免疫调节功能。临床用于治疗造血障碍性疾病,收到较好的效果。hIL-3cDNA克隆化[1,2]及表达[3]为基础研究和临床应用提供了条件。但天然型IL-3蛋白由于自身的原因难以在大肠杆菌中高效表达,本室在前期工作中成功的将天然型的hIL-3蛋白进行改造,得到突变体hIL-3蛋白在大肠杆菌中高效表达。我们在此基础上,进一步对突变体hIL-3的纯化方法进行了研究。
1 材料与方法
1.1 质粒与菌株
pSM53MVhIL-3质粒,由本室构建,宿主菌为E.coliTAP106,由第四军医大学陈苏民教授惠赠。
, http://www.100md.com
1.2 TF-I细胞
购于上海细胞所。
1.3 试剂SephaecrylS-200HR,DEAE Sepharose Fast Flow购自美国Sigma公司。
1.4 诱导表达
将含有pSM53MVhIL-3的大肠杆菌经30℃增菌培养,再转42℃诱导表达,收获菌体。
1.5 包涵体处理
超声破碎细菌细胞,释放包涵体。离心10000r/min15min,弃上清,将沉淀用0.7mol/L尿素,0.5%TritonX-100,10mmol/LEDTA反复洗涤处理得纯化包涵体。包涵体用8mol/L盐酸胍含20mmol/Lβ-疏基乙醇溶解变性(pH8.5)。
, 百拇医药
1.6 复性
将变性溶解的hIL-3突变体蛋白离心10000r/min,15min,清除不溶性杂质,上清直接用复性液,50mmol/L Tris-HCl pH8.5,5mmol/L GSH(还原型谷胱甘肽),5mmol/L GSSG(氧化型谷胱甘肽),1mmol/LPMSF稀释,使蛋白质终浓度不超过100μg/ml,尿素终浓度为0.5~1mol/L,置4℃10h。超滤浓缩后用50mmol NaAc-HAC pH 6.0透析平衡。
1.6.1 DEAE Sepharose Fast Flow离子交换层析 用50mmolNaAc-HACpH6.0平衡DEAE离子交换层析(1.5cm×20cm)。将浓缩平衡后蛋白柱液上柱,流速为1.5ml/min,收集Runthrough部分。
1.6.2 SephaecrylS-200HR凝胶过滤 将DEAE离子交换层析纯化的样品浓缩后,然后过Sephaecry1S-200HR凝胶过滤层析柱(1.5cm×50cm)进一步纯化,流速0.5ml/min,收集峰并进行SDS-PAGE分析。
, 百拇医药
1.7 活性测定
用IL-3依赖细胞株测活性[3]。
2 结果
2.1 包涵体处理
包涵体变性溶解后SDS-PAGE分析,结果见图1,其蛋白纯度约为90%。
图1 纯化hIL-3突变体蛋白SDS-PAGE分析
Fig1 SDS-PAGE analysis of purified hIL-3 matution protein
Lane1:mw standards;Lane2:Protein purified by sephaecryls-200HR;Lane 3:Protein purified by DEAE FF;Lane4:Inclusion body
, http://www.100md.com
2.2 DEAESepharoseFastF1ow离子交换层析
经诱导表达后得到hIL-3突变体蛋白,过DEAESepharoseFastFlow离子交换层析柱,见图2,hIL-3突变体蛋白主要集中在Run-through部分。
图2 hIL-3突变体DEAE Sepharose Fast Flow离子交换层析
Fig2 DEAE sepharose fast flow chromatography of
hIL-3 mutation protein
2.3 SephaecrylS-200HR凝胶过滤层析
, http://www.100md.com
收集DEAE Fast Flow分离的hIL-3进一步用Sephaecry1S-200HR凝胶过滤层析分离,取主峰进行SDS-PAGE分析鉴定其纯度达90%,见图3。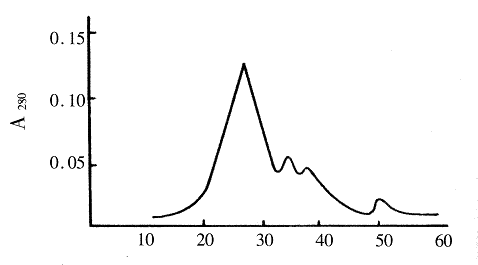
图3 hIL-3突变体Sephaecry1S-200 HR凝胶过滤层析
Fig3 Sephaecry IS-200 HR gel filtration of hIL-3
mutation protein
2.4 活性测定
用IL-3依赖细胞株检测经离子交换,凝胶过滤层析纯化处理的包涵体,后得到大肠杆菌表达有活性的hIL-3突变体蛋白,纯度90%以上的纯品,见表1。
, http://www.100md.com
表1 hIL-3突变体的活性测定
Tab1 Activity of hiL-3 mutant Purificativity stages
Activity(×104U/ml)
Inclusion bodies
1.2
DEAF FE
5.7
Sephaecry1 S-200HR
7.3
3 讨论
, http://www.100md.com
在E.coli中高效表达的外源基因产物都以包涵体的形式存在于其胞浆中[4],暗视野显微镜下可见细胞浆内有折光性很强的颗粒。在进行hIL-3突变体纯化过程中,都将遇到包涵体的处理。因包涵体中除含有重组蛋白以外,还含有细菌杂蛋白,遗传物质及内毒素等成分。利用包涵体密度大,水不溶性特点,通过离心技术和低浓度变性剂0.7mol/L尿素,0.01%Triton-100反复洗涤,抽提大部分可溶性杂质,使包涵体纯度达到90%,其中比较了含1mg/ml脱氧胆酸钠(DOC)的TE溶液洗涤包涵体,效果不如0.7mol/L尿素,DOC的TE溶液可部分溶解包涵体,导致较多的hIL-3蛋白丢失。而包涵体的变性溶解及复性才是获得有效纯化的关键。包涵体变性溶解后,需要在适当条件下才能使重组蛋白正确折迭恢复活性,同时去除了一些不溶性沉淀的杂蛋白质,复性效率与蛋白质终浓度高低及复性速度有关。蛋白质浓度过高或复性过快都会造成复性不完全而形成较多沉淀。从我们的实验中发现复性时蛋白浓度应控制在100μg/ml以下,hIL-3突变体蛋白稀释到一定浓度才能避免分子间相互作用,相互缠绕。复性过程中尿素浓度保持在0.5~1mol/L之间,使其既能维持hIL-3突变体蛋白溶解性,又不干扰蛋白的折迭复性。直至将盐酸胍完全复性后溶液经10000r/min离心,去除不溶性沉淀,上清再经离子交换层析和凝胶过滤层析,得到hIL-3突变体蛋白纯品。用TF-1细胞检测其活性,达到7.3×104U/ml。此纯化结果表明我们在E.coli中变效表达了具有活性的hIL-3突变体,并初步解决了在大肠杆菌中表达hIL-3突变体的复性及纯化问题,得到了高纯度,高活性的hIL-3突变体,从而为hIL-3突变体的大规模生产,临床应用提供了条件,也为IL-3蛋白质的结构的研究提供了基础。
, 百拇医药
作者简介:王燕(1961.12),女,江苏省常州市人,博士,讲师,主要从事蛋白质工程方面的研究,发表论文3篇。电话:(023)68752257
参考文献
[1]Merlin S,Rowold E,Abegg A,et al.Phage presentation and affinity selection of a deletion mutant of human interleukin-3[J].Appl iochem Biotechnol,1997,67(3):199-201.
[2]Phillips J A,Lopez A F,Milton S E,et al.Synthesis and expression of the gene encoding human interleukin-3[J].Gene,1989,84(2):501-503.
[3]王燕,朱锡华 ,万瑛 ,等.人白细胞介素-3突变体的构建及在大肠杆菌中表达的研究[J].中国免疫学杂志,1999,(1):12-14.
[4]Kane J F,Harthey D L.Formation of recombinant Protein inclusion bodies in Escherichia coli[J].Trends in Biotechology,1988,6(1):95-96.
收稿日期:1999-04-15
修回日期:1999-10-15, 百拇医药
单位:王燕(第三军医大学基础医学部分子遗传学教研室,重庆 400038);毛琼国(第三军医大学基础医学部分子遗传学教研室,重庆 400038);万瑛(第三军医大学基础医学部分子遗传学教研室,重庆 400038);纪贤文(第三军医大学基础医学部分子遗传学教研室,重庆 400038);刘昕(第三军医大学基础医学部分子遗传学教研室,重庆 400038)
关键词:hIL-3突变体;大肠杆菌;纯化
第三军医大学学报000110
提要 目的:将天然型hIL-3蛋白经定点突变为hIL-3突变体蛋白,并在大肠杆菌中表达及纯化。方法:超声破碎细菌得到包涵体,经DEAEFastFlow,SephaecrylS-200HR等层析步骤纯化。结果:经以上一系列纯化,得到的人IL-3突变体蛋白纯度达90%,比活性为7.3×104U/ml,总回收率为100%。结论:突变体hIL-3在大肠杆菌中得到高效表达,并获得高纯度、高活性的hIL-3蛋白。
, 百拇医药
中图法分类号 R378.21;R394 文献标识码 A
文章编号:1000-5404(2000)01-0033-03
Purification of hIL-3 mutant highly expressed in E.coli
WANG Yan,MAO Qiong-guo,WAN Yin,JI Xian-wen,LIU Xin
(Department of Molecular Biology,Faculty of Basic Medical Sciences,Third Military Medical University,Chongqing 400038)
Abstract Objective:To purify hIL-3 mutant from E.coli.Methods:Inclusion bodies were collected after the breakage of bacteria.Then the pure hIL-3 mutant was obtained by DEAE sepharose fast flow and sephacry1S-200HR.Results:The purity of the product was about 90%.In vitro test of the TF-1 cells showed the relative activity of hIL-3 mutant was 7.3× 104 unit/ml.The total recovery of this protocol was approximately 100%.Conclusion:hIL-3 mutant is highly expressed in E.coli.hIL-3 protein with high purity and activity is obtained.
, 百拇医药
Key words human IL-3 mutant; E.coli;purification
IL-3是由活化T细胞产生的一种多集落刺激因子,具有刺激造血细胞增殖分化和免疫调节功能。临床用于治疗造血障碍性疾病,收到较好的效果。hIL-3cDNA克隆化[1,2]及表达[3]为基础研究和临床应用提供了条件。但天然型IL-3蛋白由于自身的原因难以在大肠杆菌中高效表达,本室在前期工作中成功的将天然型的hIL-3蛋白进行改造,得到突变体hIL-3蛋白在大肠杆菌中高效表达。我们在此基础上,进一步对突变体hIL-3的纯化方法进行了研究。
1 材料与方法
1.1 质粒与菌株
pSM53MVhIL-3质粒,由本室构建,宿主菌为E.coliTAP106,由第四军医大学陈苏民教授惠赠。
, http://www.100md.com
1.2 TF-I细胞
购于上海细胞所。
1.3 试剂SephaecrylS-200HR,DEAE Sepharose Fast Flow购自美国Sigma公司。
1.4 诱导表达
将含有pSM53MVhIL-3的大肠杆菌经30℃增菌培养,再转42℃诱导表达,收获菌体。
1.5 包涵体处理
超声破碎细菌细胞,释放包涵体。离心10000r/min15min,弃上清,将沉淀用0.7mol/L尿素,0.5%TritonX-100,10mmol/LEDTA反复洗涤处理得纯化包涵体。包涵体用8mol/L盐酸胍含20mmol/Lβ-疏基乙醇溶解变性(pH8.5)。
, 百拇医药
1.6 复性
将变性溶解的hIL-3突变体蛋白离心10000r/min,15min,清除不溶性杂质,上清直接用复性液,50mmol/L Tris-HCl pH8.5,5mmol/L GSH(还原型谷胱甘肽),5mmol/L GSSG(氧化型谷胱甘肽),1mmol/LPMSF稀释,使蛋白质终浓度不超过100μg/ml,尿素终浓度为0.5~1mol/L,置4℃10h。超滤浓缩后用50mmol NaAc-HAC pH 6.0透析平衡。
1.6.1 DEAE Sepharose Fast Flow离子交换层析 用50mmolNaAc-HACpH6.0平衡DEAE离子交换层析(1.5cm×20cm)。将浓缩平衡后蛋白柱液上柱,流速为1.5ml/min,收集Runthrough部分。
1.6.2 SephaecrylS-200HR凝胶过滤 将DEAE离子交换层析纯化的样品浓缩后,然后过Sephaecry1S-200HR凝胶过滤层析柱(1.5cm×50cm)进一步纯化,流速0.5ml/min,收集峰并进行SDS-PAGE分析。
, 百拇医药
1.7 活性测定
用IL-3依赖细胞株测活性[3]。
2 结果
2.1 包涵体处理
包涵体变性溶解后SDS-PAGE分析,结果见图1,其蛋白纯度约为90%。

图1 纯化hIL-3突变体蛋白SDS-PAGE分析
Fig1 SDS-PAGE analysis of purified hIL-3 matution protein
Lane1:mw standards;Lane2:Protein purified by sephaecryls-200HR;Lane 3:Protein purified by DEAE FF;Lane4:Inclusion body
, http://www.100md.com
2.2 DEAESepharoseFastF1ow离子交换层析
经诱导表达后得到hIL-3突变体蛋白,过DEAESepharoseFastFlow离子交换层析柱,见图2,hIL-3突变体蛋白主要集中在Run-through部分。

图2 hIL-3突变体DEAE Sepharose Fast Flow离子交换层析
Fig2 DEAE sepharose fast flow chromatography of
hIL-3 mutation protein
2.3 SephaecrylS-200HR凝胶过滤层析
, http://www.100md.com
收集DEAE Fast Flow分离的hIL-3进一步用Sephaecry1S-200HR凝胶过滤层析分离,取主峰进行SDS-PAGE分析鉴定其纯度达90%,见图3。

图3 hIL-3突变体Sephaecry1S-200 HR凝胶过滤层析
Fig3 Sephaecry IS-200 HR gel filtration of hIL-3
mutation protein
2.4 活性测定
用IL-3依赖细胞株检测经离子交换,凝胶过滤层析纯化处理的包涵体,后得到大肠杆菌表达有活性的hIL-3突变体蛋白,纯度90%以上的纯品,见表1。
, http://www.100md.com
表1 hIL-3突变体的活性测定
Tab1 Activity of hiL-3 mutant Purificativity stages
Activity(×104U/ml)
Inclusion bodies
1.2
DEAF FE
5.7
Sephaecry1 S-200HR
7.3
3 讨论
, http://www.100md.com
在E.coli中高效表达的外源基因产物都以包涵体的形式存在于其胞浆中[4],暗视野显微镜下可见细胞浆内有折光性很强的颗粒。在进行hIL-3突变体纯化过程中,都将遇到包涵体的处理。因包涵体中除含有重组蛋白以外,还含有细菌杂蛋白,遗传物质及内毒素等成分。利用包涵体密度大,水不溶性特点,通过离心技术和低浓度变性剂0.7mol/L尿素,0.01%Triton-100反复洗涤,抽提大部分可溶性杂质,使包涵体纯度达到90%,其中比较了含1mg/ml脱氧胆酸钠(DOC)的TE溶液洗涤包涵体,效果不如0.7mol/L尿素,DOC的TE溶液可部分溶解包涵体,导致较多的hIL-3蛋白丢失。而包涵体的变性溶解及复性才是获得有效纯化的关键。包涵体变性溶解后,需要在适当条件下才能使重组蛋白正确折迭恢复活性,同时去除了一些不溶性沉淀的杂蛋白质,复性效率与蛋白质终浓度高低及复性速度有关。蛋白质浓度过高或复性过快都会造成复性不完全而形成较多沉淀。从我们的实验中发现复性时蛋白浓度应控制在100μg/ml以下,hIL-3突变体蛋白稀释到一定浓度才能避免分子间相互作用,相互缠绕。复性过程中尿素浓度保持在0.5~1mol/L之间,使其既能维持hIL-3突变体蛋白溶解性,又不干扰蛋白的折迭复性。直至将盐酸胍完全复性后溶液经10000r/min离心,去除不溶性沉淀,上清再经离子交换层析和凝胶过滤层析,得到hIL-3突变体蛋白纯品。用TF-1细胞检测其活性,达到7.3×104U/ml。此纯化结果表明我们在E.coli中变效表达了具有活性的hIL-3突变体,并初步解决了在大肠杆菌中表达hIL-3突变体的复性及纯化问题,得到了高纯度,高活性的hIL-3突变体,从而为hIL-3突变体的大规模生产,临床应用提供了条件,也为IL-3蛋白质的结构的研究提供了基础。
, 百拇医药
作者简介:王燕(1961.12),女,江苏省常州市人,博士,讲师,主要从事蛋白质工程方面的研究,发表论文3篇。电话:(023)68752257
参考文献
[1]Merlin S,Rowold E,Abegg A,et al.Phage presentation and affinity selection of a deletion mutant of human interleukin-3[J].Appl iochem Biotechnol,1997,67(3):199-201.
[2]Phillips J A,Lopez A F,Milton S E,et al.Synthesis and expression of the gene encoding human interleukin-3[J].Gene,1989,84(2):501-503.
[3]王燕,朱锡华 ,万瑛 ,等.人白细胞介素-3突变体的构建及在大肠杆菌中表达的研究[J].中国免疫学杂志,1999,(1):12-14.
[4]Kane J F,Harthey D L.Formation of recombinant Protein inclusion bodies in Escherichia coli[J].Trends in Biotechology,1988,6(1):95-96.
收稿日期:1999-04-15
修回日期:1999-10-15, 百拇医药