结核分支杆菌katG蛋白的高表达与纯化
作者:张文宏 翁心华 季朝能 毛裕民 陈一平 陈澍 邬祥惠
单位:张文宏 翁心华 陈一平 陈澍 邬祥惠(200040 上海医科大学附属华山医院传染病科);季朝能 毛裕民(复旦大学遗传学研究所)
关键词:分支杆菌,结核;katG;基因表达;蛋白纯化
中华传染病杂志000105【摘要】目的 表达与纯化结核分支杆菌katG蛋白,为深入研究异烟肼耐药机制奠定基础。方法 将含有katG基因的pET24b-katG表达载体转化大肠杆菌BL21(DE3) 菌株,在异丙基硫代-β-D-半乳糖苷(IPTG)诱导下表达,分别对不同诱导时间的表达产 物进行SDS-PAGE以及考马斯亮蓝染 色。获得稳定的高表达菌株后采用Xpress TM蛋白纯化系统对超声破菌液进行纯 化。最后对纯化产物进行过氧化氢酶活性的初步检测。结果 对诱导后的重组大肠杆菌菌液进行十二烷基硫酸钠-聚丙烯酰胺凝 胶电泳(SDS-PAGE)以及考马斯亮蓝染色后 发现相对分子质量约为80 000。表达蛋白量约占总蛋白量的17.7%。对重组katG基因表达产 物进行 纯化的结果发现,以350 mmol/L咪唑洗脱时的纯化效果最理想,蛋白纯度可达90%以上。对 表达产物进行过氧化氢酶活性初步检测证明,重组的katG基因产物具有过氧化氢酶活性。[ HTH〗结论 通过pET24b-katG表达质粒转化大肠杆菌可获得基因重组的katG高表 达菌株,表达产物具有一定酶活性,经纯化后可达到较高的纯度。
, 百拇医药
Overexpression and purification of catalase-peroxidase katG from mycobacterium tuberculosis
ZHANG Wenhong WENG Xinhua JI Chaoneng et al.
(Departme nt of Infect ious Diseases, Huashan Hospital, Shanghai Medical University, Shanghai 200040, China)
【Abstract】Objective To express and purify the catala se-peroxidase katG gene from mycobacterium tuberculosis. Methods Plasmid pET24b containing katG was transferred into com petent Escherichia coli and katG gene was overexpressed by the challenge of isopropylthio-β-D-glactoside(IPTG). The expression of katG protein was on e-step purified by Xpress systemTM. Furthermore, the catalase activity of katG protein was preliminarily detec ted. Results The recombinant escherichia coli produced katG p rotein in large quantities, accounting for 17.7% of total cell protein. The mole cular mass of katG protein was estimated to be 80 000 by sodium dodecyl sulfate -polyacrylamide gradient gel electrophresis (SDS-PAGE). It was found that imidazole at the concentration of 350 mmol/L could elute the katG protein most efficiently and yield the final preparation at greater than 90% purity. Th e katG protein was preliminarily detected to have the activity of catalase. Conclusions The stable katG overexpressing recombinant Escherichi a coli can be constructed by the plasmid pET24b containing katG gene. The reco mbinant strain can produce katG protein with catalase activity and the product o f which can be purified into higher activity.
, 百拇医药
【Key words】Mycobacterium tuberculosis; katG ; Gene expression; Protein purification
异烟肼(INH)是一种最经济有效的抗痨药,几乎所有的抗痨方案中均包括IN H。结核分支杆菌编码的katG基因的突变可致结核分支杆菌对INH 产生耐药性[1]。自1992年以来,对于katG基因变异或缺失造成分支杆菌对异烟肼 耐药的基因水平研究已较为深入[1,2],有必要在蛋白水平对耐药机制进行进一步 研究。本研究将含有katG基因的pET24b-katG表达载体转化埃希大肠杆菌BL21(DE3)菌株 ,获得稳定的高表达菌株后进一步对表达产物进行了纯化,并对纯化产物进行了酶活性的初 步检测。
材料与方法
一、材料
, http://www.100md.com
(一) 质粒与菌株 表达质粒pET24b-katG与埃希大肠杆菌BL21(DE3)由复旦大学遗传学研究 所惠赠。
(二) 试剂 XpressTM蛋白纯化系统为美国Invitrogen公司产品;异丙基-β-D硫代 半乳糖苷(IPTG)为华美生物工程公司产品;其他主要生化试剂为美国Sigma公司产品或国内A R级产品。
二、方法
(一) 表达载体的转化与基因产物的表达 将表达质粒pET24b-katG转化用氯化钙处理法得 到的感受态大肠杆菌BL21(DE3)菌株,将菌株涂于含卡那霉素的LB平板上,30°C过夜培养。 挑取抗卡那霉素的菌株接种于20 ml的LB培养基(加入20%的葡萄糖0.2 ml,浓度50 mg/ml的 卡那霉素40 μl,浓度20 mg/ml的氯霉素34 μl)中,37°C,160 r/min振摇过夜。取3 ml过 夜培养物种入100 ml的LB培养基(含20%的葡萄糖1 ml,浓度10 mg/ml的卡那霉素400 μ l, 浓度20 mg/ml的氯霉素170 μl)中,37°C以160 r/min振摇,每20 min测定1次A60 0值,直至A600值到达0.4~0.5(勿超过0.5)。随后每100 ml LB培养基中 加入1 mol/L IPTG 400 μl,分别在加入IPTG后的第2、3、4、5、6 h收集菌液。将菌液在4 °C下,5 000 g,离心5 min,弃上清。将沉淀物以10 ml缓冲液(50 mmol/L Tris.Cl, pH 8 .0, 2 mmol/L EDTA, 0.1% Triton X-100)重新悬浮,加入溶菌酶(100 μg/ml)。在冰浴中以中等强度超 声破菌,每次10 s,共3次,破菌后,4°C, 离心5 min,收集上清液备用。
, 百拇医药
(二) 表达产物的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测 参照文献[3] 进行。收集IPTG诱导后的菌液10 μl,与 加样液10 μl混合,100°C水浴,3 min后点样,25 mA恒流通电进行SDS-PAGE。电泳后以 考马斯亮蓝染色15 min,然后以脱色液脱色观察结果。
(三) 表达产物的纯化 采用Xpress TM蛋白纯化系统进行纯化。用无菌双蒸水悬 浮树 脂纯化柱3次。加入7 ml结合液(20 mmol/L磷酸钠,500 mmol/L氯化钠,pH 7.8),以及经IP TG不同时间诱导后产量最高的破菌液上清5 ml,重新悬浮纯化柱。反复轻摇混合2 min。静 置10 min,吸弃上清,再加入破菌液上清5 ml重复以上步骤。以4 ml结合液重新悬浮纯 化柱 ,温和摇动混合2 min,静置沉淀,吸弃上清,共3次。再以冲洗缓冲液(20 mmol/L磷酸钠, 500 mmol/L氯化钠,pH 6.0)洗4次,分别以不同浓度的咪唑洗脱液(50、200、350、500 mmo l/L)各5 ml加入柱中,收集不同洗脱浓度的洗脱液。将洗脱液进行SDS-PAGE。将纯化后的 蛋白以85%的硫酸胺沉淀,离心后将沉淀物以无菌双蒸水溶解,4°C透析过夜。透析产物加 入甘油(40%)后贮藏于-80°C的环境下。
, 百拇医药
(四) 过氧化氢酶活性测定 对破菌液上清进行过氧化氢酶活性的初步测定。用磷酸盐(K2 HPO4+KH2PO4,0.1 mol/L)与NaCl(2 mol/L)的缓冲液配制10%的Tween 80溶液,取 5 ml 与30%的双氧水5 ml混合。分对照管与katG管,在katG管内加入不同容积的含pET-katG表达 质粒的菌株破菌上清(20、40、80、160 μl),对照管 则加入含pET空载体的菌株破菌上清,10 min后观察气泡产生情况。如产生大量气泡则提示 酶活性较佳。
结 果
一、重组katG蛋白的诱导表达以及产物的鉴定分析
将含有katG基因的pET24b-katG表达质粒转化大肠杆菌,在IPTG诱导下表达,分别对不同诱 导时间的表达产物进行SDS-PAGE以及考马斯亮蓝染色,可在相对分子质量80 000处见一诱 导表达带 (图1)。比较不同诱导时间的表达产量可以发现,经诱导2 h后的表达产量已达到峰值。在其 后蛋白纯化中即可选取该诱导时间的产物。对此诱导表达带进行黑度密度自动扫描分析,此 处表达蛋白量约占总菌体蛋白量的17.7%。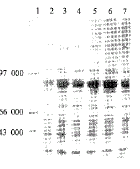
, http://www.100md.com
1:蛋白分子量标准; 2:IPGT诱导0 h;3:IPGT诱导2 h;
4:IPGT诱导3 h;5:IPGT诱导4 h; 6:IPGT诱导5 h;7:IPGT
诱导6 h
图1 KatG的表达
二、重组katG基因表达产物的纯化结果
采用Xpress TM蛋白纯化系统进行纯化发现,分别以不同浓度的咪唑洗脱液(50、 200、350、500 mmol/L)洗脱纯化柱后,所收集的洗脱液再次进行SDS-PAGE分析。结果发现 ,以350 mmol/L咪唑洗脱后纯化的效率最高,通过SDS-PAGE黑度密度自动扫描分析可以发 现纯化率可达90%以上。
, http://www.100md.com
1:蛋白分子量标准; 2:破菌上清;3:50 mmol/L咪唑洗脱液洗脱产物;4:200 mmol/L咪唑洗脱液洗脱产物;5:350 mmol/L咪唑洗脱液洗脱产物;6:500 mmol/L咪唑洗脱液洗脱产物
图2 KatG蛋白的纯化
三、对katG基因表达产物的过氧化氢酶活性测定结果
在过氧化氢反应系统中加入不同容积的破菌上清(20、40、80、160、320 μl),比较气泡产 生情况,发现加入含pET-katG表达质粒的菌株破菌上清的各管均有气泡产生,且均较对照 管为明显,而以加入量为160 μl与320 μl的反应管产生气泡最为显著。提示重组katG表达 产物具有过氧化氢酶活性。
讨 论
结核分支杆菌的katG在INH的抗结核作用机制中起着关键作用。研究表明INH实际上是一个 药物前体,需经结核分支杆菌过氧化氢酶-过氧化物酶活化后 才发挥抗结核作用,而katG则由katG基因所编码[4]。有研究 通过质粒将katG基因转移到INH耐药菌株胞内,可令其对INH重新恢复敏感性。而对结核分支 杆菌的临床耐异烟肼菌株进行katG基因分析亦发现该基因的缺失或突变是引起耐药的主要原 因[5]。然而对于katG如何活化INH以及katG发生变异后导致耐药的 确切机制仍然 不清,特别是近年来对于不同突变位点变异对药物敏感性的影响程度颇有争议[6] ,因此在蛋白水平研究katG的作用环节与耐药机制,以及比较不同位点 基因突变对酶结构与活性的影响等方面进行研究可深入了解INH耐药的发生机制,进而可 能在蛋白水平找到消除耐药的途径。由于结核分支杆菌生长较缓,而且具有较强的传染性, 长期以来在提取结核分支杆菌蛋白进行研究的进展较缓。本研究通过基因重组的katG表达载 体转化到大肠杆菌后产生高表达的katG蛋白,相对分子质量约为80 000,表达量可占总菌体 蛋白的17.7%。表明该基因重组的菌株为katG的高表达菌株,对表达产物进行初步过氧化氢 酶活性研究验证了其酶活性。进一步对表达产物进行纯化后可提取到纯度超过90%的katG蛋 白。本研究为进一步研究katG蛋白、katG对异烟肼的活化机制以及为检测katG变异耐药菌株 奠定基础,并且对深入阐明INH的耐药产生机制与寻求消除耐药的方法有较大的意义。
, http://www.100md.com
本课题为国家自然科学基金资助项目(39970672)
参考文献
1,Rouse DA, Li Z, Bai GH, et al. Characterization of the KatG a nd inhA genes of isoniazid-resistant clinical isolates of Mycobacterium tuber culosis. Antimicrob agents Chemother, 1995, 39:2472-2477.
2,Zhang Y, Heym B, Allen B, et al. The catalase-peroxidase gene and isoniazid resistance of Mycobacterium tuberculosis. Nature, 1992, 358:591-593.
, http://www.100md.com
3,Sambrook J, Fritsch EF, Maniatis T,著. 分子克隆实验指南.金冬雁,黎孟枫,译. 第2版. 北京:科学出版社,1992.
4,Telenti A, Honore N, Bernasconi C, et al. Genotypic assessment of isoniazid a nd rifampin resistance in Mycobacterium tuberculosis: a blind study at refer ence laboratory level. J Clin Microbiol, 1997, 35:719-723.
5,Stoeckle MY, Guan L, Riegler N, et al. Catalase-peroxidase gene sequences in isoniazid-sensitive and resisitant stains of,M.tuberculosis from New York City. JID, 1993,168:1063.
6,Rouse DA, DeVito JA, Li Z, et al. Site-directed mutagenesis of the K atG gene of mycobarterium tuberculosis: effects on catalase-peroxidase activite s and isoniazid resistance. Mol Microbiol. 1996, 22:583-592.
收稿日期:1999-10-26, 百拇医药
单位:张文宏 翁心华 陈一平 陈澍 邬祥惠(200040 上海医科大学附属华山医院传染病科);季朝能 毛裕民(复旦大学遗传学研究所)
关键词:分支杆菌,结核;katG;基因表达;蛋白纯化
中华传染病杂志000105【摘要】目的 表达与纯化结核分支杆菌katG蛋白,为深入研究异烟肼耐药机制奠定基础。方法 将含有katG基因的pET24b-katG表达载体转化大肠杆菌BL21(DE3) 菌株,在异丙基硫代-β-D-半乳糖苷(IPTG)诱导下表达,分别对不同诱导时间的表达产 物进行SDS-PAGE以及考马斯亮蓝染 色。获得稳定的高表达菌株后采用Xpress TM蛋白纯化系统对超声破菌液进行纯 化。最后对纯化产物进行过氧化氢酶活性的初步检测。结果 对诱导后的重组大肠杆菌菌液进行十二烷基硫酸钠-聚丙烯酰胺凝 胶电泳(SDS-PAGE)以及考马斯亮蓝染色后 发现相对分子质量约为80 000。表达蛋白量约占总蛋白量的17.7%。对重组katG基因表达产 物进行 纯化的结果发现,以350 mmol/L咪唑洗脱时的纯化效果最理想,蛋白纯度可达90%以上。对 表达产物进行过氧化氢酶活性初步检测证明,重组的katG基因产物具有过氧化氢酶活性。[ HTH〗结论 通过pET24b-katG表达质粒转化大肠杆菌可获得基因重组的katG高表 达菌株,表达产物具有一定酶活性,经纯化后可达到较高的纯度。
, 百拇医药
Overexpression and purification of catalase-peroxidase katG from mycobacterium tuberculosis
ZHANG Wenhong WENG Xinhua JI Chaoneng et al.
(Departme nt of Infect ious Diseases, Huashan Hospital, Shanghai Medical University, Shanghai 200040, China)
【Abstract】Objective To express and purify the catala se-peroxidase katG gene from mycobacterium tuberculosis. Methods Plasmid pET24b containing katG was transferred into com petent Escherichia coli and katG gene was overexpressed by the challenge of isopropylthio-β-D-glactoside(IPTG). The expression of katG protein was on e-step purified by Xpress systemTM. Furthermore, the catalase activity of katG protein was preliminarily detec ted. Results The recombinant escherichia coli produced katG p rotein in large quantities, accounting for 17.7% of total cell protein. The mole cular mass of katG protein was estimated to be 80 000 by sodium dodecyl sulfate -polyacrylamide gradient gel electrophresis (SDS-PAGE). It was found that imidazole at the concentration of 350 mmol/L could elute the katG protein most efficiently and yield the final preparation at greater than 90% purity. Th e katG protein was preliminarily detected to have the activity of catalase. Conclusions The stable katG overexpressing recombinant Escherichi a coli can be constructed by the plasmid pET24b containing katG gene. The reco mbinant strain can produce katG protein with catalase activity and the product o f which can be purified into higher activity.
, 百拇医药
【Key words】Mycobacterium tuberculosis; katG ; Gene expression; Protein purification
异烟肼(INH)是一种最经济有效的抗痨药,几乎所有的抗痨方案中均包括IN H。结核分支杆菌编码的katG基因的突变可致结核分支杆菌对INH 产生耐药性[1]。自1992年以来,对于katG基因变异或缺失造成分支杆菌对异烟肼 耐药的基因水平研究已较为深入[1,2],有必要在蛋白水平对耐药机制进行进一步 研究。本研究将含有katG基因的pET24b-katG表达载体转化埃希大肠杆菌BL21(DE3)菌株 ,获得稳定的高表达菌株后进一步对表达产物进行了纯化,并对纯化产物进行了酶活性的初 步检测。
材料与方法
一、材料
, http://www.100md.com
(一) 质粒与菌株 表达质粒pET24b-katG与埃希大肠杆菌BL21(DE3)由复旦大学遗传学研究 所惠赠。
(二) 试剂 XpressTM蛋白纯化系统为美国Invitrogen公司产品;异丙基-β-D硫代 半乳糖苷(IPTG)为华美生物工程公司产品;其他主要生化试剂为美国Sigma公司产品或国内A R级产品。
二、方法
(一) 表达载体的转化与基因产物的表达 将表达质粒pET24b-katG转化用氯化钙处理法得 到的感受态大肠杆菌BL21(DE3)菌株,将菌株涂于含卡那霉素的LB平板上,30°C过夜培养。 挑取抗卡那霉素的菌株接种于20 ml的LB培养基(加入20%的葡萄糖0.2 ml,浓度50 mg/ml的 卡那霉素40 μl,浓度20 mg/ml的氯霉素34 μl)中,37°C,160 r/min振摇过夜。取3 ml过 夜培养物种入100 ml的LB培养基(含20%的葡萄糖1 ml,浓度10 mg/ml的卡那霉素400 μ l, 浓度20 mg/ml的氯霉素170 μl)中,37°C以160 r/min振摇,每20 min测定1次A60 0值,直至A600值到达0.4~0.5(勿超过0.5)。随后每100 ml LB培养基中 加入1 mol/L IPTG 400 μl,分别在加入IPTG后的第2、3、4、5、6 h收集菌液。将菌液在4 °C下,5 000 g,离心5 min,弃上清。将沉淀物以10 ml缓冲液(50 mmol/L Tris.Cl, pH 8 .0, 2 mmol/L EDTA, 0.1% Triton X-100)重新悬浮,加入溶菌酶(100 μg/ml)。在冰浴中以中等强度超 声破菌,每次10 s,共3次,破菌后,4°C, 离心5 min,收集上清液备用。
, 百拇医药
(二) 表达产物的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测 参照文献[3] 进行。收集IPTG诱导后的菌液10 μl,与 加样液10 μl混合,100°C水浴,3 min后点样,25 mA恒流通电进行SDS-PAGE。电泳后以 考马斯亮蓝染色15 min,然后以脱色液脱色观察结果。
(三) 表达产物的纯化 采用Xpress TM蛋白纯化系统进行纯化。用无菌双蒸水悬 浮树 脂纯化柱3次。加入7 ml结合液(20 mmol/L磷酸钠,500 mmol/L氯化钠,pH 7.8),以及经IP TG不同时间诱导后产量最高的破菌液上清5 ml,重新悬浮纯化柱。反复轻摇混合2 min。静 置10 min,吸弃上清,再加入破菌液上清5 ml重复以上步骤。以4 ml结合液重新悬浮纯 化柱 ,温和摇动混合2 min,静置沉淀,吸弃上清,共3次。再以冲洗缓冲液(20 mmol/L磷酸钠, 500 mmol/L氯化钠,pH 6.0)洗4次,分别以不同浓度的咪唑洗脱液(50、200、350、500 mmo l/L)各5 ml加入柱中,收集不同洗脱浓度的洗脱液。将洗脱液进行SDS-PAGE。将纯化后的 蛋白以85%的硫酸胺沉淀,离心后将沉淀物以无菌双蒸水溶解,4°C透析过夜。透析产物加 入甘油(40%)后贮藏于-80°C的环境下。
, 百拇医药
(四) 过氧化氢酶活性测定 对破菌液上清进行过氧化氢酶活性的初步测定。用磷酸盐(K2 HPO4+KH2PO4,0.1 mol/L)与NaCl(2 mol/L)的缓冲液配制10%的Tween 80溶液,取 5 ml 与30%的双氧水5 ml混合。分对照管与katG管,在katG管内加入不同容积的含pET-katG表达 质粒的菌株破菌上清(20、40、80、160 μl),对照管 则加入含pET空载体的菌株破菌上清,10 min后观察气泡产生情况。如产生大量气泡则提示 酶活性较佳。
结 果
一、重组katG蛋白的诱导表达以及产物的鉴定分析
将含有katG基因的pET24b-katG表达质粒转化大肠杆菌,在IPTG诱导下表达,分别对不同诱 导时间的表达产物进行SDS-PAGE以及考马斯亮蓝染色,可在相对分子质量80 000处见一诱 导表达带 (图1)。比较不同诱导时间的表达产量可以发现,经诱导2 h后的表达产量已达到峰值。在其 后蛋白纯化中即可选取该诱导时间的产物。对此诱导表达带进行黑度密度自动扫描分析,此 处表达蛋白量约占总菌体蛋白量的17.7%。

, http://www.100md.com
1:蛋白分子量标准; 2:IPGT诱导0 h;3:IPGT诱导2 h;
4:IPGT诱导3 h;5:IPGT诱导4 h; 6:IPGT诱导5 h;7:IPGT
诱导6 h
图1 KatG的表达
二、重组katG基因表达产物的纯化结果
采用Xpress TM蛋白纯化系统进行纯化发现,分别以不同浓度的咪唑洗脱液(50、 200、350、500 mmol/L)洗脱纯化柱后,所收集的洗脱液再次进行SDS-PAGE分析。结果发现 ,以350 mmol/L咪唑洗脱后纯化的效率最高,通过SDS-PAGE黑度密度自动扫描分析可以发 现纯化率可达90%以上。

, http://www.100md.com
1:蛋白分子量标准; 2:破菌上清;3:50 mmol/L咪唑洗脱液洗脱产物;4:200 mmol/L咪唑洗脱液洗脱产物;5:350 mmol/L咪唑洗脱液洗脱产物;6:500 mmol/L咪唑洗脱液洗脱产物
图2 KatG蛋白的纯化
三、对katG基因表达产物的过氧化氢酶活性测定结果
在过氧化氢反应系统中加入不同容积的破菌上清(20、40、80、160、320 μl),比较气泡产 生情况,发现加入含pET-katG表达质粒的菌株破菌上清的各管均有气泡产生,且均较对照 管为明显,而以加入量为160 μl与320 μl的反应管产生气泡最为显著。提示重组katG表达 产物具有过氧化氢酶活性。
讨 论
结核分支杆菌的katG在INH的抗结核作用机制中起着关键作用。研究表明INH实际上是一个 药物前体,需经结核分支杆菌过氧化氢酶-过氧化物酶活化后 才发挥抗结核作用,而katG则由katG基因所编码[4]。有研究 通过质粒将katG基因转移到INH耐药菌株胞内,可令其对INH重新恢复敏感性。而对结核分支 杆菌的临床耐异烟肼菌株进行katG基因分析亦发现该基因的缺失或突变是引起耐药的主要原 因[5]。然而对于katG如何活化INH以及katG发生变异后导致耐药的 确切机制仍然 不清,特别是近年来对于不同突变位点变异对药物敏感性的影响程度颇有争议[6] ,因此在蛋白水平研究katG的作用环节与耐药机制,以及比较不同位点 基因突变对酶结构与活性的影响等方面进行研究可深入了解INH耐药的发生机制,进而可 能在蛋白水平找到消除耐药的途径。由于结核分支杆菌生长较缓,而且具有较强的传染性, 长期以来在提取结核分支杆菌蛋白进行研究的进展较缓。本研究通过基因重组的katG表达载 体转化到大肠杆菌后产生高表达的katG蛋白,相对分子质量约为80 000,表达量可占总菌体 蛋白的17.7%。表明该基因重组的菌株为katG的高表达菌株,对表达产物进行初步过氧化氢 酶活性研究验证了其酶活性。进一步对表达产物进行纯化后可提取到纯度超过90%的katG蛋 白。本研究为进一步研究katG蛋白、katG对异烟肼的活化机制以及为检测katG变异耐药菌株 奠定基础,并且对深入阐明INH的耐药产生机制与寻求消除耐药的方法有较大的意义。
, http://www.100md.com
本课题为国家自然科学基金资助项目(39970672)
参考文献
1,Rouse DA, Li Z, Bai GH, et al. Characterization of the KatG a nd inhA genes of isoniazid-resistant clinical isolates of Mycobacterium tuber culosis. Antimicrob agents Chemother, 1995, 39:2472-2477.
2,Zhang Y, Heym B, Allen B, et al. The catalase-peroxidase gene and isoniazid resistance of Mycobacterium tuberculosis. Nature, 1992, 358:591-593.
, http://www.100md.com
3,Sambrook J, Fritsch EF, Maniatis T,著. 分子克隆实验指南.金冬雁,黎孟枫,译. 第2版. 北京:科学出版社,1992.
4,Telenti A, Honore N, Bernasconi C, et al. Genotypic assessment of isoniazid a nd rifampin resistance in Mycobacterium tuberculosis: a blind study at refer ence laboratory level. J Clin Microbiol, 1997, 35:719-723.
5,Stoeckle MY, Guan L, Riegler N, et al. Catalase-peroxidase gene sequences in isoniazid-sensitive and resisitant stains of,M.tuberculosis from New York City. JID, 1993,168:1063.
6,Rouse DA, DeVito JA, Li Z, et al. Site-directed mutagenesis of the K atG gene of mycobarterium tuberculosis: effects on catalase-peroxidase activite s and isoniazid resistance. Mol Microbiol. 1996, 22:583-592.
收稿日期:1999-10-26, 百拇医药