乙型肝炎病毒DNA转染细胞的一种内参标准:真核细胞报告基因SEAP
作者:姚 忻 何建文 袁正宏 何丽芳
单位:200032 上海医科大学医学分子病毒学卫生部重点实验室
关键词:分泌性碱性磷酸酶基因;转染;肝癌细胞系;乙型肝炎病毒
New Page 1【摘要】 目的 建立用真核细胞报告基因SEAP转染人肝癌细胞系(Huh7、HepG2)及鸡肝癌细胞系(LMH)的表达系统,供研究HBV基因功能应用。方法 分别将带有分泌性碱性磷酸酶(SEAP)报告基因的pBC12/ PL/ SEAP及pBC12/ CMV/ SEAP质粒DNA转染Huh7、HepG2及LMH细胞,并用pBC12/ CMV/ SEAP质粒DNA与S基因区变异体的克隆HBV DNA共转染HepG2细胞。培养后收取细胞培养液,用ELISA法测定SEAP活性及HBsAg。结果 在三种细胞中pBC12/ CMV/ SEAP均可表达,以72小时表达的酶活性测定最为适宜;而pBC12/ PL/ SEAP表达仅处于低水平。以SEAP表达量作为内参对HBsAg的表达量进行比较,发现S基因129L变异体表达HBsAg量显著高于野毒株。结论 SEAP作为内参具有快速简便,不需同位素及特殊仪器的优点,有较高的实用价值。
, http://www.100md.com
An internal control for transfection of hepatitis B virus gene: eukaryotic cell reporter gene SEAP
YAO Xin, HE Jianwen, YUAN Zhnghong, et al.
Department of Molecular Virology, Shanghai Medical University, 200032
【Abstract】 Objective To develop transfection and assay system of eukaryotic reporter gene (SEAP) in human hepatoma cell lines and chicken hepatoma cell line, as internal standard control for studies of hepatitis B virus gene function. Methods DNA from two plasmid consturcts (pBC12/PL/SEAP,pBC12/CMV/SEAP), were separately used to transfect Huh7, HepG2 and LMH cell lines and supernatant samples were collected from cultures and assayed for SEAP activity. DNA from cloned HBV contructs with mutation in the S region were used to cotransfect with the reporter gene. Results pBC12/CMV/SEAP could be exprexxed in hepatoma cell lines and reached a plateau 72 hours after transfection, whereas, pBC12/PL/SEAP was expressed at very low level. Cotransfection of DNA from cloned HBV constructs with mutation in the S region together with the DNA of reporter gene, showed that the expression level of SEAP could be sued as the internal control for the efficiency of transfection. Compared to the wild tpye virus, it was found that mutations in codons 145(Arginine) and 129 (Leucine) resulted in lower and higher level of HBsAg expression respevtively. Conclusion As an internal control, SEAP has the advantages of rapid, simple, and does not need isotopes and specical equiment. Therefore, this internal control can be used to study the structure and function of hepatitis B genome.
, 百拇医药
【Key words】 Secreted placental alkaline phosphatase Gene transfection Hepatoma cell lines Hepatitis B Virus
乙型肝炎病毒(HBV)迄今尚无常规的细胞培养系统,研究HBV基因的复制与表达均需采用转染肝癌细胞技术。细胞转染的结果常常受细胞的生长与存活状况、试剂的酸碱度、磷酸钙颗粒的大小等因素的影响,故每份样品转染效率不尽相同,可比性较差。为客观判断转入外源基因的表达情况,常采用与报告基因共转染或带有报告基因的重组质粒进行转染,通过对报告基因产物的测定作为每份标本转染效率的内参。报告基因中氯霉素乙酰基转移酶(CAT)、β-半乳糖苷酶(β-Gal)、荧光素酶(Luciferase)与人生长激素分泌蛋白等的表达产物常需要收集细胞并裂解提取产物,存在重复性差、检测费时价昂、或需用放射性底物及专用测定仪器等缺点。本文报道用一种真核细胞报告基因——人分泌性碱性磷酸酶(Secreted Placental Akline Phosphatase,SEAP)[1],在常用的肝癌细胞系(Huh7、HepG2及LMH)中的表达与测定技术,并探讨了用作HBV S基因片段变异体转染效率的参比效果。
, http://www.100md.com
材料与方法
一、传代肝癌细胞系
(一) 人肝癌细胞系Huh7[2] 由美国NIH Purcell实验室转赠,用含10%胎牛血清DMEM培养液培养,每隔5天以1∶2传代1次。
(二) 人肝癌细胞系HepG2 由德国海德堡癌研究中心Schaller教授实验室提供,细胞培养液同上。每隔3天以1∶2传代1次。
(三) 鸡肝癌细胞系LMH 由法国巴黎大学Kay博士惠赠,用10%胎牛血清的等体积混合F12及DMEM培养液培养,每隔3天以1∶3传代1次。
二、pBC12/PL/SEAP及pBC12/CMV/SEAP
, 百拇医药
由美国杜克大学Gullen博士惠赠质粒DNA。各用15μg质粒DNA转化大肠杆菌MC1061,筛选出AMPR阳性菌落,大量扩增,提取质粒DNA,用QIAGEN纯化试剂盒进行纯化,酒精沉淀保存。用前离心弃去酒精,用无菌的0.1×TE溶解并稀释至1mg/ml使用。
三、转染肝癌细胞系Huh7、HepG2及LMH
5ml细胞(1×106/ ml)在转染前24小时接种至60mm平皿,根据文献报道的钙沉淀法用pBC12/PL/SEAP或pBC12/CMV/SEAP DNA(20μg/皿)分别转染Huh7、HepG2及LMH细胞。转染后16小时洗去沉淀颗粒,换培养液,在培养30小时及72小时分别收取培养液,65°C加热2分钟灭活内源性磷酸酶,15 000r/ min离心2分钟,吸上清液-20°C保存。全部标本同时进行SEAP活性检测。对照细胞用鱼精DNA 20μg/皿进行转染,同样收取上清液,进行SEAP活性检测。
, 百拇医药
四、SEAP活性检测
取已处理的细胞培养上清液100μl加入100μl 2×SEAP缓冲液混匀后,移至酶标板孔,每一标本加入2孔。检测板置37°C 10分钟后,每孔加20μl新鲜配制并在37°C预温的底物(1pmol磷酸硝基苯酚),用波长405nm测A值。
五、p3.8Ⅱ,p3.8Ⅱ 129L及p3.8Ⅱ 145R
p3.8Ⅱ为以1.2倍HBVadr亚型全基因组插入pBST的重组质粒(由中国科学院上海生化所研究惠增)。p3.8Ⅱ 129L及p3.8Ⅱ 145R是用PCR扩增患者血清中HBV的全S基因产物,经测序证实分别为nt540A→T使第129位氨基酸密码子由CAA→CTA,谷氨酰胺→亮氨酸的变异体,与nt587G→A使第145位氨基酸密码子由GGA→AGA,甘氨酸→精氨酸的变异体,酶切后置换p3.8Ⅱ的S基因的相应片断,构建成其他基因片断与p3.8Ⅱ完全相同,仅有129L及145R变异的p3.8Ⅱ 129L及p3.8Ⅱ 145R重组质粒。
, 百拇医药
六、pBC12/CMV/SEAP与HBV重组质粒共转染HepG2细胞
按上述钙沉淀法转染细胞,每一细胞平皿中加入pBC12/CMV/SEAP 20μg与HBV重组质粒(p3.8Ⅱ或p3.8Ⅱ 129L、p3.8Ⅱ 145R)20μg进行共转染。37°C培养72小时后,收集培养上清液检测SEAP活性及HBsAg的表达量。
七、HBsAg的测定
采用Abbott EIA试剂盒测定。
结果
一、pBC12/PL/SEAP及pBC12/CMV/SEAP转染Huh7细胞,培养30小时后,pBC12/PL/SEAP转染Huh7细胞的培养上清液中SEAP表达量不高,A值与对照水平非常接近;pBC12/CMV/SEAP在Huh7细胞中表达的SEAP随时间延长呈现轻微上升趋势(图1)。取转染细胞培养72小时后的上清液检测,pBC12/PL/SEAP的表达仍处于低水平,而pBC12/CMV/SEAP表达的SEAP活性很高(图2)。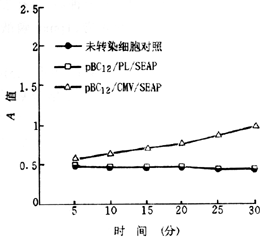
, 百拇医药
横座标为SEAP与酶底物作用的不同时间
图1 转染Huh7细胞培养30小时SEAP表达情况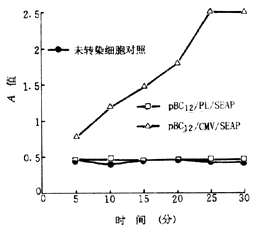
图2 转染Huh7细胞培养72小时SEAP表达情况
二、pBC12/PL/SEAP与pBC12/CMV/SEAP转染HepG2及LMH细胞后,72小时的细胞培养上清液SEAP检测,结果显示,pBC12/PL/SEAP与pBC12/CMV/SEAP在HepG2及LMH细胞中的表达情况与转染Huh7细胞的结果相似(图3、4)。可见,pBC12/CMV/SEAP在HepG2及LMH细胞中均可呈高水平表达。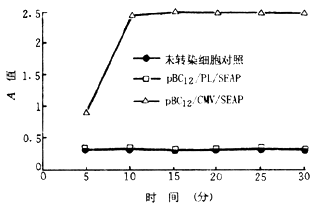
, 百拇医药
图3 转染LMH细胞培养72小时SEAP表达情况
三、pBC12/CMV/SEAP与HBV重组质粒(p3.8Ⅱ或p3.8Ⅱ 129L,p3.8Ⅱ 145R)共转染HepG2细胞。为进一步考核SEAP表达系统可否用作内参以研究HBV基因片段功能,进行了共转染实验。取共转染后72小时细胞培养上清液分别检测SEAP活性及HBsAg,结果两种产物均可表达(见表1)。
以p3.8Ⅱ质粒转染标本中SEAP的表达量为100%,分别计算其他标本表达SEAP量的百分比,作为校正系数。每份标本表达HBsAg的A值经校正后,即成为可互相比较的HBsAg A值(校正前后的A值见表1)。结果可见以Abbott试剂检测,p3.8Ⅱ145R表达的HBsAg明显低于p3.8Ⅱ,而p3.8Ⅱ129L表达的HBsAg量显著高于p3.8Ⅱ。重复3次,计算平均值及标准差分别为0.620±0.152(p3.8Ⅱ),1.106±0.095(p3.8Ⅱ 129L),0.224±0.067(p3.8 Ⅱ 145R)。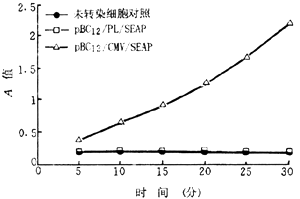
, 百拇医药
图4 转染HepG2细胞培养72小时SEAP表达情况
表1 pBC12/CMV/SEAP与HBV重组质粒共转染HepG2细胞表达SEAP与HBsAg的结果
72小时(A值)
SEAP
HBsAg
pBC12/CMV/SEAP+p3.8Ⅱ
1.207(100%)
0.513
pBC12/CMV/SEAP+p3.8Ⅱ 129L
, 百拇医药
0.683(57%)
0.997
1.43*
pBC12/CMV/SEAP+p3.8Ⅱ 145R
0.798(66%)
0.159
0.213*
*HBsAg纠正值=HBsAg A值+HBsAg A值(1—校正系数)讨论
为研究HBV基因的结构与功能,我们采用了细胞转染技术。目前国内外采用HBV DNA转染获得的体外增殖HBV的细胞培养系统有两大类型。一类是HBV基因整合并可持续产生HBV颗粒的稳定表达细胞系,如HepG2 2.215[3]及HepG2 T14[4]细胞系。另一类是用长于HBV全基因的病毒DNA短暂转染肝癌细胞系,不仅可表达病毒的抗原,还可获得病毒复制及HBV颗粒[5,6]。研究HBV各种变异株基因的结构与功能,短暂表达系统由于方法简单,出结果快,短期内可进行变异体比较,故更为适用。在应用短暂表达系统中的关键问题之一是各个标本间的可比性。建立应用HBV短暂转染试验中的内参标准系统可解决可比性问题。本室引进的SEAP系统曾被应用于多种细胞系,但尚无转染肝癌细胞系的研究。本文报道了用SEAP系统转染人肝癌细胞系及鸡肝癌细胞系的实验结果,证实SEAP系统可在上述细胞系中表达并确定了在本实验室条件下测定SEAP的最适时间及条件。由于其测定方法简便,快速,具有较高的实用价值。此外,因测定时不需要裂解细胞,还具有可保留转染的细胞供进一步研究细胞内HBV抗原表达及复制情况的优点。
, 百拇医药
实验证明SEAP作为内参标准系统可用于研究HBV基因片断的表达,因在转染的细胞培养中SEAP和HBsAg均可分别表达。此外,SEAP系统也不干扰HBeAg表达与HBV复制。
应用这一系统作为内参标准,对本室已发现的HBV S基因129L及145R变异株[7]表达HBsAg的情况进行研究,证实129L变异株表达的HBsAg值高于野毒株,而145R变异株表达的HBsAg值低于野毒株。由此可见,SEAP作为内参对客观判断转入细胞内的外源基因的表达情况具有实用价值。
本课题由美国中华医学基金资助(CMB Grant No.90-582)
参考文献
[1] Berger J, Hauber J, Hauber R, et al. Secreted placental alkaline phosphatase; A powerful new quantitative indicator of gene expression in eukaryotic cells. Gene, 1988,66:1.
, 百拇医药
[2] Nakabayashi H, Taketa K, Miyano K, et al. Growth of hepatoma cell lines with differentiaed functions in chemically defined medium. Cancer Res, 1986,42:3858.
[3] Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in HepG2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci, USA, 1987,84:1005.
[4] Sureau C, Romet-lemonne JL, Mullins JI, et al. Production of hepatitis B virus by a differential human hepatoma cell line after transfection with cloned circular HBV DNA. Cell, 1986,47:37.
, 百拇医药
[5] Chang GM, Jeng KS, Hu CP, et al. Production of hepatitis B virus in vitro by transient expression of cloned HBV DNA in hepatoma clell line. EMBO J, 1987,6:675.
[6] 闻玉梅,何丽芳,楼惠珍,等.克隆乙肝病毒DNA在HepG2细胞中的表达.中华医学杂志,1986,69:260.
[7] 何建文,吕睛,朱启,等.乙型肝炎疫苗免疫失败婴儿病毒表面抗原“a”决定族基因变异的研究.中华实验临床病毒学杂志,1996,10:308.
(收稿:1997-12-09 修回:1998-08-10), http://www.100md.com
单位:200032 上海医科大学医学分子病毒学卫生部重点实验室
关键词:分泌性碱性磷酸酶基因;转染;肝癌细胞系;乙型肝炎病毒
New Page 1【摘要】 目的 建立用真核细胞报告基因SEAP转染人肝癌细胞系(Huh7、HepG2)及鸡肝癌细胞系(LMH)的表达系统,供研究HBV基因功能应用。方法 分别将带有分泌性碱性磷酸酶(SEAP)报告基因的pBC12/ PL/ SEAP及pBC12/ CMV/ SEAP质粒DNA转染Huh7、HepG2及LMH细胞,并用pBC12/ CMV/ SEAP质粒DNA与S基因区变异体的克隆HBV DNA共转染HepG2细胞。培养后收取细胞培养液,用ELISA法测定SEAP活性及HBsAg。结果 在三种细胞中pBC12/ CMV/ SEAP均可表达,以72小时表达的酶活性测定最为适宜;而pBC12/ PL/ SEAP表达仅处于低水平。以SEAP表达量作为内参对HBsAg的表达量进行比较,发现S基因129L变异体表达HBsAg量显著高于野毒株。结论 SEAP作为内参具有快速简便,不需同位素及特殊仪器的优点,有较高的实用价值。
, http://www.100md.com
An internal control for transfection of hepatitis B virus gene: eukaryotic cell reporter gene SEAP
YAO Xin, HE Jianwen, YUAN Zhnghong, et al.
Department of Molecular Virology, Shanghai Medical University, 200032
【Abstract】 Objective To develop transfection and assay system of eukaryotic reporter gene (SEAP) in human hepatoma cell lines and chicken hepatoma cell line, as internal standard control for studies of hepatitis B virus gene function. Methods DNA from two plasmid consturcts (pBC12/PL/SEAP,pBC12/CMV/SEAP), were separately used to transfect Huh7, HepG2 and LMH cell lines and supernatant samples were collected from cultures and assayed for SEAP activity. DNA from cloned HBV contructs with mutation in the S region were used to cotransfect with the reporter gene. Results pBC12/CMV/SEAP could be exprexxed in hepatoma cell lines and reached a plateau 72 hours after transfection, whereas, pBC12/PL/SEAP was expressed at very low level. Cotransfection of DNA from cloned HBV constructs with mutation in the S region together with the DNA of reporter gene, showed that the expression level of SEAP could be sued as the internal control for the efficiency of transfection. Compared to the wild tpye virus, it was found that mutations in codons 145(Arginine) and 129 (Leucine) resulted in lower and higher level of HBsAg expression respevtively. Conclusion As an internal control, SEAP has the advantages of rapid, simple, and does not need isotopes and specical equiment. Therefore, this internal control can be used to study the structure and function of hepatitis B genome.
, 百拇医药
【Key words】 Secreted placental alkaline phosphatase Gene transfection Hepatoma cell lines Hepatitis B Virus
乙型肝炎病毒(HBV)迄今尚无常规的细胞培养系统,研究HBV基因的复制与表达均需采用转染肝癌细胞技术。细胞转染的结果常常受细胞的生长与存活状况、试剂的酸碱度、磷酸钙颗粒的大小等因素的影响,故每份样品转染效率不尽相同,可比性较差。为客观判断转入外源基因的表达情况,常采用与报告基因共转染或带有报告基因的重组质粒进行转染,通过对报告基因产物的测定作为每份标本转染效率的内参。报告基因中氯霉素乙酰基转移酶(CAT)、β-半乳糖苷酶(β-Gal)、荧光素酶(Luciferase)与人生长激素分泌蛋白等的表达产物常需要收集细胞并裂解提取产物,存在重复性差、检测费时价昂、或需用放射性底物及专用测定仪器等缺点。本文报道用一种真核细胞报告基因——人分泌性碱性磷酸酶(Secreted Placental Akline Phosphatase,SEAP)[1],在常用的肝癌细胞系(Huh7、HepG2及LMH)中的表达与测定技术,并探讨了用作HBV S基因片段变异体转染效率的参比效果。
, http://www.100md.com
材料与方法
一、传代肝癌细胞系
(一) 人肝癌细胞系Huh7[2] 由美国NIH Purcell实验室转赠,用含10%胎牛血清DMEM培养液培养,每隔5天以1∶2传代1次。
(二) 人肝癌细胞系HepG2 由德国海德堡癌研究中心Schaller教授实验室提供,细胞培养液同上。每隔3天以1∶2传代1次。
(三) 鸡肝癌细胞系LMH 由法国巴黎大学Kay博士惠赠,用10%胎牛血清的等体积混合F12及DMEM培养液培养,每隔3天以1∶3传代1次。
二、pBC12/PL/SEAP及pBC12/CMV/SEAP
, 百拇医药
由美国杜克大学Gullen博士惠赠质粒DNA。各用15μg质粒DNA转化大肠杆菌MC1061,筛选出AMPR阳性菌落,大量扩增,提取质粒DNA,用QIAGEN纯化试剂盒进行纯化,酒精沉淀保存。用前离心弃去酒精,用无菌的0.1×TE溶解并稀释至1mg/ml使用。
三、转染肝癌细胞系Huh7、HepG2及LMH
5ml细胞(1×106/ ml)在转染前24小时接种至60mm平皿,根据文献报道的钙沉淀法用pBC12/PL/SEAP或pBC12/CMV/SEAP DNA(20μg/皿)分别转染Huh7、HepG2及LMH细胞。转染后16小时洗去沉淀颗粒,换培养液,在培养30小时及72小时分别收取培养液,65°C加热2分钟灭活内源性磷酸酶,15 000r/ min离心2分钟,吸上清液-20°C保存。全部标本同时进行SEAP活性检测。对照细胞用鱼精DNA 20μg/皿进行转染,同样收取上清液,进行SEAP活性检测。
, 百拇医药
四、SEAP活性检测
取已处理的细胞培养上清液100μl加入100μl 2×SEAP缓冲液混匀后,移至酶标板孔,每一标本加入2孔。检测板置37°C 10分钟后,每孔加20μl新鲜配制并在37°C预温的底物(1pmol磷酸硝基苯酚),用波长405nm测A值。
五、p3.8Ⅱ,p3.8Ⅱ 129L及p3.8Ⅱ 145R
p3.8Ⅱ为以1.2倍HBVadr亚型全基因组插入pBST的重组质粒(由中国科学院上海生化所研究惠增)。p3.8Ⅱ 129L及p3.8Ⅱ 145R是用PCR扩增患者血清中HBV的全S基因产物,经测序证实分别为nt540A→T使第129位氨基酸密码子由CAA→CTA,谷氨酰胺→亮氨酸的变异体,与nt587G→A使第145位氨基酸密码子由GGA→AGA,甘氨酸→精氨酸的变异体,酶切后置换p3.8Ⅱ的S基因的相应片断,构建成其他基因片断与p3.8Ⅱ完全相同,仅有129L及145R变异的p3.8Ⅱ 129L及p3.8Ⅱ 145R重组质粒。
, 百拇医药
六、pBC12/CMV/SEAP与HBV重组质粒共转染HepG2细胞
按上述钙沉淀法转染细胞,每一细胞平皿中加入pBC12/CMV/SEAP 20μg与HBV重组质粒(p3.8Ⅱ或p3.8Ⅱ 129L、p3.8Ⅱ 145R)20μg进行共转染。37°C培养72小时后,收集培养上清液检测SEAP活性及HBsAg的表达量。
七、HBsAg的测定
采用Abbott EIA试剂盒测定。
结果
一、pBC12/PL/SEAP及pBC12/CMV/SEAP转染Huh7细胞,培养30小时后,pBC12/PL/SEAP转染Huh7细胞的培养上清液中SEAP表达量不高,A值与对照水平非常接近;pBC12/CMV/SEAP在Huh7细胞中表达的SEAP随时间延长呈现轻微上升趋势(图1)。取转染细胞培养72小时后的上清液检测,pBC12/PL/SEAP的表达仍处于低水平,而pBC12/CMV/SEAP表达的SEAP活性很高(图2)。

, 百拇医药
横座标为SEAP与酶底物作用的不同时间
图1 转染Huh7细胞培养30小时SEAP表达情况

图2 转染Huh7细胞培养72小时SEAP表达情况
二、pBC12/PL/SEAP与pBC12/CMV/SEAP转染HepG2及LMH细胞后,72小时的细胞培养上清液SEAP检测,结果显示,pBC12/PL/SEAP与pBC12/CMV/SEAP在HepG2及LMH细胞中的表达情况与转染Huh7细胞的结果相似(图3、4)。可见,pBC12/CMV/SEAP在HepG2及LMH细胞中均可呈高水平表达。

, 百拇医药
图3 转染LMH细胞培养72小时SEAP表达情况
三、pBC12/CMV/SEAP与HBV重组质粒(p3.8Ⅱ或p3.8Ⅱ 129L,p3.8Ⅱ 145R)共转染HepG2细胞。为进一步考核SEAP表达系统可否用作内参以研究HBV基因片段功能,进行了共转染实验。取共转染后72小时细胞培养上清液分别检测SEAP活性及HBsAg,结果两种产物均可表达(见表1)。
以p3.8Ⅱ质粒转染标本中SEAP的表达量为100%,分别计算其他标本表达SEAP量的百分比,作为校正系数。每份标本表达HBsAg的A值经校正后,即成为可互相比较的HBsAg A值(校正前后的A值见表1)。结果可见以Abbott试剂检测,p3.8Ⅱ145R表达的HBsAg明显低于p3.8Ⅱ,而p3.8Ⅱ129L表达的HBsAg量显著高于p3.8Ⅱ。重复3次,计算平均值及标准差分别为0.620±0.152(p3.8Ⅱ),1.106±0.095(p3.8Ⅱ 129L),0.224±0.067(p3.8 Ⅱ 145R)。

, 百拇医药
图4 转染HepG2细胞培养72小时SEAP表达情况
表1 pBC12/CMV/SEAP与HBV重组质粒共转染HepG2细胞表达SEAP与HBsAg的结果
72小时(A值)
SEAP
HBsAg
pBC12/CMV/SEAP+p3.8Ⅱ
1.207(100%)
0.513
pBC12/CMV/SEAP+p3.8Ⅱ 129L
, 百拇医药
0.683(57%)
0.997
1.43*
pBC12/CMV/SEAP+p3.8Ⅱ 145R
0.798(66%)
0.159
0.213*
*HBsAg纠正值=HBsAg A值+HBsAg A值(1—校正系数)讨论
为研究HBV基因的结构与功能,我们采用了细胞转染技术。目前国内外采用HBV DNA转染获得的体外增殖HBV的细胞培养系统有两大类型。一类是HBV基因整合并可持续产生HBV颗粒的稳定表达细胞系,如HepG2 2.215[3]及HepG2 T14[4]细胞系。另一类是用长于HBV全基因的病毒DNA短暂转染肝癌细胞系,不仅可表达病毒的抗原,还可获得病毒复制及HBV颗粒[5,6]。研究HBV各种变异株基因的结构与功能,短暂表达系统由于方法简单,出结果快,短期内可进行变异体比较,故更为适用。在应用短暂表达系统中的关键问题之一是各个标本间的可比性。建立应用HBV短暂转染试验中的内参标准系统可解决可比性问题。本室引进的SEAP系统曾被应用于多种细胞系,但尚无转染肝癌细胞系的研究。本文报道了用SEAP系统转染人肝癌细胞系及鸡肝癌细胞系的实验结果,证实SEAP系统可在上述细胞系中表达并确定了在本实验室条件下测定SEAP的最适时间及条件。由于其测定方法简便,快速,具有较高的实用价值。此外,因测定时不需要裂解细胞,还具有可保留转染的细胞供进一步研究细胞内HBV抗原表达及复制情况的优点。
, 百拇医药
实验证明SEAP作为内参标准系统可用于研究HBV基因片断的表达,因在转染的细胞培养中SEAP和HBsAg均可分别表达。此外,SEAP系统也不干扰HBeAg表达与HBV复制。
应用这一系统作为内参标准,对本室已发现的HBV S基因129L及145R变异株[7]表达HBsAg的情况进行研究,证实129L变异株表达的HBsAg值高于野毒株,而145R变异株表达的HBsAg值低于野毒株。由此可见,SEAP作为内参对客观判断转入细胞内的外源基因的表达情况具有实用价值。
本课题由美国中华医学基金资助(CMB Grant No.90-582)
参考文献
[1] Berger J, Hauber J, Hauber R, et al. Secreted placental alkaline phosphatase; A powerful new quantitative indicator of gene expression in eukaryotic cells. Gene, 1988,66:1.
, 百拇医药
[2] Nakabayashi H, Taketa K, Miyano K, et al. Growth of hepatoma cell lines with differentiaed functions in chemically defined medium. Cancer Res, 1986,42:3858.
[3] Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in HepG2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci, USA, 1987,84:1005.
[4] Sureau C, Romet-lemonne JL, Mullins JI, et al. Production of hepatitis B virus by a differential human hepatoma cell line after transfection with cloned circular HBV DNA. Cell, 1986,47:37.
, 百拇医药
[5] Chang GM, Jeng KS, Hu CP, et al. Production of hepatitis B virus in vitro by transient expression of cloned HBV DNA in hepatoma clell line. EMBO J, 1987,6:675.
[6] 闻玉梅,何丽芳,楼惠珍,等.克隆乙肝病毒DNA在HepG2细胞中的表达.中华医学杂志,1986,69:260.
[7] 何建文,吕睛,朱启,等.乙型肝炎疫苗免疫失败婴儿病毒表面抗原“a”决定族基因变异的研究.中华实验临床病毒学杂志,1996,10:308.
(收稿:1997-12-09 修回:1998-08-10), http://www.100md.com