顺铂诱导的喉癌细胞凋亡及其对细胞周期的影响
作者:亓放 张宝泉 徐炎 高翠华
单位:100730 中国医学科学院中国协和医科大学 北京协和医院耳鼻咽喉科(亓放、张宝泉);中国医学科学院基础医学研究所细胞生物室(徐炎、高翠华)
关键词:脱噬作用;顺铂;喉肿瘤;细胞周期
中华医学杂志/990424 【摘要】 目的 探讨顺铂对喉癌Hep2细胞株诱导细胞凋亡的作用,为抗肿瘤药物的筛选和用药方式提供理论依据。方法 体外培养的Hep2细胞与不同浓度顺铂作用2小时,利用流式细胞仪、荧光显微镜和DNA凝胶电泳技术,研究不同时间细胞凋亡的发生、形态学改变和对细胞周期的影响。结果 Hep2为贴壁生长细胞,顺铂作用后悬浮细胞增加,贴壁细胞中正常细胞占86%~96%,悬浮细胞中正常细胞占6%~13%。随着顺铂浓度增加和培养时间延长,死亡细胞增加,0 μmol/L 24小时死亡细胞仅5%,而同样时间20 μmol/L达19%。死亡细胞中以凋亡为主,流式细胞仪图中出现“亚G1期”峰。顺铂作用后贴壁细胞体积增大,具有时间和药物浓度双相依赖性。悬浮细胞DNA琼脂糖凝胶电泳呈现明显的梯度带,而贴壁细胞缺如。顺铂能造成细胞周期发生明显变化,低浓度(5~10 μmol/L)时72小时后细胞周期大致恢复正常,而20~80 μmol/L时细胞大部分阻滞在G2期。结论 (1)顺铂造成Hep2细胞死亡的方式提示临床上应采取大剂量间歇性给药方式;(2)能否诱导细胞凋亡为筛选抗肿瘤药物的重要标准之一;(3)顺铂为细胞周期非特异性化疗药物。
, http://www.100md.com
Cisplatin-induced apoptosis in laryngeal squamous cell carcinoma strain and the influence on cell cycle QI Fang, ZHANG Baoquan, XU Yan, et al. Department of Otolaryngology, Peking Union Medical College Hospital, Beijing 100730
【Abstract】 Objective To find more effective chemotherapeutic agents and treatment regimens, we studied the cytotoxicity of cisplatin to human laryngeal squamous cell carcinoma strain Hep2.Methods Using flow cytometry, fluorescence microscopy, and DNA agarose gel electrophoresis technique, we investigated in vitro Hep2 cells in different conditions. Results Hep2 was adherent cells in normal survival condition. Cisplatin affected Hep2 cell growth apparently. Under fluorescence microscope, necrotic cells were red, apoptotic cells were blue with condensed and fragmented nuclei, and normal cells were evenly blue. Adherent cells were 86%~96% viable. But nonadherent cells were 6%~13% viable. Death cells increased with the increase of drug concentration and time elapsing. Death cells were mainly apoptotic cells. The latter appeared to be time-and dose-dependent. DNA “ladder” was observed for nonadherent cells in agarose gel electrophoresis, but adherent cells were not. “Sub-G1” phase peak occurred in flow cytometry. After cisplatin treatment, the volume of adherent cells increased with dose-and time dependence. Cisplatin could cause Hep2 cell cycle to change. At first, G1 phase cell percentage reduced, while S phase increased. With time elapsing, G2/M phase increased. Cells experienced a slow-down in S-phase followed by a G2 block.Conclusion Apoptosis is a major way of Hep2 cell death after cisplatin treatment and appeared to be time-and dose-dependent. In clinical chemotherapy, cisplatin should be used in high concentration. Inducing apoptosis is one of the characteristics of chemotherapeutic agents. Cisplatin should be taken a combination regimen with cell cycle-special agents.
, 百拇医药
【Key words】 Apoptosis Cisplatin Laryngeal neoplasms Cell cycle
(Natl Med J China, 1999,79:298-301)
近几年的研究成果证实,化学结构不同、作用靶点各异的抗肿瘤药物可以诱导相应细胞发生凋亡[1],能否诱导细胞凋亡已成为评价抗肿瘤药物疗效的重要标志[2]。本实验利用流式细胞仪检查、荧光显微镜观察和DNA凝胶电泳技术,研究抗肿瘤药物顺铂对喉癌Hep2细胞株的作用及对细胞周期的影响,以 期为抗肿瘤药物的筛选和用药方式提供依据。
材料和方法
一、细胞培养
喉鳞状细胞癌Hep2细胞株由中国医学科学院实验动物研究所惠赠。培养基为RPMI 1640(美国Gibco公司),补充10%胎牛血清(中国医学科学院血液学研究所)、100 IU/ml青霉素和0.1 mg/ml链霉素。细胞培养用100 ml培养瓶,5%CO2孵箱、37℃下培养。细胞生长达汇合状态时,0.25%胰蛋白酶消化后传代。全部实验均用指数生长期细胞。
, 百拇医药
二、细胞的药物治疗
细胞生长达80%汇合时加入不同浓度(0、5、10、20、40及80 μmol/L)顺铂(美国Sigma公司),作用2小时中止反应。磷酸盐缓冲液(PBS)清洗2遍,加入新培养基继续培养。分别于0、12、24、48和72小时收集悬浮和/或贴壁细胞并照相。
三、荧光显微镜观察并计数
分别收集不同药物浓度、不同时间点的悬浮和/(或)贴壁细胞。每个标本取200 μl放入Eppendorf管中,加入荧光染料Hoechst33342(Ho33342)至终浓度10 μg/ml, 碘化丙锭(PI) 50 μg/ml, 37℃下染色15分钟。取40 μl细胞悬液迅速滴在用双面胶封在载玻片上的小室内,加盖玻片。紫外光激发,荧光显微镜下观察细胞形态及颜色以区分出正常细胞、凋亡细胞及坏死细胞[3]。随机观察100个细胞,求得3种细胞所占百分比。每个样本计数3次取平均值,3次实验结果求出标准差。
, 百拇医药
四、流式细胞仪检查
不同时间收集不同药物浓度作用的全部悬浮细胞和贴壁细胞。制备0.5 ml PBS单细胞悬液,用细吸管将其迅速喷射到8 ml 4 ℃70%乙醇中,混匀。4℃冰箱中固定至少18小时。取固定后的106个细胞,PBS漂洗2遍,1 ml PBS混匀细胞,加入RNA酶A至终浓度为50 μg/ml。37℃水浴1小时后立即放入冰浴中。加入PI至终浓度50 μg/ml,4℃避光染色1小时后经流式细胞仪,进行细胞凋亡分析和细胞周期分析。
五、DNA琼脂糖凝胶电泳
分别收集不同药物浓度和作用时间的细胞4×106个,PBS漂洗2次,用酚抽提法提取DNA[4]。最终得到120 μl含有DNA的TE(Tris-EDTA,pH8.0)液,-20℃冰柜中保存备用。
, 百拇医药 0.5×四溴乙烷电泳液配制成1.2%琼脂糖凝胶,加热使其完全溶解,待冷至60℃时加入溴化乙锭(EB) 至终浓度0.5 μg/ml。取25 μl DNA样品加入5 μl的上样缓冲液溴酚蓝,混匀后移入凝胶孔中。4 V/cm电压电泳5小时,紫外灯下观察DNA电泳结果,加近摄镜和红色滤光镜拍照。
六、统计学分析:随机区组比较用方差分析,数据以均数±标准差表示。
结果
一、顺铂对细胞生长的影响
正常状态下Hep2为贴壁生长细胞,药物作用后悬浮细胞增加,其生长曲线见图1。贴壁细胞中正常细胞占86%~96%,悬浮细胞中正常细胞占6%~13%,其余为凋亡和坏死细胞。培养过程中观察到药物作用后贴壁细胞的体积增大,且有药物浓度和时间双相依赖性。即随着药物浓度增高和培养时间延长,贴壁细胞体积增大。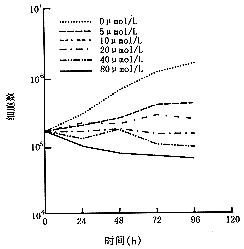
, 百拇医药
图1 顺铂作用2小时后Hep2细胞生长曲线
二、荧光显微镜检查细胞形态和分类
荧光显微镜下染成红色荧光的细胞为坏死细胞,细胞核染色质凝集、分布不均的蓝色细胞为凋亡细胞,而染色质分布均匀的蓝色细胞为正常存活细胞(图2)。
图2 荧光显微镜观察不同状态Hep2细胞 Ho33342
和PI染色 ×200
收集全细胞(悬浮细胞和贴壁细胞)计数发现,随着药物浓度增大和培养时间延长,死亡细胞逐渐增多。未经药物作用细胞中24小时死亡细胞仅5%,而同样时间20 μmol/L时死亡细胞达19%。死亡细胞中以凋亡细胞为主,但在高浓度(40、80 μmol/L)长时间(72小时)作用后的细胞中坏死细胞数量超过凋亡细胞。
, http://www.100md.com
三、流式细胞仪检查结果
1.细胞凋亡分析:所有受检标本显示有DNA低含量颗粒(“亚G1期”峰),即不同药物浓度和作用时间下均有细胞凋亡发生(表1)。不同药物浓度间(F=5.81,P<0.01)和不同时间间(F=16.98,P<0.01)凋亡的发生差异均有显著性意义。相关性分析显示药物浓度和时间与凋亡发生呈正相关,即随着药物浓度增加细胞凋亡增加,随着作用时间延长凋亡发生也增加。
表1 不同时间流式细胞仪检查凋亡细胞的发生率(%,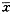 ±s) 时间(h)
±s) 时间(h)
凋亡细胞发生率
0
5
, http://www.100md.com
10
20
40
80
0
1.1±0.1△*
1.1±0.2△
1.3±0.4△
1.1±0.3△*
1.2±0.6△
2.8±0.7△
, 百拇医药
12
1.4±0.3△*
2.0±0.5△
1.4±0.2△
1.7±0.5△*
5.1±2.1△
4.7±0.8△
24
1.7±0.3*
2.4±0.1△
, http://www.100md.com
4.5±1.0△
5.5±1.3*
5.4±0.4△
6.3±2.1△
48
2.2±0.2*
3.1±0.2*△
4.9±0.9*△
6.5±1.2*
7.1±1.5*△
, 百拇医药
11.1±0.1*△
72
4.0±0.7*
8.7±1.5*△
6.8±0.7*△
20.0±6.1*
21.4±0.5*△
36.9±3.0*△
注:0~80 μmol/L为不同浓度的顺铂;不同时间、不同浓度随机区组比较用方差分析* P<0.01,△ P<0.05
, 百拇医药
2.细胞周期的改变:正常生长状态下的Hep2细胞株大多数处于G1期,S期次之,G2/M期最少。顺铂能使细胞周期发生明显变化,作用2小时后首先表现出G1期细胞减少,S期增多,随着时间延长G2/M期细胞也相应增多。低浓度时(5~10 μmol/L)经过72小时后细胞周期大致恢复正常,而20~80 μmol/L时细胞大部分阻滞在G2/M期。
三、DNA琼脂糖凝胶电泳
药物作用48小时和72小时悬浮细胞呈现出明显的DNA梯度带图谱,而同样条件下的贴壁细胞则缺如。正常对照组的贴壁细胞DNA则完全没有降解(图3)。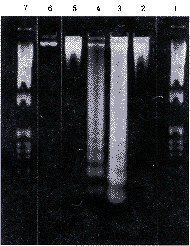
注:1.7.1 kb DNA参照相对分子质量;2.80 μmol/L顺铂72小时贴壁细胞DNA;3.80 μmol/L顺铂72小时悬浮细胞DNA;4.40 μmol/L顺铂48小时悬浮细胞DNA;5.20 μmol/L 24小时贴壁细胞DNA;6.0 μmol/L顺铂贴壁细胞DNA
, 百拇医药
图3 1.2%琼脂糖凝胶电泳图谱
讨论
顺铂是一种类烷化剂的抗肿瘤药物,其作用的分子机制为分子中的一个氯原子与鸟嘌呤的第7位氮原子(G-N7)结合,另一个氯原子可以和蛋白质或一些小分子的亲核基团如-NH2、-SH结合,造成DNA链内或链间交联,或DNA-蛋白交联。以后的DNA不全修复造成细胞毒作用[5]。目前,顺铂广泛应用于生殖系统肿瘤、小细胞肺癌和头颈部恶性肿瘤的化疗。 顺铂作用Hep2细胞株后细胞生长受到明显抑制。以往的研究发现,凋亡细胞进一步发展,其膜通透性增加,溶酶体膜破裂,最终导致坏死[6]。由此推断,顺铂作用后坏死细胞增加为凋亡后期继发性坏死,顺铂造成细胞死亡的形式主要是凋亡。流式细胞仪定量检查结果进一步证实顺铂诱导Hep2细胞株发生凋亡,且呈药物浓度和作用时间双相依赖性。此结果支持顺铂在临床中应采取大剂量给药方式,但考虑到其毒性反应,一般用间歇给药方式。
, 百拇医药
正常情况下人二倍体细胞核DNA长度为2.2 m左右,按上述酚抽提法可产生100~200 kb的基因组DNA[4],凝胶电泳图谱显示大片断DNA带。药物与靶细胞作用后激活特异性信号传递系统,造成某些基因表达,内切核酸酶被激活,使DNA双链在核小体间断裂。每个核小体的长度恰在180~200 bp之间,所以在DNA凝胶电泳图上出现特有的梯度带。顺铂作用后悬浮细胞DNA凝胶电泳出现明显的180~200 bp倍数的DNA梯度带,而贴壁细胞则缺如。这一结果与细胞形态学改变一致,也与其他大多数研究者结果相符[7~9]。
顺铂对细胞周期的影响非常显著。药物作用后,细胞首先通过S期缓慢,继之阻滞于G2期。低浓度时,细胞能克服G2期阻力进入M期继续存活;高浓度时细胞死亡,而死亡的形式是凋亡。从而证实顺铂为细胞周期非特异性化疗药物,但主要作用于G1期,化疗中应与细胞周期特异性药物采取联合用药方式。
, 百拇医药
本实验还观察到一个现象,贴壁细胞体积随药物浓度增加和培养时间延长而增大。近年来国外也有人观察到此现象,并认为该类细胞主要为G2/M期细胞[10]。笔者分析细胞受药物影响细胞周期时间延长,但许多生物合成尤其是蛋白质合成仍在继续,且细胞不能及时分裂故体积增大。至于这一现象的具体生物学意义目前还难以预测。
参考文献
[1] Hickman JA. Apoptosis induced by anticancer drugs. Cancer Metastasis Rev, 1992,11:121-125.
[2] 方敏,张鸿卿,薛绍白,等.抗三尖杉酯碱HL-60细胞的抗程序性细胞死亡及其克服.药学学报,1994,29:891-898.
[3] Darzynkiewicz Z, Bruno S, Delbino G, et al. Features of apoptotic cells measured by flow cytometry. Cytometry, 1992,13:795-808.
, 百拇医药
[4] 卢圣栋,主编.现代分子生物学实验技术.北京:高等教育出版社,1993.96-98.
[5] Chu G. Cellular responses to cisplatin: the roles of DNA-binding proteins and DNA repair. J Biol Chem, 1994,269:787-790.
[6] Kerr JFR, Winterford CM, Harmon BV. Apoptosis: its significance in cancer and cancer therapy. Cancer, 1994,73:2013-2026.
[7] Evans DL, Dive C. Effects of cisplatin on the induction of apoptosis in proliferating hepatoma cells and nonproliferating immature thymocytes. Cancer Res, 1993,53:2133-2139.
, 百拇医药
[8] Ormerod MG, O′Neill CF, Robertson D, et al. Cisplatin induces apoptosis in a human ovarian carcinoma cell line without concomitant internucleosomal degradation of DNA. Exp Cell Res, 1994,211:231-237.
[9] Chen CS, Mrksich M, Hang S, et al. Geometric control of cell life and death. Science, 1997,276:1425-1428.
[10] Ormerod MG, Orr RM, Peacock JH. The role of apoptosis in cell killing by cisplatin: a flow cytometric study. Br J Cancer, 1994,69:93-100.
(收稿:1998-08-26 修回:1999-01-18), 百拇医药
单位:100730 中国医学科学院中国协和医科大学 北京协和医院耳鼻咽喉科(亓放、张宝泉);中国医学科学院基础医学研究所细胞生物室(徐炎、高翠华)
关键词:脱噬作用;顺铂;喉肿瘤;细胞周期
中华医学杂志/990424 【摘要】 目的 探讨顺铂对喉癌Hep2细胞株诱导细胞凋亡的作用,为抗肿瘤药物的筛选和用药方式提供理论依据。方法 体外培养的Hep2细胞与不同浓度顺铂作用2小时,利用流式细胞仪、荧光显微镜和DNA凝胶电泳技术,研究不同时间细胞凋亡的发生、形态学改变和对细胞周期的影响。结果 Hep2为贴壁生长细胞,顺铂作用后悬浮细胞增加,贴壁细胞中正常细胞占86%~96%,悬浮细胞中正常细胞占6%~13%。随着顺铂浓度增加和培养时间延长,死亡细胞增加,0 μmol/L 24小时死亡细胞仅5%,而同样时间20 μmol/L达19%。死亡细胞中以凋亡为主,流式细胞仪图中出现“亚G1期”峰。顺铂作用后贴壁细胞体积增大,具有时间和药物浓度双相依赖性。悬浮细胞DNA琼脂糖凝胶电泳呈现明显的梯度带,而贴壁细胞缺如。顺铂能造成细胞周期发生明显变化,低浓度(5~10 μmol/L)时72小时后细胞周期大致恢复正常,而20~80 μmol/L时细胞大部分阻滞在G2期。结论 (1)顺铂造成Hep2细胞死亡的方式提示临床上应采取大剂量间歇性给药方式;(2)能否诱导细胞凋亡为筛选抗肿瘤药物的重要标准之一;(3)顺铂为细胞周期非特异性化疗药物。
, http://www.100md.com
Cisplatin-induced apoptosis in laryngeal squamous cell carcinoma strain and the influence on cell cycle QI Fang, ZHANG Baoquan, XU Yan, et al. Department of Otolaryngology, Peking Union Medical College Hospital, Beijing 100730
【Abstract】 Objective To find more effective chemotherapeutic agents and treatment regimens, we studied the cytotoxicity of cisplatin to human laryngeal squamous cell carcinoma strain Hep2.Methods Using flow cytometry, fluorescence microscopy, and DNA agarose gel electrophoresis technique, we investigated in vitro Hep2 cells in different conditions. Results Hep2 was adherent cells in normal survival condition. Cisplatin affected Hep2 cell growth apparently. Under fluorescence microscope, necrotic cells were red, apoptotic cells were blue with condensed and fragmented nuclei, and normal cells were evenly blue. Adherent cells were 86%~96% viable. But nonadherent cells were 6%~13% viable. Death cells increased with the increase of drug concentration and time elapsing. Death cells were mainly apoptotic cells. The latter appeared to be time-and dose-dependent. DNA “ladder” was observed for nonadherent cells in agarose gel electrophoresis, but adherent cells were not. “Sub-G1” phase peak occurred in flow cytometry. After cisplatin treatment, the volume of adherent cells increased with dose-and time dependence. Cisplatin could cause Hep2 cell cycle to change. At first, G1 phase cell percentage reduced, while S phase increased. With time elapsing, G2/M phase increased. Cells experienced a slow-down in S-phase followed by a G2 block.Conclusion Apoptosis is a major way of Hep2 cell death after cisplatin treatment and appeared to be time-and dose-dependent. In clinical chemotherapy, cisplatin should be used in high concentration. Inducing apoptosis is one of the characteristics of chemotherapeutic agents. Cisplatin should be taken a combination regimen with cell cycle-special agents.
, 百拇医药
【Key words】 Apoptosis Cisplatin Laryngeal neoplasms Cell cycle
(Natl Med J China, 1999,79:298-301)
近几年的研究成果证实,化学结构不同、作用靶点各异的抗肿瘤药物可以诱导相应细胞发生凋亡[1],能否诱导细胞凋亡已成为评价抗肿瘤药物疗效的重要标志[2]。本实验利用流式细胞仪检查、荧光显微镜观察和DNA凝胶电泳技术,研究抗肿瘤药物顺铂对喉癌Hep2细胞株的作用及对细胞周期的影响,以 期为抗肿瘤药物的筛选和用药方式提供依据。
材料和方法
一、细胞培养
喉鳞状细胞癌Hep2细胞株由中国医学科学院实验动物研究所惠赠。培养基为RPMI 1640(美国Gibco公司),补充10%胎牛血清(中国医学科学院血液学研究所)、100 IU/ml青霉素和0.1 mg/ml链霉素。细胞培养用100 ml培养瓶,5%CO2孵箱、37℃下培养。细胞生长达汇合状态时,0.25%胰蛋白酶消化后传代。全部实验均用指数生长期细胞。
, 百拇医药
二、细胞的药物治疗
细胞生长达80%汇合时加入不同浓度(0、5、10、20、40及80 μmol/L)顺铂(美国Sigma公司),作用2小时中止反应。磷酸盐缓冲液(PBS)清洗2遍,加入新培养基继续培养。分别于0、12、24、48和72小时收集悬浮和/或贴壁细胞并照相。
三、荧光显微镜观察并计数
分别收集不同药物浓度、不同时间点的悬浮和/(或)贴壁细胞。每个标本取200 μl放入Eppendorf管中,加入荧光染料Hoechst33342(Ho33342)至终浓度10 μg/ml, 碘化丙锭(PI) 50 μg/ml, 37℃下染色15分钟。取40 μl细胞悬液迅速滴在用双面胶封在载玻片上的小室内,加盖玻片。紫外光激发,荧光显微镜下观察细胞形态及颜色以区分出正常细胞、凋亡细胞及坏死细胞[3]。随机观察100个细胞,求得3种细胞所占百分比。每个样本计数3次取平均值,3次实验结果求出标准差。
, 百拇医药
四、流式细胞仪检查
不同时间收集不同药物浓度作用的全部悬浮细胞和贴壁细胞。制备0.5 ml PBS单细胞悬液,用细吸管将其迅速喷射到8 ml 4 ℃70%乙醇中,混匀。4℃冰箱中固定至少18小时。取固定后的106个细胞,PBS漂洗2遍,1 ml PBS混匀细胞,加入RNA酶A至终浓度为50 μg/ml。37℃水浴1小时后立即放入冰浴中。加入PI至终浓度50 μg/ml,4℃避光染色1小时后经流式细胞仪,进行细胞凋亡分析和细胞周期分析。
五、DNA琼脂糖凝胶电泳
分别收集不同药物浓度和作用时间的细胞4×106个,PBS漂洗2次,用酚抽提法提取DNA[4]。最终得到120 μl含有DNA的TE(Tris-EDTA,pH8.0)液,-20℃冰柜中保存备用。
, 百拇医药 0.5×四溴乙烷电泳液配制成1.2%琼脂糖凝胶,加热使其完全溶解,待冷至60℃时加入溴化乙锭(EB) 至终浓度0.5 μg/ml。取25 μl DNA样品加入5 μl的上样缓冲液溴酚蓝,混匀后移入凝胶孔中。4 V/cm电压电泳5小时,紫外灯下观察DNA电泳结果,加近摄镜和红色滤光镜拍照。
六、统计学分析:随机区组比较用方差分析,数据以均数±标准差表示。
结果
一、顺铂对细胞生长的影响
正常状态下Hep2为贴壁生长细胞,药物作用后悬浮细胞增加,其生长曲线见图1。贴壁细胞中正常细胞占86%~96%,悬浮细胞中正常细胞占6%~13%,其余为凋亡和坏死细胞。培养过程中观察到药物作用后贴壁细胞的体积增大,且有药物浓度和时间双相依赖性。即随着药物浓度增高和培养时间延长,贴壁细胞体积增大。

, 百拇医药
图1 顺铂作用2小时后Hep2细胞生长曲线
二、荧光显微镜检查细胞形态和分类
荧光显微镜下染成红色荧光的细胞为坏死细胞,细胞核染色质凝集、分布不均的蓝色细胞为凋亡细胞,而染色质分布均匀的蓝色细胞为正常存活细胞(图2)。

图2 荧光显微镜观察不同状态Hep2细胞 Ho33342
和PI染色 ×200
收集全细胞(悬浮细胞和贴壁细胞)计数发现,随着药物浓度增大和培养时间延长,死亡细胞逐渐增多。未经药物作用细胞中24小时死亡细胞仅5%,而同样时间20 μmol/L时死亡细胞达19%。死亡细胞中以凋亡细胞为主,但在高浓度(40、80 μmol/L)长时间(72小时)作用后的细胞中坏死细胞数量超过凋亡细胞。
, http://www.100md.com
三、流式细胞仪检查结果
1.细胞凋亡分析:所有受检标本显示有DNA低含量颗粒(“亚G1期”峰),即不同药物浓度和作用时间下均有细胞凋亡发生(表1)。不同药物浓度间(F=5.81,P<0.01)和不同时间间(F=16.98,P<0.01)凋亡的发生差异均有显著性意义。相关性分析显示药物浓度和时间与凋亡发生呈正相关,即随着药物浓度增加细胞凋亡增加,随着作用时间延长凋亡发生也增加。
表1 不同时间流式细胞仪检查凋亡细胞的发生率(%,
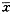 ±s) 时间(h)
±s) 时间(h)凋亡细胞发生率
0
5
, http://www.100md.com
10
20
40
80
0
1.1±0.1△*
1.1±0.2△
1.3±0.4△
1.1±0.3△*
1.2±0.6△
2.8±0.7△
, 百拇医药
12
1.4±0.3△*
2.0±0.5△
1.4±0.2△
1.7±0.5△*
5.1±2.1△
4.7±0.8△
24
1.7±0.3*
2.4±0.1△
, http://www.100md.com
4.5±1.0△
5.5±1.3*
5.4±0.4△
6.3±2.1△
48
2.2±0.2*
3.1±0.2*△
4.9±0.9*△
6.5±1.2*
7.1±1.5*△
, 百拇医药
11.1±0.1*△
72
4.0±0.7*
8.7±1.5*△
6.8±0.7*△
20.0±6.1*
21.4±0.5*△
36.9±3.0*△
注:0~80 μmol/L为不同浓度的顺铂;不同时间、不同浓度随机区组比较用方差分析* P<0.01,△ P<0.05
, 百拇医药
2.细胞周期的改变:正常生长状态下的Hep2细胞株大多数处于G1期,S期次之,G2/M期最少。顺铂能使细胞周期发生明显变化,作用2小时后首先表现出G1期细胞减少,S期增多,随着时间延长G2/M期细胞也相应增多。低浓度时(5~10 μmol/L)经过72小时后细胞周期大致恢复正常,而20~80 μmol/L时细胞大部分阻滞在G2/M期。
三、DNA琼脂糖凝胶电泳
药物作用48小时和72小时悬浮细胞呈现出明显的DNA梯度带图谱,而同样条件下的贴壁细胞则缺如。正常对照组的贴壁细胞DNA则完全没有降解(图3)。

注:1.7.1 kb DNA参照相对分子质量;2.80 μmol/L顺铂72小时贴壁细胞DNA;3.80 μmol/L顺铂72小时悬浮细胞DNA;4.40 μmol/L顺铂48小时悬浮细胞DNA;5.20 μmol/L 24小时贴壁细胞DNA;6.0 μmol/L顺铂贴壁细胞DNA
, 百拇医药
图3 1.2%琼脂糖凝胶电泳图谱
讨论
顺铂是一种类烷化剂的抗肿瘤药物,其作用的分子机制为分子中的一个氯原子与鸟嘌呤的第7位氮原子(G-N7)结合,另一个氯原子可以和蛋白质或一些小分子的亲核基团如-NH2、-SH结合,造成DNA链内或链间交联,或DNA-蛋白交联。以后的DNA不全修复造成细胞毒作用[5]。目前,顺铂广泛应用于生殖系统肿瘤、小细胞肺癌和头颈部恶性肿瘤的化疗。 顺铂作用Hep2细胞株后细胞生长受到明显抑制。以往的研究发现,凋亡细胞进一步发展,其膜通透性增加,溶酶体膜破裂,最终导致坏死[6]。由此推断,顺铂作用后坏死细胞增加为凋亡后期继发性坏死,顺铂造成细胞死亡的形式主要是凋亡。流式细胞仪定量检查结果进一步证实顺铂诱导Hep2细胞株发生凋亡,且呈药物浓度和作用时间双相依赖性。此结果支持顺铂在临床中应采取大剂量给药方式,但考虑到其毒性反应,一般用间歇给药方式。
, 百拇医药
正常情况下人二倍体细胞核DNA长度为2.2 m左右,按上述酚抽提法可产生100~200 kb的基因组DNA[4],凝胶电泳图谱显示大片断DNA带。药物与靶细胞作用后激活特异性信号传递系统,造成某些基因表达,内切核酸酶被激活,使DNA双链在核小体间断裂。每个核小体的长度恰在180~200 bp之间,所以在DNA凝胶电泳图上出现特有的梯度带。顺铂作用后悬浮细胞DNA凝胶电泳出现明显的180~200 bp倍数的DNA梯度带,而贴壁细胞则缺如。这一结果与细胞形态学改变一致,也与其他大多数研究者结果相符[7~9]。
顺铂对细胞周期的影响非常显著。药物作用后,细胞首先通过S期缓慢,继之阻滞于G2期。低浓度时,细胞能克服G2期阻力进入M期继续存活;高浓度时细胞死亡,而死亡的形式是凋亡。从而证实顺铂为细胞周期非特异性化疗药物,但主要作用于G1期,化疗中应与细胞周期特异性药物采取联合用药方式。
, 百拇医药
本实验还观察到一个现象,贴壁细胞体积随药物浓度增加和培养时间延长而增大。近年来国外也有人观察到此现象,并认为该类细胞主要为G2/M期细胞[10]。笔者分析细胞受药物影响细胞周期时间延长,但许多生物合成尤其是蛋白质合成仍在继续,且细胞不能及时分裂故体积增大。至于这一现象的具体生物学意义目前还难以预测。
参考文献
[1] Hickman JA. Apoptosis induced by anticancer drugs. Cancer Metastasis Rev, 1992,11:121-125.
[2] 方敏,张鸿卿,薛绍白,等.抗三尖杉酯碱HL-60细胞的抗程序性细胞死亡及其克服.药学学报,1994,29:891-898.
[3] Darzynkiewicz Z, Bruno S, Delbino G, et al. Features of apoptotic cells measured by flow cytometry. Cytometry, 1992,13:795-808.
, 百拇医药
[4] 卢圣栋,主编.现代分子生物学实验技术.北京:高等教育出版社,1993.96-98.
[5] Chu G. Cellular responses to cisplatin: the roles of DNA-binding proteins and DNA repair. J Biol Chem, 1994,269:787-790.
[6] Kerr JFR, Winterford CM, Harmon BV. Apoptosis: its significance in cancer and cancer therapy. Cancer, 1994,73:2013-2026.
[7] Evans DL, Dive C. Effects of cisplatin on the induction of apoptosis in proliferating hepatoma cells and nonproliferating immature thymocytes. Cancer Res, 1993,53:2133-2139.
, 百拇医药
[8] Ormerod MG, O′Neill CF, Robertson D, et al. Cisplatin induces apoptosis in a human ovarian carcinoma cell line without concomitant internucleosomal degradation of DNA. Exp Cell Res, 1994,211:231-237.
[9] Chen CS, Mrksich M, Hang S, et al. Geometric control of cell life and death. Science, 1997,276:1425-1428.
[10] Ormerod MG, Orr RM, Peacock JH. The role of apoptosis in cell killing by cisplatin: a flow cytometric study. Br J Cancer, 1994,69:93-100.
(收稿:1998-08-26 修回:1999-01-18), 百拇医药