凝血酶对大鼠血管平滑肌细胞血小板源性生长因子基因表达的影响
作者:王启贤 吕俊升
单位:王启贤(昆明医学院第一附属医院心内科,昆明 650031);吕俊升(浙江医科大学第二附属医院心内科,杭州 310009)
关键词:凝血酶;肌,平滑,;血管;血小板源性生长因子;基因表达;大鼠
中国动脉硬化杂志000107[摘 要] 为了研究凝血酶对血管平滑肌细胞血小板源性生长因子基因表达的影响,探讨凝血酶刺激血管平滑肌细胞增殖的机制,通过培养SD大鼠胸 主动脉血管平滑肌细胞 ,以3H-TdR掺入率作为评价凝血酶促血管平滑肌细胞增殖的指标 ;用反转录聚合酶链反应检测凝血酶对血管平滑肌细胞血小板源性生长因子A链mRNA表达的 影响;用Dot blot检测凝血酶对血管平滑肌细胞血小板源性生长因子B链mRNA表达的影响。 结果表明,凝血酶促血管平滑肌细胞增殖呈浓度依赖性和时间依赖性,血管平滑肌细胞在基 础状态下可检测到血小板源性生长因子A和B链mRNA表达,凝血酶刺激血管平滑肌细胞后2 h 血小板源性生长因子A 链mRNA表达开始增加,4~6 h达高峰,持续12 h,24~48 h 恢复正常。提示凝血酶对血管平滑肌细胞具有较强的促增殖作用,凝血酶促血管平滑肌细胞 的增殖作用部分可能是通过诱导血管平滑肌细胞血小板源性生长因子A链mRNA的表达来实现的。
, 百拇医药
[中图分类号] Q786 [文献标识码] A
[文章编号] 1007-3949(2000)-01-0026-06
Influence on Platelet-Derived Growth Factor Ligand Gene Expression by Thrombin in Rat Vascular Smooth Muscle Cel1ls
WANG Qi-Xian LU Jun-Sheng
(Department of Medicine, the First Affiliated Hospital, Kun ming Medical Colleage, Kunming 650031, China)
ABSTRACT Aim To study the influence of thrombin on gene expression of platelet derived growth factor(PDGF) in cultured vascular smooth muscle cells and probe into the mechanism of proliferation of vascular smooth cells induced by thrombin . Methods Take the incoporation of 3 H-thymidine as the target to evaluate vascular smooth muscle cells proliferation; thrombin-induced expression of PDGF-A mRNA in the vascular smooth muscle cells was detected by RT-PCR, while PDGF-B mRNA expression by Dot blot hybridization. Results Thrombin remarkedly stimulated proliferation of SD rat vascular smooth muscle cells in a dose-depedent and a time-dependent manner; PDGF-A and PDGF-B mRNA was detected in quiescent cultured vascular smooth muscle cells in serum-free medium for 48 hours,the expression of PDGF-A mRNA was increased in VSMC after exposure to thrombin for two hours, and reachd a peak levels after 4~6 houres exposure to thrombin. The rising level of PDGF -A mRNA continued for 12 hours,and felt to the base level 24~48 hours afterwards. Conclusion Thrombin remarkedly stimulated proliferation of SD rat vascular smooth muscle cells in a dose-depedent and a time-dependent manner, thrombin-induced vascular smooth muscle cells proliferation was partially mediated by expression of PDGF- A mRNA.
, 百拇医药
MeSH Thrombin; Vascular; Muscle, Smooth; Platelet Derived Growth Factor; Gene Expression; Mice
经皮腔内冠状动脉成形术后再狭窄是以血管损伤部位血栓形成及血管平滑肌细胞(vascular smooth cells, VSMC)增殖为主要病理特征。近来研究表明,凝血酶除有促血凝作用之外 ,还具有许多细胞效应,如激活血小板使其粘附聚集,并释放5-羟色胺、血 栓素A2、血小 板因子-4、血小板源性生长因子(platelet-derived growth factor, PDGF)和许多凝血物质 ;刺激血管内皮细胞产生血小板源性生长因子、前列环素、内皮素、血小板活化因 子和纤溶酶原激活物;促进VSMC增殖[1~4]。而在动脉粥样硬化病灶中,内皮细胞 、内膜平滑肌细胞和巨噬细胞的凝血酶受体表达增加[5],在球囊导管损伤的动脉 血管壁中,VSMC的凝血酶受体表达也明显上调[6],推测凝血酶的增加可能促使VSM C迁移增殖。为进一步探讨其机制,本实验观察了凝血酶对培养的SD大鼠胸主动脉VSMC中PDG F基因表达的影响,旨在从分子生物学水平探讨凝血酶促VSMC增殖的机制。
, 百拇医药
1 材料和方法
1.1 材料
实验动物为 SD大鼠;新生牛血清购自杭州四季青公司;DMEM培养基、Trizol、鲑(鲱)鱼精、MMLV反转录酶购自GIBCOL-BRL公司;凝血酶为Sigma产品,来源于牛血清;随机引物标记试剂盒、随机引物、ECORI和dNTPs均为Promega产品;DEPC为Serva产品;去离子甲酰胺为CLONTECH产品;3H-TdR购自上海原子核研究所;α-32 P-dCTP购自北京亚辉生物医学工程公司;其余材料和试剂均为进口分装或国内产品。重组质粒由中科院上海细胞所提供。
1.2 血管平滑肌细胞培养
按贴块法进行SD大鼠胸主动脉VSMC原代培养,倒置显微镜下,细胞具有典型的“峰谷”结构。第4~8代细胞用于实验。
, http://www.100md.com
1.3 重组质粒的制备和cDNA插入片段的回收
采用碱裂解法制备小量质粒DNA[7]。Pic18-PDGF-BcDNA用ECORI酶切。用上海华顺生物试剂公司柱离心式胶回收试剂盒回收目的cDNA 。
1.4 凝血酶对血管平滑肌细胞3H-TdR掺入率的影响
1.4.1 细胞处理 用含15%小牛血清的DMEM培养液将VSMC数调整至5×107/L,加入24孔细胞培养板,每孔1 mL。48 h后培养板内已有80%的细胞呈汇合状态,吸出培养液,改用含0.4%小牛血清的DMEM培养48 h。
1.4.2 不同浓度凝血酶对3 H-TdR掺入率的影响 实验组加入含不同浓度凝血酶( 100 u/L、 500 u/L、 1 000 u/L、 5 000 u/L和10 000 u/L)的培养液,在对照组加入 等体积的含0.4%小牛血清的DMEM培养液。实验组每组为4孔,每孔反应体积为1 mL。加入刺激 因素的同时在培养板内加入3H-TdR 37 kBq/孔,作用24 h后吸出培养液,用磷酸缓冲生理盐水(phosphate buffer solution, PBS)洗孔三次,每孔用1 mL冰冷的10%三氯乙酸于4°C固定细胞30 min,再用10%三氯乙酸洗孔三次。每孔加入0.5 mL 1 mol/L NaOH裂解细胞,显微镜下观察到细胞彻底裂解后,每孔加入0.5 mL 1 mol/L HCl中和,最后每孔取1 mL加入5 mL闪烁液中,用液体闪烁计数仪测cpm值。
, 百拇医药
1.4.3 不同时间凝血酶对3 H-TdR掺入率的影响 实验分凝血酶组和对照组,凝血酶组每孔加入每升含凝血酶5 000 u的DMEM培养液(DMEM内含0.4%小牛血清);对照组加入等体积的含0.4%小牛血清的DMEM。凝血酶组和对照组各4孔,每孔培养液量为1 mL,分别加入凝血酶作用24 h、48 h和72 h,同时每孔加入3H-TdR 37 kBq ,作用不同时间后按前述方法终止3H-TdR掺入实验。
1.5 凝血酶对血小板源性生长因子基因表达的影响
1.5.1 细胞处理 用含15%小牛血清的DMEM培养液将细胞数调整为5×107/L,于100 mL培养瓶中培养,第3~4天生长达汇合状态,然后用含0.4%小牛血清的DMEM培养液培养48 h后,吸出培养液,分为8组,每组两瓶细胞。第一组用凝血酶(5 000 u /L)作用0 h,第2~8组分别作用2 h、 4 h、 6 h、 8 h、 12 h、 24 h和 48 h后提取总RNA。
, 百拇医药
1.5.2 总RNA提取及鉴定 用Trizol试剂,按试剂说明书方法提取VSMC的总RNA。取RNA样品4.5 μL,加入5×甲醛凝胶电泳缓冲液2 μL、甲醛3.5 μL和甲酰胺10 μL,于65°C温育15 min,冰育冷却,离心5 s,使管内所有液体集中于管底,加含EB 0.5 mg/L的甲醛凝胶上样缓冲液2 μL。加样前将凝胶预电泳5 min,电压降为5 V/cm。随后将样品加入凝胶加样孔中,将凝胶浸入1×甲醛凝胶电泳缓冲液中,3~4 V/ cm电压下进行电泳1 h左右,用鹰眼静态成像系统观察并摄片。
1.5.3 反转录聚合酶链反应 ①引物采用文献[8]报导PDGF-A链特引序系列,扩增片段为220 bp, PDGF-A Upstream: 5'-CCT GCC CAT TCG GAG GAA GAG-3', P DGF- A Downstream: 5'-TTG GCC ACC TTG ACG CTG CG-3'; β-actin引物扩增片段为310 bp。 ②PDGF-A链cDNA第一链的合成:样本总RNA (对照组和凝血酶组) 2 μg, 随机引物0.3 μg ,先加DEPC水10 μL,70°C温育50 min,置冰上后按顺序加入:5×buffer 5 μL, dNTP 1 μL, Rnasin 25 u,MMLV 1 μL, 加DEPC水至25 μL, 混匀后置37°C 90 min 95°C灭活反转 录酶10 min。 ③PCR: 反转录产物(cDNA) 2.5 μL, dNTP 1 μL (10 mm),10×buffer 5 μL, MgCl2 5 μL, PDGF-A上游引物:2 μL (10 pmol),下游引物2 μL (10 pmol),β-act in上游引物1 μL (10 pmol),下游引物1 μL (10 pmol)。Taq DNA Polymerase 0.5 μL (5×106 u/L ),加灭菌去离子水至50 μL, 混匀后加液体石蜡50 μL,短暂离心15 s。PCR扩增首轮循环:94°C 5 min,58°C 35 s,72°C 1 min;后续循环:94°C 1 min,58°C 35 s,72°C 1 min;末轮循环:94°C 1 min,58°C 35 s,72°C 10 min;共25~35个循环。实验组和对照组比较用31个循环。 ④PCR扩增产物用4%琼脂糖凝胶电泳,紫外线灯观察结果,鹰眼静态成像系统摄像。PCR像片经照相机翻拍后,再经激光光密度扫描,与内参照β-actin表达进行对比(PDGF-A/β-actin),分析凝血酶刺激血管平滑肌细胞PDGF-A mRNA相对表达量。
, 百拇医药
1.5.4 RNA斑点杂交[7] ①将一张尼龙膜在水中浸泡片刻使之湿润,再用20×SSC于室温浸泡1 h;用0.1 mol/L NaOH溶液清洗多孔过滤点样器,用10×SSC清洗每个加样孔,上面铺上尼龙膜。将10 μL RNA水溶液与下述溶液混和:100%甲酰胺 20 μL,37%甲醛 7 μL,20×SSC 2 μL,于68°C温育15 min,水浴冷却样品;每一份RNA样品加2倍体积20×SSC,混匀后加于孔中,每孔用1 mL 10×SSC清洗2次并继续抽吸5 min;取出尼龙膜,室温晾干后,夹在2张新华3号纸中间,置烤箱80°C干烤2 h固定RNA。 ②预杂交:预杂交液用6×SSC、5×Denhardt、0.5%SDS和100%/mL经变性断裂成片段的鲑鱼精或鲱鱼DNA、50%甲酰胺。预杂交体积为10 mL,当尼龙膜置入杂交管后加入预杂交液,42°C杂交炉内滚动预杂交12~16 h。 ③探针标记:按Prime-a-Gene Labeling试剂盒说明进行操作。 ④杂交:预杂交后,倾出预杂交液,换为新配制的杂交液,加入上法制备的 变性cDNA探针,杂交炉内杂交24~48 h。 ⑤洗膜并放射自显影。尼龙膜的重复使用按分子克隆实验指南方法进行[7]。
, 百拇医药
1.6 统计学处理
实验所得数据用均数±标准差( ±s)表示,两样本均数比较采用t检验。
±s)表示,两样本均数比较采用t检验。
2 结果
2.1 总RNA质量鉴定
用DNA/RNA测定仪检测RNA的260 nm/280 nm比值在1.6~1.8之间,符合Trizol试剂要求。1%琼脂糖凝胶电泳显示28S和18S两条电泳带清晰,前者约为后者的两倍,说明所提VSMC RNA无降解(图1, Figure 1),可用于反转录聚合酶链反应和核酸杂交实验。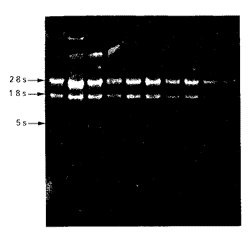
图1. RNA琼脂糖凝胶电泳
, http://www.100md.com
Figure 1. Agarose eletrophresis of RNA
2.2 不同浓度凝血酶对血管平滑肌细胞增殖的作用
从表1 (Table 1)中可以看出,随着凝血酶浓度的增加,血管平滑肌细胞3H-TdR掺入率也 增加。每升培养液内含500 u凝血酶时,3H-TdR掺入率就明显增加(P<0.01),每升培养液内含5 000 u凝血酶时,3H-TdR掺入率达高峰 。但当每升培养液内含10 000 u凝血酶时,3H-TdR掺入率较前反而降低。
表1. 不同浓度凝血酶对平滑肌细胞3H-TdR掺入率的影响( ±s )
±s )
, 百拇医药
Table 1. Effect of thrombin on VSMC 3H-TdR incoporation
in different concentration Thrombin (u/L)
Incoporation
0
12257±3724
100
12845±4168
500
19001±6985a
1000
, 百拇医药
22910±8277a
5000
26226±6746a
10000
13618±5302a
a: P<0.01, compared with 0 u/L thrombin group
2.3 凝血酶不同作用时间对3H-TdR掺入率的影响
从表2 (Table 2)中可以看出,凝血酶刺激VSMCs 24 h 3 H-TdR掺入率就较对照组明显增加(P<0.01),48 h 3 H-TdR掺入率较24 h下降,72 h 3 H-TdR掺入率较24 h下降更明显。
, 百拇医药
表2. 不同作用时间凝血酶对平滑肌细胞3H-TdR掺入率的影响
Table 2. The influence of thrombin onVSMC 3H-TdR
incoporation at different time Groups
24h
48h
72h
Control
100%
100%
100%
, http://www.100md.com
Thrombin
198%a
138%
42%
a: P<0.01, compared with control group
2.4 凝血酶对血小板源性生长因子-A链mRNA表达的影响
为了建立PDGF-A链和β-actin特异序列指数扩增条件,我们从25个循环开始,对凝血酶刺激 后4 h提取的SD大鼠胸主动脉VSMC总RNA经反转录为cDNA,用PDGF-A和β-actin引物在同一管内进行扩增,分析在一定模板量的条件下循环数与PCR产物的关系。结果表明在25~35个循环之间扩增反应处于指数增长期;然后将凝血酶刺激培养的VSMC后不同时间(0 h、 2 h、 4 h、 6 h、 8 h、 12 h、 24 h和48 h)提取的总RNA经反转录 为cDNA,在同样条件下(31个循环)扩增,结果如图2 (Figure 2)。
, http://www.100md.com
图2. 聚合酶链反应检测凝血酶诱导平滑肌细胞血小板源性生长因子-A链mRNA的表达
Figure 2. Effect of thrombin on PDGF-A mRNA expression in rat cultured VSMC
从图2 (Figure 2)和表3 (Table 3)中可以看出,凝血酶刺激后2 h VSMCs PDGF-A链mRN A较对照组表达开始增加,4~6 h较对照组表达明显增加,持续至12 h,24~48 h恢复到刺 激前水平。
表3. 凝血酶诱导平滑肌细胞血小板源性生长因子-A链mRNA的相对表达量
Table 3. The relative expression quantity of
VSMC PDGF-A mRNA induced by thrombin Time(h)
, 百拇医药
PDGF-A/β-actin
0
0.39
2
0.79
4
0.88
6
0.85
8
0.73
12
0.77
, 百拇医药
24
0.57
48
0.49
2.5 凝血酶对血小板源性生长因子-B链mRNA表达的影响
从图3 (Figure 3)和表4 (Table 4)可见, 凝血酶作用不同时间(0 h、 2 h、 4 h、 6 h、 8 h、 12 h、 24 h和48 h)后PDGF-B链mRNA 的表达在2~8 h明显下降,12 h后恢复到凝血酶作用前水平。图3 B为同一张膜的β-actin DNA探针Dot blot杂交图。
图3. 凝血酶刺激平滑肌细胞血小板源性生长
, http://www.100md.com
因子-B链mRNA表达的Dot blot杂交图.
A:PDGF-B链cDNA探针杂交图;B: β-acetin cDNA探针杂交图.
RNA: a. 20 μg, b. 10 μg, c. 5 μg, d. 2.5 μg, e. 1.25 μg
Figure 3. Effect of thrombin on PDGF- B mRNA expression in rat cultured VSMC.
A:PDGF-B cDNA probe hybridization; B:β-actin cDNA probe hybridization.
RNA: a.20 μg, b.10 μg, c.5 μg, d.2.5 μg, e.1.25 μg
, 百拇医药
表4. 凝血酶诱导平滑肌细胞血小板源性生长因子-B链 mRNA的相对表达量
Table 4. The relative expression quantity of
VSMC PDGF- B mRNA induced by thrombin Time(h)
PDGF-B/β-actin
0
1.26
2
0.54
4
0.63
, 百拇医药
6
0.56
8
0.59
12
1.01
24
1.03
48
0.88
3 讨论
近年来人们发现凝血酶具有促进VSMC增殖作用[1~4],凝血酶诱导VSMC增殖依赖于 其催化活性,凝血酶受体激活多肽在刺激VSMCs增殖方面与凝血酶同样有效。虽然已经知道凝血酶诱导VSMC增殖是通过类似于已经克隆的人和仓鼠的凝血酶受体来实现的,但参与调节受体介导的VSMC增殖机制尚未完全阐明。
, 百拇医药
最近研究发现,在凝血酶作用 后10 min内,凝血酶剪切巨核细胞和成纤维细胞表面的凝血酶受体。此外,凝血酶作用VSMC 后数秒钟内可提高细胞内游离钙浓度[9,10 ]。我们研究发现,凝血酶刺激VSMC增 殖呈浓度依赖性,在一定范围内VSMC增殖随凝血酶浓度的增加而递增,当凝血酶浓度达到10 000 u/L时,VSMC增殖反而下降。凝血酶诱导的VSMC的增殖显示了一个延迟的分裂作用,其 最大延迟分裂作用发生在凝血酶作用后48~72 h[10] 。我们的研究结果显示凝血 酶作用后24 h,VSMC内3H-TdR 掺入率较对照组明显增加,凝血酶作用后48 h,VSMC内3 H-TdR 掺入率较前开始下降,说明凝血酶促VSMC增殖作用在24 h后达到最大,与前面的研究有所不同。总之,凝血酶刺激VSMC的这种延迟性增殖效应可能是诱导了VSMC内自分泌和/或旁分泌生长因子所致。
血小板源性生长因子(PDGF)是机体普遍存在的促分裂剂。PDGF在正常生理情况下存在于血小板的颗粒内。当血小板与凝血酶、胶原、ADP等接触时便聚集脱颗粒将PDGF释放入血。由于血小板不具备合成蛋白质的能力,所以它可能只是PDGF的储存场所,其储存的PDGF来自骨髓的巨核细胞。此外,巨噬细胞、内皮细胞、VSMC等也能合成释放PDGF。人PDGF是由两条不同的多肽链组成,分别称A链和B链。A链和B链的氨基酸序列约有60%同源性。PDGF具有广范的生物学活性, PDGF对成纤维细胞、VSMC和中性粒细胞有趋化作用,PDGF诱导VSMCs和成纤维细胞的趋化性在损伤修复过程中极为重要,它能刺激多种细胞如平滑肌细胞、成纤维细胞、胶质细胞的分裂增殖,通过刺激胶原合成和胶原酶的活化作用调节 细胞外基质的更新,最终DNA合成和细胞裂解、增殖。PDGF还可诱导诸如c-myc和c-fos等原癌基因的表达[11]。
, 百拇医药
研究发现多种因素都可刺激VSMC血小板源性生长因子基因的表达,如生长因子、细胞因子和一些兴奋剂。我们的研究结果发现,培养的VSMC在基础状态下可表达PDGF-A mRNA,在凝血酶刺激培养VSMCs后2 h PDGF-A mRNA表达开始增加,4~6 h达高峰,持续到12 h,24~48 h恢复到正常,与Okazaki等[12]用Northern印迹杂交显示的凝血酶体外培养的VSMC表达PDGF-A mRNA而非PDGF-B mRNA结果基本一致。Kanthou等[4]研究发现凝血酶促进了血管平滑肌DNA合成和细胞增殖,以时间依赖的方式诱导PDGF-A mRNA表达,Bydlowski等[13]研究发现凝血酶以剂量依赖的方式诱导促进了血管平滑肌细胞DNA合成和细胞增殖,他认为凝血酶同时促进了血管平滑肌细胞DNA合成和细胞增殖,部分是由于增加了血管平滑肌细胞内源性PDGF-A产生。由此可见,凝血酶刺激VSMC增殖,部 分可能是诱导VSMC内自分泌和/或旁分泌生长因子所致。国外一些研究发现凝血酶还可诱导血 管平滑肌细胞表达表皮生长因子和碱性纤维母细胞生长因子[14,15],这进一步说明凝血酶促VSMC的增殖机制。
, 百拇医药
[作者简介] 王启贤,男,1959年出生,讲师,医学博士。 吕俊升,男,1930年5月出生,内科学心血管专业教授,博士生导师,博士后导师。中华医 学会浙江分会副会长,《中华心血管病杂志》、《中国动脉硬化杂志》编委。
参考文献
[1] McNamara CA, Sarembock IJ, Gimple LW, et al. Thrombin stimulates proliferation of cultured rat aortic smooth muscle cells by a proteolytically activated receptor [J]. J Clin Invest, 1993, 91: 94-98
[2] Graham DJ, Alexander IJ. The effects of thrombin on bovine aortic endothelial and smooth muscle cells [J]. J Vasc Surg,1990, 11: 307-310
, 百拇医药
[3] Herbert JM, Lamarche I, Dol F. Induction of vascular smooth muscle cell growth by selective activation of the thrombin receptor: effect of heparin [J]. FEBS Lett, 1992, 301: 155-159
[4] Kanthou C, Parray G, Wijelath E, et al . Thrombin-induced proliferation and expression of platelet-derived growth factor A-chain gene in human vascular smooth muslce cells [J]. FEBS Lett, 1992, 314:143-148
[5] Nelken NA, Soifer SJ, OKeefe J, et al. Thrombin receptor expression in normal and atherosclerotic human arteries [J]. J Clin Invest, 1992, 90(4): 1 614-621
, 百拇医药
[6] Wilcox JN, Rodriguez J, Subramanian R, et al. Characterization of thrombin receptor expression during vascular lesion formation [J]. Circulation Research, 1994, 75(6): 1 029-038
[7] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning, A Laboratory Manual, 2nd ed[M], Cold Spring Harbor Laboratory Press, 1989
[8] Koster R, Windstetter U, Gulizia JM, et al. Quantitative Polymerase Chain Reaction(PCR) to Analyze messenger-RNA expression in tissue obtained by directional atherectomy [J]. Angiology, 1994, 45: 911-916
, 百拇医药
[9] Chen LB, Buchanan JM. Mitogenicity activity of blood components, I: thrombin and prothrombin [J]. Proc Natl Acad Sci USA, 1975, 72: 131-135
[10] Chen LB, Teng NNH, Buchanan JM. Mitogenicity of thrombin and surface alteration on mouse spenocyte [J]. Exp Cell Res, 1976, 101: 41-46
[11] Kelly JD, Haldeman BA, Grant FG, et al. Platelet-derived growth factor(PDGF) receptor subunit dimerization and intersubunit trans-phosphorylation [J]. J Biol Chem, 1991, 266(14): 8 987-992
, http://www.100md.com
[12] Okazaki H, Majesky MW, Harker LA, et al. Regulation of platetlet-derived growth factor ligand and receptor gene expression by a-thrombin in vascular smooth muscle cells [J]. Circulation Research, 1992, 71: 1 285-293
[13] Bydlowski SP, Pares MM, Soares RP, et al. Stimulation of human smooth muscle cell proliferation by thrombin involves increased synthesis of platelet-derived growth factor [J]. Chest, 1998,114(1): 236-240
, 百拇医药 [14] Nakano T, Raines EW, Albraham JA, et al. Glucocorticoid inhibits thrombin induced expression of platelet-derived growth factor A-chain and heparinbinding epidermal growth factor in human aortic smooth musce cells [J]. J Biol Chem, 1993, 268(22): 941-947
[15] Weiss RH, Maduri M. The mitogenic effect of thrombin in vascular smooth muscle cells is argely due to basic fibroblast growth factor [J]. J Biol Chem, 1993, 268(5): 724-727
(此文1999-07-28收到, 2000-01-15修回), 百拇医药
单位:王启贤(昆明医学院第一附属医院心内科,昆明 650031);吕俊升(浙江医科大学第二附属医院心内科,杭州 310009)
关键词:凝血酶;肌,平滑,;血管;血小板源性生长因子;基因表达;大鼠
中国动脉硬化杂志000107[摘 要] 为了研究凝血酶对血管平滑肌细胞血小板源性生长因子基因表达的影响,探讨凝血酶刺激血管平滑肌细胞增殖的机制,通过培养SD大鼠胸 主动脉血管平滑肌细胞 ,以3H-TdR掺入率作为评价凝血酶促血管平滑肌细胞增殖的指标 ;用反转录聚合酶链反应检测凝血酶对血管平滑肌细胞血小板源性生长因子A链mRNA表达的 影响;用Dot blot检测凝血酶对血管平滑肌细胞血小板源性生长因子B链mRNA表达的影响。 结果表明,凝血酶促血管平滑肌细胞增殖呈浓度依赖性和时间依赖性,血管平滑肌细胞在基 础状态下可检测到血小板源性生长因子A和B链mRNA表达,凝血酶刺激血管平滑肌细胞后2 h 血小板源性生长因子A 链mRNA表达开始增加,4~6 h达高峰,持续12 h,24~48 h 恢复正常。提示凝血酶对血管平滑肌细胞具有较强的促增殖作用,凝血酶促血管平滑肌细胞 的增殖作用部分可能是通过诱导血管平滑肌细胞血小板源性生长因子A链mRNA的表达来实现的。
, 百拇医药
[中图分类号] Q786 [文献标识码] A
[文章编号] 1007-3949(2000)-01-0026-06
Influence on Platelet-Derived Growth Factor Ligand Gene Expression by Thrombin in Rat Vascular Smooth Muscle Cel1ls
WANG Qi-Xian LU Jun-Sheng
(Department of Medicine, the First Affiliated Hospital, Kun ming Medical Colleage, Kunming 650031, China)
ABSTRACT Aim To study the influence of thrombin on gene expression of platelet derived growth factor(PDGF) in cultured vascular smooth muscle cells and probe into the mechanism of proliferation of vascular smooth cells induced by thrombin . Methods Take the incoporation of 3 H-thymidine as the target to evaluate vascular smooth muscle cells proliferation; thrombin-induced expression of PDGF-A mRNA in the vascular smooth muscle cells was detected by RT-PCR, while PDGF-B mRNA expression by Dot blot hybridization. Results Thrombin remarkedly stimulated proliferation of SD rat vascular smooth muscle cells in a dose-depedent and a time-dependent manner; PDGF-A and PDGF-B mRNA was detected in quiescent cultured vascular smooth muscle cells in serum-free medium for 48 hours,the expression of PDGF-A mRNA was increased in VSMC after exposure to thrombin for two hours, and reachd a peak levels after 4~6 houres exposure to thrombin. The rising level of PDGF -A mRNA continued for 12 hours,and felt to the base level 24~48 hours afterwards. Conclusion Thrombin remarkedly stimulated proliferation of SD rat vascular smooth muscle cells in a dose-depedent and a time-dependent manner, thrombin-induced vascular smooth muscle cells proliferation was partially mediated by expression of PDGF- A mRNA.
, 百拇医药
MeSH Thrombin; Vascular; Muscle, Smooth; Platelet Derived Growth Factor; Gene Expression; Mice
经皮腔内冠状动脉成形术后再狭窄是以血管损伤部位血栓形成及血管平滑肌细胞(vascular smooth cells, VSMC)增殖为主要病理特征。近来研究表明,凝血酶除有促血凝作用之外 ,还具有许多细胞效应,如激活血小板使其粘附聚集,并释放5-羟色胺、血 栓素A2、血小 板因子-4、血小板源性生长因子(platelet-derived growth factor, PDGF)和许多凝血物质 ;刺激血管内皮细胞产生血小板源性生长因子、前列环素、内皮素、血小板活化因 子和纤溶酶原激活物;促进VSMC增殖[1~4]。而在动脉粥样硬化病灶中,内皮细胞 、内膜平滑肌细胞和巨噬细胞的凝血酶受体表达增加[5],在球囊导管损伤的动脉 血管壁中,VSMC的凝血酶受体表达也明显上调[6],推测凝血酶的增加可能促使VSM C迁移增殖。为进一步探讨其机制,本实验观察了凝血酶对培养的SD大鼠胸主动脉VSMC中PDG F基因表达的影响,旨在从分子生物学水平探讨凝血酶促VSMC增殖的机制。
, 百拇医药
1 材料和方法
1.1 材料
实验动物为 SD大鼠;新生牛血清购自杭州四季青公司;DMEM培养基、Trizol、鲑(鲱)鱼精、MMLV反转录酶购自GIBCOL-BRL公司;凝血酶为Sigma产品,来源于牛血清;随机引物标记试剂盒、随机引物、ECORI和dNTPs均为Promega产品;DEPC为Serva产品;去离子甲酰胺为CLONTECH产品;3H-TdR购自上海原子核研究所;α-32 P-dCTP购自北京亚辉生物医学工程公司;其余材料和试剂均为进口分装或国内产品。重组质粒由中科院上海细胞所提供。
1.2 血管平滑肌细胞培养
按贴块法进行SD大鼠胸主动脉VSMC原代培养,倒置显微镜下,细胞具有典型的“峰谷”结构。第4~8代细胞用于实验。
, http://www.100md.com
1.3 重组质粒的制备和cDNA插入片段的回收

采用碱裂解法制备小量质粒DNA[7]。Pic18-PDGF-BcDNA用ECORI酶切。用上海华顺生物试剂公司柱离心式胶回收试剂盒回收目的cDNA 。
1.4 凝血酶对血管平滑肌细胞3H-TdR掺入率的影响
1.4.1 细胞处理 用含15%小牛血清的DMEM培养液将VSMC数调整至5×107/L,加入24孔细胞培养板,每孔1 mL。48 h后培养板内已有80%的细胞呈汇合状态,吸出培养液,改用含0.4%小牛血清的DMEM培养48 h。
1.4.2 不同浓度凝血酶对3 H-TdR掺入率的影响 实验组加入含不同浓度凝血酶( 100 u/L、 500 u/L、 1 000 u/L、 5 000 u/L和10 000 u/L)的培养液,在对照组加入 等体积的含0.4%小牛血清的DMEM培养液。实验组每组为4孔,每孔反应体积为1 mL。加入刺激 因素的同时在培养板内加入3H-TdR 37 kBq/孔,作用24 h后吸出培养液,用磷酸缓冲生理盐水(phosphate buffer solution, PBS)洗孔三次,每孔用1 mL冰冷的10%三氯乙酸于4°C固定细胞30 min,再用10%三氯乙酸洗孔三次。每孔加入0.5 mL 1 mol/L NaOH裂解细胞,显微镜下观察到细胞彻底裂解后,每孔加入0.5 mL 1 mol/L HCl中和,最后每孔取1 mL加入5 mL闪烁液中,用液体闪烁计数仪测cpm值。
, 百拇医药
1.4.3 不同时间凝血酶对3 H-TdR掺入率的影响 实验分凝血酶组和对照组,凝血酶组每孔加入每升含凝血酶5 000 u的DMEM培养液(DMEM内含0.4%小牛血清);对照组加入等体积的含0.4%小牛血清的DMEM。凝血酶组和对照组各4孔,每孔培养液量为1 mL,分别加入凝血酶作用24 h、48 h和72 h,同时每孔加入3H-TdR 37 kBq ,作用不同时间后按前述方法终止3H-TdR掺入实验。
1.5 凝血酶对血小板源性生长因子基因表达的影响
1.5.1 细胞处理 用含15%小牛血清的DMEM培养液将细胞数调整为5×107/L,于100 mL培养瓶中培养,第3~4天生长达汇合状态,然后用含0.4%小牛血清的DMEM培养液培养48 h后,吸出培养液,分为8组,每组两瓶细胞。第一组用凝血酶(5 000 u /L)作用0 h,第2~8组分别作用2 h、 4 h、 6 h、 8 h、 12 h、 24 h和 48 h后提取总RNA。
, 百拇医药
1.5.2 总RNA提取及鉴定 用Trizol试剂,按试剂说明书方法提取VSMC的总RNA。取RNA样品4.5 μL,加入5×甲醛凝胶电泳缓冲液2 μL、甲醛3.5 μL和甲酰胺10 μL,于65°C温育15 min,冰育冷却,离心5 s,使管内所有液体集中于管底,加含EB 0.5 mg/L的甲醛凝胶上样缓冲液2 μL。加样前将凝胶预电泳5 min,电压降为5 V/cm。随后将样品加入凝胶加样孔中,将凝胶浸入1×甲醛凝胶电泳缓冲液中,3~4 V/ cm电压下进行电泳1 h左右,用鹰眼静态成像系统观察并摄片。
1.5.3 反转录聚合酶链反应 ①引物采用文献[8]报导PDGF-A链特引序系列,扩增片段为220 bp, PDGF-A Upstream: 5'-CCT GCC CAT TCG GAG GAA GAG-3', P DGF- A Downstream: 5'-TTG GCC ACC TTG ACG CTG CG-3'; β-actin引物扩增片段为310 bp。 ②PDGF-A链cDNA第一链的合成:样本总RNA (对照组和凝血酶组) 2 μg, 随机引物0.3 μg ,先加DEPC水10 μL,70°C温育50 min,置冰上后按顺序加入:5×buffer 5 μL, dNTP 1 μL, Rnasin 25 u,MMLV 1 μL, 加DEPC水至25 μL, 混匀后置37°C 90 min 95°C灭活反转 录酶10 min。 ③PCR: 反转录产物(cDNA) 2.5 μL, dNTP 1 μL (10 mm),10×buffer 5 μL, MgCl2 5 μL, PDGF-A上游引物:2 μL (10 pmol),下游引物2 μL (10 pmol),β-act in上游引物1 μL (10 pmol),下游引物1 μL (10 pmol)。Taq DNA Polymerase 0.5 μL (5×106 u/L ),加灭菌去离子水至50 μL, 混匀后加液体石蜡50 μL,短暂离心15 s。PCR扩增首轮循环:94°C 5 min,58°C 35 s,72°C 1 min;后续循环:94°C 1 min,58°C 35 s,72°C 1 min;末轮循环:94°C 1 min,58°C 35 s,72°C 10 min;共25~35个循环。实验组和对照组比较用31个循环。 ④PCR扩增产物用4%琼脂糖凝胶电泳,紫外线灯观察结果,鹰眼静态成像系统摄像。PCR像片经照相机翻拍后,再经激光光密度扫描,与内参照β-actin表达进行对比(PDGF-A/β-actin),分析凝血酶刺激血管平滑肌细胞PDGF-A mRNA相对表达量。
, 百拇医药
1.5.4 RNA斑点杂交[7] ①将一张尼龙膜在水中浸泡片刻使之湿润,再用20×SSC于室温浸泡1 h;用0.1 mol/L NaOH溶液清洗多孔过滤点样器,用10×SSC清洗每个加样孔,上面铺上尼龙膜。将10 μL RNA水溶液与下述溶液混和:100%甲酰胺 20 μL,37%甲醛 7 μL,20×SSC 2 μL,于68°C温育15 min,水浴冷却样品;每一份RNA样品加2倍体积20×SSC,混匀后加于孔中,每孔用1 mL 10×SSC清洗2次并继续抽吸5 min;取出尼龙膜,室温晾干后,夹在2张新华3号纸中间,置烤箱80°C干烤2 h固定RNA。 ②预杂交:预杂交液用6×SSC、5×Denhardt、0.5%SDS和100%/mL经变性断裂成片段的鲑鱼精或鲱鱼DNA、50%甲酰胺。预杂交体积为10 mL,当尼龙膜置入杂交管后加入预杂交液,42°C杂交炉内滚动预杂交12~16 h。 ③探针标记:按Prime-a-Gene Labeling试剂盒说明进行操作。 ④杂交:预杂交后,倾出预杂交液,换为新配制的杂交液,加入上法制备的 变性cDNA探针,杂交炉内杂交24~48 h。 ⑤洗膜并放射自显影。尼龙膜的重复使用按分子克隆实验指南方法进行[7]。
, 百拇医药
1.6 统计学处理
实验所得数据用均数±标准差(
 ±s)表示,两样本均数比较采用t检验。
±s)表示,两样本均数比较采用t检验。2 结果
2.1 总RNA质量鉴定
用DNA/RNA测定仪检测RNA的260 nm/280 nm比值在1.6~1.8之间,符合Trizol试剂要求。1%琼脂糖凝胶电泳显示28S和18S两条电泳带清晰,前者约为后者的两倍,说明所提VSMC RNA无降解(图1, Figure 1),可用于反转录聚合酶链反应和核酸杂交实验。

图1. RNA琼脂糖凝胶电泳
, http://www.100md.com
Figure 1. Agarose eletrophresis of RNA
2.2 不同浓度凝血酶对血管平滑肌细胞增殖的作用
从表1 (Table 1)中可以看出,随着凝血酶浓度的增加,血管平滑肌细胞3H-TdR掺入率也 增加。每升培养液内含500 u凝血酶时,3H-TdR掺入率就明显增加(P<0.01),每升培养液内含5 000 u凝血酶时,3H-TdR掺入率达高峰 。但当每升培养液内含10 000 u凝血酶时,3H-TdR掺入率较前反而降低。
表1. 不同浓度凝血酶对平滑肌细胞3H-TdR掺入率的影响(
 ±s )
±s ), 百拇医药
Table 1. Effect of thrombin on VSMC 3H-TdR incoporation
in different concentration Thrombin (u/L)
Incoporation
0
12257±3724
100
12845±4168
500
19001±6985a
1000
, 百拇医药
22910±8277a
5000
26226±6746a
10000
13618±5302a
a: P<0.01, compared with 0 u/L thrombin group
2.3 凝血酶不同作用时间对3H-TdR掺入率的影响
从表2 (Table 2)中可以看出,凝血酶刺激VSMCs 24 h 3 H-TdR掺入率就较对照组明显增加(P<0.01),48 h 3 H-TdR掺入率较24 h下降,72 h 3 H-TdR掺入率较24 h下降更明显。
, 百拇医药
表2. 不同作用时间凝血酶对平滑肌细胞3H-TdR掺入率的影响
Table 2. The influence of thrombin onVSMC 3H-TdR
incoporation at different time Groups
24h
48h
72h
Control
100%
100%
100%
, http://www.100md.com
Thrombin
198%a
138%
42%
a: P<0.01, compared with control group
2.4 凝血酶对血小板源性生长因子-A链mRNA表达的影响
为了建立PDGF-A链和β-actin特异序列指数扩增条件,我们从25个循环开始,对凝血酶刺激 后4 h提取的SD大鼠胸主动脉VSMC总RNA经反转录为cDNA,用PDGF-A和β-actin引物在同一管内进行扩增,分析在一定模板量的条件下循环数与PCR产物的关系。结果表明在25~35个循环之间扩增反应处于指数增长期;然后将凝血酶刺激培养的VSMC后不同时间(0 h、 2 h、 4 h、 6 h、 8 h、 12 h、 24 h和48 h)提取的总RNA经反转录 为cDNA,在同样条件下(31个循环)扩增,结果如图2 (Figure 2)。

, http://www.100md.com
图2. 聚合酶链反应检测凝血酶诱导平滑肌细胞血小板源性生长因子-A链mRNA的表达
Figure 2. Effect of thrombin on PDGF-A mRNA expression in rat cultured VSMC
从图2 (Figure 2)和表3 (Table 3)中可以看出,凝血酶刺激后2 h VSMCs PDGF-A链mRN A较对照组表达开始增加,4~6 h较对照组表达明显增加,持续至12 h,24~48 h恢复到刺 激前水平。
表3. 凝血酶诱导平滑肌细胞血小板源性生长因子-A链mRNA的相对表达量
Table 3. The relative expression quantity of
VSMC PDGF-A mRNA induced by thrombin Time(h)
, 百拇医药
PDGF-A/β-actin
0
0.39
2
0.79
4
0.88
6
0.85
8
0.73
12
0.77
, 百拇医药
24
0.57
48
0.49
2.5 凝血酶对血小板源性生长因子-B链mRNA表达的影响
从图3 (Figure 3)和表4 (Table 4)可见, 凝血酶作用不同时间(0 h、 2 h、 4 h、 6 h、 8 h、 12 h、 24 h和48 h)后PDGF-B链mRNA 的表达在2~8 h明显下降,12 h后恢复到凝血酶作用前水平。图3 B为同一张膜的β-actin DNA探针Dot blot杂交图。

图3. 凝血酶刺激平滑肌细胞血小板源性生长
, http://www.100md.com
因子-B链mRNA表达的Dot blot杂交图.
A:PDGF-B链cDNA探针杂交图;B: β-acetin cDNA探针杂交图.
RNA: a. 20 μg, b. 10 μg, c. 5 μg, d. 2.5 μg, e. 1.25 μg
Figure 3. Effect of thrombin on PDGF- B mRNA expression in rat cultured VSMC.
A:PDGF-B cDNA probe hybridization; B:β-actin cDNA probe hybridization.
RNA: a.20 μg, b.10 μg, c.5 μg, d.2.5 μg, e.1.25 μg
, 百拇医药
表4. 凝血酶诱导平滑肌细胞血小板源性生长因子-B链 mRNA的相对表达量
Table 4. The relative expression quantity of
VSMC PDGF- B mRNA induced by thrombin Time(h)
PDGF-B/β-actin
0
1.26
2
0.54
4
0.63
, 百拇医药
6
0.56
8
0.59
12
1.01
24
1.03
48
0.88
3 讨论
近年来人们发现凝血酶具有促进VSMC增殖作用[1~4],凝血酶诱导VSMC增殖依赖于 其催化活性,凝血酶受体激活多肽在刺激VSMCs增殖方面与凝血酶同样有效。虽然已经知道凝血酶诱导VSMC增殖是通过类似于已经克隆的人和仓鼠的凝血酶受体来实现的,但参与调节受体介导的VSMC增殖机制尚未完全阐明。
, 百拇医药
最近研究发现,在凝血酶作用 后10 min内,凝血酶剪切巨核细胞和成纤维细胞表面的凝血酶受体。此外,凝血酶作用VSMC 后数秒钟内可提高细胞内游离钙浓度[9,10 ]。我们研究发现,凝血酶刺激VSMC增 殖呈浓度依赖性,在一定范围内VSMC增殖随凝血酶浓度的增加而递增,当凝血酶浓度达到10 000 u/L时,VSMC增殖反而下降。凝血酶诱导的VSMC的增殖显示了一个延迟的分裂作用,其 最大延迟分裂作用发生在凝血酶作用后48~72 h[10] 。我们的研究结果显示凝血 酶作用后24 h,VSMC内3H-TdR 掺入率较对照组明显增加,凝血酶作用后48 h,VSMC内3 H-TdR 掺入率较前开始下降,说明凝血酶促VSMC增殖作用在24 h后达到最大,与前面的研究有所不同。总之,凝血酶刺激VSMC的这种延迟性增殖效应可能是诱导了VSMC内自分泌和/或旁分泌生长因子所致。
血小板源性生长因子(PDGF)是机体普遍存在的促分裂剂。PDGF在正常生理情况下存在于血小板的颗粒内。当血小板与凝血酶、胶原、ADP等接触时便聚集脱颗粒将PDGF释放入血。由于血小板不具备合成蛋白质的能力,所以它可能只是PDGF的储存场所,其储存的PDGF来自骨髓的巨核细胞。此外,巨噬细胞、内皮细胞、VSMC等也能合成释放PDGF。人PDGF是由两条不同的多肽链组成,分别称A链和B链。A链和B链的氨基酸序列约有60%同源性。PDGF具有广范的生物学活性, PDGF对成纤维细胞、VSMC和中性粒细胞有趋化作用,PDGF诱导VSMCs和成纤维细胞的趋化性在损伤修复过程中极为重要,它能刺激多种细胞如平滑肌细胞、成纤维细胞、胶质细胞的分裂增殖,通过刺激胶原合成和胶原酶的活化作用调节 细胞外基质的更新,最终DNA合成和细胞裂解、增殖。PDGF还可诱导诸如c-myc和c-fos等原癌基因的表达[11]。
, 百拇医药
研究发现多种因素都可刺激VSMC血小板源性生长因子基因的表达,如生长因子、细胞因子和一些兴奋剂。我们的研究结果发现,培养的VSMC在基础状态下可表达PDGF-A mRNA,在凝血酶刺激培养VSMCs后2 h PDGF-A mRNA表达开始增加,4~6 h达高峰,持续到12 h,24~48 h恢复到正常,与Okazaki等[12]用Northern印迹杂交显示的凝血酶体外培养的VSMC表达PDGF-A mRNA而非PDGF-B mRNA结果基本一致。Kanthou等[4]研究发现凝血酶促进了血管平滑肌DNA合成和细胞增殖,以时间依赖的方式诱导PDGF-A mRNA表达,Bydlowski等[13]研究发现凝血酶以剂量依赖的方式诱导促进了血管平滑肌细胞DNA合成和细胞增殖,他认为凝血酶同时促进了血管平滑肌细胞DNA合成和细胞增殖,部分是由于增加了血管平滑肌细胞内源性PDGF-A产生。由此可见,凝血酶刺激VSMC增殖,部 分可能是诱导VSMC内自分泌和/或旁分泌生长因子所致。国外一些研究发现凝血酶还可诱导血 管平滑肌细胞表达表皮生长因子和碱性纤维母细胞生长因子[14,15],这进一步说明凝血酶促VSMC的增殖机制。
, 百拇医药
[作者简介] 王启贤,男,1959年出生,讲师,医学博士。 吕俊升,男,1930年5月出生,内科学心血管专业教授,博士生导师,博士后导师。中华医 学会浙江分会副会长,《中华心血管病杂志》、《中国动脉硬化杂志》编委。
参考文献
[1] McNamara CA, Sarembock IJ, Gimple LW, et al. Thrombin stimulates proliferation of cultured rat aortic smooth muscle cells by a proteolytically activated receptor [J]. J Clin Invest, 1993, 91: 94-98
[2] Graham DJ, Alexander IJ. The effects of thrombin on bovine aortic endothelial and smooth muscle cells [J]. J Vasc Surg,1990, 11: 307-310
, 百拇医药
[3] Herbert JM, Lamarche I, Dol F. Induction of vascular smooth muscle cell growth by selective activation of the thrombin receptor: effect of heparin [J]. FEBS Lett, 1992, 301: 155-159
[4] Kanthou C, Parray G, Wijelath E, et al . Thrombin-induced proliferation and expression of platelet-derived growth factor A-chain gene in human vascular smooth muslce cells [J]. FEBS Lett, 1992, 314:143-148
[5] Nelken NA, Soifer SJ, OKeefe J, et al. Thrombin receptor expression in normal and atherosclerotic human arteries [J]. J Clin Invest, 1992, 90(4): 1 614-621
, 百拇医药
[6] Wilcox JN, Rodriguez J, Subramanian R, et al. Characterization of thrombin receptor expression during vascular lesion formation [J]. Circulation Research, 1994, 75(6): 1 029-038
[7] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning, A Laboratory Manual, 2nd ed[M], Cold Spring Harbor Laboratory Press, 1989
[8] Koster R, Windstetter U, Gulizia JM, et al. Quantitative Polymerase Chain Reaction(PCR) to Analyze messenger-RNA expression in tissue obtained by directional atherectomy [J]. Angiology, 1994, 45: 911-916
, 百拇医药
[9] Chen LB, Buchanan JM. Mitogenicity activity of blood components, I: thrombin and prothrombin [J]. Proc Natl Acad Sci USA, 1975, 72: 131-135
[10] Chen LB, Teng NNH, Buchanan JM. Mitogenicity of thrombin and surface alteration on mouse spenocyte [J]. Exp Cell Res, 1976, 101: 41-46
[11] Kelly JD, Haldeman BA, Grant FG, et al. Platelet-derived growth factor(PDGF) receptor subunit dimerization and intersubunit trans-phosphorylation [J]. J Biol Chem, 1991, 266(14): 8 987-992
, http://www.100md.com
[12] Okazaki H, Majesky MW, Harker LA, et al. Regulation of platetlet-derived growth factor ligand and receptor gene expression by a-thrombin in vascular smooth muscle cells [J]. Circulation Research, 1992, 71: 1 285-293
[13] Bydlowski SP, Pares MM, Soares RP, et al. Stimulation of human smooth muscle cell proliferation by thrombin involves increased synthesis of platelet-derived growth factor [J]. Chest, 1998,114(1): 236-240
, 百拇医药 [14] Nakano T, Raines EW, Albraham JA, et al. Glucocorticoid inhibits thrombin induced expression of platelet-derived growth factor A-chain and heparinbinding epidermal growth factor in human aortic smooth musce cells [J]. J Biol Chem, 1993, 268(22): 941-947
[15] Weiss RH, Maduri M. The mitogenic effect of thrombin in vascular smooth muscle cells is argely due to basic fibroblast growth factor [J]. J Biol Chem, 1993, 268(5): 724-727
(此文1999-07-28收到, 2000-01-15修回), 百拇医药