生长因子对成年大鼠肺泡Ⅱ型细胞增生的影响
作者:曾庆富 钱仲棐 孙去病 蒋海鹰 苏涛
单位:曾庆富 钱仲棐 蒋海鹰(湖南医科大学病理学教研室,);孙去病(肿瘤研究所,);苏涛(放射免疫中心,长沙 410078)
关键词:表皮生长因子;转化生长因子α;转化生长因子β;血小板源性生长因子;成纤维细胞生长因子;肺泡Ⅱ型细胞培养;大鼠
解剖学报000214 【摘要】 目的 探讨EGF、TGFα、TGFβ1、PDGF、bFGF对肺泡Ⅱ型细胞增生的影响。 方法 在原代培养的成年大鼠肺泡Ⅱ型细胞中,加入不同种类、不同剂量的生长因子,作用48h,测定3H-TdR掺入、细胞数量和Ki-67标记指数。 结果 EGF、TGFα均促进肺泡Ⅱ型细胞3H-TdR掺入量、细胞数量及Ki-67阳性标记率增加,TGFα比EGF的作用更强;TGFβ1的作用与EGF、TGFα相反。EGF、TGFα和TGFβ1对肺泡Ⅱ型细胞增生的影响均呈明显量效关系。PDGF和bFGF对肺泡Ⅱ型细胞增生的影响未显示出明确的量效规律。同时或先后加入TGFα和TGFβ1,肺泡Ⅱ型细胞的增生反应不同。 结论 EGF、TGFα和TGFβ1对培养的成年大鼠肺泡Ⅱ型细胞增生有明显的调控作用;TGFα和TGFβ1共同作用于细胞时,其生物效应与加入不同因子的时序有关。
, 百拇医药
【中图分类号】 R349.3;R392.11 【文献标识码】 A
【文章编号】 0529-1356(2000)02-152
EFFECTS OF GROWTH FACTORS ON THE PROLIFERATION
OF ADULT RAT ALVEOLAR TYPE Ⅱ CELLS
ZENG Qing-fu QIAN Zhong-fei,JIANG Hai-ying
(Department of Pathology,)
SUN Qu-bing
(Institute of Cancer Research,)
, 百拇医药
SU Tao
(Radioimmunologic Centre,Hunan Medical University,Changsha 410078,China)
【Abstract】 Objective To study in vitro effects of epidermal growth factor(EGF)
,transforming growth factor α and β1(TGFα,TGFβ1),platelet derived growth factor(PDGF),and basic fibroblast growth factor(bFGF) on proliferation of alveolar type Ⅱ cells isolated from adult rat. Methods 3H-TdR incorporation,cell counting,and Ki-67 labeling index were used in this experiment. Results Both EGF and TGFα increased 3H-TdR incorporation,cell numbers,and Ki-67 labeling index as compared with the control.TGFα effect was stronger than that of EGF.The effect of TGFβ1 was contrary with EGF and TGFα.Effects of EGF,TGFα,and TGFβ1 on alveolar type Ⅱ cells were dose-dependent,but there was no consistent dose-dependent response to either PDGF or bFGF.Cooperative effects of TGFα and TGFβ1 revealed that when TGFα and TGFβ1 were added simultaneously,or TGFα was added prior to TGFβ1.TGFα did not express the stimulating effect as used alone,but the inhibiting effect of TGF β1 was demonstrated.On the contrary,when TGFβ1 was added first,then addition of TGFα exhibited significantly stimulative effect. Conclusion Special growth factors including EGF,TGFα,and TGFβ1 have been implicated in the regulation of proliferation of cultured alveolar type Ⅱ cells isolated from adult rat.
, http://www.100md.com
【Key words】 Epidermal growth factor; Transforming growth factor alpha; Transform
ing growth factor beta; Platelet derived growth factor; Basic fibroblast growth fact
or; Alveolar type Ⅱ cell; Rat
肺泡Ⅱ型细胞是肺泡上皮的干细胞,参与肺生长发育、损伤修复过程。已有研究表明,人及动物肺损伤病变中均出现肺泡Ⅱ型细胞增生,本室研究发现,成年大鼠吸入石英粉尘或有机粉尘可致肺泡Ⅱ型细胞数量增多,体积增大[1,2]。
近年有关生长因子参与肺泡Ⅱ型细胞增生的体内外实验研究已有一些报道[3,4],由于肺泡Ⅱ型细胞分离纯化及培养均有一定的难度,国内尚缺乏体外研究报道,国外的研究主要集中在新生肺和胎肺肺泡Ⅱ型细胞。尚有许多问题有待进一步探讨,如不同年龄动物肺泡Ⅱ型细胞对生长因子反应的差异性;多种生长因子的协同作用对肺泡Ⅱ型细胞的影响;肺泡Ⅱ型细胞与其他肺细胞的相互作用是否受生长因子介导等。本实验用3H-TdR掺入、细胞计数、Ki-67标记指数,探讨表皮生长因子(EGF)、转化生长因子α和β1(TGFα,TGFβ1)、血小板源性生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)对体外培养的成年大鼠肺泡Ⅱ型细胞增生的影响。
, 百拇医药
材料和方法
1. 肺泡Ⅱ型细胞分离纯化及原代培养
实验动物为体重140~180g雄性SD大鼠共9只(鼠龄3~4月,清洁级)(湘雅医院动物科)。细胞分离培养按我室建立的方法进行[5]。经大鼠IgG(中国军事医学科学院)粘附纯化后的肺泡Ⅱ型细胞,碱性磷酸酶(AKP)染色,细胞纯度在90%以上。实验分3次进行,每次分离3只大鼠细胞供实验用。
2. 3H-TdR掺入
纯化后的肺泡Ⅱ型细胞用含20%FCS(杭州四季青生物材料研究所)的DMEM(Gibco/BRL)培养基调节细胞浓度至7×105个/ml,按4×105细胞/cm2的密度接种于24孔培养板中(相当于每孔1ml悬液),置5%CO2培养箱中培养24h。去除未贴壁细胞,更换含10%FCS的DMEM新鲜培基,同时加5μCi/ml 3H-TdR(30Ci/mmol,中国科学院上海原子能研究所)及不同剂量(0.01~100μg/L)的生长因子[包括rhEGF,rhTGFα,natural TGFβ1(Promega),rhbFGF(Baehringer Mannheim,B.M),PDGF-BB(Austral Biologicals)],同一剂量置3个复平孔。继续培养48h后用0.06%胰蛋白酶/0.01%EDTA消化收集细胞于玻璃纤维滤纸上,10%三氯乙酸固定,无水乙醇干燥。置37℃过夜烘干,将纤维滤纸置于闪烁瓶中加5ml混合闪烁液,Beckman LS3801液闪仪测定DMP值。
, 百拇医药
3. 细胞计数
肺泡Ⅱ型细胞培养24h,换液后第1次细胞计数作为基数。更换含10%FCS的DMEM再培养48h后对加生长因子的实验孔和未加生长因子的对照孔进行第2次细胞计数。计数方法[6]:在装有目测试格倒置显微镜下,随机计数培养孔中单位面积(1/16mm2)内细胞数,每1实验组计数6个单位面积,取其均值作为该组的细胞密度。
4. Ki-67阳性表达率
肺泡Ⅱ型细胞加生长因子培养48h后胰酶消化,细胞涂片,4℃丙酮固定30min,常规免疫组织化学SP法染色(Ki-67小鼠单抗为Santa Cruz产品,SP试剂盒为Maxin Biotech产品),实验设阳性对照和阴性对照。光镜观察,每1实验组计数300个以上细胞中的Ki-67阳性细胞数。
5. TGFα和TGFβ1协同作用实验
, http://www.100md.com
肺泡Ⅱ型细胞培养24h后,分6组:A组,对照组,不加任何生长因子;B组,TGFα组(100μg/L);C组,TGFβ1组(10μg/L);D组,TGFα(100μg/L)和TGFβ1(10μg/L)同时加入培养基中;E组,TGFα(100μg/L)作用6h后加TGFβ1(10μg/L);F组:TGFβ1(10μg/L)作用6h后加TGFα(100μg/L)。每组3个复平孔,按上述方法测定肺泡Ⅱ型细胞3H-TdR掺入和细胞计数。
6. 统计分析
3H-TdR掺入和细胞计数的数据以( ±
±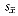 )表示,多组间比较用方差分析,两组间比较用t检测,Ki-67阳性细胞以百分率表示,两样本率用u检验。
)表示,多组间比较用方差分析,两组间比较用t检测,Ki-67阳性细胞以百分率表示,两样本率用u检验。
, http://www.100md.com
结果
1. 不同浓度生长因子对肺泡Ⅱ型细胞3H-TdR掺入的影响
随EGF或TGFα浓度递增(0.1~100μg/L),肺泡Ⅱ型细胞3H-TdR掺入量逐渐增大,呈量效正相关。与对照组比较,EGF,TGFα均能明显促进肺泡Ⅱ型细胞3H-TdR掺入(P<0.05和P<0.01)。在相同剂量下,TGFα的促进作用比EGF更强(P<0.01)(图1)。
图1 EGF和TGFα对肺泡Ⅱ型细胞3H-TdR掺入的影响
Fig.1 The effect of EGF,TGFα on 3H-TdR incorporation of
, http://www.100md.com
alveolar type Ⅱ cells
随TGFβ1浓度递增(0.01~10μg/L),3H-TdR掺入量则逐渐减少,TGFβ1能明显抑制肺泡Ⅱ型细胞3H-TdR掺入,呈量效负相关(P<0.01)(图2)。
图2 TGFβ1对肺泡Ⅱ型细胞3H-TdR的影响
Fig.2 The effect of TGFβ1 on 3H-TdR incorporation of
alveolar type Ⅱ cells
PDGF-BB(0.1~100μg/L)和bFGF(0.01~10μg/L)对肺泡Ⅱ型细胞3H-TdR掺入量的影响,PDGF-BB为10μg/L浓度时,3H-TdR掺入量比对照组减少8%,其他剂量组则轻微增加;bFGF为1μg/L浓度时,3H-TdR掺入量比对照组增加29%,其他各剂量组则下降8%~16%。两者的量效曲线呈“Z”字型,未显示出明确的量效规律性。
, http://www.100md.com
2. 不同浓度生长因子对肺泡Ⅱ型细胞数量增长的影响
肺泡Ⅱ型细胞培养24h换液后计数,平均为71.2±8.2个细胞/单位面积。再培养48h后第2次细胞计数,对照组为90.0±9.1个细胞。随EGF或TGFα浓度递增,肺泡Ⅱ型细胞数量也逐渐增多(图3);TGFβ1浓度递增,细胞数量则逐渐减少(图4)。EGF,TGFα和TGFβ1对肺泡Ⅱ型细胞数量增长的影响呈明显的量效关系。三者对肺泡Ⅱ型细胞数量增长的影响与对照组比较均有显著性差异(P<0.01)。PDGF-BB和bFGF对肺泡Ⅱ型细胞数量增长的影响与3H-TdR掺入结果相似,未显示出明确的量效规律性。
图3 EGF和TGFα对肺泡Ⅱ型细胞数量增长的影响
Fig.3 The effect of EGF,TGFα on number of alveolar type Ⅱ cells
, 百拇医药
图4 TGFβ1对肺泡Ⅱ型细胞数量增长的影响
Fig.4 The effect of TGFβ1 on number of alveolar type Ⅱ cells
3. 不同生长因子对肺泡Ⅱ型细胞Ki-67表达的影响
附表所示,TGFα组细胞的Ki-67表达率最高,其次为EGF组,两者均显著高于对照组(P<0.01)。TGFβ1组细胞的Ki-67阳性表达率最低,明显低于对照组(P<0.05)。
附表 不同生长因子对肺泡Ⅱ型细胞Ki-67表达的影响
Table The effect of growth factors on Ki-67 expression
of alveolar type Ⅱ cells 组别
, http://www.100md.com
group
计数细胞量
number of
counted cells
阳性细胞数
number of
positive cells
阳性率
positive rate
对照组
control group
423
, 百拇医药
55
13.0%
TGFα(100μg/L)
330
101
30.6%**
EGF(100μg/L)
335
71
21.2%**
TGFβ1(10μg/L)
321
, 百拇医药
28
8.4%*
动物数(N)=9只;与对照组比较*P<0.05,**P<0.01
number of animals 9 cases,*P<0.05 or **P<0.01 as compared with control group
4. TGFα、TGFβ1协同作用对肺泡Ⅱ型细胞增生的影响
图5所示,TGFα、TGFβ1同时加入培养基中(D组),肺泡Ⅱ型细胞3H-TdR掺入量比对照组(A组)减少5.7%。先加TGFα作用6h后加TGFβ1(E组),掺入量比A组增加7.6%;比D组增加14.9%。先加TGFβ1作用6h后加TGFα(F组),掺入量明显增加,比A组增加61.5%;比D组增加72.7%(P均<0.01)。TGFα和TGFβ1各类协同作用组(D、E、F组)均比单独TGFβ组(C组)的3H-TdR掺入量显著增高,而比单独TGFα组(B组)显著降低(P<0.01)。图6所示细胞计数结果与3H-TdR掺入的结果基本一致。
, 百拇医药
图5 TGFα和TGFβ1协同作用对肺泡Ⅱ型细胞3H-TdR掺入的影响
Fig.5 The effect of combined TGFα and TGFβ1 on 3H-TdR
incorporation of alveolar type Ⅱ cells.
★P<0.01 compared with A,#P<0.01 compared with C,ΔP<0.01 compared with B,■P<0.01 compared with D
图6 TGFα和TGFβ1协同作用对肺泡Ⅱ型细胞数量的影响
, http://www.100md.com Fig.6 The effect of combined TGFα and TGFβ1 on number
of alveolar type Ⅱ cells.
★P<0.01,★★P<0.05 compared with A,#P<0.01 compared with C,ΔP<0.01 compared with B,■P<0.01,■■P<0.05 compared with D
讨论
EGF、TGFα是多种上皮细胞的促分裂因子,它们均与EGF受体(EGFR)结合,激活受体内酪氨酸激酶导致自身磷酸化,调节细胞增生。EGF能促进孕猴体内的胎肺生长发育,加速肺泡Ⅱ型细胞结构和功能分化[7];大鼠出生前2d至终身,肺泡Ⅱ型细胞均有EGF蛋白表达[8]。但体外实验发现,不同年龄动物的肺泡Ⅱ型细胞对EGF的反应性存在差异,大鼠胎肺肺泡Ⅱ型细胞对EGF无反应[9],而EGF、TGFα能明显促进新生兔肺泡Ⅱ型细胞增生[6]。本实验用原代培养的成年大鼠肺泡Ⅱ型细胞,以3H-TdR掺入、细胞计数和Ki-67阳性率作为细胞增殖参数,结果显示EGF、TGFα均能引起3H-TdR掺入量增大以及细胞数量增长和Ki-67阳性率增加。而且在相同剂量下,TGFα的促进作用比EGF更强,与Ryan等[6]和Leslie等[10]报道的新生兔和成年大鼠肺肺泡Ⅱ型细胞的研究结果相似。说明成年和新生动物的肺泡Ⅱ型细胞对EGF、TGFα的反应性基本一致,但与胎肺肺泡Ⅱ型细胞的反应性可能存在差异。至于不同动物间是否存在差异,尚未见研究报道。
, 百拇医药
TGFβ1是一种多效调节因子,可抑制大多数上皮细胞生长。TGFβ1对培养的人正常支气管上皮细胞增生有明显抑制作用,对胎鼠和新生兔的肺泡Ⅱ型细胞也表现出明显抑制效应[6,11]。本实验结果显示TGFβ1能明显抑制成年大鼠肺泡Ⅱ型细胞3H-TdR渗入,细胞数量和Ki-67阳性率也较对照组减少。由此可见无论是胎肺、新生肺或成年肺,TGFβ1都是肺泡Ⅱ型细胞增生的有效抑制因子。
Antoniades等[12]用免疫组织化学法、原位杂交及Northern blot技术,证实在人特发性肺纤维化病变中肺泡上皮细胞有C-sis/PDGF-B mRNA和PDGF样蛋白表达,但未检测出PDGF受体mRNA。在体外,PDGF能促进培养的大鼠胎肺肺泡Ⅱ型细胞增生[10];对新生兔肺泡Ⅱ型细胞增生有轻微作用,但未显示出量效相关效应[6]。本实验用较大剂量(0.1~100μg/L)PDGF作用于成年大鼠肺泡Ⅱ型细胞,也未显示出PDGF与肺泡Ⅱ型细胞增生有明确的量效规律。说明成年肺、新生肺的肺泡Ⅱ型细胞对PDGF的反应性与胎肺肺泡Ⅱ型细胞的反应性也存在差别。
, 百拇医药
文献报道,酸性成纤维细胞生长因子(aFGF)能促进成年大鼠肺泡Ⅱ型细胞增生,其效应比TGFα更强[10,13],而且对低密度培养的成年大鼠肺泡Ⅱ型细胞克隆形成至关重要[12]。bFGF与aFGF结构相关,本实验用0.01~10μg/L bFGF作用于成年大鼠肺泡Ⅱ型细胞,其3H-TdR掺入、细胞计数与bFGF无明确的量效规律,说明bFGF与aFGF对肺泡Ⅱ型细胞的作用可能存在差别。
尽管研究单个生长因子对肺泡Ⅱ型细胞增生的影响十分重要,但应注意到组织和细胞的稳态机制是由细胞因子网络控制,而不是单一细胞因子完成,体内肺发育及肺损伤修复过程不同阶段有多种生长因子存在和参与[6]。本实验将TGFα,TGFβ1以不同时间顺序加入同一培养体系中,结果显示,TGFα、TGFβ1同时加入培养基中,细胞增生反应与对照组相似,表明TGFα(100μg/L)和TGFβ1(10μg/L)对肺泡Ⅱ型细胞的作用可以相互拮抗而抵消。但若先加入TGFα再加TGFβ1(相隔6h),只呈现轻微增生效应;若先加TGFβ1再加TGFα,则表现为明显的TGFα促进效应。从时序上看,先后加入TGFα和TGFβ1或反之,往往表现为后加入的生长因子效应。可能的原因或是与生长因子作用的半衰期有关,或许可能是先加入的一种生长因子(TGFα或TGFβ1)6h内仅改变了少部分细胞的细胞周期进程,其生物效应未完全表现出来,即被后加入的另一种生长因子所拮抗。值得注意的是,所有TGFα、TGFβ1协同作用组所致的细胞增生反应,都比单独的TGFα或TGFβ1的作用弱,这也说明TGFα或TGFβ1都受到了另一个作用相反的生长因子的制约。关于TGFα、TGFβ1相互拮抗机制尚不清楚。有人认为与TGFβ1影响的TGFα与受体结合,降低TGFα所致的EGFR磷酸化有关[14]。我们研究中发现TGFα能上调肺泡Ⅱ型细胞的细胞周期蛋白依赖性激酶4(CDK4)mRNA和蛋白表达,而TGFβ1则对CDK4起下调作用,CDK4可能为TGFα、TGFβ1共同的靶分子,成为肺泡Ⅱ型细胞增生调控的共同信号通路(另文报道)。
, 百拇医药
【基金项目】国家自然科学基金资助项目(39400048)
作者简介:曾庆富(1963—),男(汉族),湖南澧县人,博士,教授,教研室副主任
参考文献
[1]钱仲棐,郭晓璇,戚以谟.吸入石英粉尘对大鼠肺泡Ⅱ型上皮细胞的影响[J].湖南医科大学学报,1995,20(1):13-15.
[2]郭晓璇,钱仲棐.实验性过敏性肺泡炎Ⅱ型肺泡上皮细胞的改变[J].中华病理学杂志,1992,21(4):241-243.
[3]Leslie CC,Mc-shannor K,Shannon JM,et al.Heparin-binding EGF-like growth factor is mitogen for rat alveolar type Ⅱ cell[J].Am J Respir Cell Mol Biol,1997,16(3):379-387.
, 百拇医药
[4]Panos RJ,Patel B,Bak PM.Intratracheal administration of hepatocyte growth factor/scatter factor stimulates rat alveolar type Ⅱ cell proliferation in Vivo[J].Am J Respir Cell Mol Biol,1996,15(5):574-581.
[5]曾庆富,蒋海鹰,钱仲棐,等.肺泡Ⅱ型上皮细胞的分离纯化和原代培养[J].中华病理学杂志,1998,27(4):384-385.
[6]Ryan RM,Mineo-KuhN MM,Kramer CM,et al.Growth factors alter neonatal type Ⅱ alveolar epithelial cell proliferation[J].Am J Physiol,1994,266(1ptl):L17-22.
, 百拇医药
[7]Plopper CG,ST-George-JA,Read LC,et al.Acceleration of alveolar type Ⅱ cell differentiation in fetal rhesus monkey lung by administration of EGF[J].Am J Physiol,1992,262(3pt10):L313-319.
[8]Raaberg L,Poulsen SS,Nexo E,et al.Epidermal growth factor in the rat lung[J].Histochemistry,1991,95(5):471-475.
[9]Stiles AO,Smith BT,Post M.Reciprocal autocrine and paracrine regulation of growth of mesenchymal and alveolar epithelial cells from fetal lung[J].Exp Lung Res,1986,11(1):165-177.
, 百拇医药
[10]Leslic CC,Mc-shannon K,Masson RJ,et al.Proliferation of rat alveolar epthelial cells in low density primary culture[J].Am J Respir cell Mol Biol,1993,9(1):64-72.
[11]Torday JS,Kourembanas S.Fetal rat lung fibroblasts produce a TGF-β homolog that blocks alveolar type Ⅱ cell maturation[J].Dev Biology,1990,139(1):35-41.
[12]Antoniades HN,Galanopoulos T,Neville-Golden J,et al.Malignant epithelial cells in primary human lung carcinomas coexpress in vivo platelet-derived growth factor(PDGF)and PDGF receptor mRNA and their protin products[J].Proc Natl Acad Sci USA,1992,89(4):3942-3947.
, 百拇医药
[13]Shirator M,Michalopoulos G,Shinozuka H,et al.Hepatocyte growth factor stimulate DNA synthesis in alveolar eptielial type Ⅱ cell in vitro[J].Am J Respir cell Mol Biol,1995,12(2):171-180.
[14]Chess PR,Ryan RM,Finkelstein JN.Tyrosine kinase activity is necessary for growth factor-stimulated rabbit type Ⅱ pneumocyte proliferation[J].Pediatr Res,1994,36(4):481-486.
【收稿日期】1999-01-08
【修稿日期】1999-07-05, 百拇医药
单位:曾庆富 钱仲棐 蒋海鹰(湖南医科大学病理学教研室,);孙去病(肿瘤研究所,);苏涛(放射免疫中心,长沙 410078)
关键词:表皮生长因子;转化生长因子α;转化生长因子β;血小板源性生长因子;成纤维细胞生长因子;肺泡Ⅱ型细胞培养;大鼠
解剖学报000214 【摘要】 目的 探讨EGF、TGFα、TGFβ1、PDGF、bFGF对肺泡Ⅱ型细胞增生的影响。 方法 在原代培养的成年大鼠肺泡Ⅱ型细胞中,加入不同种类、不同剂量的生长因子,作用48h,测定3H-TdR掺入、细胞数量和Ki-67标记指数。 结果 EGF、TGFα均促进肺泡Ⅱ型细胞3H-TdR掺入量、细胞数量及Ki-67阳性标记率增加,TGFα比EGF的作用更强;TGFβ1的作用与EGF、TGFα相反。EGF、TGFα和TGFβ1对肺泡Ⅱ型细胞增生的影响均呈明显量效关系。PDGF和bFGF对肺泡Ⅱ型细胞增生的影响未显示出明确的量效规律。同时或先后加入TGFα和TGFβ1,肺泡Ⅱ型细胞的增生反应不同。 结论 EGF、TGFα和TGFβ1对培养的成年大鼠肺泡Ⅱ型细胞增生有明显的调控作用;TGFα和TGFβ1共同作用于细胞时,其生物效应与加入不同因子的时序有关。
, 百拇医药
【中图分类号】 R349.3;R392.11 【文献标识码】 A
【文章编号】 0529-1356(2000)02-152
EFFECTS OF GROWTH FACTORS ON THE PROLIFERATION
OF ADULT RAT ALVEOLAR TYPE Ⅱ CELLS
ZENG Qing-fu QIAN Zhong-fei,JIANG Hai-ying
(Department of Pathology,)
SUN Qu-bing
(Institute of Cancer Research,)
, 百拇医药
SU Tao
(Radioimmunologic Centre,Hunan Medical University,Changsha 410078,China)
【Abstract】 Objective To study in vitro effects of epidermal growth factor(EGF)
,transforming growth factor α and β1(TGFα,TGFβ1),platelet derived growth factor(PDGF),and basic fibroblast growth factor(bFGF) on proliferation of alveolar type Ⅱ cells isolated from adult rat. Methods 3H-TdR incorporation,cell counting,and Ki-67 labeling index were used in this experiment. Results Both EGF and TGFα increased 3H-TdR incorporation,cell numbers,and Ki-67 labeling index as compared with the control.TGFα effect was stronger than that of EGF.The effect of TGFβ1 was contrary with EGF and TGFα.Effects of EGF,TGFα,and TGFβ1 on alveolar type Ⅱ cells were dose-dependent,but there was no consistent dose-dependent response to either PDGF or bFGF.Cooperative effects of TGFα and TGFβ1 revealed that when TGFα and TGFβ1 were added simultaneously,or TGFα was added prior to TGFβ1.TGFα did not express the stimulating effect as used alone,but the inhibiting effect of TGF β1 was demonstrated.On the contrary,when TGFβ1 was added first,then addition of TGFα exhibited significantly stimulative effect. Conclusion Special growth factors including EGF,TGFα,and TGFβ1 have been implicated in the regulation of proliferation of cultured alveolar type Ⅱ cells isolated from adult rat.
, http://www.100md.com
【Key words】 Epidermal growth factor; Transforming growth factor alpha; Transform
ing growth factor beta; Platelet derived growth factor; Basic fibroblast growth fact
or; Alveolar type Ⅱ cell; Rat
肺泡Ⅱ型细胞是肺泡上皮的干细胞,参与肺生长发育、损伤修复过程。已有研究表明,人及动物肺损伤病变中均出现肺泡Ⅱ型细胞增生,本室研究发现,成年大鼠吸入石英粉尘或有机粉尘可致肺泡Ⅱ型细胞数量增多,体积增大[1,2]。
近年有关生长因子参与肺泡Ⅱ型细胞增生的体内外实验研究已有一些报道[3,4],由于肺泡Ⅱ型细胞分离纯化及培养均有一定的难度,国内尚缺乏体外研究报道,国外的研究主要集中在新生肺和胎肺肺泡Ⅱ型细胞。尚有许多问题有待进一步探讨,如不同年龄动物肺泡Ⅱ型细胞对生长因子反应的差异性;多种生长因子的协同作用对肺泡Ⅱ型细胞的影响;肺泡Ⅱ型细胞与其他肺细胞的相互作用是否受生长因子介导等。本实验用3H-TdR掺入、细胞计数、Ki-67标记指数,探讨表皮生长因子(EGF)、转化生长因子α和β1(TGFα,TGFβ1)、血小板源性生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)对体外培养的成年大鼠肺泡Ⅱ型细胞增生的影响。
, 百拇医药
材料和方法
1. 肺泡Ⅱ型细胞分离纯化及原代培养
实验动物为体重140~180g雄性SD大鼠共9只(鼠龄3~4月,清洁级)(湘雅医院动物科)。细胞分离培养按我室建立的方法进行[5]。经大鼠IgG(中国军事医学科学院)粘附纯化后的肺泡Ⅱ型细胞,碱性磷酸酶(AKP)染色,细胞纯度在90%以上。实验分3次进行,每次分离3只大鼠细胞供实验用。
2. 3H-TdR掺入
纯化后的肺泡Ⅱ型细胞用含20%FCS(杭州四季青生物材料研究所)的DMEM(Gibco/BRL)培养基调节细胞浓度至7×105个/ml,按4×105细胞/cm2的密度接种于24孔培养板中(相当于每孔1ml悬液),置5%CO2培养箱中培养24h。去除未贴壁细胞,更换含10%FCS的DMEM新鲜培基,同时加5μCi/ml 3H-TdR(30Ci/mmol,中国科学院上海原子能研究所)及不同剂量(0.01~100μg/L)的生长因子[包括rhEGF,rhTGFα,natural TGFβ1(Promega),rhbFGF(Baehringer Mannheim,B.M),PDGF-BB(Austral Biologicals)],同一剂量置3个复平孔。继续培养48h后用0.06%胰蛋白酶/0.01%EDTA消化收集细胞于玻璃纤维滤纸上,10%三氯乙酸固定,无水乙醇干燥。置37℃过夜烘干,将纤维滤纸置于闪烁瓶中加5ml混合闪烁液,Beckman LS3801液闪仪测定DMP值。
, 百拇医药
3. 细胞计数
肺泡Ⅱ型细胞培养24h,换液后第1次细胞计数作为基数。更换含10%FCS的DMEM再培养48h后对加生长因子的实验孔和未加生长因子的对照孔进行第2次细胞计数。计数方法[6]:在装有目测试格倒置显微镜下,随机计数培养孔中单位面积(1/16mm2)内细胞数,每1实验组计数6个单位面积,取其均值作为该组的细胞密度。
4. Ki-67阳性表达率
肺泡Ⅱ型细胞加生长因子培养48h后胰酶消化,细胞涂片,4℃丙酮固定30min,常规免疫组织化学SP法染色(Ki-67小鼠单抗为Santa Cruz产品,SP试剂盒为Maxin Biotech产品),实验设阳性对照和阴性对照。光镜观察,每1实验组计数300个以上细胞中的Ki-67阳性细胞数。
5. TGFα和TGFβ1协同作用实验
, http://www.100md.com
肺泡Ⅱ型细胞培养24h后,分6组:A组,对照组,不加任何生长因子;B组,TGFα组(100μg/L);C组,TGFβ1组(10μg/L);D组,TGFα(100μg/L)和TGFβ1(10μg/L)同时加入培养基中;E组,TGFα(100μg/L)作用6h后加TGFβ1(10μg/L);F组:TGFβ1(10μg/L)作用6h后加TGFα(100μg/L)。每组3个复平孔,按上述方法测定肺泡Ⅱ型细胞3H-TdR掺入和细胞计数。
6. 统计分析
3H-TdR掺入和细胞计数的数据以(
 ±
±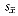 )表示,多组间比较用方差分析,两组间比较用t检测,Ki-67阳性细胞以百分率表示,两样本率用u检验。
)表示,多组间比较用方差分析,两组间比较用t检测,Ki-67阳性细胞以百分率表示,两样本率用u检验。, http://www.100md.com
结果
1. 不同浓度生长因子对肺泡Ⅱ型细胞3H-TdR掺入的影响
随EGF或TGFα浓度递增(0.1~100μg/L),肺泡Ⅱ型细胞3H-TdR掺入量逐渐增大,呈量效正相关。与对照组比较,EGF,TGFα均能明显促进肺泡Ⅱ型细胞3H-TdR掺入(P<0.05和P<0.01)。在相同剂量下,TGFα的促进作用比EGF更强(P<0.01)(图1)。

图1 EGF和TGFα对肺泡Ⅱ型细胞3H-TdR掺入的影响
Fig.1 The effect of EGF,TGFα on 3H-TdR incorporation of
, http://www.100md.com
alveolar type Ⅱ cells
随TGFβ1浓度递增(0.01~10μg/L),3H-TdR掺入量则逐渐减少,TGFβ1能明显抑制肺泡Ⅱ型细胞3H-TdR掺入,呈量效负相关(P<0.01)(图2)。

图2 TGFβ1对肺泡Ⅱ型细胞3H-TdR的影响
Fig.2 The effect of TGFβ1 on 3H-TdR incorporation of
alveolar type Ⅱ cells
PDGF-BB(0.1~100μg/L)和bFGF(0.01~10μg/L)对肺泡Ⅱ型细胞3H-TdR掺入量的影响,PDGF-BB为10μg/L浓度时,3H-TdR掺入量比对照组减少8%,其他剂量组则轻微增加;bFGF为1μg/L浓度时,3H-TdR掺入量比对照组增加29%,其他各剂量组则下降8%~16%。两者的量效曲线呈“Z”字型,未显示出明确的量效规律性。
, http://www.100md.com
2. 不同浓度生长因子对肺泡Ⅱ型细胞数量增长的影响
肺泡Ⅱ型细胞培养24h换液后计数,平均为71.2±8.2个细胞/单位面积。再培养48h后第2次细胞计数,对照组为90.0±9.1个细胞。随EGF或TGFα浓度递增,肺泡Ⅱ型细胞数量也逐渐增多(图3);TGFβ1浓度递增,细胞数量则逐渐减少(图4)。EGF,TGFα和TGFβ1对肺泡Ⅱ型细胞数量增长的影响呈明显的量效关系。三者对肺泡Ⅱ型细胞数量增长的影响与对照组比较均有显著性差异(P<0.01)。PDGF-BB和bFGF对肺泡Ⅱ型细胞数量增长的影响与3H-TdR掺入结果相似,未显示出明确的量效规律性。

图3 EGF和TGFα对肺泡Ⅱ型细胞数量增长的影响
Fig.3 The effect of EGF,TGFα on number of alveolar type Ⅱ cells

, 百拇医药
图4 TGFβ1对肺泡Ⅱ型细胞数量增长的影响
Fig.4 The effect of TGFβ1 on number of alveolar type Ⅱ cells
3. 不同生长因子对肺泡Ⅱ型细胞Ki-67表达的影响
附表所示,TGFα组细胞的Ki-67表达率最高,其次为EGF组,两者均显著高于对照组(P<0.01)。TGFβ1组细胞的Ki-67阳性表达率最低,明显低于对照组(P<0.05)。
附表 不同生长因子对肺泡Ⅱ型细胞Ki-67表达的影响
Table The effect of growth factors on Ki-67 expression
of alveolar type Ⅱ cells 组别
, http://www.100md.com
group
计数细胞量
number of
counted cells
阳性细胞数
number of
positive cells
阳性率
positive rate
对照组
control group
423
, 百拇医药
55
13.0%
TGFα(100μg/L)
330
101
30.6%**
EGF(100μg/L)
335
71
21.2%**
TGFβ1(10μg/L)
321
, 百拇医药
28
8.4%*
动物数(N)=9只;与对照组比较*P<0.05,**P<0.01
number of animals 9 cases,*P<0.05 or **P<0.01 as compared with control group
4. TGFα、TGFβ1协同作用对肺泡Ⅱ型细胞增生的影响
图5所示,TGFα、TGFβ1同时加入培养基中(D组),肺泡Ⅱ型细胞3H-TdR掺入量比对照组(A组)减少5.7%。先加TGFα作用6h后加TGFβ1(E组),掺入量比A组增加7.6%;比D组增加14.9%。先加TGFβ1作用6h后加TGFα(F组),掺入量明显增加,比A组增加61.5%;比D组增加72.7%(P均<0.01)。TGFα和TGFβ1各类协同作用组(D、E、F组)均比单独TGFβ组(C组)的3H-TdR掺入量显著增高,而比单独TGFα组(B组)显著降低(P<0.01)。图6所示细胞计数结果与3H-TdR掺入的结果基本一致。

, 百拇医药
图5 TGFα和TGFβ1协同作用对肺泡Ⅱ型细胞3H-TdR掺入的影响
Fig.5 The effect of combined TGFα and TGFβ1 on 3H-TdR
incorporation of alveolar type Ⅱ cells.
★P<0.01 compared with A,#P<0.01 compared with C,ΔP<0.01 compared with B,■P<0.01 compared with D

图6 TGFα和TGFβ1协同作用对肺泡Ⅱ型细胞数量的影响
, http://www.100md.com Fig.6 The effect of combined TGFα and TGFβ1 on number
of alveolar type Ⅱ cells.
★P<0.01,★★P<0.05 compared with A,#P<0.01 compared with C,ΔP<0.01 compared with B,■P<0.01,■■P<0.05 compared with D
讨论
EGF、TGFα是多种上皮细胞的促分裂因子,它们均与EGF受体(EGFR)结合,激活受体内酪氨酸激酶导致自身磷酸化,调节细胞增生。EGF能促进孕猴体内的胎肺生长发育,加速肺泡Ⅱ型细胞结构和功能分化[7];大鼠出生前2d至终身,肺泡Ⅱ型细胞均有EGF蛋白表达[8]。但体外实验发现,不同年龄动物的肺泡Ⅱ型细胞对EGF的反应性存在差异,大鼠胎肺肺泡Ⅱ型细胞对EGF无反应[9],而EGF、TGFα能明显促进新生兔肺泡Ⅱ型细胞增生[6]。本实验用原代培养的成年大鼠肺泡Ⅱ型细胞,以3H-TdR掺入、细胞计数和Ki-67阳性率作为细胞增殖参数,结果显示EGF、TGFα均能引起3H-TdR掺入量增大以及细胞数量增长和Ki-67阳性率增加。而且在相同剂量下,TGFα的促进作用比EGF更强,与Ryan等[6]和Leslie等[10]报道的新生兔和成年大鼠肺肺泡Ⅱ型细胞的研究结果相似。说明成年和新生动物的肺泡Ⅱ型细胞对EGF、TGFα的反应性基本一致,但与胎肺肺泡Ⅱ型细胞的反应性可能存在差异。至于不同动物间是否存在差异,尚未见研究报道。
, 百拇医药
TGFβ1是一种多效调节因子,可抑制大多数上皮细胞生长。TGFβ1对培养的人正常支气管上皮细胞增生有明显抑制作用,对胎鼠和新生兔的肺泡Ⅱ型细胞也表现出明显抑制效应[6,11]。本实验结果显示TGFβ1能明显抑制成年大鼠肺泡Ⅱ型细胞3H-TdR渗入,细胞数量和Ki-67阳性率也较对照组减少。由此可见无论是胎肺、新生肺或成年肺,TGFβ1都是肺泡Ⅱ型细胞增生的有效抑制因子。
Antoniades等[12]用免疫组织化学法、原位杂交及Northern blot技术,证实在人特发性肺纤维化病变中肺泡上皮细胞有C-sis/PDGF-B mRNA和PDGF样蛋白表达,但未检测出PDGF受体mRNA。在体外,PDGF能促进培养的大鼠胎肺肺泡Ⅱ型细胞增生[10];对新生兔肺泡Ⅱ型细胞增生有轻微作用,但未显示出量效相关效应[6]。本实验用较大剂量(0.1~100μg/L)PDGF作用于成年大鼠肺泡Ⅱ型细胞,也未显示出PDGF与肺泡Ⅱ型细胞增生有明确的量效规律。说明成年肺、新生肺的肺泡Ⅱ型细胞对PDGF的反应性与胎肺肺泡Ⅱ型细胞的反应性也存在差别。
, 百拇医药
文献报道,酸性成纤维细胞生长因子(aFGF)能促进成年大鼠肺泡Ⅱ型细胞增生,其效应比TGFα更强[10,13],而且对低密度培养的成年大鼠肺泡Ⅱ型细胞克隆形成至关重要[12]。bFGF与aFGF结构相关,本实验用0.01~10μg/L bFGF作用于成年大鼠肺泡Ⅱ型细胞,其3H-TdR掺入、细胞计数与bFGF无明确的量效规律,说明bFGF与aFGF对肺泡Ⅱ型细胞的作用可能存在差别。
尽管研究单个生长因子对肺泡Ⅱ型细胞增生的影响十分重要,但应注意到组织和细胞的稳态机制是由细胞因子网络控制,而不是单一细胞因子完成,体内肺发育及肺损伤修复过程不同阶段有多种生长因子存在和参与[6]。本实验将TGFα,TGFβ1以不同时间顺序加入同一培养体系中,结果显示,TGFα、TGFβ1同时加入培养基中,细胞增生反应与对照组相似,表明TGFα(100μg/L)和TGFβ1(10μg/L)对肺泡Ⅱ型细胞的作用可以相互拮抗而抵消。但若先加入TGFα再加TGFβ1(相隔6h),只呈现轻微增生效应;若先加TGFβ1再加TGFα,则表现为明显的TGFα促进效应。从时序上看,先后加入TGFα和TGFβ1或反之,往往表现为后加入的生长因子效应。可能的原因或是与生长因子作用的半衰期有关,或许可能是先加入的一种生长因子(TGFα或TGFβ1)6h内仅改变了少部分细胞的细胞周期进程,其生物效应未完全表现出来,即被后加入的另一种生长因子所拮抗。值得注意的是,所有TGFα、TGFβ1协同作用组所致的细胞增生反应,都比单独的TGFα或TGFβ1的作用弱,这也说明TGFα或TGFβ1都受到了另一个作用相反的生长因子的制约。关于TGFα、TGFβ1相互拮抗机制尚不清楚。有人认为与TGFβ1影响的TGFα与受体结合,降低TGFα所致的EGFR磷酸化有关[14]。我们研究中发现TGFα能上调肺泡Ⅱ型细胞的细胞周期蛋白依赖性激酶4(CDK4)mRNA和蛋白表达,而TGFβ1则对CDK4起下调作用,CDK4可能为TGFα、TGFβ1共同的靶分子,成为肺泡Ⅱ型细胞增生调控的共同信号通路(另文报道)。
, 百拇医药
【基金项目】国家自然科学基金资助项目(39400048)
作者简介:曾庆富(1963—),男(汉族),湖南澧县人,博士,教授,教研室副主任
参考文献
[1]钱仲棐,郭晓璇,戚以谟.吸入石英粉尘对大鼠肺泡Ⅱ型上皮细胞的影响[J].湖南医科大学学报,1995,20(1):13-15.
[2]郭晓璇,钱仲棐.实验性过敏性肺泡炎Ⅱ型肺泡上皮细胞的改变[J].中华病理学杂志,1992,21(4):241-243.
[3]Leslie CC,Mc-shannor K,Shannon JM,et al.Heparin-binding EGF-like growth factor is mitogen for rat alveolar type Ⅱ cell[J].Am J Respir Cell Mol Biol,1997,16(3):379-387.
, 百拇医药
[4]Panos RJ,Patel B,Bak PM.Intratracheal administration of hepatocyte growth factor/scatter factor stimulates rat alveolar type Ⅱ cell proliferation in Vivo[J].Am J Respir Cell Mol Biol,1996,15(5):574-581.
[5]曾庆富,蒋海鹰,钱仲棐,等.肺泡Ⅱ型上皮细胞的分离纯化和原代培养[J].中华病理学杂志,1998,27(4):384-385.
[6]Ryan RM,Mineo-KuhN MM,Kramer CM,et al.Growth factors alter neonatal type Ⅱ alveolar epithelial cell proliferation[J].Am J Physiol,1994,266(1ptl):L17-22.
, 百拇医药
[7]Plopper CG,ST-George-JA,Read LC,et al.Acceleration of alveolar type Ⅱ cell differentiation in fetal rhesus monkey lung by administration of EGF[J].Am J Physiol,1992,262(3pt10):L313-319.
[8]Raaberg L,Poulsen SS,Nexo E,et al.Epidermal growth factor in the rat lung[J].Histochemistry,1991,95(5):471-475.
[9]Stiles AO,Smith BT,Post M.Reciprocal autocrine and paracrine regulation of growth of mesenchymal and alveolar epithelial cells from fetal lung[J].Exp Lung Res,1986,11(1):165-177.
, 百拇医药
[10]Leslic CC,Mc-shannon K,Masson RJ,et al.Proliferation of rat alveolar epthelial cells in low density primary culture[J].Am J Respir cell Mol Biol,1993,9(1):64-72.
[11]Torday JS,Kourembanas S.Fetal rat lung fibroblasts produce a TGF-β homolog that blocks alveolar type Ⅱ cell maturation[J].Dev Biology,1990,139(1):35-41.
[12]Antoniades HN,Galanopoulos T,Neville-Golden J,et al.Malignant epithelial cells in primary human lung carcinomas coexpress in vivo platelet-derived growth factor(PDGF)and PDGF receptor mRNA and their protin products[J].Proc Natl Acad Sci USA,1992,89(4):3942-3947.
, 百拇医药
[13]Shirator M,Michalopoulos G,Shinozuka H,et al.Hepatocyte growth factor stimulate DNA synthesis in alveolar eptielial type Ⅱ cell in vitro[J].Am J Respir cell Mol Biol,1995,12(2):171-180.
[14]Chess PR,Ryan RM,Finkelstein JN.Tyrosine kinase activity is necessary for growth factor-stimulated rabbit type Ⅱ pneumocyte proliferation[J].Pediatr Res,1994,36(4):481-486.
【收稿日期】1999-01-08
【修稿日期】1999-07-05, 百拇医药