He-Ne激光照射引起离体小鼠胸腺细胞凋亡的超微结构观察
作者:刘炳荣 张蕙心 胡庆沈 徐清 史桂英 谭立军 陈新宇
单位:刘炳荣 张蕙心 胡庆沈 徐清 史桂英 谭立军 陈新宇(上海第二医科大学生物物理学教研室200025)
关键词:激光;胸腺;凋亡
中国激光医学杂志990109摘要
目的 探讨低强度激光照射治疗的作用机制。
方法 以功率11.3 mW、能量密度103.6 J/cm2的He-Ne激光照射离体小鼠胸腺细胞120 min后,用透射电镜对细胞作超微结构观察,用流式细胞仪对Annexin V-FITC/propidium iodide (PI)和Rhodamine 123/PI荧光双标记的胸腺细胞作双参数定量检测。
, 百拇医药
结果 透射电镜观察发现在同一标本中正常、 早期凋亡、晚期凋亡和坏死细胞的超微结构形态特征并存;流式细胞计分析则显示胸腺细胞可分活细胞、早期凋亡细胞和坏死细胞三群。
结论 两种检测技术均证实低功率He-Ne激光照射可引起细胞凋亡,这可能是激光治疗作用的基础。
Ultrastructural Observation of Mouse Thymocytes Apoptosis Induced by He-Ne Laser Irradiation in Vitro
LIU Bingrong, ZHANG HuiXin, HU Qingshen, XU Qing, SHI Guiying, TAN Lijun, CHEN Xinyu
, 百拇医药
Department of Biophysics,Shanghai Second Medical University, Shanghai 200025
ABSTRACT
Objective To investigate the fundament of low power laser irradiation therapy, a study of low power He-Ne laser irradiation on the mouse thymocytes in vitro was conducted.
Methods Transmission electron microscope(TEM) was used to determine the ultrastructural features of apoptotic thymocytes. In combination with the staining with annexin V-FITC or rhodamine 123(Rh 123) and propidium iodide(PI), dual parameter flow cytometry(FCM)was used to demonstrate the characteristics of apoptosis.
, http://www.100md.com
Results Normal living cells,early apoptotic cells,late apoptotic cells and necrotic cells were found under TEM after the treatment of He-Ne laser(11.3 mW) irradiation for 120 min(the light dose was 103.6 J/cm2). However, only three populations, i.e. living cells, early apoptotic cells and necrotic cells were discovered by FCM in the same specimen.
Conclusions Apoptosis of mouse thymocytes was induced by low power He-Ne laser irradiation. This might be the basic role of low power laser irradiation therapy in clinic. Meanwhile, it suggested that both TEM and FCM should be chosen to detect different phases of apoptosis.
, 百拇医药
Key words Lasers; Thymus gland; Apoptosis
生物体在进化过程中,形成了一系列调节机制,对细胞增殖、分化和细胞凋亡进行精细调控。 20多年前,针对多种肿瘤动力学研究中出现的细胞自然丢失现象,提出了细胞凋亡理论[1]。脊椎动物青蛙演变过程中蝌蚪尾巴的自然脱落和消失,成年哺乳类动物中增殖快的小肠隐窝上皮细胞在数量上保持平衡等[2],是正常组织中产生凋亡的例子。在正常组织中通过细胞凋亡调节机体内各类细胞使之在数量和功能上处于相对恒定状态。放射治疗、肿瘤化疗药物、激素的下降或增加、细胞毒淋巴细胞和温和的过热等刺激均可引起细胞凋亡[2,3]。为探讨低功率激光照射治疗的作用机制,我们用He-Ne激光对离体小鼠胸腺细胞作较长时间照射,利用透射电镜和流式细胞仪定量分析,观察到胸腺细胞从早期凋亡到晚期凋亡直至坏死的动态变化过程,现总结如下。
材料与方法
, 百拇医药
1.细胞制备 ICR种小白鼠(中国科学院动物研究所引种),雄性,4周龄,3只。在无菌条件下,开胸取胸腺,小心剥离包膜,在IMDM(Iscove's Modified Dulbecco's Medium)中漂洗2次,去除残留血迹, 再在IMDM中以尖锐的器具分离胸腺, 可见IMDM逐渐混浊,1 500 r/min离心5 min,弃上清液,调整细胞浓度为(5~6)×106个/ml,取3 ml细胞悬液进行激光照射。
2.激光照射 He-Ne激光器用双光纤传输,一根光纤末端输出功率11.3 mW,波长632.8 nm,传输激光至照射部位;另一根光纤留作连续监视激光器输出的稳定性。光斑直径10 mm,照射时间120 min。激光能量密度103.6 J/cm2,激光照射时每隔15 min摇动样品一次,以免细胞沉淀。
3.透射电镜样品制备 激光照射胸腺细胞以后,立刻1 500 r/min离心,漂洗1次,沉淀物用2%戊二醛磷酸盐缓冲液(PBS)作前固定2 h(4℃),用PBS漂洗2次,每次10 min,再用1%锇酸PBS作后固定2 h,PBS漂洗2次,每次10 min。30%~100%乙醇逐级脱水处理(70%乙醇含3%醋酸双氧铀),每次10 min。环氧树脂包埋,超薄切片,再用醋酸双氧铀和枸橼酸铅双重染色。
, http://www.100md.com
4.荧光双标记流式细胞仪定量分析 激光照射以后,立刻用Annexin V-FITC和Propidium Iodide(PI)或Rhodamine 123(Rh 123)和PI作双荧光标记[4,5],用FACScan型流式细胞仪(FCM,美国Becton-Dickinson公司)对胸腺细胞作双参数定量分析,第一通道(FL1-H)为Annexin V-FITC和 Rh 123绿色荧光,第二通道(FL2-H)为PI的红色荧光。
结果
一、透射电镜观察
胸腺细胞正常形态可见大的卵圆形细胞核,核膜完整,线粒体存在,周围有较少细胞质(图1A)。当用功率为11.3 mW的He-Ne激光照射至激光剂量为103.6 J/cm2时,胸腺细胞超微结构发生变化,有的胸腺细胞核变形,细胞核膜向中间凹陷,线粒体形态、大小以及细胞质没有明显变化(图1B);有的细胞核染色质浓缩向周围集中,呈车轮状(图1C),有的细胞核膜向中间明显凹陷,染色质开始浓缩,线粒体电子密度加深(图1D)。这些均为细胞早期凋亡的形态特征。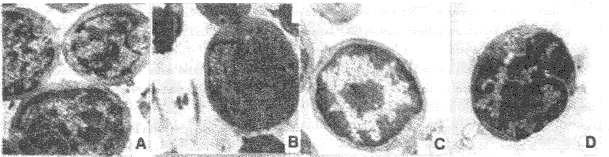
, http://www.100md.com
A.正常胸腺细胞 normal thymocytes B.细胞核变形 nuclear deformation C.染色质边缘化,呈车轮状 chromatin margination D.核染色质进一步固缩,细胞质浓缩,线粒体电子密度加深 nuclear condensation and plasma shrinkage, the electron density of mitochondria became darken
图1 He-Ne激光(103.6 J/cm2)照射小鼠胸腺细胞120 min后,透射电镜检查可观察到正常和早期凋亡胸腺细胞(×7 000)
Fig.1 Electron micrograph showing normal thymocytes and early apoptotic thymocytes, immediately after He-Ne laser (103.6 J/cm2, 120 min) irradiation(×7 000)
, http://www.100md.com
在同样的样品中,也可见到晚期凋亡和坏死细胞。晚期凋亡细胞细胞核染色质明显浓缩,似马蹄形,细胞质减少,细胞质内见空泡状结构(图2A);或细胞核浓缩的染色质开始分裂,呈串珠状,细胞质进一步减少,空泡状结构增多(图2B);或细胞核偏在一边,染色质分离,细胞内空泡更加增多(图2C)。有的细胞则细胞膜和核膜均消失,细胞器结构模糊不清,呈现细胞坏死形态(图2D)。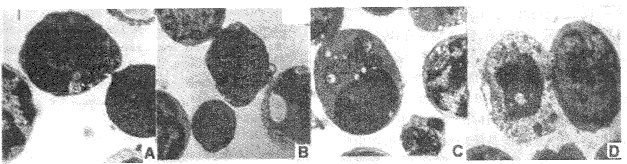
A.细胞核染色质浓缩,细胞质内可见空泡状结构 chromatin condensation and plasma vacuoles B.染色质浓缩,开始分离,空泡状结构增多 chromatin condensation and separation C.细胞核偏在一边,细胞质内可见凋亡小体,且空泡结构更加增多 condensed nucleus, more pronounced plasma vacuolization and presence of apoptotic bodies D.细胞坏死(左)necrotic cell (left)
, 百拇医药
图2 He-Ne激光(103.6 J/cm2)照射小鼠胸腺细胞120 min后,透射电镜检查可观察到晚期凋亡和坏死胸腺细胞(×7 000)
Fig.2 Electron micrograph showing late apoptosis and necrosis of mouse thymocytes, immediately after He-Ne laser (103.6 J/cm2, 120 min) irradiation (×7 000)
二、荧光双标记定量检测
激光照射120 min后,经荧光双标记的胸腺细胞用FCM分析可分三群:活细胞、早期凋亡细胞和坏死细胞。用Annexin V-FITC和PI双标记,测得凋亡细胞占21.3%,活细胞占48.9%,坏死细胞占17.8%;用Rh 123和PI双标记,测得凋亡细胞占34.8%,活细胞占12.9%,坏死细胞占29.0%。
, http://www.100md.com
讨论
细胞脱水作用是一种细胞早期凋亡特征,细胞内水分丢失导致细胞质凝聚,接着细胞大小和形态改变,由原初的圆形变成椭圆,体积缩小。多数凋亡细胞的特点是核染色质凝聚,凝聚的染色质外表光滑、均匀,常呈新月形、马鞍形和镰刀形,分布在核的周边,核分裂成碎块,与细胞质成分包围完整的细胞器形成“凋亡小体”[2,6]。本实验中也观察到凋亡细胞的上述形态特征。在激光照射后的同一胸腺细胞样品中,透射电镜下观察可见正常细胞、早期凋亡细胞、晚期凋亡细胞以及坏死细胞;经Annexin V-FITC 和PI或Rh 123和PI荧光双标记后用FCM检测可分为活细胞、早期凋亡细胞和坏死细胞三群。Annexin V可检测早期凋亡细胞细胞膜磷脂结构的改变,特征性较强。Rh 123是细胞活性的荧光探针,特征性较差,但是Rh 123价格便宜得多,可用作研究细胞早期凋亡的初筛试剂。FCM分析可相对定量,而超微结构的观察可正确地确定细胞死亡过程的性质。
, 百拇医药
Mower等[7]经灰鼠B淋巴细胞试验提出早期凋亡以细胞体积减小和细胞膜结构改变为特征;中期凋亡为已出现DNA断裂,但细胞膜仍保持通透性改变以前的状态;晚期凋亡为细胞膜变得对PI可通透。Annexin V是Ca2+依赖的磷脂结合蛋白,对磷脂酰丝氨酸(Phosphatidylserine, PS)有高亲合性。活细胞细胞膜磷脂双层在正常情况呈不对称分布,卵磷脂和鞘磷脂在细胞膜的外层,PS位于内层。细胞凋亡早期,细胞膜磷脂双层分布不对称性丢失,PS暴露在细胞膜的外层,Annexin V表达阳性[4];但细胞膜仍能排除PI,PI阴性。
细胞经受凋亡过程,在单细胞水平至少显示三个变化能用细胞荧光法定量:过氧化物阴离子产物增加;PS残基异常暴露在细胞膜的外表面;线粒体跨膜电势(mitochondrial transmembrane potential, MTP)丢失[8]。线粒体是细胞供能的细胞器,细胞凋亡的早期线粒体表现为功能下降,线粒体跨膜电势丢失,对Rh 123的滞留减少,然而细胞膜仍能排除PI。Rh 123和PI荧光双标记的FCM分析,早期凋亡细胞Rh 123荧光强度低于活细胞,且PI为阴性;晚期凋亡细胞细胞膜可破坏,故PI染色呈阳性,与坏死细胞难以区别。可见电镜与流式细胞术对细胞凋亡的检测是有所侧重的,运用时可以加以选择。
, 百拇医药
本实验证实低功率He-Ne激光照射可导致小鼠胸腺细胞凋亡,这可能是低功率激光照射产生临床治疗作用的基础。但本实验同时也提示,激光照射治疗时应控制照射时间、功率和总剂量,尤其是血管内照射对局部血管内皮细胞可能会引起凋亡,应予以注意和重视。显然,需要进一步探讨合适的低功率激光照射的时间、强度和波长,以扬长避短,更好地发挥低功率激光的作用,扩大其临床应用。
本课题受国家自然科学基金资助
参考文献
[1]Kerr JF, Searle J. A suggested explanation for the paradoxically slow growth rate of basal-cell carcinomas that contain numerous mitotic figures. J Pathol, 1972, 107:41-44.
, http://www.100md.com
[2]Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy. Cancer, 1994, 73:2013-2026.
[3]Barry MA, Behnke CA, Eastman A. Activation of programmed cell death (apoptosis) by cisplatin, other anticancer drugs, toxins and hyperthermia. Biochem Pharmacol, 1990, 40:2353-2362.
[4]Koopman G, Reutelingsperger CP, Kuijten GA, et al. Annexin V for flow cytometric detection of phosphatidylserine expression on B cells undergoing apoptosis. Blood, 1994, 84:1415-1420.
, 百拇医药
[5]Shimizu S, Eguchi Y, Kamiike W, et al. Bcl-2 blocks loss of mitochondrial membrane potential while ICE inhibitors act at a different step during inhibition of death induced by respiratory chain inhibitors. Oncogene, 1996, 13:21-29.
[6]Darzynkiewicz Z, Juan G, Li X, et al. Cytometry in cell necrobiology: analysis of apoptosis and accidental cell death (necrosis). Cytometry, 1997, 27:1-20.
[7]Mower DA Jr, Peckham DW, Illera VA, et al. Decreased membrane phospholipid packing and decreased cell size precede DNA cleavage in mature mouse B cell apoptosis. J Immunol, 1994, 152:4832-4842.
[8]Castedo M, Hirsch T, Susin SA, et al. Sequential acquisition of mitochondrial and plasma membrane alterations during early lymphocyte apoptosis. J Immunol, 1996, 157:512-521.
(收稿日期:1998-03-04), 百拇医药
单位:刘炳荣 张蕙心 胡庆沈 徐清 史桂英 谭立军 陈新宇(上海第二医科大学生物物理学教研室200025)
关键词:激光;胸腺;凋亡
中国激光医学杂志990109摘要
目的 探讨低强度激光照射治疗的作用机制。
方法 以功率11.3 mW、能量密度103.6 J/cm2的He-Ne激光照射离体小鼠胸腺细胞120 min后,用透射电镜对细胞作超微结构观察,用流式细胞仪对Annexin V-FITC/propidium iodide (PI)和Rhodamine 123/PI荧光双标记的胸腺细胞作双参数定量检测。
, 百拇医药
结果 透射电镜观察发现在同一标本中正常、 早期凋亡、晚期凋亡和坏死细胞的超微结构形态特征并存;流式细胞计分析则显示胸腺细胞可分活细胞、早期凋亡细胞和坏死细胞三群。
结论 两种检测技术均证实低功率He-Ne激光照射可引起细胞凋亡,这可能是激光治疗作用的基础。
Ultrastructural Observation of Mouse Thymocytes Apoptosis Induced by He-Ne Laser Irradiation in Vitro
LIU Bingrong, ZHANG HuiXin, HU Qingshen, XU Qing, SHI Guiying, TAN Lijun, CHEN Xinyu
, 百拇医药
Department of Biophysics,Shanghai Second Medical University, Shanghai 200025
ABSTRACT
Objective To investigate the fundament of low power laser irradiation therapy, a study of low power He-Ne laser irradiation on the mouse thymocytes in vitro was conducted.
Methods Transmission electron microscope(TEM) was used to determine the ultrastructural features of apoptotic thymocytes. In combination with the staining with annexin V-FITC or rhodamine 123(Rh 123) and propidium iodide(PI), dual parameter flow cytometry(FCM)was used to demonstrate the characteristics of apoptosis.
, http://www.100md.com
Results Normal living cells,early apoptotic cells,late apoptotic cells and necrotic cells were found under TEM after the treatment of He-Ne laser(11.3 mW) irradiation for 120 min(the light dose was 103.6 J/cm2). However, only three populations, i.e. living cells, early apoptotic cells and necrotic cells were discovered by FCM in the same specimen.
Conclusions Apoptosis of mouse thymocytes was induced by low power He-Ne laser irradiation. This might be the basic role of low power laser irradiation therapy in clinic. Meanwhile, it suggested that both TEM and FCM should be chosen to detect different phases of apoptosis.
, 百拇医药
Key words Lasers; Thymus gland; Apoptosis
生物体在进化过程中,形成了一系列调节机制,对细胞增殖、分化和细胞凋亡进行精细调控。 20多年前,针对多种肿瘤动力学研究中出现的细胞自然丢失现象,提出了细胞凋亡理论[1]。脊椎动物青蛙演变过程中蝌蚪尾巴的自然脱落和消失,成年哺乳类动物中增殖快的小肠隐窝上皮细胞在数量上保持平衡等[2],是正常组织中产生凋亡的例子。在正常组织中通过细胞凋亡调节机体内各类细胞使之在数量和功能上处于相对恒定状态。放射治疗、肿瘤化疗药物、激素的下降或增加、细胞毒淋巴细胞和温和的过热等刺激均可引起细胞凋亡[2,3]。为探讨低功率激光照射治疗的作用机制,我们用He-Ne激光对离体小鼠胸腺细胞作较长时间照射,利用透射电镜和流式细胞仪定量分析,观察到胸腺细胞从早期凋亡到晚期凋亡直至坏死的动态变化过程,现总结如下。
材料与方法
, 百拇医药
1.细胞制备 ICR种小白鼠(中国科学院动物研究所引种),雄性,4周龄,3只。在无菌条件下,开胸取胸腺,小心剥离包膜,在IMDM(Iscove's Modified Dulbecco's Medium)中漂洗2次,去除残留血迹, 再在IMDM中以尖锐的器具分离胸腺, 可见IMDM逐渐混浊,1 500 r/min离心5 min,弃上清液,调整细胞浓度为(5~6)×106个/ml,取3 ml细胞悬液进行激光照射。
2.激光照射 He-Ne激光器用双光纤传输,一根光纤末端输出功率11.3 mW,波长632.8 nm,传输激光至照射部位;另一根光纤留作连续监视激光器输出的稳定性。光斑直径10 mm,照射时间120 min。激光能量密度103.6 J/cm2,激光照射时每隔15 min摇动样品一次,以免细胞沉淀。
3.透射电镜样品制备 激光照射胸腺细胞以后,立刻1 500 r/min离心,漂洗1次,沉淀物用2%戊二醛磷酸盐缓冲液(PBS)作前固定2 h(4℃),用PBS漂洗2次,每次10 min,再用1%锇酸PBS作后固定2 h,PBS漂洗2次,每次10 min。30%~100%乙醇逐级脱水处理(70%乙醇含3%醋酸双氧铀),每次10 min。环氧树脂包埋,超薄切片,再用醋酸双氧铀和枸橼酸铅双重染色。
, http://www.100md.com
4.荧光双标记流式细胞仪定量分析 激光照射以后,立刻用Annexin V-FITC和Propidium Iodide(PI)或Rhodamine 123(Rh 123)和PI作双荧光标记[4,5],用FACScan型流式细胞仪(FCM,美国Becton-Dickinson公司)对胸腺细胞作双参数定量分析,第一通道(FL1-H)为Annexin V-FITC和 Rh 123绿色荧光,第二通道(FL2-H)为PI的红色荧光。
结果
一、透射电镜观察
胸腺细胞正常形态可见大的卵圆形细胞核,核膜完整,线粒体存在,周围有较少细胞质(图1A)。当用功率为11.3 mW的He-Ne激光照射至激光剂量为103.6 J/cm2时,胸腺细胞超微结构发生变化,有的胸腺细胞核变形,细胞核膜向中间凹陷,线粒体形态、大小以及细胞质没有明显变化(图1B);有的细胞核染色质浓缩向周围集中,呈车轮状(图1C),有的细胞核膜向中间明显凹陷,染色质开始浓缩,线粒体电子密度加深(图1D)。这些均为细胞早期凋亡的形态特征。

, http://www.100md.com
A.正常胸腺细胞 normal thymocytes B.细胞核变形 nuclear deformation C.染色质边缘化,呈车轮状 chromatin margination D.核染色质进一步固缩,细胞质浓缩,线粒体电子密度加深 nuclear condensation and plasma shrinkage, the electron density of mitochondria became darken
图1 He-Ne激光(103.6 J/cm2)照射小鼠胸腺细胞120 min后,透射电镜检查可观察到正常和早期凋亡胸腺细胞(×7 000)
Fig.1 Electron micrograph showing normal thymocytes and early apoptotic thymocytes, immediately after He-Ne laser (103.6 J/cm2, 120 min) irradiation(×7 000)
, http://www.100md.com
在同样的样品中,也可见到晚期凋亡和坏死细胞。晚期凋亡细胞细胞核染色质明显浓缩,似马蹄形,细胞质减少,细胞质内见空泡状结构(图2A);或细胞核浓缩的染色质开始分裂,呈串珠状,细胞质进一步减少,空泡状结构增多(图2B);或细胞核偏在一边,染色质分离,细胞内空泡更加增多(图2C)。有的细胞则细胞膜和核膜均消失,细胞器结构模糊不清,呈现细胞坏死形态(图2D)。

A.细胞核染色质浓缩,细胞质内可见空泡状结构 chromatin condensation and plasma vacuoles B.染色质浓缩,开始分离,空泡状结构增多 chromatin condensation and separation C.细胞核偏在一边,细胞质内可见凋亡小体,且空泡结构更加增多 condensed nucleus, more pronounced plasma vacuolization and presence of apoptotic bodies D.细胞坏死(左)necrotic cell (left)
, 百拇医药
图2 He-Ne激光(103.6 J/cm2)照射小鼠胸腺细胞120 min后,透射电镜检查可观察到晚期凋亡和坏死胸腺细胞(×7 000)
Fig.2 Electron micrograph showing late apoptosis and necrosis of mouse thymocytes, immediately after He-Ne laser (103.6 J/cm2, 120 min) irradiation (×7 000)
二、荧光双标记定量检测
激光照射120 min后,经荧光双标记的胸腺细胞用FCM分析可分三群:活细胞、早期凋亡细胞和坏死细胞。用Annexin V-FITC和PI双标记,测得凋亡细胞占21.3%,活细胞占48.9%,坏死细胞占17.8%;用Rh 123和PI双标记,测得凋亡细胞占34.8%,活细胞占12.9%,坏死细胞占29.0%。
, http://www.100md.com
讨论
细胞脱水作用是一种细胞早期凋亡特征,细胞内水分丢失导致细胞质凝聚,接着细胞大小和形态改变,由原初的圆形变成椭圆,体积缩小。多数凋亡细胞的特点是核染色质凝聚,凝聚的染色质外表光滑、均匀,常呈新月形、马鞍形和镰刀形,分布在核的周边,核分裂成碎块,与细胞质成分包围完整的细胞器形成“凋亡小体”[2,6]。本实验中也观察到凋亡细胞的上述形态特征。在激光照射后的同一胸腺细胞样品中,透射电镜下观察可见正常细胞、早期凋亡细胞、晚期凋亡细胞以及坏死细胞;经Annexin V-FITC 和PI或Rh 123和PI荧光双标记后用FCM检测可分为活细胞、早期凋亡细胞和坏死细胞三群。Annexin V可检测早期凋亡细胞细胞膜磷脂结构的改变,特征性较强。Rh 123是细胞活性的荧光探针,特征性较差,但是Rh 123价格便宜得多,可用作研究细胞早期凋亡的初筛试剂。FCM分析可相对定量,而超微结构的观察可正确地确定细胞死亡过程的性质。
, 百拇医药
Mower等[7]经灰鼠B淋巴细胞试验提出早期凋亡以细胞体积减小和细胞膜结构改变为特征;中期凋亡为已出现DNA断裂,但细胞膜仍保持通透性改变以前的状态;晚期凋亡为细胞膜变得对PI可通透。Annexin V是Ca2+依赖的磷脂结合蛋白,对磷脂酰丝氨酸(Phosphatidylserine, PS)有高亲合性。活细胞细胞膜磷脂双层在正常情况呈不对称分布,卵磷脂和鞘磷脂在细胞膜的外层,PS位于内层。细胞凋亡早期,细胞膜磷脂双层分布不对称性丢失,PS暴露在细胞膜的外层,Annexin V表达阳性[4];但细胞膜仍能排除PI,PI阴性。
细胞经受凋亡过程,在单细胞水平至少显示三个变化能用细胞荧光法定量:过氧化物阴离子产物增加;PS残基异常暴露在细胞膜的外表面;线粒体跨膜电势(mitochondrial transmembrane potential, MTP)丢失[8]。线粒体是细胞供能的细胞器,细胞凋亡的早期线粒体表现为功能下降,线粒体跨膜电势丢失,对Rh 123的滞留减少,然而细胞膜仍能排除PI。Rh 123和PI荧光双标记的FCM分析,早期凋亡细胞Rh 123荧光强度低于活细胞,且PI为阴性;晚期凋亡细胞细胞膜可破坏,故PI染色呈阳性,与坏死细胞难以区别。可见电镜与流式细胞术对细胞凋亡的检测是有所侧重的,运用时可以加以选择。
, 百拇医药
本实验证实低功率He-Ne激光照射可导致小鼠胸腺细胞凋亡,这可能是低功率激光照射产生临床治疗作用的基础。但本实验同时也提示,激光照射治疗时应控制照射时间、功率和总剂量,尤其是血管内照射对局部血管内皮细胞可能会引起凋亡,应予以注意和重视。显然,需要进一步探讨合适的低功率激光照射的时间、强度和波长,以扬长避短,更好地发挥低功率激光的作用,扩大其临床应用。
本课题受国家自然科学基金资助
参考文献
[1]Kerr JF, Searle J. A suggested explanation for the paradoxically slow growth rate of basal-cell carcinomas that contain numerous mitotic figures. J Pathol, 1972, 107:41-44.
, http://www.100md.com
[2]Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy. Cancer, 1994, 73:2013-2026.
[3]Barry MA, Behnke CA, Eastman A. Activation of programmed cell death (apoptosis) by cisplatin, other anticancer drugs, toxins and hyperthermia. Biochem Pharmacol, 1990, 40:2353-2362.
[4]Koopman G, Reutelingsperger CP, Kuijten GA, et al. Annexin V for flow cytometric detection of phosphatidylserine expression on B cells undergoing apoptosis. Blood, 1994, 84:1415-1420.
, 百拇医药
[5]Shimizu S, Eguchi Y, Kamiike W, et al. Bcl-2 blocks loss of mitochondrial membrane potential while ICE inhibitors act at a different step during inhibition of death induced by respiratory chain inhibitors. Oncogene, 1996, 13:21-29.
[6]Darzynkiewicz Z, Juan G, Li X, et al. Cytometry in cell necrobiology: analysis of apoptosis and accidental cell death (necrosis). Cytometry, 1997, 27:1-20.
[7]Mower DA Jr, Peckham DW, Illera VA, et al. Decreased membrane phospholipid packing and decreased cell size precede DNA cleavage in mature mouse B cell apoptosis. J Immunol, 1994, 152:4832-4842.
[8]Castedo M, Hirsch T, Susin SA, et al. Sequential acquisition of mitochondrial and plasma membrane alterations during early lymphocyte apoptosis. J Immunol, 1996, 157:512-521.
(收稿日期:1998-03-04), 百拇医药