吗啡对大鼠红细胞生物力学特性的影响
作者:聂 欣 黄力新 文宗曜 程伯基
单位:(夏欣 黄力新 程伯基)北京医科大学 基础医学院 生物物理系,北京 100083;(文宗曜)北京医科大学 血液流变学中心,北京 100083
关键词:吗啡;血液流变学;激光衍射法
生物医学工程学杂志990210
摘要 研究了吗啡的急性作用和体外作用对大鼠红细胞膜的生物力学特性的影响。作者采用新型激光衍射法测量上述血样红细胞膜的弹性模量E和膜粘度μm,同时通过DPH标记的荧光偏振法测定了这些红细胞膜的流动性,还采用富立叶变换的红外技术(FT-IR)测量了红细胞膜蛋白构象的动态变化,并对上述红细胞膜结构改变所引起的微观流变特性的变化进行了初步探讨。结果表明,吗啡对大鼠的作用会导致其红细胞膜流动性的下降,弹性剪切模量的升高和膜蛋白质二级结构的变化。
, http://www.100md.com
Changes in Rat Erythrocyte Hemorheology
Caused by Morphine Dependence
Xie Xin Huang Lixin Wen Zongyao Cheng Boji
Department of Biophysics, Beijing Medical University,Beijing 100083
Department of Physics, Beijing Medical University,Beijing 100083
Abstract This study was aimed at the effect of morphine on the biomechanics properties of rat erythrocyte membrane in vivo and in vitro. The shear elastic modulus (E) and the surface viscotsity viscosity (μm) of rat erythrocyte membrane was measured by using the method of the new ektacytometry.The changes in hemorheology caused by morphine dependence were investigated and the mechanisms of the changes are suggested.
, 百拇医药
Key words Morphine Hemorheology Ektacytometry
吗啡对生物体的影响已有广泛的报道,然而人们的研究工作主要集中在神经内分泌及免疫系统,在其它方面尤其在血液系统则很少有人涉及。我们的研究工作表明:吗啡对大鼠的长期作用可以导致其红细胞的各种生物物理特性的变化。这种变化到底是由什么原因引起的呢?
血液流变学自从60年代发展起来,其研究重点正逐步由血粘度及其与临床疾病的关系等宏观流变学方向转到红细胞变形性、膜的力学物理特征量及其与临床疾病间的联系等微观流变学方向。最近几年发展起来的一种新型激光衍射法可以将低粘悬浮介质的切变流场中所测得的DI分离为红细胞在C=0轨道上的变形指数(DI)d和红细胞从C=0轨道转向随机取向的取向指数(DI)or。我国学者[1~4]通过测定变形指数(DI)d定量地计算出红细胞膜的弹性剪切模量(E)和微粘度(μm)[5],从而为我们扩大了微观流变学的指标。我们采用新型激光衍射法测量了吗啡作用后的大鼠红细胞膜的弹性剪切模量等流变学指标,通过DPH标主记的荧光偏振法和富立叶变换的红外技术(FT-IR)研究了红细胞膜结构改变,从而进一步探讨吗啡对大鼠红细胞膜的影响。
, http://www.100md.com
1 材料与方法
1.1 实验动物、试剂与仪器
Wistar雄性大鼠(体重250 g左右),由北京医科大学实验动物部提供;盐酸吗啡,青海制药厂产品;GYJ-I型自动激光衍射仪,北京医科大学与北京地质仪器厂联合研制;Hitachi 820型紫外/可见分光光度计;Hitachi 850型荧光分光光度计;Bio-Rad FTS-65A红外光谱仪。
1.2 实验方法与步骤
1.2.1 吗啡的处理 (1)急性给药:Wistar雄性大鼠(250 g左右),注射40 mg/Kg体重的吗啡,2 h内取血测量;(2)吗啡在体外与红细胞直接作用(以后简称为体外作用):从Wistar雄性大鼠(250 g左右)取血,体外加入吗啡(终浓度为20 mg/kg),37 ℃温育30 min后取血,测量在2 h内完成。
, 百拇医药
1.2.2 新型激光衍射法测量红细胞的小变形(DI)d 将采得的血样用3%的PVP-K30溶液(pH=7.4,渗透压=300 mOsm/Kg,粘度=2 cp)悬浮,用激光衍射仪测量红细胞在C=0轨道上的小变形(DI)d。测量条件:切变率: max=200 s-1。
max=200 s-1。
1.2.3 传统激光衍射法测量红细胞的最大变形性(DI)max和红细胞变形恢复半衰减时间(t0.5) 将采得的血样用15%的PVP-K30溶液(pH=7.4,渗透压=300 mOsm/Kg,粘度=12 cp)悬浮,用激光衍射仪测量红细胞的最大变形性(DI)max和变形恢复半衰减时间(t0.5)。测量条件:最大切变率: max=800s-1;红细胞变形恢复时间扫描范围:1 s;采样点:250。
max=800s-1;红细胞变形恢复时间扫描范围:1 s;采样点:250。
, 百拇医药
1.3 红细胞渗透脆性的测定
(1)配制从40~300 mOsm/Kg不同渗透压的PBS缓冲液(pH=7.4);(2)制备红细胞:将血样以2,000 rpm离心10 min,虹吸法吸去血浆及白细胞等,然后用等渗PBS溶液离心(2,000 rpm,10 min),洗涤三次,即得干净的红细胞;(3)测量渗透脆性:将红细胞分别悬浮于上述不同渗透压的PBS缓冲液中,红细胞终浓度为8 μl/ml,静置1 h后离心(2,000 rpm,10 min),取上清液在540 nm处比色测量渗透脆性。
1.4 用荧光偏振法测红细胞膜脂的流动性
(1)红细胞膜的制备:低渗溶解法[6];(2)膜蛋白含量的测定:Folin-酚法[7];(3)荧光偏振法测红细胞膜脂的流动性:取1 ml血影(膜蛋白终浓度为200 μg/ml),加入1 ml 2×10-6M DPH,37 ℃下孵育半小时,然后以10,000 rpm离心10 min,弃去上清,再用等渗PBS缓冲液洗涤3次,加等渗PBS缓冲液至终体积为2 ml,25 ℃测偏振度(P)。
, http://www.100md.com
测量条件:λex=360 min;λem=430 nm;狭缝宽:5 nm
1.5 用FT-IR技术测细胞膜结构的变化
新制备的血影0.2 ml,于4 ℃以10,000 rpm离心20 min,让其压实,弃去上清,加入含有0.9% NaCl的D2O溶液,室温下静置0.5 h,使样品进行完全的氢氘交换。实验时测量条件如下:分辨率4 cm-1,扫描范围400~4000 cm,扫描叠加400次。样品池采用CaF2窗片,液层厚25 μm,温度21 ℃。样品的测定和数据处理按Bio-Rad FTS-6SA 3200 Data Station软件程序进行,其中,去卷积处理时,FWHH=13,分辨率增强因子k=1.1;在二阶导数光谱的指导下,对酰胺I带的原谱进行曲线拟和,以优化至去卷积谱与拟和谱的差谱基本成一条直线,且RMS<0.001为止。
, http://www.100md.com
2 结果与讨论
(1)分子振动光谱是用于蛋白质结构研究有力工具,最近发展起来的富立叶变换的红外光谱技术可用来分析蛋白质等大分子的二级结构的含量,并可以分析其构象的变化。通过研究注射吗啡后大鼠红细胞力学性质的变化,我们发现,大鼠红细胞膜的蛋白构象发生了改变,在红外光谱上也表现出不同(见图1):除了在1653、1456、1213 cm-1处与正常血影一致,在1082和990 cm-1处各多了一个峰。利用富立叶变换的方法将得到的血影的红外图谱进行曲线拟和(见表1),可见吗啡的急性作用可改变膜蛋白的二级结构,使其α-螺旋减少,β-结构(β-sheet,turns)和无规卷曲则增多。
图1 大鼠红细胞膜蛋白的红外光谱
Fig 1 D2O subtracted FT-IR spectra of rat erythrocyte membrane protein
, http://www.100md.com
1. Morphine injected;2. Morphine dependent;3. normal
表1 大鼠红细胞膜蛋白的二级结构
Table 1 The second structure of rat erythrocyte membrane protein
Normal rat
Morphine-injected rat
Bands(cm-1)
Area(%)
Bands(cm-1)
, http://www.100md.com Area(%)
α-helix
1652
31
.0%
1651
15
.4%
β-sheet
1625,1636,1674
35
.6%
1624,1636,1673
, http://www.100md.com
45
.3%
Turns
1664,1684
25
.5%
1660,1668,1682,1686
28
.4%
Random coil
1644
4
.3%
, 百拇医药
1644
9
.7%
Stretching
1609,1617
4
.7%
1615
1
.3%
(2)红细胞膜脂流动性是调控跨膜物质运输的重要因素,荧光偏振度P值可以反映膜脂的流动性:P值越大,表示流动性越小。从我们的实验结果可知吗啡处理过的红细胞膜荧光偏振度(P)值上升(见表2),这说明膜表面蛋白构象的改变通过蛋白与脂的相互作用导致了膜脂状态的变化,从而表现出流动性的降低。表2 吗啡处理的大鼠红细胞膜脂的流动性
, 百拇医药
Table 2 Membrane lipid fluidity of rat erythrocyte treated by morphine ±s
±s
n
P
正常鼠
0.266±0.003
5
急性给药鼠
0.291±0.007
5
<0.001
, http://www.100md.com
体外给药鼠
0.299±0.008
5
<0.001
(3)我们测量了不同情况下吗啡处理后的红细胞在C=0轨道上的小变形(DI)d(见表3),利用由施岩等人论文中[8]提出的公式:
将表3中的小变形值(DI)d及红细胞平均半径代入公式即可得到红细胞膜剪切弹性模量(E)(图2)。其中E值代表膜的硬度,E越大则膜越硬。
表3 吗啡处理的大鼠红细胞的小变形性
, 百拇医药 Table 3 (DI)d of rat erythrocyte treated by morphine
正常鼠
急性给药鼠
体外给药鼠 ±s
±s
13.1±1.2
6.1±2.2
6.4±2.2
n
5
5
, 百拇医药
5
图2 吗啡处理的大鼠红细胞膜的弹性剪切模量
Fig 2 The shear elastic modulus of rat erythrocyte membrane treated by morphine
由图2可见,红细胞膜经过吗啡处理后其膜弹性模量(E)上升,而且体外给药和急性给药的作用差异不大,都使红细胞膜的弹性降低,趋于硬化。
(4)红细胞的许多生理功能如膜的坦克履带运动、氧的透膜扩散、膜上酶的生物活性和红细胞的变形能力等都与膜的微粘度有密切关系,而红细胞的变形恢复过程则充分表现了它的粘滞性,所以人们通常通过这一过程来测量红细胞的膜粘度(μm)。采用较高粘度的悬浮介质,我们测量了红细胞变形恢复半衰减时间t0.5(见表4)。
, 百拇医药
表4 吗啡处理的大鼠红细胞变形恢复半衰减时间
Table 4 t0.5 of rat erythrocyte treated by morphine
正常鼠
急性给药鼠
体外给药鼠 ±s
±s
0.064±0.009
0.048±0.005
0.047±0.008
n
, 百拇医药
13
4
6
由施岩等人论文中提出公式[8]: ,分别代入以上测得的红细胞膜剪切弹性模量(E)和红细胞变形恢复时间(t0.5)即可得到吗啡处理后的大鼠红细胞膜粘度(μm)的变化(见图3)。
,分别代入以上测得的红细胞膜剪切弹性模量(E)和红细胞变形恢复时间(t0.5)即可得到吗啡处理后的大鼠红细胞膜粘度(μm)的变化(见图3)。
图3 吗啡处理的大鼠红细胞膜的表面粘度
Fig 3 Surface viscosity(μm) of rat erythrocyte membrane treated by morphine
, 百拇医药
不难看出,经过吗啡的作用红细胞膜粘度(μm)也有所上升,而且急性给药对大鼠红细胞膜粘度的影响比体外给药大。此外,我们发现吗啡处理后能使红细胞变形能力(DI)max下降(见表5)。而红细胞良好的变形能力是血液运输气体的必要条件,变形能力的降低势必会影响红细胞乃至整个血液系统力学性质的改变。
表5 吗啡处理的大鼠红细胞的变形性
Table 1 Erythrocyte deformability (DImax) of rat treated by morphine ±s
±s
n
P
正常鼠
, 百拇医药
61.3±2.5
8
急性给药鼠
54.1±2.5
4
<0.001
体外给药鼠
45.5±3.5
6
<0.001
红细胞膜的分子组成和结构是其生物力学的基础,在大多数情况下,红细胞形态和功能的改变在根本上都归因于其膜分子结构的变化,而红细胞膜的粘度和红细胞膜的弹性剪切模量是红细胞的微观力学特征和流变学性质的基础,它们的改变将导致红细胞变形能力的下降,从而导致红细胞寿命的减短,微循环灌注的恶化,血液粘度的增加,最后造成心血管系统的损伤。
, 百拇医药
(5)红细胞具有渗透脆性的特征,即在低渗溶液中膨胀而破裂。这种渗透脆性的大小主要取决于红细胞的表面积/容积之比和红细胞膜的弹性。通过我们的实验检测发现吗啡的体外作用和急性给药都导致了膜渗透脆性增加,即抗张能力下降(见图4)。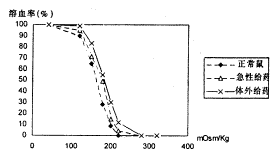
图4 吗啡处理的大鼠红细胞膜的渗透脆性
Fig 4 Osmotic fragility of rat red blood cell treated by morphine
综上所述,吗啡作用于红细胞后将导致:(1)红细胞膜蛋白二级结构改变,使其α-螺旋减少,β-结构(β-sheet,turns)和无规卷曲则增多;(2)红细胞膜脂流动性下降;(3)红细胞膜弹性模量(E)上升;粘度(μm)上升;红细胞变形能力下降;(4)红细胞的渗透脆性增加。
, 百拇医药
由此可见,吗啡的处理可造成红细胞膜力学性质乃至流变学性质的诸多变化,其作用的机制有可能解释为蛋白与蛋白相互作用、蛋白与脂相互作用及红细胞膜表面蛋白构象改变等。
参考文献
1 聂 欣,黄力新,程伯基等.吗啡对大鼠红细胞生物物理特性的影响.生物物理学报,1998;14(3)∶438
2 陶祖菜,文宗曜,曹 实等.红细胞变形的动力学行为.生物物理学报,1991;7(2)∶233
3 文宗耀,陶祖来,孙大公等.大分子吸附对低粘切变流场中红细胞取向的影响.生物物理学报,1993;9∶677
4 宋立川,文宗耀,马维原等.切变流场中红细胞取向与变形性行为的研究.生物物理学报,1996;12(2)∶323
, http://www.100md.com
5 文宗耀,陶祖莱,曹 实等,PBS作为悬浮介质代替PVP用于红细胞变形性测量的可能性.中国生物医学工程学报,1992;11(1)∶50
6 文宗耀,严宗毅.测量红细胞膜剪切弹性模量及粘度的新方法——新型激光衍射法.现代力学与科技进步,1997;741
7 中国科学院动物所细胞室生物膜组,细胞膜的研究(二).生物化学与生物物理进展,1977;13(1)∶22
8 Lowry OH, Rosebrough NJ, Farr AL et al. J Biol Chem, 1951;193∶265
9 施 岩,马维原,孙大公等.用激光衍射法研究在切变流场中红细胞的松驰过程.中国物理医学杂志,1995;17(3)∶161
收稿:1998-02-11 修回:1998-07-03, http://www.100md.com
单位:(夏欣 黄力新 程伯基)北京医科大学 基础医学院 生物物理系,北京 100083;(文宗曜)北京医科大学 血液流变学中心,北京 100083
关键词:吗啡;血液流变学;激光衍射法
生物医学工程学杂志990210
摘要 研究了吗啡的急性作用和体外作用对大鼠红细胞膜的生物力学特性的影响。作者采用新型激光衍射法测量上述血样红细胞膜的弹性模量E和膜粘度μm,同时通过DPH标记的荧光偏振法测定了这些红细胞膜的流动性,还采用富立叶变换的红外技术(FT-IR)测量了红细胞膜蛋白构象的动态变化,并对上述红细胞膜结构改变所引起的微观流变特性的变化进行了初步探讨。结果表明,吗啡对大鼠的作用会导致其红细胞膜流动性的下降,弹性剪切模量的升高和膜蛋白质二级结构的变化。
, http://www.100md.com
Changes in Rat Erythrocyte Hemorheology
Caused by Morphine Dependence
Xie Xin Huang Lixin Wen Zongyao Cheng Boji
Department of Biophysics, Beijing Medical University,Beijing 100083
Department of Physics, Beijing Medical University,Beijing 100083
Abstract This study was aimed at the effect of morphine on the biomechanics properties of rat erythrocyte membrane in vivo and in vitro. The shear elastic modulus (E) and the surface viscotsity viscosity (μm) of rat erythrocyte membrane was measured by using the method of the new ektacytometry.The changes in hemorheology caused by morphine dependence were investigated and the mechanisms of the changes are suggested.
, 百拇医药
Key words Morphine Hemorheology Ektacytometry
吗啡对生物体的影响已有广泛的报道,然而人们的研究工作主要集中在神经内分泌及免疫系统,在其它方面尤其在血液系统则很少有人涉及。我们的研究工作表明:吗啡对大鼠的长期作用可以导致其红细胞的各种生物物理特性的变化。这种变化到底是由什么原因引起的呢?
血液流变学自从60年代发展起来,其研究重点正逐步由血粘度及其与临床疾病的关系等宏观流变学方向转到红细胞变形性、膜的力学物理特征量及其与临床疾病间的联系等微观流变学方向。最近几年发展起来的一种新型激光衍射法可以将低粘悬浮介质的切变流场中所测得的DI分离为红细胞在C=0轨道上的变形指数(DI)d和红细胞从C=0轨道转向随机取向的取向指数(DI)or。我国学者[1~4]通过测定变形指数(DI)d定量地计算出红细胞膜的弹性剪切模量(E)和微粘度(μm)[5],从而为我们扩大了微观流变学的指标。我们采用新型激光衍射法测量了吗啡作用后的大鼠红细胞膜的弹性剪切模量等流变学指标,通过DPH标主记的荧光偏振法和富立叶变换的红外技术(FT-IR)研究了红细胞膜结构改变,从而进一步探讨吗啡对大鼠红细胞膜的影响。
, http://www.100md.com
1 材料与方法
1.1 实验动物、试剂与仪器
Wistar雄性大鼠(体重250 g左右),由北京医科大学实验动物部提供;盐酸吗啡,青海制药厂产品;GYJ-I型自动激光衍射仪,北京医科大学与北京地质仪器厂联合研制;Hitachi 820型紫外/可见分光光度计;Hitachi 850型荧光分光光度计;Bio-Rad FTS-65A红外光谱仪。
1.2 实验方法与步骤
1.2.1 吗啡的处理 (1)急性给药:Wistar雄性大鼠(250 g左右),注射40 mg/Kg体重的吗啡,2 h内取血测量;(2)吗啡在体外与红细胞直接作用(以后简称为体外作用):从Wistar雄性大鼠(250 g左右)取血,体外加入吗啡(终浓度为20 mg/kg),37 ℃温育30 min后取血,测量在2 h内完成。
, 百拇医药
1.2.2 新型激光衍射法测量红细胞的小变形(DI)d 将采得的血样用3%的PVP-K30溶液(pH=7.4,渗透压=300 mOsm/Kg,粘度=2 cp)悬浮,用激光衍射仪测量红细胞在C=0轨道上的小变形(DI)d。测量条件:切变率:
 max=200 s-1。
max=200 s-1。1.2.3 传统激光衍射法测量红细胞的最大变形性(DI)max和红细胞变形恢复半衰减时间(t0.5) 将采得的血样用15%的PVP-K30溶液(pH=7.4,渗透压=300 mOsm/Kg,粘度=12 cp)悬浮,用激光衍射仪测量红细胞的最大变形性(DI)max和变形恢复半衰减时间(t0.5)。测量条件:最大切变率:
 max=800s-1;红细胞变形恢复时间扫描范围:1 s;采样点:250。
max=800s-1;红细胞变形恢复时间扫描范围:1 s;采样点:250。, 百拇医药
1.3 红细胞渗透脆性的测定
(1)配制从40~300 mOsm/Kg不同渗透压的PBS缓冲液(pH=7.4);(2)制备红细胞:将血样以2,000 rpm离心10 min,虹吸法吸去血浆及白细胞等,然后用等渗PBS溶液离心(2,000 rpm,10 min),洗涤三次,即得干净的红细胞;(3)测量渗透脆性:将红细胞分别悬浮于上述不同渗透压的PBS缓冲液中,红细胞终浓度为8 μl/ml,静置1 h后离心(2,000 rpm,10 min),取上清液在540 nm处比色测量渗透脆性。
1.4 用荧光偏振法测红细胞膜脂的流动性
(1)红细胞膜的制备:低渗溶解法[6];(2)膜蛋白含量的测定:Folin-酚法[7];(3)荧光偏振法测红细胞膜脂的流动性:取1 ml血影(膜蛋白终浓度为200 μg/ml),加入1 ml 2×10-6M DPH,37 ℃下孵育半小时,然后以10,000 rpm离心10 min,弃去上清,再用等渗PBS缓冲液洗涤3次,加等渗PBS缓冲液至终体积为2 ml,25 ℃测偏振度(P)。
, http://www.100md.com
测量条件:λex=360 min;λem=430 nm;狭缝宽:5 nm
1.5 用FT-IR技术测细胞膜结构的变化
新制备的血影0.2 ml,于4 ℃以10,000 rpm离心20 min,让其压实,弃去上清,加入含有0.9% NaCl的D2O溶液,室温下静置0.5 h,使样品进行完全的氢氘交换。实验时测量条件如下:分辨率4 cm-1,扫描范围400~4000 cm,扫描叠加400次。样品池采用CaF2窗片,液层厚25 μm,温度21 ℃。样品的测定和数据处理按Bio-Rad FTS-6SA 3200 Data Station软件程序进行,其中,去卷积处理时,FWHH=13,分辨率增强因子k=1.1;在二阶导数光谱的指导下,对酰胺I带的原谱进行曲线拟和,以优化至去卷积谱与拟和谱的差谱基本成一条直线,且RMS<0.001为止。
, http://www.100md.com
2 结果与讨论
(1)分子振动光谱是用于蛋白质结构研究有力工具,最近发展起来的富立叶变换的红外光谱技术可用来分析蛋白质等大分子的二级结构的含量,并可以分析其构象的变化。通过研究注射吗啡后大鼠红细胞力学性质的变化,我们发现,大鼠红细胞膜的蛋白构象发生了改变,在红外光谱上也表现出不同(见图1):除了在1653、1456、1213 cm-1处与正常血影一致,在1082和990 cm-1处各多了一个峰。利用富立叶变换的方法将得到的血影的红外图谱进行曲线拟和(见表1),可见吗啡的急性作用可改变膜蛋白的二级结构,使其α-螺旋减少,β-结构(β-sheet,turns)和无规卷曲则增多。

图1 大鼠红细胞膜蛋白的红外光谱
Fig 1 D2O subtracted FT-IR spectra of rat erythrocyte membrane protein
, http://www.100md.com
1. Morphine injected;2. Morphine dependent;3. normal
表1 大鼠红细胞膜蛋白的二级结构
Table 1 The second structure of rat erythrocyte membrane protein
Normal rat
Morphine-injected rat
Bands(cm-1)
Area(%)
Bands(cm-1)
, http://www.100md.com Area(%)
α-helix
1652
31
.0%
1651
15
.4%
β-sheet
1625,1636,1674
35
.6%
1624,1636,1673
, http://www.100md.com
45
.3%
Turns
1664,1684
25
.5%
1660,1668,1682,1686
28
.4%
Random coil
1644
4
.3%
, 百拇医药
1644
9
.7%
Stretching
1609,1617
4
.7%
1615
1
.3%
(2)红细胞膜脂流动性是调控跨膜物质运输的重要因素,荧光偏振度P值可以反映膜脂的流动性:P值越大,表示流动性越小。从我们的实验结果可知吗啡处理过的红细胞膜荧光偏振度(P)值上升(见表2),这说明膜表面蛋白构象的改变通过蛋白与脂的相互作用导致了膜脂状态的变化,从而表现出流动性的降低。表2 吗啡处理的大鼠红细胞膜脂的流动性
, 百拇医药
Table 2 Membrane lipid fluidity of rat erythrocyte treated by morphine
 ±s
±sn
P
正常鼠
0.266±0.003
5
急性给药鼠
0.291±0.007
5
<0.001
, http://www.100md.com
体外给药鼠
0.299±0.008
5
<0.001
(3)我们测量了不同情况下吗啡处理后的红细胞在C=0轨道上的小变形(DI)d(见表3),利用由施岩等人论文中[8]提出的公式:

将表3中的小变形值(DI)d及红细胞平均半径代入公式即可得到红细胞膜剪切弹性模量(E)(图2)。其中E值代表膜的硬度,E越大则膜越硬。
表3 吗啡处理的大鼠红细胞的小变形性
, 百拇医药 Table 3 (DI)d of rat erythrocyte treated by morphine
正常鼠
急性给药鼠
体外给药鼠
 ±s
±s13.1±1.2
6.1±2.2
6.4±2.2
n
5
5
, 百拇医药
5

图2 吗啡处理的大鼠红细胞膜的弹性剪切模量
Fig 2 The shear elastic modulus of rat erythrocyte membrane treated by morphine
由图2可见,红细胞膜经过吗啡处理后其膜弹性模量(E)上升,而且体外给药和急性给药的作用差异不大,都使红细胞膜的弹性降低,趋于硬化。
(4)红细胞的许多生理功能如膜的坦克履带运动、氧的透膜扩散、膜上酶的生物活性和红细胞的变形能力等都与膜的微粘度有密切关系,而红细胞的变形恢复过程则充分表现了它的粘滞性,所以人们通常通过这一过程来测量红细胞的膜粘度(μm)。采用较高粘度的悬浮介质,我们测量了红细胞变形恢复半衰减时间t0.5(见表4)。
, 百拇医药
表4 吗啡处理的大鼠红细胞变形恢复半衰减时间
Table 4 t0.5 of rat erythrocyte treated by morphine
正常鼠
急性给药鼠
体外给药鼠
 ±s
±s0.064±0.009
0.048±0.005
0.047±0.008
n
, 百拇医药
13
4
6
由施岩等人论文中提出公式[8]:
 ,分别代入以上测得的红细胞膜剪切弹性模量(E)和红细胞变形恢复时间(t0.5)即可得到吗啡处理后的大鼠红细胞膜粘度(μm)的变化(见图3)。
,分别代入以上测得的红细胞膜剪切弹性模量(E)和红细胞变形恢复时间(t0.5)即可得到吗啡处理后的大鼠红细胞膜粘度(μm)的变化(见图3)。
图3 吗啡处理的大鼠红细胞膜的表面粘度
Fig 3 Surface viscosity(μm) of rat erythrocyte membrane treated by morphine
, 百拇医药
不难看出,经过吗啡的作用红细胞膜粘度(μm)也有所上升,而且急性给药对大鼠红细胞膜粘度的影响比体外给药大。此外,我们发现吗啡处理后能使红细胞变形能力(DI)max下降(见表5)。而红细胞良好的变形能力是血液运输气体的必要条件,变形能力的降低势必会影响红细胞乃至整个血液系统力学性质的改变。
表5 吗啡处理的大鼠红细胞的变形性
Table 1 Erythrocyte deformability (DImax) of rat treated by morphine
 ±s
±sn
P
正常鼠
, 百拇医药
61.3±2.5
8
急性给药鼠
54.1±2.5
4
<0.001
体外给药鼠
45.5±3.5
6
<0.001
红细胞膜的分子组成和结构是其生物力学的基础,在大多数情况下,红细胞形态和功能的改变在根本上都归因于其膜分子结构的变化,而红细胞膜的粘度和红细胞膜的弹性剪切模量是红细胞的微观力学特征和流变学性质的基础,它们的改变将导致红细胞变形能力的下降,从而导致红细胞寿命的减短,微循环灌注的恶化,血液粘度的增加,最后造成心血管系统的损伤。
, 百拇医药
(5)红细胞具有渗透脆性的特征,即在低渗溶液中膨胀而破裂。这种渗透脆性的大小主要取决于红细胞的表面积/容积之比和红细胞膜的弹性。通过我们的实验检测发现吗啡的体外作用和急性给药都导致了膜渗透脆性增加,即抗张能力下降(见图4)。

图4 吗啡处理的大鼠红细胞膜的渗透脆性
Fig 4 Osmotic fragility of rat red blood cell treated by morphine
综上所述,吗啡作用于红细胞后将导致:(1)红细胞膜蛋白二级结构改变,使其α-螺旋减少,β-结构(β-sheet,turns)和无规卷曲则增多;(2)红细胞膜脂流动性下降;(3)红细胞膜弹性模量(E)上升;粘度(μm)上升;红细胞变形能力下降;(4)红细胞的渗透脆性增加。
, 百拇医药
由此可见,吗啡的处理可造成红细胞膜力学性质乃至流变学性质的诸多变化,其作用的机制有可能解释为蛋白与蛋白相互作用、蛋白与脂相互作用及红细胞膜表面蛋白构象改变等。
参考文献
1 聂 欣,黄力新,程伯基等.吗啡对大鼠红细胞生物物理特性的影响.生物物理学报,1998;14(3)∶438
2 陶祖菜,文宗曜,曹 实等.红细胞变形的动力学行为.生物物理学报,1991;7(2)∶233
3 文宗耀,陶祖来,孙大公等.大分子吸附对低粘切变流场中红细胞取向的影响.生物物理学报,1993;9∶677
4 宋立川,文宗耀,马维原等.切变流场中红细胞取向与变形性行为的研究.生物物理学报,1996;12(2)∶323
, http://www.100md.com
5 文宗耀,陶祖莱,曹 实等,PBS作为悬浮介质代替PVP用于红细胞变形性测量的可能性.中国生物医学工程学报,1992;11(1)∶50
6 文宗耀,严宗毅.测量红细胞膜剪切弹性模量及粘度的新方法——新型激光衍射法.现代力学与科技进步,1997;741
7 中国科学院动物所细胞室生物膜组,细胞膜的研究(二).生物化学与生物物理进展,1977;13(1)∶22
8 Lowry OH, Rosebrough NJ, Farr AL et al. J Biol Chem, 1951;193∶265
9 施 岩,马维原,孙大公等.用激光衍射法研究在切变流场中红细胞的松驰过程.中国物理医学杂志,1995;17(3)∶161
收稿:1998-02-11 修回:1998-07-03, http://www.100md.com