去卵巢山羊成骨细胞的体外培养*
作者:邓 力 陈槐卿 郑 虎 彭雪梅
单位:邓 力 郑 虎(华西医科大学 药学院,成都 610041);陈槐卿(华西医科大学 基础医学院,成都 610014);彭雪梅(华西医科大学 法医系,成都 610041)
关键词:成骨细胞;细胞培养;碱性磷酸酶;骨形成
生物医学工程学杂志990322 摘要 选用摘除双侧卵巢的山羊颅盖骨,体外分离培养成骨细胞,并对分离的成骨细胞做多方面生物学特性鉴定。结果表明:体外培养的去卵巢山羊成骨细胞具有典型成骨细胞的形态特征、碱性磷酸酶活性以及在体外发生钙化的功能;证实了体外培养的去卵巢山羊成骨细胞具有体内成骨细胞的功能和特性。为骨代谢的研究提供了新的实验手段。
A Study on Ovariectomized Goat Osteoblast Culture in Vitro
, 百拇医药
Deng Li1 Chen Huaiqing1 Zheng Hu1 Peng Xuemei3
1(College of Pharmacy,West China University of Medical Sciences,Chengdu 610041)
2(College of Basicl Medicine,West China University of Medical Sciences,Chengdu 610041)
3(Department of Forensic Psychiatry,West China University of Medical Sciences,Chengdu 610041)
Abstract Osteoblasts were isolated from the frontal parietal bone of ovariectomized goat and were confirmed by testing for multiple biological features. The results showed that the goat osteoblasts cultured had the typical morphological feature of osteoblasts, the activity of alkaline phosphatase,and the ability of calcification in vitro. Also, the results proved that these goat osteoblasts in vitro had the same function and features as those in vivo. The experimental techniques in this study have provided a useful system for researches in bone metabolism.
, 百拇医药
Key words Osteoblast Cell culture Alkaline phosphatase Osteogenesis
1 前 言
体外培养成骨细胞是骨代射研究的重要手段。国内外已有文献报道采用鼠、鸡、兔等动物的颅盖骨为材料培养成骨细胞。而用山羊颅盖骨为材料培养成骨细胞尚未见报道。为了在细胞分子水平上研究闭经引起的骨质疏松症的骨代谢提供有益的实验手段,本研究建立了用摘除双侧卵巢山羊的颅盖骨培养成骨细胞的方法。用去卵巢山羊颅盖骨为材料,通过酶消化,成功地获得成骨细胞,观察了细胞生长过程显微形态的变化,并通过碱性磷酸酶(ALP)染色[1],钙化(von kossa)染色[2]、扫描电镜对培养获得的成骨细胞进行了鉴定。
2 材料和方法
2.1 材料
, 百拇医药
(1)6~12月成都山羊:2±岁雌性成都山羊切除双侧卵巢,于切除卵巢后半年,1年处死山羊,取颅盖骨(由华西医科大学生物医学工程研究室提供)。
(2)HamF-12培养基10.6 g/L,α-MEM培养基10.2 g/L,(Dulbecco's Phosphate-Buffered Saline(PBS)9.6 g/L缓冲液,胎牛血清(FBS)均为Gibco公司产品,谷氨酰胺,β-甘油磷酸钠,Ⅰ型胶原酶,胰蛋白均为Sigma公司产品。青霉素80万U/L,链霉素100 μg/L。
2.2 方法
2.2.1 山羊颅盖骨的准备 颅盖骨取自刚刚处死的去卵巢山羊,在75%酒精中浸泡30 s,然后浸泡在PBS液中,无菌条件下刮除结缔组织、周边软骨和骨膜,剪成0.2~0.4 mm3大小碎块,放入F-12培养液中待用。
, http://www.100md.com
2.2.2 成骨细胞培养 将骨碎片中加入含0.1%胶原酶和0.25%胰蛋白酶的消化液10 ml,置37 ℃水浴中振荡20 min,吸取消化液至离心管中,加入新的消化液反复消化5次,收集消化液以2000 r/min离心10 min,使细胞沉淀,用培养液洗细胞两次,台盼兰染色显示90%以上细胞存活,将细胞悬液种植于10 cm培养皿中,细胞密度4×104/cm2,用含10%FBS的F-12培养液,在37 ℃、5%CO2和饱和湿度下培养,每周更换4~5次培养液。当细胞长至皿底面积60%~80%时,用PBS液冲洗3遍,0.25%胰蛋白酶消化,以1∶2做传代培养。传代培养中预先平行放载玻片,使细胞接种于其上,逐日在倒置显微镜下进行活体相差显微镜观察及照像。
2.2.3 碱性磷酸酶(ALP)染色观察 培养到第6 d时,取出玻片以荼酚AS-MX磷酸酯为底物,Fast blue BB及偶氮副品红为偶氮染料,条件为37 ℃、10 min。
, 百拇医药
2.2.4 Von Kossa染色与骨形成观察 传代培养的成骨细胞培养3 d后,加入10 mmol/L β-甘油磷酸钠和100 μg/ml维生素C和含10%FBS的α-MEM培养液培养,隔天更换一次培养液,至20~30 d时,用Von Kossa法染色,显微镜下拍照。
3 结 果
3.1 山羊成骨细胞显微结构形态
培养第2 d就可见细胞为成纤维细胞型贴壁生长,成梭形,第3 d细胞呈集团生长,细胞周围有光晕,胞核呈椭圆型位于中间,轮廓清晰,核内可见2~3个核仁。培养10 d后,细胞已开始融合成片,分界较为模糊,形态由长梭形变成宽梭形和不规则形。培养20 d后,部分细胞聚集成灶,细胞呈立方形状或短柱形,培养25 d后,山羊成骨细胞相互交织紊乱,似编织骨状。在维生素C和β-甘油磷酸钠作用下,体外培养30 d左右出现骨小结(见图1)。
, http://www.100md.com
图1 体外培养30 d,出现不透明的有三维结构的细胞结节。×100
Fig 1 Phase contrast micrograph of a mineralized nodule 30 days in culture the nodule is opague and three-dimensional.×100
3.2 碱性磷酸酶染色观察
成骨细胞碱性磷酸酶染色见细胞胞浆及树枝突起染兰黑色,提示该细胞的胞浆及突起富含碱性磷酸酶。
3.3 Von Kossa染色观察
经Von Kossa染色后,骨小结部分被染色成茶褐色,此为骨形成的表现(见图2)。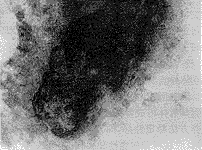
, http://www.100md.com
图2 培养细胞结节的Von Kossa钙盐染色,结节区染色呈阳性,表明结节内有钙盐沉积。×100
Fig 2 Von Kossa staining for calcium phosphate of a mineralized nodule, stained black shows positive reaction indicating the presence of calcium phosphate.×100
3.4 扫描电镜观察
去卵巢山羊颅盖骨成骨细胞培养2 d后,在载玻片上可看到三种形态的细胞:长梭形细胞、圆球形细胞、鳞片形细胞。长梭形细胞两端尖长,中间肥胖,体积较小,其上有不同数目、长短、粗细的突起,细胞膜上有微绒毛(见图3)。圆球形细胞的体积较小,厚度高,细胞核部位的厚度更高,也有不同数目、长短、粗细的突起,膜上有微绒毛(见图4)。鳞片形细胞呈多角形,细胞扁平,无隆起或增厚的部位,细胞伸出众多突起,突起有不同粗细及长短,其核处于偏心位(见图5)。随着培养时间推移,在细胞表面出现钙盐结晶(见图6),且继续形成、增多,最终可形成骨结节。在培养过程中,鳞片形细胞数量最多,且该形细胞不仅能相互接触,还能相互重叠,形成多层结构。而长梭形和球形细胞的数量明显较少,并处于鳞片形细胞之间的空隙中。
, http://www.100md.com
图3 长梭形细胞的扫描电镜图。×2000
Fig 3 Scanning electron micrograph (SEM-graph) of Spindleshaped cells.×2000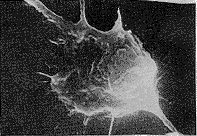
图4 圆球形细胞的扫描电镜图。×1000
Fig 4 Scanning electron micrograph (SEM-graph) of globular cells.×1000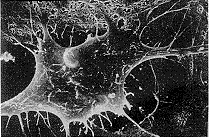
图5 鳞片形细胞的扫描电镜图。×2000
Fig 5 Scanning electron micrograph (SEM-graph) of Squamaus cells.×2000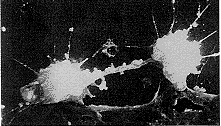
, 百拇医药
图6 细胞表面有钙盐结晶。×3000
Fig 6 Calcium crystal on the surface of the osteoblase cell.×3000
4 讨 论
体外培养成骨细胞的重要来源是取自动物的颅盖骨[3],十多年前用大鼠胎儿颅盖骨培养成骨细胞的方法[3]就已建立,用鸡、兔颅骨培养成骨细胞的方法也已有文献报道。最近又建立了用成熟大鼠颅盖骨培养成骨细胞的方法[2],这为研究骨质疏松症方面的骨代谢提供了适宜的实验模型。在此方法的基础上,我们进行了用摘除双侧卵巢的山羊颅盖骨培养成骨细胞的研究。由于我们研究室正在进行山羊骨质疏松动物模型的研究,为了从细胞分子水平的角度研究正常山羊和骨质疏松山羊以及加药治疗后山羊骨细胞代谢,功能改变等,建立不同状况的山羊成骨细胞系是首先要进行的研究工作。
, http://www.100md.com
骨组织中含有多种细胞,其中结合成骨细胞的蛋白质是胶原,因此要分离出成骨细胞就必须用胶原酶,而成纤维细胞也是通过胶原结合的,故使用胶原酶消化颅盖骨碎片时,其用量和时间都致关重要。由于骨缝处成纤维细胞较多[4],在取颅盖骨组织块时,应尽量剔除骨缝结缔组织和透明软骨。
本研究培养的细胞呈集落生长,形态为梭形、多角形、三角形、单核、核仁2~3个,具有多数学者报道的成骨细胞的形态特征[5~7],以及体内相似的形态特征[8]。
碱性磷酸酶(ALP)为成骨细胞主要功能活性酶。本研究培养的山羊成骨细胞碱性磷酸酶染色呈阳性反应,证实该细胞具有ALP活性,符合成骨细胞重要生物学特征之一。
体外钙化是成骨细胞的另一重要特征[9]。有文献报道用结合α-磷酸甘油和维生素C对钙盐沉积的促进作用来证实成骨细胞[10],本研究培养的细胞在维生素C作用下,出现骨小结,经Von Kossa染色呈阳性反应,表明该细胞在体外能发生钙化。
, http://www.100md.com
综上所述,本研究获取的去卵巢山羊成骨细胞具有体内成骨细胞的多种生物学特性,其培养方法稳定性好,周期不长,是用于药物筛选,口腔材料骨相容性和骨代谢方面研究的一种有益的实验手段。
*国家自然科学基金资助项目(39430120)
参考文献
1 杨景山.医学细胞化学与细胞生物技术.北京:北京医科大学/协和医科大学联合出版社,1990∶42-44
2 Kato H, Matsuo R, Koniyama O et al. Decreased mitogenic and osteogenic responsiveness of calvarial osteoblasts isolated from aged rats to basic fibroblast growth factor. Gerontology, 1995;41(suppl 1)∶20
, 百拇医药
3 Bharava U. Bar-Lev, Bellows CG et al. Ultrastrual analysis of bone nodules formed in vitro by isolated fetal rat calvaria cells. Bone,1988;9∶155
4 王 前,钟世镇,龚文汇等.鼠颅盖骨成骨细胞体外培养及ALP免疫组化法鉴别纯化.中华骨科杂志,1995;6(15)∶364
5 Marie PJ, Abderrahimlomri. Aymansabbagh et al. Culture and behavior of osteoblastic cells isolated from normal trabecular bone surface. In Vitro 1989,25∶373
6 Betlina Auf mkolk. Hausckka PV, Schwartz ER. Characterization of human bone cells culture. Calcif Tissue Int 1985;37∶228
, 百拇医药
7 Masquelier DC,krummel TA. Morphological characterization of osteoblast-like cell culture isolated from new born rat calvaria. calcif Tissue Int,1990;47∶92
8 徐荣辉,朱雅萍,柴本甫等.胚胎大鼠颅骨分离细胞早期体外培养的组织化学观察.解剖学报,1988;19(13)∶53
9 Koshiharn Y, Kawamurn M, Endo S et al. Establishment of human osteoblastic cells derived from Periosteum in culture. In Vitro Cell & Dav Biol 1989;25∶37
10 Majeska RJ, Rook A, Flotte TJ et al. Culture and activity of osteoblast and osteoblast-like cells. In: Butler WT, od. The chemistry and biology of mineralized tissues. Birmingham:Ebsco Media 1985∶279
(收稿:1998-07-27 修回:1998-11-19), http://www.100md.com
单位:邓 力 郑 虎(华西医科大学 药学院,成都 610041);陈槐卿(华西医科大学 基础医学院,成都 610014);彭雪梅(华西医科大学 法医系,成都 610041)
关键词:成骨细胞;细胞培养;碱性磷酸酶;骨形成
生物医学工程学杂志990322 摘要 选用摘除双侧卵巢的山羊颅盖骨,体外分离培养成骨细胞,并对分离的成骨细胞做多方面生物学特性鉴定。结果表明:体外培养的去卵巢山羊成骨细胞具有典型成骨细胞的形态特征、碱性磷酸酶活性以及在体外发生钙化的功能;证实了体外培养的去卵巢山羊成骨细胞具有体内成骨细胞的功能和特性。为骨代谢的研究提供了新的实验手段。
A Study on Ovariectomized Goat Osteoblast Culture in Vitro
, 百拇医药
Deng Li1 Chen Huaiqing1 Zheng Hu1 Peng Xuemei3
1(College of Pharmacy,West China University of Medical Sciences,Chengdu 610041)
2(College of Basicl Medicine,West China University of Medical Sciences,Chengdu 610041)
3(Department of Forensic Psychiatry,West China University of Medical Sciences,Chengdu 610041)
Abstract Osteoblasts were isolated from the frontal parietal bone of ovariectomized goat and were confirmed by testing for multiple biological features. The results showed that the goat osteoblasts cultured had the typical morphological feature of osteoblasts, the activity of alkaline phosphatase,and the ability of calcification in vitro. Also, the results proved that these goat osteoblasts in vitro had the same function and features as those in vivo. The experimental techniques in this study have provided a useful system for researches in bone metabolism.
, 百拇医药
Key words Osteoblast Cell culture Alkaline phosphatase Osteogenesis
1 前 言
体外培养成骨细胞是骨代射研究的重要手段。国内外已有文献报道采用鼠、鸡、兔等动物的颅盖骨为材料培养成骨细胞。而用山羊颅盖骨为材料培养成骨细胞尚未见报道。为了在细胞分子水平上研究闭经引起的骨质疏松症的骨代谢提供有益的实验手段,本研究建立了用摘除双侧卵巢山羊的颅盖骨培养成骨细胞的方法。用去卵巢山羊颅盖骨为材料,通过酶消化,成功地获得成骨细胞,观察了细胞生长过程显微形态的变化,并通过碱性磷酸酶(ALP)染色[1],钙化(von kossa)染色[2]、扫描电镜对培养获得的成骨细胞进行了鉴定。
2 材料和方法
2.1 材料
, 百拇医药
(1)6~12月成都山羊:2±岁雌性成都山羊切除双侧卵巢,于切除卵巢后半年,1年处死山羊,取颅盖骨(由华西医科大学生物医学工程研究室提供)。
(2)HamF-12培养基10.6 g/L,α-MEM培养基10.2 g/L,(Dulbecco's Phosphate-Buffered Saline(PBS)9.6 g/L缓冲液,胎牛血清(FBS)均为Gibco公司产品,谷氨酰胺,β-甘油磷酸钠,Ⅰ型胶原酶,胰蛋白均为Sigma公司产品。青霉素80万U/L,链霉素100 μg/L。
2.2 方法
2.2.1 山羊颅盖骨的准备 颅盖骨取自刚刚处死的去卵巢山羊,在75%酒精中浸泡30 s,然后浸泡在PBS液中,无菌条件下刮除结缔组织、周边软骨和骨膜,剪成0.2~0.4 mm3大小碎块,放入F-12培养液中待用。
, http://www.100md.com
2.2.2 成骨细胞培养 将骨碎片中加入含0.1%胶原酶和0.25%胰蛋白酶的消化液10 ml,置37 ℃水浴中振荡20 min,吸取消化液至离心管中,加入新的消化液反复消化5次,收集消化液以2000 r/min离心10 min,使细胞沉淀,用培养液洗细胞两次,台盼兰染色显示90%以上细胞存活,将细胞悬液种植于10 cm培养皿中,细胞密度4×104/cm2,用含10%FBS的F-12培养液,在37 ℃、5%CO2和饱和湿度下培养,每周更换4~5次培养液。当细胞长至皿底面积60%~80%时,用PBS液冲洗3遍,0.25%胰蛋白酶消化,以1∶2做传代培养。传代培养中预先平行放载玻片,使细胞接种于其上,逐日在倒置显微镜下进行活体相差显微镜观察及照像。
2.2.3 碱性磷酸酶(ALP)染色观察 培养到第6 d时,取出玻片以荼酚AS-MX磷酸酯为底物,Fast blue BB及偶氮副品红为偶氮染料,条件为37 ℃、10 min。
, 百拇医药
2.2.4 Von Kossa染色与骨形成观察 传代培养的成骨细胞培养3 d后,加入10 mmol/L β-甘油磷酸钠和100 μg/ml维生素C和含10%FBS的α-MEM培养液培养,隔天更换一次培养液,至20~30 d时,用Von Kossa法染色,显微镜下拍照。
3 结 果
3.1 山羊成骨细胞显微结构形态
培养第2 d就可见细胞为成纤维细胞型贴壁生长,成梭形,第3 d细胞呈集团生长,细胞周围有光晕,胞核呈椭圆型位于中间,轮廓清晰,核内可见2~3个核仁。培养10 d后,细胞已开始融合成片,分界较为模糊,形态由长梭形变成宽梭形和不规则形。培养20 d后,部分细胞聚集成灶,细胞呈立方形状或短柱形,培养25 d后,山羊成骨细胞相互交织紊乱,似编织骨状。在维生素C和β-甘油磷酸钠作用下,体外培养30 d左右出现骨小结(见图1)。

, http://www.100md.com
图1 体外培养30 d,出现不透明的有三维结构的细胞结节。×100
Fig 1 Phase contrast micrograph of a mineralized nodule 30 days in culture the nodule is opague and three-dimensional.×100
3.2 碱性磷酸酶染色观察
成骨细胞碱性磷酸酶染色见细胞胞浆及树枝突起染兰黑色,提示该细胞的胞浆及突起富含碱性磷酸酶。
3.3 Von Kossa染色观察
经Von Kossa染色后,骨小结部分被染色成茶褐色,此为骨形成的表现(见图2)。

, http://www.100md.com
图2 培养细胞结节的Von Kossa钙盐染色,结节区染色呈阳性,表明结节内有钙盐沉积。×100
Fig 2 Von Kossa staining for calcium phosphate of a mineralized nodule, stained black shows positive reaction indicating the presence of calcium phosphate.×100
3.4 扫描电镜观察
去卵巢山羊颅盖骨成骨细胞培养2 d后,在载玻片上可看到三种形态的细胞:长梭形细胞、圆球形细胞、鳞片形细胞。长梭形细胞两端尖长,中间肥胖,体积较小,其上有不同数目、长短、粗细的突起,细胞膜上有微绒毛(见图3)。圆球形细胞的体积较小,厚度高,细胞核部位的厚度更高,也有不同数目、长短、粗细的突起,膜上有微绒毛(见图4)。鳞片形细胞呈多角形,细胞扁平,无隆起或增厚的部位,细胞伸出众多突起,突起有不同粗细及长短,其核处于偏心位(见图5)。随着培养时间推移,在细胞表面出现钙盐结晶(见图6),且继续形成、增多,最终可形成骨结节。在培养过程中,鳞片形细胞数量最多,且该形细胞不仅能相互接触,还能相互重叠,形成多层结构。而长梭形和球形细胞的数量明显较少,并处于鳞片形细胞之间的空隙中。

, http://www.100md.com
图3 长梭形细胞的扫描电镜图。×2000
Fig 3 Scanning electron micrograph (SEM-graph) of Spindleshaped cells.×2000

图4 圆球形细胞的扫描电镜图。×1000
Fig 4 Scanning electron micrograph (SEM-graph) of globular cells.×1000

图5 鳞片形细胞的扫描电镜图。×2000
Fig 5 Scanning electron micrograph (SEM-graph) of Squamaus cells.×2000

, 百拇医药
图6 细胞表面有钙盐结晶。×3000
Fig 6 Calcium crystal on the surface of the osteoblase cell.×3000
4 讨 论
体外培养成骨细胞的重要来源是取自动物的颅盖骨[3],十多年前用大鼠胎儿颅盖骨培养成骨细胞的方法[3]就已建立,用鸡、兔颅骨培养成骨细胞的方法也已有文献报道。最近又建立了用成熟大鼠颅盖骨培养成骨细胞的方法[2],这为研究骨质疏松症方面的骨代谢提供了适宜的实验模型。在此方法的基础上,我们进行了用摘除双侧卵巢的山羊颅盖骨培养成骨细胞的研究。由于我们研究室正在进行山羊骨质疏松动物模型的研究,为了从细胞分子水平的角度研究正常山羊和骨质疏松山羊以及加药治疗后山羊骨细胞代谢,功能改变等,建立不同状况的山羊成骨细胞系是首先要进行的研究工作。
, http://www.100md.com
骨组织中含有多种细胞,其中结合成骨细胞的蛋白质是胶原,因此要分离出成骨细胞就必须用胶原酶,而成纤维细胞也是通过胶原结合的,故使用胶原酶消化颅盖骨碎片时,其用量和时间都致关重要。由于骨缝处成纤维细胞较多[4],在取颅盖骨组织块时,应尽量剔除骨缝结缔组织和透明软骨。
本研究培养的细胞呈集落生长,形态为梭形、多角形、三角形、单核、核仁2~3个,具有多数学者报道的成骨细胞的形态特征[5~7],以及体内相似的形态特征[8]。
碱性磷酸酶(ALP)为成骨细胞主要功能活性酶。本研究培养的山羊成骨细胞碱性磷酸酶染色呈阳性反应,证实该细胞具有ALP活性,符合成骨细胞重要生物学特征之一。
体外钙化是成骨细胞的另一重要特征[9]。有文献报道用结合α-磷酸甘油和维生素C对钙盐沉积的促进作用来证实成骨细胞[10],本研究培养的细胞在维生素C作用下,出现骨小结,经Von Kossa染色呈阳性反应,表明该细胞在体外能发生钙化。
, http://www.100md.com
综上所述,本研究获取的去卵巢山羊成骨细胞具有体内成骨细胞的多种生物学特性,其培养方法稳定性好,周期不长,是用于药物筛选,口腔材料骨相容性和骨代谢方面研究的一种有益的实验手段。
*国家自然科学基金资助项目(39430120)
参考文献
1 杨景山.医学细胞化学与细胞生物技术.北京:北京医科大学/协和医科大学联合出版社,1990∶42-44
2 Kato H, Matsuo R, Koniyama O et al. Decreased mitogenic and osteogenic responsiveness of calvarial osteoblasts isolated from aged rats to basic fibroblast growth factor. Gerontology, 1995;41(suppl 1)∶20
, 百拇医药
3 Bharava U. Bar-Lev, Bellows CG et al. Ultrastrual analysis of bone nodules formed in vitro by isolated fetal rat calvaria cells. Bone,1988;9∶155
4 王 前,钟世镇,龚文汇等.鼠颅盖骨成骨细胞体外培养及ALP免疫组化法鉴别纯化.中华骨科杂志,1995;6(15)∶364
5 Marie PJ, Abderrahimlomri. Aymansabbagh et al. Culture and behavior of osteoblastic cells isolated from normal trabecular bone surface. In Vitro 1989,25∶373
6 Betlina Auf mkolk. Hausckka PV, Schwartz ER. Characterization of human bone cells culture. Calcif Tissue Int 1985;37∶228
, 百拇医药
7 Masquelier DC,krummel TA. Morphological characterization of osteoblast-like cell culture isolated from new born rat calvaria. calcif Tissue Int,1990;47∶92
8 徐荣辉,朱雅萍,柴本甫等.胚胎大鼠颅骨分离细胞早期体外培养的组织化学观察.解剖学报,1988;19(13)∶53
9 Koshiharn Y, Kawamurn M, Endo S et al. Establishment of human osteoblastic cells derived from Periosteum in culture. In Vitro Cell & Dav Biol 1989;25∶37
10 Majeska RJ, Rook A, Flotte TJ et al. Culture and activity of osteoblast and osteoblast-like cells. In: Butler WT, od. The chemistry and biology of mineralized tissues. Birmingham:Ebsco Media 1985∶279
(收稿:1998-07-27 修回:1998-11-19), http://www.100md.com