微循环系统局部控制过程的生物力学模型
作者:郭仲三
单位:郭仲三(中国科学院 成都计算机应用研究所自动推理实验室,成都 610041)
关键词:微循环;局部控制;生物力学模型
生物医学工程学杂志000204 摘要 分析了间质内血管代谢物质的产生和运动、毛细血管前括约肌的开闭过程、微动脉平均半径的影响因素及微动脉自律运动振幅的变化情况,建立了微循环系统局部控制过程的生物力学模型,有助于对该过程进行定量分析。
A Biomechanical Model of Local Control of Microcirculation
Guo Zhongsan
(Chengdu Institute of Computer Application, Academia Sinica, Chengdu 610041)
, http://www.100md.com
Abstract In this paper we analyze the generation and motion of vasoactive metabolites in interstitium, the open and closure of precapillary sphincters, the factors affecting mean arteriolar diameter, and the change of amplitude of arteriolar vasomotion. A biomechanical model of local control of microcirculation has been developed. It is useful in quantitative analysis of microcirculatory local control.
Key words Microcirculation Local control Biomechanical model
, 百拇医药
1 引 言
微血管床是组织灌流、血液-组织流体交换和组织血容量的控制场所。主要的控制者是微动脉和毛细血管前括约肌,主要控制机制有局部控制(Local control,或Intrinsic control)和全身控制(Remote control,或Extrinsic control),主要控制目标是在各种环境条件改变(最常见的是血压和氧浓度改度)时保持内环境的稳定性。
全身控制主要指神经控制与体液控制。二者关系十分密切,因为神经控制也是通过体液因子实现的[1],体液因子的大部分是神经递质,如去甲肾上腺素、乙酰胆碱等,有的则是细胞的释放产物,如腺甙(adenosine)。
局部控制包括肌原性控制与代谢性控制。肌原性控制是指微动脉在内外压差增大时主动收缩以控制血流量的现象。代谢性控制是通过细胞代谢产物进行的控制。有研究认为[1],微循环的局部调节中,75%是代谢性调节。
, http://www.100md.com
微循环系统控制过程的定量研究工作非常少。作者分析研究了有关的生理过程,建立了微循环系统局部控制过程的生物力学模型,有利于对这一过程进行定量分析。
2 间质腺甙源强度及腺甙浓度分布公式
细胞(假设均匀分布在间质空间内)释放活血管代谢物质(在心肌中,最重要的是腺甙;为叙述方便,本文中我们用腺甙代表所有可能的活血管代谢物质)取决于线粒体的氧利用率。线粒体内的细胞色素(Cytochrom)aa3以还原与氧化两种方式存在并可互相转化。氧进入细胞后,即作为电子的受体与作为电子供体的还原aa3相互作用,而线粒体的氧利用率UO2MM就由细胞内电子受体的浓度CO2cellcell与电子供体的浓度[aa3]R共同决定[2]: (1)
(1)
, 百拇医药
在静息状态下,[aa3]R只占细胞色素总浓度[aa3]T的1/10或更少。当细胞氧浓度降低时,氧化作用减弱,aa3的氧化-还原动态平衡被破坏,部分氧化的aa3被还原,[aa3]R增加,从而补偿了CO2cellcell降低的影响,使UO2MM维持不变或基本不变。这种补偿作用进行到aa3全部还原时,细胞氧浓度就到了一个临界值CO2cccc,进一步降低就会使UO2MM显著减小,细胞开始大量释放腺甙。据此可得[2]: (2)
(2)
, 百拇医药
其中:PO2cell为细胞氧分压;UO2max为线粒体最大氧利用率,常量;KM为细胞氧分压参考值,表示线粒体氧利用率为最大氧利用率的50%时的细胞氧分压。在大多数组织中,KM<0.1 mmHg。而通常细胞氧分压比KM大1~2个数量级[37℃时约为2~5 mmHg(1mmHg=0.133kPa)]。因此,细胞氧浓度在相当大的范围内变化时,UO2M的变化都非常小。一般地说,细胞氧分压大于1 mmHg时,均可近似认为UO2M是一个常量。在本文中,我们用线粒体相对氧利用率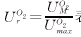
, http://www.100md.com
表示细胞是否缺氧及缺氧程度;例如,UO2rr<0.95为轻度缺氧,UO2rr<0.90为重度缺氧,等等。
细胞氧浓度由下式给出[3]:
其中:Vcell为细胞体积,JO2cellcell为进入细胞的氧通量:
其中:CO2II为间质氧浓度。由于对氧分子扩散的阻力,细胞内外存在氧浓度梯度。实验表明,细胞具有调节这一氧浓度的能力,在间质缺氧时减小这一梯度,从而部分地维持细胞正常的氧合作用[4]。这种功能性变化可能是因为aa3与氧的亲合力随细胞的能量状况发生改变所引起的[5]。因此,上式中的系数Kc2应该是[aa3]R的函数。但在本文中,我们暂取Kc2为常量。
, http://www.100md.com
可以看出,线粒体氧利用率、细胞氧浓度和间质氧浓度的关系是很复杂的。作为简化,我们假设细胞氧浓度随时间变化很慢,进入细胞的氧与线粒体消耗的氧随时保持平衡,从而得到:
其中: 为对应于KM的氧浓度。
为对应于KM的氧浓度。
根据上述分析,并假设细胞释放腺甙的强度与线粒体氧利用率成线性关系,我们得到如下腺甙源强度公式: (3)
(3)
其中:Sad为间质腺甙源强度;Kad为腺甙源强度系数。
从腺甙源产生的腺甙在间质内的输运过程与氧相似,也包括扩散、对流和机械弥散三方面,且亦可假设间质对腺甙无排斥作用。此外,血液循环和毛细血管网的存在对腺甙的分布和运动能产生很大影响。实验表明,在微静脉注入0.1 μM浓度的腺甙,能显著扩张相邻微动脉的管径[6],说明在微动脉-微静脉之间存在“扩散交连”,使已经“离开”了微循环单元的腺甙仍能产生影响。在毛细血管内注入去甲肾上腺素,能使供血微动脉管径减小,毛细血管流速降低(直至降为零);注入乙酰胆硷或缓激肽,可使微动脉扩张并增加血流速度[7,8]。作者认为,这种从毛细血管到微动脉的退行性调节,既不是从毛细血管直接向微动脉扩散的结果,也不是通过微动脉-微静脉扩散交连实现的,而是因为毛细血管本身就具有传输活血管物质的功能。此外,毛细血管内皮细胞还能吸收大量腺甙[9]。因此,活血管物质在微循环单元中的运动方式可能十分复杂,有待进一步研究。作为简化,作者用源点迭加法计算间质各处的腺甙浓度,i点的腺甙源Sadi在j点产生的腺甙浓度CadI(ij)由平方反比律给出:
, http://www.100md.com
其中:Xij为i、j之间的距离。这样,某一时刻j点的腺甙浓度就由下式给出: (4)
(4)
其中:CadI(j)为间质内某点j的腺甙浓度;Sadi为某点i的腺甙源强度。其积分形式为:
其中:V为间质体积。
3 毛细血管前扩约肌的局部控制模型
近代的研究表明[10,11],毛细血管的储备(Reserve)与募集(Recruitment)提供了一个精巧的调节机制;组织内关闭着的毛细血管需要时可以开放,开放着的毛细血管亦可能关闭,使血液在微血管床内更有效地重新分布,从而在血流量不变的条件下便可满足增加了的需要。这种调节是微循环单元内部的调节,不影响其余单元的灌流,不增加心脏泵血功能,在本文中我们称之为内部调节或第一调节。
, http://www.100md.com
当血液分布在所有可交换面上仍不能满足组织的需要时,微动脉将会显著地扩张,使进入该微循环单元的血流量增加,从而满足组织的需要。这种调节方式会改变其余微循环单元的血流状况,或增加心脏负荷,因此我们称之为外部调节或第二调节。
设毛细血管前括约肌处的腺甙浓度大于第一调节临界值Cml时,该毛细血管即完全开放,反之则完全关闭,便得到如下的毛细血管前括约肌代谢性调控模型: (5)
(5)
其中:rc为毛细血管半径;rco为半径常量;J(x)为阶跃函数。
4 微动脉平均半径的局部控制模型
微动脉肌原性控制的机理还不很清楚,目前尚无普遍接受的生物力学模型。实际应用中常采用Laplace公式:
, http://www.100md.com
rp=常数
其中:r为微动脉半径;p为压力。这是根据微动脉壁内合力不变的假设而得到的。由于微动脉属厚壁管,故我们假设肌原性调节的目的是保持微动脉壁内平均应力σa不变,即:
rp=σah h—壁厚
同时假设管壁不可压缩,由此得到微动脉的肌原性调控模型: (6)
(6)
其中:a0为微动脉入口半径平均值;a00为正常情况下微动脉入口半径平均值;Pa0为微动脉入口处血压;P′ao为正常情况下微动脉入口处血压; ;h0为微动脉入口处管壁厚度。由于式中包含了半径与壁厚之比,故比Laplace公式更能反映不同微动脉的差别。可以看出,σa越小,上式越接近于Laplace公式。
;h0为微动脉入口处管壁厚度。由于式中包含了半径与壁厚之比,故比Laplace公式更能反映不同微动脉的差别。可以看出,σa越小,上式越接近于Laplace公式。
, 百拇医药
从不同的角度可以给出不同的模型。例如,有的作者[12]通过引入“参考直径”的概念来建立微动脉肌原性调控模型。值得指出的是,该文作者得到的r随P的变化速度和此处的(6)式都比Laplace公式所给出的速度慢。
微动脉半径随微动脉入口处的腺甙浓度增减而增减。根据对金黄仓鼠的实验[13],当腺甙浓度为10-4M左右时,微动脉扩张达到最大值。各级微动脉的静息直径约为最大直径的70%。当组织氧浓度超过需要时,微动脉管径将减小,从而提供一个负反馈调节,使组织氧供应与消耗趋于平衡。但在定量研究上目前存在较大差别:有的认为动脉氧分压高于正常值时,微动脉直径仅有很小的减少[14],而Kunert等[15]用降低血球氧亲和力的方法得到的结果则是当组织氧分压增加百分之十几到四十几时,微动脉直径将降低30%~50%。由于微动脉直径不会随腺甙浓度的增减而无限增加或趋于零,故我们设二者的关系为: (7)
(7)
, 百拇医药
其中:ramax和ramin为微动脉代谢调节的最大与最小半径,cado为腺甙的某一参考浓度。条件n>1是为了使曲线呈“S”形,如图1所示。
图1 微动脉半径与腺甙浓度的关系
Fig 1 Relationship between arteriole radius and adenosine concentration
由于间质腺甙浓度改变时,首先将引起毛细血管密度改变,而微动脉管径的显著改变则发生在毛细血管密度达到最大值之后,故第一调节临界浓度Cml应大于微动脉“正常”浓度Cadn且位于微动脉半径变化率较小的位置。
, http://www.100md.com
上式中的两个常数n和Cado可由一定的已知条件确定。根据Kroll和Stepp[16]的估计,狗心肌间质腺甙浓度约为100~200 nM。以此作为腺甙浓度的“正常”值Cadn,则可得:
Cad=Cadn时: ra=ran
另据前述Frame和Sarelius[13]的研究结果,可设腺甙浓度为CadM=10-4M时,微动脉半径已非常接近代谢调节的极大值,例如等于0.99ramax。这样,我们得到:
Cad=CadM时: ra=0.99ramax
, 百拇医药
将此二式代入式(7),就可确定常数n和Cado。于是,腺甙浓度变化引起微动脉入口半径的改变可表为:

将肌原性调控与代谢性调控结合起来,就得到微动脉半径的局部调控模型: (8)
(8)
其中: ;Pac为微动脉塌陷的临界压力。
;Pac为微动脉塌陷的临界压力。
5 微动脉自律运动振幅的局部控制模型
研究表明,微动脉血压在一定范围内变化时,对自律运动振幅没有影响;而当血压低于某一临界值时,自律运动将突然停止。由此,我们可将自律运动振幅的肌原性控制表为:
, 百拇医药
b=bof(CNO).J(Pao-Pcrit) (9)
其中:bo为振幅常量;Pcrit为自律运动突然停止的临界压力;f(CNO)为一氧化氮对振幅的影响函数。有实验表明[17],高食盐造成的高血压(166 mmHg)能使鼠微动脉自律运动的振幅增加达93%;作者认为,维持自律运动振幅不变的是基础一氧化氮(Basal nitric oxide),高食盐性高血压形成过程中,一氧化氮的作用被抑制了,导致自律运动振幅增加。文献[18]也表明,抑制NO将增加鼠脑微动脉血流的振幅。因此,自律运动振幅应该是一氧化氮浓度CNO的函数。但是,由于存在相反的实验结果,即增加NO能增强自律运动,加之对其机制还很不了解,故目前尚不能给出函数f(CNO)的具体形式。
, 百拇医药
6 讨 论
微循环局部控制主要指肌原性控制与代谢性控制,有的作者[19]则认为还应包括内皮细胞控制。微血管内皮细胞本身具有调节微循环的功能,已从电镜得到证实。内皮细胞胞体突向腔向(有的可达腔内1/2~2/3),血管壁局部凹陷等,都能不同程度地影响血流。因此可以认为,毛细血管内皮细胞是积极参与微循环局部调节的。
从组织缺氧到微血管作出反应有几秒到几十秒的滞后时间[14]。可以认为这就是腺甙从细胞到毛细血管前括约肌或微动脉的运动时间。由于毛细血管前括约肌和微动脉处的腺甙浓度不断变化,使毛细血管分布与微动脉管径不断变化,因此,作为简化,我们取自律运动的一个周期作为滞后时间,以一周期内某点腺甙浓度的平均值是否超过临界值作为引起调节的条件,而调节的结果则在下一周期内表现出来。这一简化的根据是,自律运动周期约10 s左右,毛细血管间歇性开闭状态每一相的延续时间约2~8 s,与滞后时间接近。
, 百拇医药
由于毛细血管前括约肌距组织缺氧区较近,阈值较低,故微循环系统第一调节总比第二调节先发生。数值计算结果表明,由于组织缺氧区分布在距毛细血管(尤其是其微动脉端)较远的地方,所以这些地区内毛细血管的开放或开放着的毛细血管向这些地区延伸,对于改变组织缺氧状况,具有最重要的意义,能在不增加血流量的情况下,显著减小直至完全消灭缺氧区。若毛细血管分布范围不变,仅密度增加,则间质氧浓度除分布有所改变外,平均浓度并无明显变化。这表明毛细血管“平均密度”概念的应用范围是有限的,很多时候其分布状况起着重要的作用。计算结果还表明,距毛细血管大于100 μm的地方,在自律运动的整个周期内,几乎都处于缺氧状态。文献[20]指出,正常人体细胞与毛细血管的距离小于50 μm。
缺氧区消灭后,间质腺甙浓度降低,部分毛细血管前括约肌重新关闭。不少实验观测都发现在正常生理条件下,毛细血管内的流动时断时续,大小和方向都经常改变。有的研究者[21]更发现所观测的全部毛细血管均有长短不等的零流量时间,并认为这是由WBC堵塞造成的。我们的研究则表明,毛细血管第一调节也可以造成这一现象。
, 百拇医药
国家自然科学基金资助项目(19472067)
参考文献
1,吴其夏主编.体液因素和血液循环病理生理学.北京:北京医科大学、中国协和医科大学联合出版社,1991
2,Granger HJ,Borders JL,Meininger GA et al.Microcirculatory control systems. in: The physiology and pharmacology of the microcirculation, vol.1, Mortillaro, NA(ed), Academic Press,1983∶209
3,Granger HJ,Shepherd AP. Dynamics and control of the microcirculation. Adv.in Biomed. Eng.1979;7∶1
, 百拇医药
4,Takahashi E,Doi K. Regulation of oxygen diffusion in hypoxic isolated cardiac myocytes. Am. J. Physiol,1996;271∶H1734
5,Hoshi Y, Hazeki O;Tamura M. Oxygen dependence of redox state of copper in cytochrome oxydase in vitro. J.Appl.Physiol.1993;74∶1622
6,Hester RL. Uptake of metabolites by postcapillary venules: Mechanism for the control of arteriolar diameter. Microvasc. Res,1993;46(2)∶254
7,Dietrick HH,Tyml K. Capillary as a communicating medium in the microvasculature. Microvasc. Res.1992;43(1)∶87
, 百拇医药
8,Mitchell D,Yu K,Tyml K. Comparable effects of arteriolar and capillary stimuli on blood flow in rat skeletal muscle. Microvasc. Res.1997;53(1)∶22
9,Bertuglia S,Colantuoni A,Arnold M et al.Dynamic coherence analysis of vasomotion and flow motion in skeletal muscle microcirculation. Microvasc. Res,1996;52(3)∶235
10,Duran WN,Mortimer PN,Lemich JM et al.Capillary reserve in isometrically contracting dog hearts. Am J. Physiol.1977;233∶H276
, 百拇医药
11,Aschheim E.Passage of substances across the walls of blood vessels: kinetics and mechanism. in: Microcirculation. vol.1,Kaley, G et al.(eds).Univ.Park Press. Baltimore, London,Tokyo,1977∶213
12,Lee S,Schmid-Schonbein GW. Biomechanical model for the myogenic response in the microcirculation:Part I-Formulation and initial testing. J.Biomech.Eng.1996;118∶145
13,Frame MDS,Sarelius IH. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc.Res,1993;46(2)∶190
, http://www.100md.com
14,Kontos HA,Fingar MH,Wieman JY et al.Role of tissue hypoxia in local regulation of cerebrol microcirculation. Am. J. Physiol,1978;234∶H582
15,Kunert MP, Liard JF,Abraham DJ et al.Low-affinity hemogl-
obin increases tissue PO2 and decreases arteriolar diameter and flow in the rat cremaster muscle. Microvasc. Res.1996;52(1)∶58
16,Kroll K,Stepp DW. Adenosine kinetics in canine coronary circulation. Am J. Physiol.1996;270(4)∶H1469
, http://www.100md.com
17,Boegehold MA. Enhanced arteriolar vasomotion in rats with chronic salt-induced hypertension. Microvasc.Res.1993;45(1)∶83
18,Dirnagl U, Lindauer U,Villringer A. Nitric oxide synthase blockade enhances vasomotion in the cerebral microcirculation of anesthetized rats. Microvasc.Res.1993;45(3)∶318
19,田 牛.微循环.北京:科学出版社,1986∶1
20,武星户编.人体正常生理数据.北京:科学普及出版社,1987∶55
21,Mayrovitz MN. Skin capillary matrics and hemodynamics in the hairless mouse. Microvasc.Res,1992;43(1)∶46
(收稿:1998-12-17), 百拇医药
单位:郭仲三(中国科学院 成都计算机应用研究所自动推理实验室,成都 610041)
关键词:微循环;局部控制;生物力学模型
生物医学工程学杂志000204 摘要 分析了间质内血管代谢物质的产生和运动、毛细血管前括约肌的开闭过程、微动脉平均半径的影响因素及微动脉自律运动振幅的变化情况,建立了微循环系统局部控制过程的生物力学模型,有助于对该过程进行定量分析。
A Biomechanical Model of Local Control of Microcirculation
Guo Zhongsan
(Chengdu Institute of Computer Application, Academia Sinica, Chengdu 610041)
, http://www.100md.com
Abstract In this paper we analyze the generation and motion of vasoactive metabolites in interstitium, the open and closure of precapillary sphincters, the factors affecting mean arteriolar diameter, and the change of amplitude of arteriolar vasomotion. A biomechanical model of local control of microcirculation has been developed. It is useful in quantitative analysis of microcirculatory local control.
Key words Microcirculation Local control Biomechanical model
, 百拇医药
1 引 言
微血管床是组织灌流、血液-组织流体交换和组织血容量的控制场所。主要的控制者是微动脉和毛细血管前括约肌,主要控制机制有局部控制(Local control,或Intrinsic control)和全身控制(Remote control,或Extrinsic control),主要控制目标是在各种环境条件改变(最常见的是血压和氧浓度改度)时保持内环境的稳定性。
全身控制主要指神经控制与体液控制。二者关系十分密切,因为神经控制也是通过体液因子实现的[1],体液因子的大部分是神经递质,如去甲肾上腺素、乙酰胆碱等,有的则是细胞的释放产物,如腺甙(adenosine)。
局部控制包括肌原性控制与代谢性控制。肌原性控制是指微动脉在内外压差增大时主动收缩以控制血流量的现象。代谢性控制是通过细胞代谢产物进行的控制。有研究认为[1],微循环的局部调节中,75%是代谢性调节。
, http://www.100md.com
微循环系统控制过程的定量研究工作非常少。作者分析研究了有关的生理过程,建立了微循环系统局部控制过程的生物力学模型,有利于对这一过程进行定量分析。
2 间质腺甙源强度及腺甙浓度分布公式
细胞(假设均匀分布在间质空间内)释放活血管代谢物质(在心肌中,最重要的是腺甙;为叙述方便,本文中我们用腺甙代表所有可能的活血管代谢物质)取决于线粒体的氧利用率。线粒体内的细胞色素(Cytochrom)aa3以还原与氧化两种方式存在并可互相转化。氧进入细胞后,即作为电子的受体与作为电子供体的还原aa3相互作用,而线粒体的氧利用率UO2MM就由细胞内电子受体的浓度CO2cellcell与电子供体的浓度[aa3]R共同决定[2]:
 (1)
(1), 百拇医药
在静息状态下,[aa3]R只占细胞色素总浓度[aa3]T的1/10或更少。当细胞氧浓度降低时,氧化作用减弱,aa3的氧化-还原动态平衡被破坏,部分氧化的aa3被还原,[aa3]R增加,从而补偿了CO2cellcell降低的影响,使UO2MM维持不变或基本不变。这种补偿作用进行到aa3全部还原时,细胞氧浓度就到了一个临界值CO2cccc,进一步降低就会使UO2MM显著减小,细胞开始大量释放腺甙。据此可得[2]:
 (2)
(2), 百拇医药
其中:PO2cell为细胞氧分压;UO2max为线粒体最大氧利用率,常量;KM为细胞氧分压参考值,表示线粒体氧利用率为最大氧利用率的50%时的细胞氧分压。在大多数组织中,KM<0.1 mmHg。而通常细胞氧分压比KM大1~2个数量级[37℃时约为2~5 mmHg(1mmHg=0.133kPa)]。因此,细胞氧浓度在相当大的范围内变化时,UO2M的变化都非常小。一般地说,细胞氧分压大于1 mmHg时,均可近似认为UO2M是一个常量。在本文中,我们用线粒体相对氧利用率
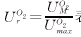
, http://www.100md.com
表示细胞是否缺氧及缺氧程度;例如,UO2rr<0.95为轻度缺氧,UO2rr<0.90为重度缺氧,等等。
细胞氧浓度由下式给出[3]:

其中:Vcell为细胞体积,JO2cellcell为进入细胞的氧通量:

其中:CO2II为间质氧浓度。由于对氧分子扩散的阻力,细胞内外存在氧浓度梯度。实验表明,细胞具有调节这一氧浓度的能力,在间质缺氧时减小这一梯度,从而部分地维持细胞正常的氧合作用[4]。这种功能性变化可能是因为aa3与氧的亲合力随细胞的能量状况发生改变所引起的[5]。因此,上式中的系数Kc2应该是[aa3]R的函数。但在本文中,我们暂取Kc2为常量。
, http://www.100md.com
可以看出,线粒体氧利用率、细胞氧浓度和间质氧浓度的关系是很复杂的。作为简化,我们假设细胞氧浓度随时间变化很慢,进入细胞的氧与线粒体消耗的氧随时保持平衡,从而得到:

其中:
 为对应于KM的氧浓度。
为对应于KM的氧浓度。根据上述分析,并假设细胞释放腺甙的强度与线粒体氧利用率成线性关系,我们得到如下腺甙源强度公式:
 (3)
(3)其中:Sad为间质腺甙源强度;Kad为腺甙源强度系数。
从腺甙源产生的腺甙在间质内的输运过程与氧相似,也包括扩散、对流和机械弥散三方面,且亦可假设间质对腺甙无排斥作用。此外,血液循环和毛细血管网的存在对腺甙的分布和运动能产生很大影响。实验表明,在微静脉注入0.1 μM浓度的腺甙,能显著扩张相邻微动脉的管径[6],说明在微动脉-微静脉之间存在“扩散交连”,使已经“离开”了微循环单元的腺甙仍能产生影响。在毛细血管内注入去甲肾上腺素,能使供血微动脉管径减小,毛细血管流速降低(直至降为零);注入乙酰胆硷或缓激肽,可使微动脉扩张并增加血流速度[7,8]。作者认为,这种从毛细血管到微动脉的退行性调节,既不是从毛细血管直接向微动脉扩散的结果,也不是通过微动脉-微静脉扩散交连实现的,而是因为毛细血管本身就具有传输活血管物质的功能。此外,毛细血管内皮细胞还能吸收大量腺甙[9]。因此,活血管物质在微循环单元中的运动方式可能十分复杂,有待进一步研究。作为简化,作者用源点迭加法计算间质各处的腺甙浓度,i点的腺甙源Sadi在j点产生的腺甙浓度CadI(ij)由平方反比律给出:

, http://www.100md.com
其中:Xij为i、j之间的距离。这样,某一时刻j点的腺甙浓度就由下式给出:
 (4)
(4)其中:CadI(j)为间质内某点j的腺甙浓度;Sadi为某点i的腺甙源强度。其积分形式为:

其中:V为间质体积。
3 毛细血管前扩约肌的局部控制模型
近代的研究表明[10,11],毛细血管的储备(Reserve)与募集(Recruitment)提供了一个精巧的调节机制;组织内关闭着的毛细血管需要时可以开放,开放着的毛细血管亦可能关闭,使血液在微血管床内更有效地重新分布,从而在血流量不变的条件下便可满足增加了的需要。这种调节是微循环单元内部的调节,不影响其余单元的灌流,不增加心脏泵血功能,在本文中我们称之为内部调节或第一调节。
, http://www.100md.com
当血液分布在所有可交换面上仍不能满足组织的需要时,微动脉将会显著地扩张,使进入该微循环单元的血流量增加,从而满足组织的需要。这种调节方式会改变其余微循环单元的血流状况,或增加心脏负荷,因此我们称之为外部调节或第二调节。
设毛细血管前括约肌处的腺甙浓度大于第一调节临界值Cml时,该毛细血管即完全开放,反之则完全关闭,便得到如下的毛细血管前括约肌代谢性调控模型:
 (5)
(5)其中:rc为毛细血管半径;rco为半径常量;J(x)为阶跃函数。
4 微动脉平均半径的局部控制模型
微动脉肌原性控制的机理还不很清楚,目前尚无普遍接受的生物力学模型。实际应用中常采用Laplace公式:
, http://www.100md.com
rp=常数
其中:r为微动脉半径;p为压力。这是根据微动脉壁内合力不变的假设而得到的。由于微动脉属厚壁管,故我们假设肌原性调节的目的是保持微动脉壁内平均应力σa不变,即:
rp=σah h—壁厚
同时假设管壁不可压缩,由此得到微动脉的肌原性调控模型:
 (6)
(6)其中:a0为微动脉入口半径平均值;a00为正常情况下微动脉入口半径平均值;Pa0为微动脉入口处血压;P′ao为正常情况下微动脉入口处血压;
 ;h0为微动脉入口处管壁厚度。由于式中包含了半径与壁厚之比,故比Laplace公式更能反映不同微动脉的差别。可以看出,σa越小,上式越接近于Laplace公式。
;h0为微动脉入口处管壁厚度。由于式中包含了半径与壁厚之比,故比Laplace公式更能反映不同微动脉的差别。可以看出,σa越小,上式越接近于Laplace公式。, 百拇医药
从不同的角度可以给出不同的模型。例如,有的作者[12]通过引入“参考直径”的概念来建立微动脉肌原性调控模型。值得指出的是,该文作者得到的r随P的变化速度和此处的(6)式都比Laplace公式所给出的速度慢。
微动脉半径随微动脉入口处的腺甙浓度增减而增减。根据对金黄仓鼠的实验[13],当腺甙浓度为10-4M左右时,微动脉扩张达到最大值。各级微动脉的静息直径约为最大直径的70%。当组织氧浓度超过需要时,微动脉管径将减小,从而提供一个负反馈调节,使组织氧供应与消耗趋于平衡。但在定量研究上目前存在较大差别:有的认为动脉氧分压高于正常值时,微动脉直径仅有很小的减少[14],而Kunert等[15]用降低血球氧亲和力的方法得到的结果则是当组织氧分压增加百分之十几到四十几时,微动脉直径将降低30%~50%。由于微动脉直径不会随腺甙浓度的增减而无限增加或趋于零,故我们设二者的关系为:
 (7)
(7), 百拇医药
其中:ramax和ramin为微动脉代谢调节的最大与最小半径,cado为腺甙的某一参考浓度。条件n>1是为了使曲线呈“S”形,如图1所示。

图1 微动脉半径与腺甙浓度的关系
Fig 1 Relationship between arteriole radius and adenosine concentration
由于间质腺甙浓度改变时,首先将引起毛细血管密度改变,而微动脉管径的显著改变则发生在毛细血管密度达到最大值之后,故第一调节临界浓度Cml应大于微动脉“正常”浓度Cadn且位于微动脉半径变化率较小的位置。
, http://www.100md.com
上式中的两个常数n和Cado可由一定的已知条件确定。根据Kroll和Stepp[16]的估计,狗心肌间质腺甙浓度约为100~200 nM。以此作为腺甙浓度的“正常”值Cadn,则可得:
Cad=Cadn时: ra=ran
另据前述Frame和Sarelius[13]的研究结果,可设腺甙浓度为CadM=10-4M时,微动脉半径已非常接近代谢调节的极大值,例如等于0.99ramax。这样,我们得到:
Cad=CadM时: ra=0.99ramax
, 百拇医药
将此二式代入式(7),就可确定常数n和Cado。于是,腺甙浓度变化引起微动脉入口半径的改变可表为:


将肌原性调控与代谢性调控结合起来,就得到微动脉半径的局部调控模型:
 (8)
(8)其中:
 ;Pac为微动脉塌陷的临界压力。
;Pac为微动脉塌陷的临界压力。5 微动脉自律运动振幅的局部控制模型
研究表明,微动脉血压在一定范围内变化时,对自律运动振幅没有影响;而当血压低于某一临界值时,自律运动将突然停止。由此,我们可将自律运动振幅的肌原性控制表为:
, 百拇医药
b=bof(CNO).J(Pao-Pcrit) (9)
其中:bo为振幅常量;Pcrit为自律运动突然停止的临界压力;f(CNO)为一氧化氮对振幅的影响函数。有实验表明[17],高食盐造成的高血压(166 mmHg)能使鼠微动脉自律运动的振幅增加达93%;作者认为,维持自律运动振幅不变的是基础一氧化氮(Basal nitric oxide),高食盐性高血压形成过程中,一氧化氮的作用被抑制了,导致自律运动振幅增加。文献[18]也表明,抑制NO将增加鼠脑微动脉血流的振幅。因此,自律运动振幅应该是一氧化氮浓度CNO的函数。但是,由于存在相反的实验结果,即增加NO能增强自律运动,加之对其机制还很不了解,故目前尚不能给出函数f(CNO)的具体形式。
, 百拇医药
6 讨 论
微循环局部控制主要指肌原性控制与代谢性控制,有的作者[19]则认为还应包括内皮细胞控制。微血管内皮细胞本身具有调节微循环的功能,已从电镜得到证实。内皮细胞胞体突向腔向(有的可达腔内1/2~2/3),血管壁局部凹陷等,都能不同程度地影响血流。因此可以认为,毛细血管内皮细胞是积极参与微循环局部调节的。
从组织缺氧到微血管作出反应有几秒到几十秒的滞后时间[14]。可以认为这就是腺甙从细胞到毛细血管前括约肌或微动脉的运动时间。由于毛细血管前括约肌和微动脉处的腺甙浓度不断变化,使毛细血管分布与微动脉管径不断变化,因此,作为简化,我们取自律运动的一个周期作为滞后时间,以一周期内某点腺甙浓度的平均值是否超过临界值作为引起调节的条件,而调节的结果则在下一周期内表现出来。这一简化的根据是,自律运动周期约10 s左右,毛细血管间歇性开闭状态每一相的延续时间约2~8 s,与滞后时间接近。
, 百拇医药
由于毛细血管前括约肌距组织缺氧区较近,阈值较低,故微循环系统第一调节总比第二调节先发生。数值计算结果表明,由于组织缺氧区分布在距毛细血管(尤其是其微动脉端)较远的地方,所以这些地区内毛细血管的开放或开放着的毛细血管向这些地区延伸,对于改变组织缺氧状况,具有最重要的意义,能在不增加血流量的情况下,显著减小直至完全消灭缺氧区。若毛细血管分布范围不变,仅密度增加,则间质氧浓度除分布有所改变外,平均浓度并无明显变化。这表明毛细血管“平均密度”概念的应用范围是有限的,很多时候其分布状况起着重要的作用。计算结果还表明,距毛细血管大于100 μm的地方,在自律运动的整个周期内,几乎都处于缺氧状态。文献[20]指出,正常人体细胞与毛细血管的距离小于50 μm。
缺氧区消灭后,间质腺甙浓度降低,部分毛细血管前括约肌重新关闭。不少实验观测都发现在正常生理条件下,毛细血管内的流动时断时续,大小和方向都经常改变。有的研究者[21]更发现所观测的全部毛细血管均有长短不等的零流量时间,并认为这是由WBC堵塞造成的。我们的研究则表明,毛细血管第一调节也可以造成这一现象。
, 百拇医药
国家自然科学基金资助项目(19472067)
参考文献
1,吴其夏主编.体液因素和血液循环病理生理学.北京:北京医科大学、中国协和医科大学联合出版社,1991
2,Granger HJ,Borders JL,Meininger GA et al.Microcirculatory control systems. in: The physiology and pharmacology of the microcirculation, vol.1, Mortillaro, NA(ed), Academic Press,1983∶209
3,Granger HJ,Shepherd AP. Dynamics and control of the microcirculation. Adv.in Biomed. Eng.1979;7∶1
, 百拇医药
4,Takahashi E,Doi K. Regulation of oxygen diffusion in hypoxic isolated cardiac myocytes. Am. J. Physiol,1996;271∶H1734
5,Hoshi Y, Hazeki O;Tamura M. Oxygen dependence of redox state of copper in cytochrome oxydase in vitro. J.Appl.Physiol.1993;74∶1622
6,Hester RL. Uptake of metabolites by postcapillary venules: Mechanism for the control of arteriolar diameter. Microvasc. Res,1993;46(2)∶254
7,Dietrick HH,Tyml K. Capillary as a communicating medium in the microvasculature. Microvasc. Res.1992;43(1)∶87
, 百拇医药
8,Mitchell D,Yu K,Tyml K. Comparable effects of arteriolar and capillary stimuli on blood flow in rat skeletal muscle. Microvasc. Res.1997;53(1)∶22
9,Bertuglia S,Colantuoni A,Arnold M et al.Dynamic coherence analysis of vasomotion and flow motion in skeletal muscle microcirculation. Microvasc. Res,1996;52(3)∶235
10,Duran WN,Mortimer PN,Lemich JM et al.Capillary reserve in isometrically contracting dog hearts. Am J. Physiol.1977;233∶H276
, 百拇医药
11,Aschheim E.Passage of substances across the walls of blood vessels: kinetics and mechanism. in: Microcirculation. vol.1,Kaley, G et al.(eds).Univ.Park Press. Baltimore, London,Tokyo,1977∶213
12,Lee S,Schmid-Schonbein GW. Biomechanical model for the myogenic response in the microcirculation:Part I-Formulation and initial testing. J.Biomech.Eng.1996;118∶145
13,Frame MDS,Sarelius IH. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc.Res,1993;46(2)∶190
, http://www.100md.com
14,Kontos HA,Fingar MH,Wieman JY et al.Role of tissue hypoxia in local regulation of cerebrol microcirculation. Am. J. Physiol,1978;234∶H582
15,Kunert MP, Liard JF,Abraham DJ et al.Low-affinity hemogl-
obin increases tissue PO2 and decreases arteriolar diameter and flow in the rat cremaster muscle. Microvasc. Res.1996;52(1)∶58
16,Kroll K,Stepp DW. Adenosine kinetics in canine coronary circulation. Am J. Physiol.1996;270(4)∶H1469
, http://www.100md.com
17,Boegehold MA. Enhanced arteriolar vasomotion in rats with chronic salt-induced hypertension. Microvasc.Res.1993;45(1)∶83
18,Dirnagl U, Lindauer U,Villringer A. Nitric oxide synthase blockade enhances vasomotion in the cerebral microcirculation of anesthetized rats. Microvasc.Res.1993;45(3)∶318
19,田 牛.微循环.北京:科学出版社,1986∶1
20,武星户编.人体正常生理数据.北京:科学普及出版社,1987∶55
21,Mayrovitz MN. Skin capillary matrics and hemodynamics in the hairless mouse. Microvasc.Res,1992;43(1)∶46
(收稿:1998-12-17), 百拇医药