一氧化碳在急性呼吸窘迫综合征发病机制中作用的初步研究
作者:陈莉 赵金垣
单位:100083 北京医科大学第三临床学院职业病研究中心
关键词:呼吸窘迫综合征;一氧化碳;一氧化氮
中华内科杂志000608 【摘要】 目的 探讨一氧化碳(CO)在急性呼吸窘迫综合征(ARDS)发病中的变化及其意义。方法 通过尾静脉注射油酸(OA)制备大鼠ARDS模型,测其不同病程时肺动脉、颈动脉、颈静脉血和支气管肺泡灌洗液(BALF)中CO含量变化,同时测定一氧化氮(NO)水平。结果 给大鼠静脉注射OA 0.5 h,其肺动脉血CO水平即见增加,2 h显著高于对照组,也高于同一时间点颈动脉血和静脉血,此后一直维持于较高水平;0.5~24 h BALF中可检出CO。注射OA后 0.5 、2 h ARDS大鼠肺动脉血、颈动脉血和颈静脉血浆中NO均明显升高,6 h开始下降,12 h后接近正常水平;BALF中 NO显著高于对照组。结论 给大鼠静脉注射OA可引起肺循环血中CO水平增加,其在ARDS发病中可能具有和NO不同的重要作用。
, 百拇医药
The role of elevated carbon monoxide in oleic acid-induced acute respiratory distress syndrome
CHEN Li, ZHAO Jinyuan.
Research Center of Occupational Medicine, Third School of Clinical Medicine, Beijing Medical University, Beijing 100083, China
【Abstract】 Objective To explore the possible involvement of carbon monoxide (CO) in the development of oleic acid (OA)-induced ARDS. Methods We determined the blood concentration of CO in pulmonary artery, carotid artery and jugular vein, as well as the concentration of CO in bronchoalvcolar lavage fluid (BALF)from male SD rats 0.5, 2, 6, 12, 24, 72 h after injection with OA via caudal vein. The plasma concentration of nitric oxide (NO) in the same samples as above was detected at the sametime. Results There was a tendency of increase of pulmonary artery CO in rats 0.5 h after OA injection.The pulmonary artery CO was significantly higher in the rats at 2 h after OA injection than in control rats (0.135±0.010) g/L versus (0.116±0.005) g/L, P<0.01. It was also higher than that in carotid artery (0.117±0.013) g/L and jugular vein (0.107±0.018) g/L in the same group of rats and maintained a relatively high level thereafter. CO was detected in BALF of all the rats 0.5~24 h after OA injection, but in none of the controls and the 72 h group. The plasma levels of NO in pulmonary and systemic circulation were all markedly elevated in rats 0.5, 2 h after OA injection, and then sharply declined. The BALF NO in all the OA injection rats was significantly higher than that in the control rats. Conclusion It is suggested that increased concentration of CO in pulmonary artery might play an important role that differs from NO in the pathogenesis of ARDS.
, 百拇医药
【Key words】 Respiratory distress syndrome; Monoxide carbon; Oxide nitric
急性呼吸窘迫综合征(ARDS)是临床各科常见的急危重症, 也是刺激性气体中毒的最严重后果。顽固性低氧血症是ARDS的重要临床特征,但其发生的确切机制尚不清楚。有研究提示,肺循环功能不良可能是ARDS低氧血症发生的关键所在,应用改善肺循环功能的药物可提高ARDS动物模型的动脉血氧分压及生存率[1]。一氧化碳(CO)是继一氧化氮(NO)之后发现的一种新的细胞信使分子[2],通过舒张血管平滑肌细胞和抑制血小板聚集,而发挥维持血管正常张力和血液流态,调节血压的作用,而且其舒张远端肺动脉的作用比NO强[3]。临床研究发现重症监护病房(ICU)的危重病患者颈动脉血中碳氧血红蛋白(HbCO)含量明显高于健康对照者,也高于自身右房混合静脉血,提示肺是产生CO的器官[4]。因此, 我们尝试将CO引入化学中毒型急性肺损伤发生机制的研究, 同时与NO进行比较, 希望为更有效的治疗提供新的思路。
, http://www.100md.com
材料和方法
1.动物及其ARDS模型制备:健康、雄性SD大鼠,体重240~280 g(解放军总医院实验动物中心提供),于实验室饲养(商品化干块料,自由饮水,温度20~22℃, 湿度50%~55%, 12 h人工照明),观察1周后随机分为健康对照组和实验组,实验组再根据观察时间分为0.5,2,6,12,24,72 h等6个亚组。 实验组动物经尾静脉注射油酸(OA)化学纯,北京金龙化学试剂有限公司生产,剂量为0.15 ml/kg体重;健康对照组不加任何处理。
2.检测方法: (1)生理指标测定:将实验大鼠用25%乌拉坦腹腔注射(1.2 g/kg体重)麻醉后固定于手术台上,接心率导联于多道生理记录仪(日本, NIHON KOHDEN);作颈正中三角形切口,分别作气管插管,右颈动脉插管,左颈静脉插管, 然后分离右颈外静脉,在多道生理记录仪监视下经由右颈外静脉作肺动脉插管;同时记录呼吸,心率,肺动脉压力的变化。(2) 血样收集:分别经肺动脉插管,右颈动脉插管和左颈外静脉插管采集肺动脉血、体动脉血和体静脉血,肝素抗凝,接插胶塞针头后置4℃冰箱待测CO和NO。(3)支气管肺泡灌洗(BALF):采血样后,打开胸腔,肉眼观察动物肺表面变化后,经气管插管注射灭菌生理盐水5 ml,反复抽洗3次后吸出,插带胶塞针头放4℃冰箱(备用)。(4) 样品中CO和NO水平的测定: ① CO测定: 采用双波长分光光度法[5]测定全血和BALF 中HbCO含量, Hb和HbCO最大吸收峰分别为430 nm和420 nm(Shimadzu UV-160A可见紫外分光光度计),血液取样量为10 μl,BALF为20 μl。通过解联立方程得出HbCO在血液中的比率, 再根据Hb含量计算出HbCO浓度。② NO水平测定: 测完HbCO后,将剩余血液和BALF分别置于1.5 ml Eppendorf管内, 4℃ 1 000 g离心10 min, 取上清, 用Griess试剂比色法, 于550 nm波长下(美国产Spectronic Genesys 5 型可见紫外分光光度计,比色杯液池容积750 μl) 测定NO终产物NO-2含量。
, 百拇医药
3. 统计学分析:多组均数比较采用方差分析, 然后进行Q检验。
结果
1.一般状态观察:给大鼠尾静脉注射油酸后,均出现短暂呼吸停止,数秒后重新呼吸,且明显加快、口鼻发绀、精神萎糜、少动、拒食或少食、个别动物出现血尿。
2.生理指标测定和动脉血氧合指数(PaO2/FiO2)的变化: ARDS大鼠呼吸频率明显增加;心率开始时明显减慢,12 h后开始增加,72 h恢复正常;肺动脉压力于注射OA 10 min后开始升高,2 h后大致维持于较恒定的高水平状态(图1)。各OA组大鼠动脉血PaO2/FiO2均显著低于对照组,其中2 h组最低(152±27) mm Hg,对照组(418±18) mm Hg,0.5 h和6 h组亦都低于200 mm Hg。
, 百拇医药
图1 染OA不同时间大鼠呼吸频率、心率、平均肺动脉压力变化
3.CO水平的变化:给大鼠注射OA后0.5 h,肺动脉血中HbCO浓度即见增加,2 h浓度最高,与对照组相比差异非常显著,并且高于颈动脉血和静脉血,此后一直维持于较高水平(表1);颈动脉血中HbCO水平亦呈增高趋势,24 h与对照组相比差异显著,72 h降到正常水平;静脉血中HbCO浓度无明显变化。
表1 ARDS大鼠不同途径全血和BALF中
HbCO水平变化(g/L,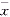 ±s) 时间(h)
±s) 时间(h)
只
数
肺动脉血
, http://www.100md.com
颈动脉血
颈静脉血
BALF
对照
5
0.116±
0.005++
0.111±
0.011
0.099±
0.003
测不出
0.5
, http://www.100md.com
5
0.121±
0.014
0.120±
0.011
0.108±
0.006
0.002 8±
0.000 8
2
6
0.135±
0.010(**)/(△+)
, http://www.100md.com
0.117±
0.013
0.107±
0.018
0.002 9±
0.000 8①
6
6
0.124±
0.014+
0.123±
0.013
, http://www.100md.com
0.103±
0.015
0.003 5±
0.001 2①
12
6
0.131±
0.009**+
0.128±
0.017
0.115±
0.015
, 百拇医药
0.003 6±
0.000 7
24
7
0.125±
0.006*++
0.128±
0.013*
0.112±
0.012
0.003 9±
0.001 6①
, 百拇医药
72
5
0.125±
0.007△
0.108±
0.011
0.113±
0.018
测不出
注:①各少1例;与对照组比较,*P<0.05,**P<0.01;与同组颈动脉血比较,△P<0.05;与同组颈静脉血比较,+P<0.05,++P<0.01
, 百拇医药
对照组大鼠BALF中未能测出HbCO。 0.5~24 h ARDS大鼠BALF中HbCO浓度明显升高,72 h恢复正常(表1)。
4.NO水平的变化:ARDS大鼠染毒后0.5, 2 h,肺动脉血、颈动脉血和颈静脉血中NO-2水平均较对照组明显升高,6 h开始下降, 12 h以后接近正常水平; 肺动脉血与颈动脉血和颈静脉血相比, NO-2水平无明显差别。ARDS大鼠各时间点BALF中NO-2浓度均显著高于对照组(表2)。
表2 ARDS大鼠不同途径血浆和BALF中NO2-
水平变化(μmo1/L,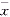 ±s) 时间(h)
±s) 时间(h)
, 百拇医药
只
数
肺动脉血
颈动脉血
颈静脉血
BALF
对照
5
3.49±
2.09
3.57±
1.17
3.82±
, 百拇医药
1.61
2.51±
0.85
0.5
5
16.42±
4.32**
18.02±
6.72**
13.96±
4.64**
54.93±
, http://www.100md.com
7.94**
2
5
14.60±
6.91**
8.86±
4.42*
8.05±
2.61*
51.34±
4.94**
, 百拇医药 6
5
6.07±
1.25*
5.65±
0.81*
4.92±
1.82
68.25±
11.63**
12
5
, 百拇医药
4.21±
1.22
4.89±
1.29
5.10±
1.29
35.58±
6.37**
24
5
4.28±
1.38
3.21±
, 百拇医药
1.01
3.87±
0.68
48.63±
12.68**
72
5
2.12±
0.56
3.71±
1.06
3.82±
1.14
, 百拇医药
7.04±
1.76**
注:与对照组比较,*P<0.05,**P<0.01
讨论
一、CO的体内来源
CO在体内主要由血红素加氧酶 (heme oxygenase, HO) 催化血红素分解产生。HO是高等真核生物体内广泛存在的一种重要抗氧化酶,在有NADPH-细胞色素P450还原酶的存在下,催化血红素分解为胆绿素、Fe和CO。 同一氧化氮合酶 (nitric oxide synthase, NOS)一样,HO在体内也有两种存在型,即HO-2(固有型酶)和HO-1(诱生型酶)。HO-1是迄今为止所发现的生物体内最容易被诱导产生的酶。 有研究文献报道高氧、内毒素均可诱导大鼠肺组织中HO-1 mRNA表达和酶活性的明显增加[6],低氧可诱导大鼠主动脉和肺动脉平滑肌细胞中HO-1 mRNA表达和酶催化产物CO水平的显著增加[7]。CO在体内主要以HbCO的形式存在[2],因此,测定血中HbCO 含量可反映机体CO的生成水平。
, 百拇医药
本研究结果显示, 正常大鼠肺动脉血中HbCO水平高于颈静脉血, 表明生理条件下肺血管系统即可产生CO; 给大鼠静脉注射OA 0.5 h肺动脉血中HbCO开始升高,2 h达峰值,此后也一直维持于较高水平;颈动脉血HbCO也有增高趋势,24 h与对照组相比差别显著;颈静脉血HbCO则无明显变化,提示肺循环血中的CO主要产生于肺脏。另外,给大鼠静脉注射OA后72 h,肺已呈明显增殖性炎性病变,此时BALF亦非血性,其HbCO和对照组一样不能测出,提示 ARDS大鼠早期BALF中的CO可能主要来源于肺血流中的漏出。
二、CO在化学性ARDS发病中的意义
1.CO在ARDS病程中的变化:OA为含一个不饱和双键的烯酸,给动物静脉注射后可引起ARDS。本实验给大鼠静脉注射OA后10 min,肺动脉压力即开始增加,表明此时肺循环功能已发生改变,即由肺血管的收缩反应导致的压力升高;0.5 h后肺循环血和颈动脉血中CO水平即见升高,可能是肺血管系统对OA刺激产生的收缩反应和其后缺氧状态的一种应激反应。生理条件下,HO-2和NOS互为补充、共同调节血管的舒张状态和血压[3]。给大鼠静脉注射OA所引起的血管收缩和缺氧可诱导肺动脉平滑肌细胞中HO-1的大量产生,CO/HO不仅通过舒张血管平滑肌细胞,调整血管舒缩状态;还可藉对内皮细胞的旁分泌作用,增加内皮细胞的cGMP含量,减少丝裂原如内皮素-1(ET-1)和血小板源生长因子-B(PDGF-B)的生成, 或通过阻遏调控细胞周期的转录因子E2F-1的表达来抑制平滑肌细胞的增殖[8],从而改善低氧条件下肺血管的舒张状态,调节肺循环血液动力学的变化。但也有实验发现内源性CO和NO可通过增加cGMP水平,介导细胞因子抑制肺泡II型上皮细胞分泌磷脂酰胆碱,减少肺表面活性物质的产生[9],故OA型ARDS大鼠肺血管内CO生成的增加,对肺损伤的发生、发展是否同时具有利与弊的双重作用,尚需进一步探讨。
, 百拇医药
2. CO和NO作用的比较:本研究结果表明,生理条件下,肺血流和气道上皮衬液中即有NO的存在,这对维持机体的正常生理功能如舒张血管和气道平滑肌细胞以及杀菌抗炎等具有重要意义。给大鼠静脉注射OA后,可刺激气道上皮细胞、巨噬细胞和中性粒细胞内诱导型一氧化氮合酶(iNOS)生成明显增加,使BALF中NO-2持续维持于高水平。研究表明由iNOS催化产生的大量NO可通过直接的组织损伤和过氧化亚硝基阴离子的形成对机体产生明显的毒作用;Kristof等[10]发现将小鼠iNOS基因敲除后,再腹腔内注射LPS几乎不引起明显的肺损伤。本实验ARDS大鼠早期肺循环血和外周血中NO-2水平可呈短暂性升高,表明给大鼠静脉注射OA可刺激血管内皮细胞NO生成增加,但其后低氧并不能明显诱导肺血管系统NO的产生。上述结果提示,是CO而不是NO调节了低氧时肺血管平滑肌细胞的舒张状态,与体外实验HO的特异抑制剂锡原卟啉-9可明显抑制低氧时平滑肌细胞中CO的生成和cGMP 水平的提高,NOS抑制剂NW-硝基-L-精氨酸则对cGMP的变化无影响[7],结果一致。
, 百拇医药
志谢 本文承蒙军事医学科学院毒物药物研究所杜先林教授,彭双清、丁日高博士,野战输血研究所王全力博士, 北京医科大学第一医院唐朝枢教授, 北京医科大学公共卫生学院王起恩博士, 北京市第四医院李凤莲主任等的热情帮助
基金项目:国家自然科学基金资助项目(39770638); 国家教育部博士点基金课题 (9822)
参考文献
1,刘宏,赵金垣,刘艳云,等. 肺循环高凝状态与成人呼吸窘迫综合征的发病机理. 中华劳动卫生职业病杂志,1996,14:193-196.
2,陈莉, 赵金垣. 一种新的细胞信使分子——一氧化碳. 中华内科杂志, 1999, 38:270-272.
3,Zakhary R, Gaine SP, Dinerman JL, et al. Heme oxygenase-2: endothelial and neuronal localization and role in endothelium-dependent relaxation. Proc Natl Acad Sci USA, 1996, 93:795-798.
, 百拇医药
4,Meyer J,Prien T, Van Aken H,et al. Arterio-venous carboxyhemoglobin difference suggests carbon monoxide production by human lungs. Biochem Biophys Res Commun, 1998,244:230-232.
5,谢萍, 马相民. 分光光度法测定血液中碳氧血红蛋白规范化研究. 工业卫生与职业病, 1990, 16:38-42.
6,Choi AM, Alam J. Heme oxygenase-1: function, regulation, and implication of a novel stress-inducible protein in oxidant-induced lung injury. Am J Respir Cell Mol Biol, 1996, 15:9-19.
, 百拇医药
7,Morita T, Perrella MA, Lee ME, et al. Smooth muscle cell-derived carbon monoxide is a regulator of vascular cGMP. Proc Natl Acad Sci U S A, 1995, 92:1475-1479.
8,Morita T, Mitsialis SA, Koike H, et al. Carbon monoxide controls the proliferation of hypoxic vascular smooth muscle cells. J Biol Chem, 1997,272:32804-32809.
9,Arias-Diaz J, Villa N, Hernandez J, et al. Carbon monoxide contributes to the cytokine-induced inhibition of surfactant synthesis by human type II pneumocytes. Arch Surg, 1997, 132:1352-1361.
10,Kristof AS, Goldberg P, Laubach V, et al. Role of inducible nitric oxide synthase in endotoxin-induced acute lung injury. Am J Respir Crit Care Med, 1998, 158:1883-1889.
(收稿日期:1999-11-10), 百拇医药
单位:100083 北京医科大学第三临床学院职业病研究中心
关键词:呼吸窘迫综合征;一氧化碳;一氧化氮
中华内科杂志000608 【摘要】 目的 探讨一氧化碳(CO)在急性呼吸窘迫综合征(ARDS)发病中的变化及其意义。方法 通过尾静脉注射油酸(OA)制备大鼠ARDS模型,测其不同病程时肺动脉、颈动脉、颈静脉血和支气管肺泡灌洗液(BALF)中CO含量变化,同时测定一氧化氮(NO)水平。结果 给大鼠静脉注射OA 0.5 h,其肺动脉血CO水平即见增加,2 h显著高于对照组,也高于同一时间点颈动脉血和静脉血,此后一直维持于较高水平;0.5~24 h BALF中可检出CO。注射OA后 0.5 、2 h ARDS大鼠肺动脉血、颈动脉血和颈静脉血浆中NO均明显升高,6 h开始下降,12 h后接近正常水平;BALF中 NO显著高于对照组。结论 给大鼠静脉注射OA可引起肺循环血中CO水平增加,其在ARDS发病中可能具有和NO不同的重要作用。
, 百拇医药
The role of elevated carbon monoxide in oleic acid-induced acute respiratory distress syndrome
CHEN Li, ZHAO Jinyuan.
Research Center of Occupational Medicine, Third School of Clinical Medicine, Beijing Medical University, Beijing 100083, China
【Abstract】 Objective To explore the possible involvement of carbon monoxide (CO) in the development of oleic acid (OA)-induced ARDS. Methods We determined the blood concentration of CO in pulmonary artery, carotid artery and jugular vein, as well as the concentration of CO in bronchoalvcolar lavage fluid (BALF)from male SD rats 0.5, 2, 6, 12, 24, 72 h after injection with OA via caudal vein. The plasma concentration of nitric oxide (NO) in the same samples as above was detected at the sametime. Results There was a tendency of increase of pulmonary artery CO in rats 0.5 h after OA injection.The pulmonary artery CO was significantly higher in the rats at 2 h after OA injection than in control rats (0.135±0.010) g/L versus (0.116±0.005) g/L, P<0.01. It was also higher than that in carotid artery (0.117±0.013) g/L and jugular vein (0.107±0.018) g/L in the same group of rats and maintained a relatively high level thereafter. CO was detected in BALF of all the rats 0.5~24 h after OA injection, but in none of the controls and the 72 h group. The plasma levels of NO in pulmonary and systemic circulation were all markedly elevated in rats 0.5, 2 h after OA injection, and then sharply declined. The BALF NO in all the OA injection rats was significantly higher than that in the control rats. Conclusion It is suggested that increased concentration of CO in pulmonary artery might play an important role that differs from NO in the pathogenesis of ARDS.
, 百拇医药
【Key words】 Respiratory distress syndrome; Monoxide carbon; Oxide nitric
急性呼吸窘迫综合征(ARDS)是临床各科常见的急危重症, 也是刺激性气体中毒的最严重后果。顽固性低氧血症是ARDS的重要临床特征,但其发生的确切机制尚不清楚。有研究提示,肺循环功能不良可能是ARDS低氧血症发生的关键所在,应用改善肺循环功能的药物可提高ARDS动物模型的动脉血氧分压及生存率[1]。一氧化碳(CO)是继一氧化氮(NO)之后发现的一种新的细胞信使分子[2],通过舒张血管平滑肌细胞和抑制血小板聚集,而发挥维持血管正常张力和血液流态,调节血压的作用,而且其舒张远端肺动脉的作用比NO强[3]。临床研究发现重症监护病房(ICU)的危重病患者颈动脉血中碳氧血红蛋白(HbCO)含量明显高于健康对照者,也高于自身右房混合静脉血,提示肺是产生CO的器官[4]。因此, 我们尝试将CO引入化学中毒型急性肺损伤发生机制的研究, 同时与NO进行比较, 希望为更有效的治疗提供新的思路。
, http://www.100md.com
材料和方法
1.动物及其ARDS模型制备:健康、雄性SD大鼠,体重240~280 g(解放军总医院实验动物中心提供),于实验室饲养(商品化干块料,自由饮水,温度20~22℃, 湿度50%~55%, 12 h人工照明),观察1周后随机分为健康对照组和实验组,实验组再根据观察时间分为0.5,2,6,12,24,72 h等6个亚组。 实验组动物经尾静脉注射油酸(OA)化学纯,北京金龙化学试剂有限公司生产,剂量为0.15 ml/kg体重;健康对照组不加任何处理。
2.检测方法: (1)生理指标测定:将实验大鼠用25%乌拉坦腹腔注射(1.2 g/kg体重)麻醉后固定于手术台上,接心率导联于多道生理记录仪(日本, NIHON KOHDEN);作颈正中三角形切口,分别作气管插管,右颈动脉插管,左颈静脉插管, 然后分离右颈外静脉,在多道生理记录仪监视下经由右颈外静脉作肺动脉插管;同时记录呼吸,心率,肺动脉压力的变化。(2) 血样收集:分别经肺动脉插管,右颈动脉插管和左颈外静脉插管采集肺动脉血、体动脉血和体静脉血,肝素抗凝,接插胶塞针头后置4℃冰箱待测CO和NO。(3)支气管肺泡灌洗(BALF):采血样后,打开胸腔,肉眼观察动物肺表面变化后,经气管插管注射灭菌生理盐水5 ml,反复抽洗3次后吸出,插带胶塞针头放4℃冰箱(备用)。(4) 样品中CO和NO水平的测定: ① CO测定: 采用双波长分光光度法[5]测定全血和BALF 中HbCO含量, Hb和HbCO最大吸收峰分别为430 nm和420 nm(Shimadzu UV-160A可见紫外分光光度计),血液取样量为10 μl,BALF为20 μl。通过解联立方程得出HbCO在血液中的比率, 再根据Hb含量计算出HbCO浓度。② NO水平测定: 测完HbCO后,将剩余血液和BALF分别置于1.5 ml Eppendorf管内, 4℃ 1 000 g离心10 min, 取上清, 用Griess试剂比色法, 于550 nm波长下(美国产Spectronic Genesys 5 型可见紫外分光光度计,比色杯液池容积750 μl) 测定NO终产物NO-2含量。
, 百拇医药
3. 统计学分析:多组均数比较采用方差分析, 然后进行Q检验。
结果
1.一般状态观察:给大鼠尾静脉注射油酸后,均出现短暂呼吸停止,数秒后重新呼吸,且明显加快、口鼻发绀、精神萎糜、少动、拒食或少食、个别动物出现血尿。
2.生理指标测定和动脉血氧合指数(PaO2/FiO2)的变化: ARDS大鼠呼吸频率明显增加;心率开始时明显减慢,12 h后开始增加,72 h恢复正常;肺动脉压力于注射OA 10 min后开始升高,2 h后大致维持于较恒定的高水平状态(图1)。各OA组大鼠动脉血PaO2/FiO2均显著低于对照组,其中2 h组最低(152±27) mm Hg,对照组(418±18) mm Hg,0.5 h和6 h组亦都低于200 mm Hg。

, 百拇医药
图1 染OA不同时间大鼠呼吸频率、心率、平均肺动脉压力变化
3.CO水平的变化:给大鼠注射OA后0.5 h,肺动脉血中HbCO浓度即见增加,2 h浓度最高,与对照组相比差异非常显著,并且高于颈动脉血和静脉血,此后一直维持于较高水平(表1);颈动脉血中HbCO水平亦呈增高趋势,24 h与对照组相比差异显著,72 h降到正常水平;静脉血中HbCO浓度无明显变化。
表1 ARDS大鼠不同途径全血和BALF中
HbCO水平变化(g/L,
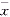 ±s) 时间(h)
±s) 时间(h)只
数
肺动脉血
, http://www.100md.com
颈动脉血
颈静脉血
BALF
对照
5
0.116±
0.005++
0.111±
0.011
0.099±
0.003
测不出
0.5
, http://www.100md.com
5
0.121±
0.014
0.120±
0.011
0.108±
0.006
0.002 8±
0.000 8
2
6
0.135±
0.010(**)/(△+)
, http://www.100md.com
0.117±
0.013
0.107±
0.018
0.002 9±
0.000 8①
6
6
0.124±
0.014+
0.123±
0.013
, http://www.100md.com
0.103±
0.015
0.003 5±
0.001 2①
12
6
0.131±
0.009**+
0.128±
0.017
0.115±
0.015
, 百拇医药
0.003 6±
0.000 7
24
7
0.125±
0.006*++
0.128±
0.013*
0.112±
0.012
0.003 9±
0.001 6①
, 百拇医药
72
5
0.125±
0.007△
0.108±
0.011
0.113±
0.018
测不出
注:①各少1例;与对照组比较,*P<0.05,**P<0.01;与同组颈动脉血比较,△P<0.05;与同组颈静脉血比较,+P<0.05,++P<0.01
, 百拇医药
对照组大鼠BALF中未能测出HbCO。 0.5~24 h ARDS大鼠BALF中HbCO浓度明显升高,72 h恢复正常(表1)。
4.NO水平的变化:ARDS大鼠染毒后0.5, 2 h,肺动脉血、颈动脉血和颈静脉血中NO-2水平均较对照组明显升高,6 h开始下降, 12 h以后接近正常水平; 肺动脉血与颈动脉血和颈静脉血相比, NO-2水平无明显差别。ARDS大鼠各时间点BALF中NO-2浓度均显著高于对照组(表2)。
表2 ARDS大鼠不同途径血浆和BALF中NO2-
水平变化(μmo1/L,
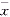 ±s) 时间(h)
±s) 时间(h), 百拇医药
只
数
肺动脉血
颈动脉血
颈静脉血
BALF
对照
5
3.49±
2.09
3.57±
1.17
3.82±
, 百拇医药
1.61
2.51±
0.85
0.5
5
16.42±
4.32**
18.02±
6.72**
13.96±
4.64**
54.93±
, http://www.100md.com
7.94**
2
5
14.60±
6.91**
8.86±
4.42*
8.05±
2.61*
51.34±
4.94**
, 百拇医药 6
5
6.07±
1.25*
5.65±
0.81*
4.92±
1.82
68.25±
11.63**
12
5
, 百拇医药
4.21±
1.22
4.89±
1.29
5.10±
1.29
35.58±
6.37**
24
5
4.28±
1.38
3.21±
, 百拇医药
1.01
3.87±
0.68
48.63±
12.68**
72
5
2.12±
0.56
3.71±
1.06
3.82±
1.14
, 百拇医药
7.04±
1.76**
注:与对照组比较,*P<0.05,**P<0.01
讨论
一、CO的体内来源
CO在体内主要由血红素加氧酶 (heme oxygenase, HO) 催化血红素分解产生。HO是高等真核生物体内广泛存在的一种重要抗氧化酶,在有NADPH-细胞色素P450还原酶的存在下,催化血红素分解为胆绿素、Fe和CO。 同一氧化氮合酶 (nitric oxide synthase, NOS)一样,HO在体内也有两种存在型,即HO-2(固有型酶)和HO-1(诱生型酶)。HO-1是迄今为止所发现的生物体内最容易被诱导产生的酶。 有研究文献报道高氧、内毒素均可诱导大鼠肺组织中HO-1 mRNA表达和酶活性的明显增加[6],低氧可诱导大鼠主动脉和肺动脉平滑肌细胞中HO-1 mRNA表达和酶催化产物CO水平的显著增加[7]。CO在体内主要以HbCO的形式存在[2],因此,测定血中HbCO 含量可反映机体CO的生成水平。
, 百拇医药
本研究结果显示, 正常大鼠肺动脉血中HbCO水平高于颈静脉血, 表明生理条件下肺血管系统即可产生CO; 给大鼠静脉注射OA 0.5 h肺动脉血中HbCO开始升高,2 h达峰值,此后也一直维持于较高水平;颈动脉血HbCO也有增高趋势,24 h与对照组相比差别显著;颈静脉血HbCO则无明显变化,提示肺循环血中的CO主要产生于肺脏。另外,给大鼠静脉注射OA后72 h,肺已呈明显增殖性炎性病变,此时BALF亦非血性,其HbCO和对照组一样不能测出,提示 ARDS大鼠早期BALF中的CO可能主要来源于肺血流中的漏出。
二、CO在化学性ARDS发病中的意义
1.CO在ARDS病程中的变化:OA为含一个不饱和双键的烯酸,给动物静脉注射后可引起ARDS。本实验给大鼠静脉注射OA后10 min,肺动脉压力即开始增加,表明此时肺循环功能已发生改变,即由肺血管的收缩反应导致的压力升高;0.5 h后肺循环血和颈动脉血中CO水平即见升高,可能是肺血管系统对OA刺激产生的收缩反应和其后缺氧状态的一种应激反应。生理条件下,HO-2和NOS互为补充、共同调节血管的舒张状态和血压[3]。给大鼠静脉注射OA所引起的血管收缩和缺氧可诱导肺动脉平滑肌细胞中HO-1的大量产生,CO/HO不仅通过舒张血管平滑肌细胞,调整血管舒缩状态;还可藉对内皮细胞的旁分泌作用,增加内皮细胞的cGMP含量,减少丝裂原如内皮素-1(ET-1)和血小板源生长因子-B(PDGF-B)的生成, 或通过阻遏调控细胞周期的转录因子E2F-1的表达来抑制平滑肌细胞的增殖[8],从而改善低氧条件下肺血管的舒张状态,调节肺循环血液动力学的变化。但也有实验发现内源性CO和NO可通过增加cGMP水平,介导细胞因子抑制肺泡II型上皮细胞分泌磷脂酰胆碱,减少肺表面活性物质的产生[9],故OA型ARDS大鼠肺血管内CO生成的增加,对肺损伤的发生、发展是否同时具有利与弊的双重作用,尚需进一步探讨。
, 百拇医药
2. CO和NO作用的比较:本研究结果表明,生理条件下,肺血流和气道上皮衬液中即有NO的存在,这对维持机体的正常生理功能如舒张血管和气道平滑肌细胞以及杀菌抗炎等具有重要意义。给大鼠静脉注射OA后,可刺激气道上皮细胞、巨噬细胞和中性粒细胞内诱导型一氧化氮合酶(iNOS)生成明显增加,使BALF中NO-2持续维持于高水平。研究表明由iNOS催化产生的大量NO可通过直接的组织损伤和过氧化亚硝基阴离子的形成对机体产生明显的毒作用;Kristof等[10]发现将小鼠iNOS基因敲除后,再腹腔内注射LPS几乎不引起明显的肺损伤。本实验ARDS大鼠早期肺循环血和外周血中NO-2水平可呈短暂性升高,表明给大鼠静脉注射OA可刺激血管内皮细胞NO生成增加,但其后低氧并不能明显诱导肺血管系统NO的产生。上述结果提示,是CO而不是NO调节了低氧时肺血管平滑肌细胞的舒张状态,与体外实验HO的特异抑制剂锡原卟啉-9可明显抑制低氧时平滑肌细胞中CO的生成和cGMP 水平的提高,NOS抑制剂NW-硝基-L-精氨酸则对cGMP的变化无影响[7],结果一致。
, 百拇医药
志谢 本文承蒙军事医学科学院毒物药物研究所杜先林教授,彭双清、丁日高博士,野战输血研究所王全力博士, 北京医科大学第一医院唐朝枢教授, 北京医科大学公共卫生学院王起恩博士, 北京市第四医院李凤莲主任等的热情帮助
基金项目:国家自然科学基金资助项目(39770638); 国家教育部博士点基金课题 (9822)
参考文献
1,刘宏,赵金垣,刘艳云,等. 肺循环高凝状态与成人呼吸窘迫综合征的发病机理. 中华劳动卫生职业病杂志,1996,14:193-196.
2,陈莉, 赵金垣. 一种新的细胞信使分子——一氧化碳. 中华内科杂志, 1999, 38:270-272.
3,Zakhary R, Gaine SP, Dinerman JL, et al. Heme oxygenase-2: endothelial and neuronal localization and role in endothelium-dependent relaxation. Proc Natl Acad Sci USA, 1996, 93:795-798.
, 百拇医药
4,Meyer J,Prien T, Van Aken H,et al. Arterio-venous carboxyhemoglobin difference suggests carbon monoxide production by human lungs. Biochem Biophys Res Commun, 1998,244:230-232.
5,谢萍, 马相民. 分光光度法测定血液中碳氧血红蛋白规范化研究. 工业卫生与职业病, 1990, 16:38-42.
6,Choi AM, Alam J. Heme oxygenase-1: function, regulation, and implication of a novel stress-inducible protein in oxidant-induced lung injury. Am J Respir Cell Mol Biol, 1996, 15:9-19.
, 百拇医药
7,Morita T, Perrella MA, Lee ME, et al. Smooth muscle cell-derived carbon monoxide is a regulator of vascular cGMP. Proc Natl Acad Sci U S A, 1995, 92:1475-1479.
8,Morita T, Mitsialis SA, Koike H, et al. Carbon monoxide controls the proliferation of hypoxic vascular smooth muscle cells. J Biol Chem, 1997,272:32804-32809.
9,Arias-Diaz J, Villa N, Hernandez J, et al. Carbon monoxide contributes to the cytokine-induced inhibition of surfactant synthesis by human type II pneumocytes. Arch Surg, 1997, 132:1352-1361.
10,Kristof AS, Goldberg P, Laubach V, et al. Role of inducible nitric oxide synthase in endotoxin-induced acute lung injury. Am J Respir Crit Care Med, 1998, 158:1883-1889.
(收稿日期:1999-11-10), 百拇医药