细胞增殖与程序性细胞死亡在颞下颌关节发育中的意义
作者:李 松 金 岩 王惠芸 李 媛
单位:西安第四军医大学口腔医学院 710032
关键词:增殖细胞核抗原;程序性细胞死亡;颞下颌关节;胚胎
实用口腔医学杂志990304
〔摘要〕 目的: 探讨细胞增殖与程序性细胞死亡在颞下颌关节发育中的作用。方法:利用免疫组织化学技术及原位末端标记法,对胚胎及生后一周SD 大鼠颞下颌关节不同发育时期髁状突软骨中增殖细胞核抗原(PCNA)的表达及程序性细胞死亡(PCD)进行了观察。结果:胎鼠颞下颌关节髁状突软骨增殖层PCNA 阳性细胞率最高,进入浅层肥厚层PCNA 阳性细胞数减少,深层肥厚层中则未见PCNA 阳性细胞。出生后髁状突软骨PCNA 阳性细胞率均较出生前低。PCD 阳性细胞主要分布于软骨增殖层及邻近深层肥厚层的浅层肥厚层中,在关节腔开始形成时髁状突软骨表面PCD 明显。结论:细胞增殖与程序性细胞死亡密切相关,协同参与调控颞下颌关节的生长发育与塑形。
, http://www.100md.com
The role of cell proliferation and programmed cell death in the temporomandibular joint development.
Li Song, Jin Yan, Wang Huiyun, et al. Stomatological College, Fourth Military Medical University, Xi'an 710032
〔Abstract〕Objective: To study the role of cell proliferation and programmed cell death(PCD) in the temporomandibular joint(TMJ) development . Methods:Expression of proliferation cell nuclear antigen(PCNA) and PCD were observed by immunohistochemical staining and Tdt-mediated dUTP nick end labelling (TUNEL) in TMJ of SD rats during series prenatal and postnatal developmental periods. Result:The PCNA positive cells accounted for 55.3% of the cells in proliferative zone of condylar cartilage of fetuses and 21.9% in prehypertrophic zone, no positive cell was found in late hypertrophic zone. PCD positive cells were mainly located in proliferative zone and the area between prehypertrophic and late hypertrophic zones, PCD positive cells of condylar surface increased obviously during the formation of joint cavity.:Conclusion: Cells proliferation and programmed cell death are interactive with each other in the regulation of the development of TMJ.
, http://www.100md.com
Key words Proliferating cell nuclear antigen; Programmed cell death; Temporomandi-bular joint; Embryo
颞下颌关节发育期髁状突软骨是下颌骨的主要生长区之一。髁状突软骨具有类似于长骨生长板独立生长的特性,软骨细胞可不断分裂、增殖使下颌骨及颞下颌关节得以生长发育[1]。程序性细胞死亡(programmed cell death ,简称PCD)是一种细胞自然死亡现象,虽然对它在胚胎发生、器官发育及形成中的作用已有所认识[2],但作为细胞生命活动的增殖及程序性细胞死亡在颞下颌关节发育过程中的相互关系及作用的研究尚未见报道。本文通过观察胚胎及出生后一周SD 大鼠各时期颞下颌关节发育中增殖细胞核抗原(proliferating cell nuclear antigen ,简称PCNA)的表达及 PCD的变化,探讨细胞增殖与程序性细胞死亡在颞下颌关节发育中的意义。
, http://www.100md.com
1 材料与方法
1.1 动物模型及标本制备
选用纯系、三月龄 SD大鼠(上海产)20 只,按雌雄4∶1的比例同笼,每天早晨8∶00 观察雌鼠阴栓,以观察到阴栓计为妊娠0 d,分别于妊娠13、14、15、16、17、18、19、20 d脱颈处死大鼠,切取胎鼠(E)颞下颌关节部置于40 g/L 的多聚甲醛中固定后常规脱水、石蜡包埋。另取出生后(P)1、2、3、4、5、6、7 d幼鼠颞下颌关节部(沿正中线切开鼠头后分切)置入含盐酸、甲酸及冰醋酸的40 g/L 多聚甲醛液中充分固定、脱钙,流水冲洗后脱水、石蜡包埋。作颞下颌关节矢状面切片,厚度5 μm,以备HE染色、免疫组织化学染色及原位末断标记使用,切片前载玻片预先严格清洁处理并涂APES胶。
1.2 免疫组织化学检测PCNA
免疫组织化学染色采用 ABC法,石蜡切片脱蜡至水,经体积分数为φ=3% H2O2 封闭内源性过氧化物酶及枸橼酸缓冲液微波修复抗原10 min后,用正常羊血清封闭30 min;加PCNA单抗(鼠抗大鼠,美国Santa Cruz 公司产品)置于4 ℃过夜,室温下复温1 h后滴加生物素化二抗37 ℃反应30 min ;再加ABC复合物37 ℃孵育30 min,DAB 显色后,二甲苯透明、封片。
, http://www.100md.com
1.3 原位末断标记法(TUNEL法)标记PCD细胞
TUNEL (Tdt-mediated dUTP nick end labelling)法(试剂盒购自美国Oncor公司):切片常规脱蜡至水,室温下20 mg/L的蛋白酶K消化15 min;然后置于含φ =3% H2O2的 PBS溶液中处理5 min,加50 μl的平衡液(TUNEL试剂盒原配)1 min;再加含TDT 酶反应液15 μl于37 ℃反应1.5 h后用预热的中止反应液中止反应(TUNEL试剂盒原配);buffer1漂洗2 次(15 min/次)后加φ=2% 的正常羊血清孵育30 min;滴加抗地高辛碱性磷酸酶抗体置于湿盒中孵育2 h;经buffer1 、buffer3漂洗后,加新配制的显色液 (NBT/BCIP显色系统,用buffer3配制,NBT 4.5 μl、BCIP 3.5 μl、左旋咪唑0.24 mg/ml) 20 μl,暗处显色。中止显色后,梯度酒精脱水,二甲苯透明封片。
, 百拇医药
1.4 PCNA、PCD阳性细胞计数及统计方法
在光学显微镜下,随机选取5 个 40×10高倍视野,用10×10 网格分别计数髁状突软骨增殖层及浅层肥厚层的阳性细胞数及细胞总数,并分别计算胚胎及生后PCNA 及PCD 的平均阳性细胞百分率和标准差。
2 结 果
2.1 HE染色 E13 d颞下颌关节区开始出现未分化间充质细胞聚集、增殖、分化为软骨细胞,至E14 d颞下颌关节髁状突软骨组织增厚,软骨各层分界明显;E 14~E 15 d关节腔开始形成,E 17、18 d关节盘出现;E13 d即可见下颌骨体部端有骨化出现,以后骨化逐渐扩展到髁状突颈部;出生后关节软骨逐渐变薄,下颌骨骨化接近关节软骨区。
2.2 PCNA 免疫组织化学染色 PCNA 阳性细胞为胞核着棕黄色。胚胎颞下颌关节髁状突软骨增殖层PCNA 阳性软骨细胞多(图1),进入浅层肥厚层PCNA 阳性软骨细胞数逐渐减少(图2),深层肥厚层中未见PCNA 阳性软骨细胞。出生后髁状突软骨增殖层及浅肥厚层PCNA 阳性细胞率均较出生前低。PCNA 阳性细胞率详见表 1。
, 百拇医药
图1 E14 d,髁状突软骨增殖层PCNA 表达阳性软骨细胞多(40×15)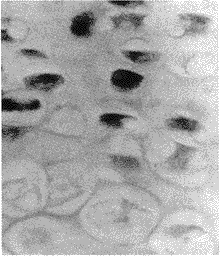
图2 E14 d,髁状突软骨浅层肥厚层PCNA 阳性细胞数减少(40×15)
表1 出生前、后增殖层及浅肥厚层中 PCNA、PCD 阳性细胞率 ( %, ±s)
±s)
分组
PCNA
PCD
生 增殖层
55.3±3.9
, 百拇医药
19.0±3.2
前 浅肥厚层
11.9±2.8
15.4±2.6
生 增殖层
34.2±3.1
18.5±3.6
后 浅肥厚层
8.0±2.2
14.2±2.8
2.3 TUNEL染色 阳性细胞为细胞核着紫蓝色,出生前、后 PCD阳性细胞主要分布于软骨增殖层及邻近深层肥厚层的浅层肥厚层中(图3,4),深层肥厚层成熟软骨细胞中PCD 阳性细胞少;仅于邻近骨化端处散在出现PCD 阳性细胞,E 14~E 15 d关节腔开始形成时软骨表面PCD 阳性细胞多。PCD 阳性细胞率详见表1。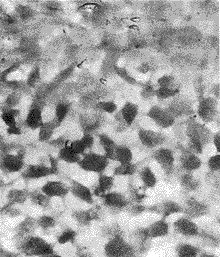
, http://www.100md.com
图3 E19 d, 髁状突软骨增殖层中PCD 阳性细胞(40×15)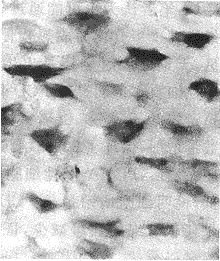
图4 E19 d,髁状突软骨浅层肥厚层与深层肥厚层交界区PCD细胞(40×15)
3 讨 论
PCNA是一种Mr 36 000 的细胞核酸性蛋白,是DNA聚合酶δ的辅助因子。PCNA只出现在增殖状态的细胞中,在细胞增殖的S期达到高峰。因此,PCNA阳性着色细胞多少可反映出细胞增殖的状况[3]。表1中可见,胎鼠颞下颌关节髁状突软骨增殖带PCNA 阳性细胞率高达55.3%,表明增殖层软骨细胞增殖能力强,增殖层软骨细胞不断分裂、增殖并向深层移动,使深层软骨细胞得到补充,以保证下颌骨及下颌骨髁状突不断生长发育。进入浅层肥厚层后,虽然PCNA 阳性细胞数减少,但该层软骨PCNA 阳性细胞率仍达到11.9%,表明浅层肥厚层软骨细胞在分化成熟的同时仍具有一定的增殖能力。此点与以往认为的浅肥厚层细胞无增殖能力的观点有所不同。当进入深层肥厚层后PCNA阳性表达消失,说明随着肥厚层软骨细胞分化成熟,软骨细胞逐渐丧失了增殖能力。出生后一周内髁状突软骨PCNA阳性细胞率较胎鼠低,表明出生后颞下颌关节髁状突区生长较胚胎时期减慢。
, 百拇医药
程序性细胞死亡亦称细胞凋亡(apoptosis)是1972 年由Kerr首先提出的一种细胞自我消亡形式。目前已认识到细胞凋亡在胚胎发生、器官发育、肿瘤发生及保持机体的稳态中发挥着至关重要的作用[2]。骨和关节的发育是一个复杂的过程,此间也伴随着PCD。PCD 的紊乱可能导致骨和关节的畸形[4]。最近Matsuda等[5]报道颞下颌关节发育过程中有PCD 的参与,并推测PCD 的异常可能导致先天性髁状突分裂及其它畸形,由此可成为颞下颌关节功能紊乱症(TMD) 及颞下颌关节骨关节疾病(TMJOA) 的病因。
本研究显示,胚胎及生后一周颞下颌关节髁状突软骨均有规律性分布的PCD。PCD 阳性细胞主要位于髁状突软骨的增殖层及与深层肥厚层的交界浅层肥厚层中。此结果与Matsuda等[5]用透射电镜观察到的、仅于生后当天出现PCD 不同。一般认为,增殖层是由未分化的间充质细胞构成的,它具有不断增殖、分化为软骨细胞的能力,该区相应出现较高比例的PCD 可控制软骨细胞的数量达到控制生长速度的目的,也可清除快速增殖中出现的异常细胞,保证关节的正常发育。而浅层肥厚层中的PCD 主要出现于邻近深层肥厚层的区域,笔者认为也可能通过PCD 控制浅层肥厚层软骨细胞进一步分化为成熟软骨细胞的数量。从表 1中可见,无论胚胎时期还是出生以后,增殖层的PCNA 的阳性细胞率都明显较PCD 阳性细胞率高,说明细胞增殖量较PCD 量多,二者共同作用的结果是软骨细胞的数量增加,保证了深层软骨细胞得到补充。而进入浅层肥厚层后,PCNA 阳性细胞率转而较PCD阳性细胞率低,说明细胞增殖量较PCD 量少,二者共同作用的结果使软骨细胞数量减少,证明在浅层肥厚层中软骨细胞是以分化、成熟为主。深层肥厚层成熟软骨细胞中PCD 细胞少,充分保证了成熟软骨细胞的数量,有利于合成分泌软骨基质,当邻近骨化端时深层肥厚层软骨细胞衰老,此衰老软骨细胞以PCD 形式被清除,这是骨骼发育的生理性需要。另据Abu等[6]报道,在鸡膝关节的形成的过程中PCD 出现在关节腔形成前,或与其相伴出现,Abu 认为 PCD可能是关节腔形成的因素之一。本实验也发现E14~E15 d关节腔开始形成时关节腔区软骨表面PCD 较其它区域明显,而PCNA 阳性细胞却未见明显增多,提示细胞增殖与PCD 的协调作用共同促使了关节腔的形成及髁状突的塑形。
, http://www.100md.com
综上可见,在PCNA 阳性细胞率高、细胞增殖旺盛的区域,PCD 阳性细胞也相应多,髁状突软骨增殖层及浅肥厚层软骨细胞不断增殖的同时通过PCD 可清除多余的细胞,控制着细胞数量,调节生长发育的速度。细胞增殖与PCD 的相互作用也协同参与关节腔、髁状突等结构的塑形。
参考文献
1 Shibata S, Suzuki S, Tengan T, et al. A histological study of the developing condylar cartilage of the fetal mouse mandible using coronal section. Arch Oral Biol, 1996, 41(1): 47
2 Michael DJ, Miguel W, Martin CR, et al. Programmed cell death in animal development. Cell, 1997, 88:347
, 百拇医药
3 Zusman I, Reifen R, Livni O, et al. Role of apoptosis, proliferating cell nuclear antigen and p53 protein in chemically induced colon cancer in rats fed corncob fiber treated with the fungus Pleurotus ostreatus. Anticancer Res, 1997,17(3C):2105
4 Zou HY, Niswander L. Requirement for BMP signaling in interdigital apoptosis and scale formation. Science, 1996,272:738
5 Matsuda S, Mishima KCH, Yoshimura Y, et al. Apoptosis in the development of the temporomandibular joint. Anat Embryol, 1997, 196:383
6 Abu-Hijleh G, Reid O, Scothorne RJ, et al. Cell death in the developing chick knee joint: I. Spatial and temporal patterns.Clin Anat, 1997,10(3):183
(收稿:1998-10-19 修回:1998-11-20), 百拇医药
单位:西安第四军医大学口腔医学院 710032
关键词:增殖细胞核抗原;程序性细胞死亡;颞下颌关节;胚胎
实用口腔医学杂志990304
〔摘要〕 目的: 探讨细胞增殖与程序性细胞死亡在颞下颌关节发育中的作用。方法:利用免疫组织化学技术及原位末端标记法,对胚胎及生后一周SD 大鼠颞下颌关节不同发育时期髁状突软骨中增殖细胞核抗原(PCNA)的表达及程序性细胞死亡(PCD)进行了观察。结果:胎鼠颞下颌关节髁状突软骨增殖层PCNA 阳性细胞率最高,进入浅层肥厚层PCNA 阳性细胞数减少,深层肥厚层中则未见PCNA 阳性细胞。出生后髁状突软骨PCNA 阳性细胞率均较出生前低。PCD 阳性细胞主要分布于软骨增殖层及邻近深层肥厚层的浅层肥厚层中,在关节腔开始形成时髁状突软骨表面PCD 明显。结论:细胞增殖与程序性细胞死亡密切相关,协同参与调控颞下颌关节的生长发育与塑形。
, http://www.100md.com
The role of cell proliferation and programmed cell death in the temporomandibular joint development.
Li Song, Jin Yan, Wang Huiyun, et al. Stomatological College, Fourth Military Medical University, Xi'an 710032
〔Abstract〕Objective: To study the role of cell proliferation and programmed cell death(PCD) in the temporomandibular joint(TMJ) development . Methods:Expression of proliferation cell nuclear antigen(PCNA) and PCD were observed by immunohistochemical staining and Tdt-mediated dUTP nick end labelling (TUNEL) in TMJ of SD rats during series prenatal and postnatal developmental periods. Result:The PCNA positive cells accounted for 55.3% of the cells in proliferative zone of condylar cartilage of fetuses and 21.9% in prehypertrophic zone, no positive cell was found in late hypertrophic zone. PCD positive cells were mainly located in proliferative zone and the area between prehypertrophic and late hypertrophic zones, PCD positive cells of condylar surface increased obviously during the formation of joint cavity.:Conclusion: Cells proliferation and programmed cell death are interactive with each other in the regulation of the development of TMJ.
, http://www.100md.com
Key words Proliferating cell nuclear antigen; Programmed cell death; Temporomandi-bular joint; Embryo
颞下颌关节发育期髁状突软骨是下颌骨的主要生长区之一。髁状突软骨具有类似于长骨生长板独立生长的特性,软骨细胞可不断分裂、增殖使下颌骨及颞下颌关节得以生长发育[1]。程序性细胞死亡(programmed cell death ,简称PCD)是一种细胞自然死亡现象,虽然对它在胚胎发生、器官发育及形成中的作用已有所认识[2],但作为细胞生命活动的增殖及程序性细胞死亡在颞下颌关节发育过程中的相互关系及作用的研究尚未见报道。本文通过观察胚胎及出生后一周SD 大鼠各时期颞下颌关节发育中增殖细胞核抗原(proliferating cell nuclear antigen ,简称PCNA)的表达及 PCD的变化,探讨细胞增殖与程序性细胞死亡在颞下颌关节发育中的意义。
, http://www.100md.com
1 材料与方法
1.1 动物模型及标本制备
选用纯系、三月龄 SD大鼠(上海产)20 只,按雌雄4∶1的比例同笼,每天早晨8∶00 观察雌鼠阴栓,以观察到阴栓计为妊娠0 d,分别于妊娠13、14、15、16、17、18、19、20 d脱颈处死大鼠,切取胎鼠(E)颞下颌关节部置于40 g/L 的多聚甲醛中固定后常规脱水、石蜡包埋。另取出生后(P)1、2、3、4、5、6、7 d幼鼠颞下颌关节部(沿正中线切开鼠头后分切)置入含盐酸、甲酸及冰醋酸的40 g/L 多聚甲醛液中充分固定、脱钙,流水冲洗后脱水、石蜡包埋。作颞下颌关节矢状面切片,厚度5 μm,以备HE染色、免疫组织化学染色及原位末断标记使用,切片前载玻片预先严格清洁处理并涂APES胶。
1.2 免疫组织化学检测PCNA
免疫组织化学染色采用 ABC法,石蜡切片脱蜡至水,经体积分数为φ=3% H2O2 封闭内源性过氧化物酶及枸橼酸缓冲液微波修复抗原10 min后,用正常羊血清封闭30 min;加PCNA单抗(鼠抗大鼠,美国Santa Cruz 公司产品)置于4 ℃过夜,室温下复温1 h后滴加生物素化二抗37 ℃反应30 min ;再加ABC复合物37 ℃孵育30 min,DAB 显色后,二甲苯透明、封片。
, http://www.100md.com
1.3 原位末断标记法(TUNEL法)标记PCD细胞
TUNEL (Tdt-mediated dUTP nick end labelling)法(试剂盒购自美国Oncor公司):切片常规脱蜡至水,室温下20 mg/L的蛋白酶K消化15 min;然后置于含φ =3% H2O2的 PBS溶液中处理5 min,加50 μl的平衡液(TUNEL试剂盒原配)1 min;再加含TDT 酶反应液15 μl于37 ℃反应1.5 h后用预热的中止反应液中止反应(TUNEL试剂盒原配);buffer1漂洗2 次(15 min/次)后加φ=2% 的正常羊血清孵育30 min;滴加抗地高辛碱性磷酸酶抗体置于湿盒中孵育2 h;经buffer1 、buffer3漂洗后,加新配制的显色液 (NBT/BCIP显色系统,用buffer3配制,NBT 4.5 μl、BCIP 3.5 μl、左旋咪唑0.24 mg/ml) 20 μl,暗处显色。中止显色后,梯度酒精脱水,二甲苯透明封片。
, 百拇医药
1.4 PCNA、PCD阳性细胞计数及统计方法
在光学显微镜下,随机选取5 个 40×10高倍视野,用10×10 网格分别计数髁状突软骨增殖层及浅层肥厚层的阳性细胞数及细胞总数,并分别计算胚胎及生后PCNA 及PCD 的平均阳性细胞百分率和标准差。
2 结 果
2.1 HE染色 E13 d颞下颌关节区开始出现未分化间充质细胞聚集、增殖、分化为软骨细胞,至E14 d颞下颌关节髁状突软骨组织增厚,软骨各层分界明显;E 14~E 15 d关节腔开始形成,E 17、18 d关节盘出现;E13 d即可见下颌骨体部端有骨化出现,以后骨化逐渐扩展到髁状突颈部;出生后关节软骨逐渐变薄,下颌骨骨化接近关节软骨区。
2.2 PCNA 免疫组织化学染色 PCNA 阳性细胞为胞核着棕黄色。胚胎颞下颌关节髁状突软骨增殖层PCNA 阳性软骨细胞多(图1),进入浅层肥厚层PCNA 阳性软骨细胞数逐渐减少(图2),深层肥厚层中未见PCNA 阳性软骨细胞。出生后髁状突软骨增殖层及浅肥厚层PCNA 阳性细胞率均较出生前低。PCNA 阳性细胞率详见表 1。

, 百拇医药
图1 E14 d,髁状突软骨增殖层PCNA 表达阳性软骨细胞多(40×15)

图2 E14 d,髁状突软骨浅层肥厚层PCNA 阳性细胞数减少(40×15)
表1 出生前、后增殖层及浅肥厚层中 PCNA、PCD 阳性细胞率 ( %,
 ±s)
±s)分组
PCNA
PCD
生 增殖层
55.3±3.9
, 百拇医药
19.0±3.2
前 浅肥厚层
11.9±2.8
15.4±2.6
生 增殖层
34.2±3.1
18.5±3.6
后 浅肥厚层
8.0±2.2
14.2±2.8
2.3 TUNEL染色 阳性细胞为细胞核着紫蓝色,出生前、后 PCD阳性细胞主要分布于软骨增殖层及邻近深层肥厚层的浅层肥厚层中(图3,4),深层肥厚层成熟软骨细胞中PCD 阳性细胞少;仅于邻近骨化端处散在出现PCD 阳性细胞,E 14~E 15 d关节腔开始形成时软骨表面PCD 阳性细胞多。PCD 阳性细胞率详见表1。

, http://www.100md.com
图3 E19 d, 髁状突软骨增殖层中PCD 阳性细胞(40×15)

图4 E19 d,髁状突软骨浅层肥厚层与深层肥厚层交界区PCD细胞(40×15)
3 讨 论
PCNA是一种Mr 36 000 的细胞核酸性蛋白,是DNA聚合酶δ的辅助因子。PCNA只出现在增殖状态的细胞中,在细胞增殖的S期达到高峰。因此,PCNA阳性着色细胞多少可反映出细胞增殖的状况[3]。表1中可见,胎鼠颞下颌关节髁状突软骨增殖带PCNA 阳性细胞率高达55.3%,表明增殖层软骨细胞增殖能力强,增殖层软骨细胞不断分裂、增殖并向深层移动,使深层软骨细胞得到补充,以保证下颌骨及下颌骨髁状突不断生长发育。进入浅层肥厚层后,虽然PCNA 阳性细胞数减少,但该层软骨PCNA 阳性细胞率仍达到11.9%,表明浅层肥厚层软骨细胞在分化成熟的同时仍具有一定的增殖能力。此点与以往认为的浅肥厚层细胞无增殖能力的观点有所不同。当进入深层肥厚层后PCNA阳性表达消失,说明随着肥厚层软骨细胞分化成熟,软骨细胞逐渐丧失了增殖能力。出生后一周内髁状突软骨PCNA阳性细胞率较胎鼠低,表明出生后颞下颌关节髁状突区生长较胚胎时期减慢。
, 百拇医药
程序性细胞死亡亦称细胞凋亡(apoptosis)是1972 年由Kerr首先提出的一种细胞自我消亡形式。目前已认识到细胞凋亡在胚胎发生、器官发育、肿瘤发生及保持机体的稳态中发挥着至关重要的作用[2]。骨和关节的发育是一个复杂的过程,此间也伴随着PCD。PCD 的紊乱可能导致骨和关节的畸形[4]。最近Matsuda等[5]报道颞下颌关节发育过程中有PCD 的参与,并推测PCD 的异常可能导致先天性髁状突分裂及其它畸形,由此可成为颞下颌关节功能紊乱症(TMD) 及颞下颌关节骨关节疾病(TMJOA) 的病因。
本研究显示,胚胎及生后一周颞下颌关节髁状突软骨均有规律性分布的PCD。PCD 阳性细胞主要位于髁状突软骨的增殖层及与深层肥厚层的交界浅层肥厚层中。此结果与Matsuda等[5]用透射电镜观察到的、仅于生后当天出现PCD 不同。一般认为,增殖层是由未分化的间充质细胞构成的,它具有不断增殖、分化为软骨细胞的能力,该区相应出现较高比例的PCD 可控制软骨细胞的数量达到控制生长速度的目的,也可清除快速增殖中出现的异常细胞,保证关节的正常发育。而浅层肥厚层中的PCD 主要出现于邻近深层肥厚层的区域,笔者认为也可能通过PCD 控制浅层肥厚层软骨细胞进一步分化为成熟软骨细胞的数量。从表 1中可见,无论胚胎时期还是出生以后,增殖层的PCNA 的阳性细胞率都明显较PCD 阳性细胞率高,说明细胞增殖量较PCD 量多,二者共同作用的结果是软骨细胞的数量增加,保证了深层软骨细胞得到补充。而进入浅层肥厚层后,PCNA 阳性细胞率转而较PCD阳性细胞率低,说明细胞增殖量较PCD 量少,二者共同作用的结果使软骨细胞数量减少,证明在浅层肥厚层中软骨细胞是以分化、成熟为主。深层肥厚层成熟软骨细胞中PCD 细胞少,充分保证了成熟软骨细胞的数量,有利于合成分泌软骨基质,当邻近骨化端时深层肥厚层软骨细胞衰老,此衰老软骨细胞以PCD 形式被清除,这是骨骼发育的生理性需要。另据Abu等[6]报道,在鸡膝关节的形成的过程中PCD 出现在关节腔形成前,或与其相伴出现,Abu 认为 PCD可能是关节腔形成的因素之一。本实验也发现E14~E15 d关节腔开始形成时关节腔区软骨表面PCD 较其它区域明显,而PCNA 阳性细胞却未见明显增多,提示细胞增殖与PCD 的协调作用共同促使了关节腔的形成及髁状突的塑形。
, http://www.100md.com
综上可见,在PCNA 阳性细胞率高、细胞增殖旺盛的区域,PCD 阳性细胞也相应多,髁状突软骨增殖层及浅肥厚层软骨细胞不断增殖的同时通过PCD 可清除多余的细胞,控制着细胞数量,调节生长发育的速度。细胞增殖与PCD 的相互作用也协同参与关节腔、髁状突等结构的塑形。
参考文献
1 Shibata S, Suzuki S, Tengan T, et al. A histological study of the developing condylar cartilage of the fetal mouse mandible using coronal section. Arch Oral Biol, 1996, 41(1): 47
2 Michael DJ, Miguel W, Martin CR, et al. Programmed cell death in animal development. Cell, 1997, 88:347
, 百拇医药
3 Zusman I, Reifen R, Livni O, et al. Role of apoptosis, proliferating cell nuclear antigen and p53 protein in chemically induced colon cancer in rats fed corncob fiber treated with the fungus Pleurotus ostreatus. Anticancer Res, 1997,17(3C):2105
4 Zou HY, Niswander L. Requirement for BMP signaling in interdigital apoptosis and scale formation. Science, 1996,272:738
5 Matsuda S, Mishima KCH, Yoshimura Y, et al. Apoptosis in the development of the temporomandibular joint. Anat Embryol, 1997, 196:383
6 Abu-Hijleh G, Reid O, Scothorne RJ, et al. Cell death in the developing chick knee joint: I. Spatial and temporal patterns.Clin Anat, 1997,10(3):183
(收稿:1998-10-19 修回:1998-11-20), 百拇医药