磁导向甲氨蝶呤缓释药物的研制及含量测定
作者:张皖清 毛天球 孙玉鹏 何远辉 王文学
单位:张皖清(第四军医大学口腔医学院,710032;现在304医院工作);毛天球(第四军医大学口腔医学院,710032;);孙玉鹏(第四军医大学口腔医学院,710032);何远辉(西南应用磁学研究所);王文学(第四军医大学毒理教研室)
关键词:甲氨蝶呤;磁微球;靶向给药系统;高效液相色谱法
实用口腔医学杂志000120 摘 要:目的:应用化学交联法研制磁导向甲氨蝶呤缓释药物。方法:采用碳二亚胺、活化酯及SPDP法将甲氨蝶呤(MTX)与中间载体人血清白蛋白(HSA)交联,并活化MTX非药理活性基团,与生物磁液结合,制成胶态偶联物—甲氨蝶呤磁性抗癌药FM-MTX。应用光谱及色谱法检测其药物含量。结果:化学交联法制备出磁导向甲氨蝶呤白蛋白缓释药物,其性质及药物含量稳定。结论:以化学交联法研制磁导向甲氨蝶呤缓释药物方法可行,药物含量以高效液相色谱法检测最准确。
, http://www.100md.com
分类号:R739.8 文献标识码:A
文章编号:1001-3733(2000)01-0061-04
Preparation and determination of the contents of ferromagnetic methotrexate albumin microspheres
Zhang Wanqing Mao Tianqiu Sun Yupeng et al.
(Stomatological Hospital,Fourth Military Medical University,Xi'an 710032)
Abstract:Objective:To prepare ferromagnetic albumin methotrexate conjugate(FM-MTX) as a slow release and magnetic targeted antitumor drug.Methods:The FM-MTX was conjugated step by step with carbodiimide,active ester,heterobifunctional reagent SPDP.The reversed-phase ion-pairing high performance liquid chromatography (HPLC) and ultraviolet spectrophotometry were used to purify the preparation and to measure the content of MTX in the conjugate.Results:The prepared FM-MTX was colloidal.The content (mg/L) of MTX in FM-MTX were 250 and 260 measured with HPLC and ultraviolet spectrophotometry respectively.Conclusion:The method of chemical conjugation of FMMTX is reliable and the HPLC is precise for determination of the contents of FM-MTX.
, 百拇医药
Key words:Methotrexate; Magnetic microspheres; Targeting drug delivery system;High performance liquid chromatography
恶性肿瘤已成为当今世界最主要的死亡原因之一。化学药物治疗,经历了半个多世纪的不断发展和完善,已成为恶性肿瘤综合治疗的主要手段之一。但几乎所有的抗癌药物在杀伤肿瘤细胞的同时,也杀伤正常组织细胞。临床应用时常引起严重的毒副反应。寻求既能保护正常组织器官,又具有最大可能杀伤肿瘤细胞的治疗途径和方法,是广大医药工作者研究的热门课题。
抗癌药物磁性微球载体系统是七十年代末期开始研究的一种新型剂型〔1〕。它是将药物与具有磁响应物质结合构成完整的药理体系〔2,3〕。将磁性药物注入体内,同时在肿瘤外部施加一定场强的外磁场,利用磁性药物的流动性能和磁场诱导性能,将磁性药物载体固定于肿瘤靶区内。在靶区药物以受控的方式从载体中释放。由于它能提高靶区的药物浓度,并能延长药物在靶区的作用时间,使药物在靶组织的细胞或亚细胞水平发挥药效作用,而对正常组织细胞无太大影响〔4,5〕。
, http://www.100md.com
本研究选用抗瘤谱较广、生化药理机制最为清楚的抗癌药甲氨蝶呤,根据甲氨蝶呤分子结构的特点,采用碳二亚胺法、活化酯法及SPDP异型双功能试剂法将甲氨蝶呤(MTX)与中间载体人血清白蛋白交联,并活化MTX非药理活性基团,与含有超微磁粒的生物磁液结合,制备出胶态偶联物甲氨蝶呤磁性白蛋白微球载体系统(FM-MTX)。并分别利用高效液相色谱法及紫外光谱法检测其理化性能及药物含量。
1 材料与方法
1.1 主要实验试剂
甲氨蝶呤原料药由上海第十二制药厂提供,纯度为99.7%;人血清白蛋白(上海生物制品研究所);N-羟基琥珀酰亚胺(Fluka chemie AG);3-(2-吡啶二巯基)丙酸-N-琥珀酰亚胺酯(SPDP)(第四军医大学毒理教研室);碘化-1-环己基-3-(3-三甲氨丙基)碳二亚胺(上海东风试剂厂);2,2’—二环己基碳二亚胺(DCC)(军事医学科学院);氨水、氯化胺(西安试剂厂);十二烷基油酸钠(西安试剂厂);FeCl2 、FeCl3(成都试剂厂)
, 百拇医药
1.2 生物磁液的制备
将氯化亚铁及氯化铁按1∶2比例分别制成溶液后混匀,加氨水、氢氧化钠、碳酸钠、进行沉淀反应。调节液体的pH值为10,使铁离子完全沉淀为止。制得黑色四氧化三铁胶体溶液放置澄清后,用虹吸方法进行沉淀分离。用蒸馏水洗涤沉淀物数遍,洗至无酸根离子。向沉淀物中加入表面活性剂十二烷基油酸钠,在86~90 ℃恒温条件下进行半小时吸附反应,使硫酸离子吸附在沉淀物四氧化三铁表面,冷却后加入稀盐酸,调溶液pH值等于5,让被油酸阴离子包裹的胶体粒子絮凝下来。絮凝物用蒸馏水洗至无氯离子,其沉淀部分放在抽气漏斗中过滤,即得到含水分的覆盖油酸的四氧化三铁滤饼。取出滤饼,放真空干燥箱内80 ℃烘干,即制得四氧化三铁超精细微粒。将磁粒与基液按一定体积重量比,充分混合研磨,促进四氧化三铁胶体微粉充分分散在基液中,即得到界面稳定的生物磁液。
1.3 MTX活化酯的制备
MTX原料药1 000 mg、DCC 480 mg溶于40 ml二甲基甲酰胺溶液中,4 ℃反应18 h后,于反应混合物中加入NHS 280 mg、吡啶320 μl,继续在4 ℃反应6h,反应混合物离心(10 000 r/min,20 min),收集上清,-30 ℃冷冻干燥保存。
, 百拇医药
1.4 磁性甲氨蝶呤缓释剂的制备
人血清白蛋白HSA首先通过Sephadex G-150以去除HSA双体,40 ml HSA(10 g/L)室温下与5倍过量SPDP(溶于二甲基甲酰胺中)反应,1 h后过Sephadex G-25柱,去除未反应的试剂,得到暴露巯基的人血清白蛋白HSA-SH。加入MTX活化酯二甲基甲酰胺溶液,以0.2 mol/L氢氧化钠调pH至8.0,4 ℃反应18 h,反应混合物过Sephadex G-25柱,去除游离甲氨蝶呤。在生物磁液中加入EDCI 40 g/L,搅拌加入HS-HSA-MTX交联物,超声振动5 min,置4 ℃搅拌3 h,磁场吸附3 h,透析72 h,过Sephadex 4B柱,浓缩分装后冷冻干燥保存或封装保存。
1.5 磁性甲氨蝶呤缓释药物含量检测
1.5.1 紫外分光光度法MTX含量检测〔6〕
, http://www.100md.com
精密称取标准品MTX 5 mg两份,分别置于100 ml容量瓶中,用1.5 ml 2 g/L Na2CO3溶解,然后用0.1 mol/L HCl稀释至刻度。此溶液仍用0.1 mol/L HCl分别稀释成含12.5,6.25,3.125,1.562 5,0.781 25 mg/L,在306 nm处测定其吸光度。将测得的数据按回归法处理得标准曲线方程,并绘出吸光度-浓度曲线。
精密吸取FM-MTX 1 ml 3份,按等比浓度稀释1∶10,1∶100,1∶1 000,分别测定306 nm处吸光度,在吸光度-浓度标准曲线上推算其含量浓度。
1.5.2 高效液相色谱法MTX含量检测〔7〕
精密称取MTX标准品1 mg,放置于20 ml容量瓶中,终浓度为50 mg/L。再依次稀释成5、4、3、2、1 mg/L。各吸取0.1 ml上样,在高效液相色谱仪(HPLC)上检测306 nm处的MTX峰值及峰面积(色谱柱150 mm×4 mm,填料YWG-C18,直径10 μm;流动相:甲醇-pH6.0磷酸缓冲液40份∶60份,流速1.0 ml/min)。以峰高为纵坐标,MTX浓度为横坐标,拟合标准曲线方程。
, http://www.100md.com
精密吸取FM-MTX 0.1 ml,分别稀释成10、100、1 000 ml。各取0.1 ml上样,在HPLC上检测MTX特征峰,以峰高及面积在标准曲线上求得MTX药物浓度。
1.5.3 原子吸收光谱法Fe3O4含量检测
精密吸取FM-MTX 0.1 ml3 份,加10 ml HNO3-HCIO4(4∶1)消化液,盖上表面皿,置电垫板上低温消化至液体透明,大火蒸干,无碳化时取下,加体积分数为0.2%的HNO3溶解残渣 ,用去离子水定容至10 ml,在原子吸收光谱仪上进行Fe原子测定。灯电流15 mA,波长为248.3 nm,空气压力156.89 kPa,乙炔气压力25.49kPa,按三份样品计算均值标准差,按Fe分子量55.847,O分子量15.999 4,计算Fe3O4含量=1.382×Fe含量。
, http://www.100md.com
2 结 果
2.1 生物磁液及FM-MTX特性
Fe3+及Fe2+高度弥散于水基液态载液中,构成一种高稳定性的胶体溶液。微粒与载液通过界面活性剂十二烷基油酸钠制成的这种微乳磁液,即使在重力场、电场、磁场作用下也能长期稳定存在,不产生沉淀和分离。制得的磁液经高速离心和梯度磁场处理,测得其磁化曲线呈光滑对称的“S”形,无矫顽力及剩磁,呈超顺磁性。稀释12~20倍后仍呈同样曲线,仅其磁化强度缩小12~20倍。
甲氨蝶呤经过活化酯反应,在SPDP双功能试剂的作用下与暴露巯基-SH的HSA氨基反应,制得SH-HSA-MTX交联物,在EDCI和4-DMAP的作用下与生物磁液反应,制备出稳定的FM-MTX结合物。冷冻干燥后直接封装安瓿保存,无结构特性改变。
, http://www.100md.com
2.2 MTX含量测定结果
2.2.1 紫外光谱检测
在盐酸溶液稀释下,紫外光谱扫描显示,在306 nm波长处有最大吸收峰,MTX的特性吸收曲线不变。(图1)
图1 MTX紫外光谱306 nm吸收图谱
按MTX标准品12.5、6.25、3.125、1.5625、及0.781 25 mg/L在306 nm处测得的光吸收度,绘制标准曲线(图2)。r=0.997,在0.8~12 mg/L区间光吸收度与MTX浓度呈直线关系。FM-MTX用HCl等比浓度1∶100稀释后,测定306 nm处吸光度0.12。从标准曲线上推算出FM-MTX中MTX的含量为250 mg/L。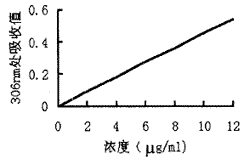
, http://www.100md.com
图2 MTX紫外光谱306 nm吸收标准曲线
2.2.2 高效液相色谱测定结果
MTX分子量恒定,其极性结构在甲醇洗脱液中为恒定峰。MTX标准品在反相高效液相色谱仪上呈现恒定单峰型,样品出峰时间一致,为8.9 min。现配的MTX标准品1、2、3、4、5 mg/L在HPLC上显示的峰高及峰型如图3所示。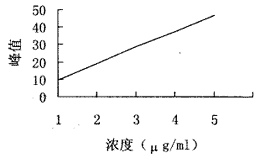
图3 MTX标准品峰型
以MTX为横座标,峰高为纵座标,绘制MTX标准曲线(图4)。其标准曲线方程为:Y=9.34X+3.30(r=0.99986,AUFs=0.01)。
, 百拇医药
图4 MTX HPLC标准曲线
FM-MTX样品HPLC峰型及出峰时间与MTX标准品一致。稀释100倍的样品,以离心后过滤膜,在HPLC测得的峰高在HPLC MTX标准曲线上求得MTX含量为260 mg/L;从而证实FM-MTX样品原药中MTX含量为260 mg/L。
2.3 FM-MTX中Fe3O4含量测定结果
取FM-MTX样品3份,每份在原子吸收光谱仪上测定3次,Fe元素含量为(47.97±0.52) mg/L,即F33O4平均含量为66.29 mg/L。
3 讨 论
抗癌药物磁性微球载体是将药物与具有磁响应的物质结合构成的一种新剂型。为使磁性药物微球具有足够的磁响应力,强磁材料中以Fe3O4铁氧体为最佳〔1〕。采用10 nm以下Fe3O4微粒能稳定地分散在水和油中,形成磁性胶体溶液,在重力场作用下也不会发生凝聚和沉淀。作为药物载体,以Fe3O4为基核的强磁材料优于纯铁粉、羰基铁、钴铁合金、钡锶铁氧体及钕铁硼等稀土材料。在表面活性剂存在下,Fe3O4无机物表面有机化,制备成亲水或疏水极性的生物磁液。这是可以制备磁性药物载体的分子基础。
, 百拇医药
制备缓释药物,Widder等〔1〕采用热固化法制成阿霉素磁性白蛋白微球,将Fe3O4药物水溶液加入棉籽油中,加热至105~120 ℃,热固定10 min,使药物固定于白蛋白基质中。由于热固定方法温度太高,药物容易分解破坏。后又采用戊二醛或甲醛硬化微球,避免了阿霉素药理活性丧失。制得的药物微球直径1~3 μm,可供动脉和静脉注射应用。
王平康等〔2〕采用氧化铁,加入IV族元素,在700 ℃高温烧结后粉碎净化,与阿拉伯胶、水解明胶及药物混合,加入液体石蜡及Span等活性剂,加温至30~60 ℃进行搅拌,冷却后得到直径为8 μm以下的磁性药物载体。由于明胶微球稳定性欠佳,达不到药用标准。
有关甲氨蝶呤与白蛋白连接的方法很多。Leuy等〔3〕报道采用重氮反应法,使甲氨蝶呤的胺基与亚硝酸反应得到重氮盐。然后直接交联在蛋白质中酪氨酸残基酚羟基的邻位,成为一个偶氮化合物。采用此方法,易形成大量沉淀,难于得到具有活性的结合物。Ibrahim等〔9〕采用碳二亚胺法替代重氮化反应,水溶性碳二亚胺可激活羧基,形成中间产物酰异脲及酐,再与蛋白质胺基反应形成酰胺链。但是,由于甲氨蝶呤及蛋白质中存在羧基和胺基,会形成分子内和分子间交联,影响生物活性。Devineni等〔10〕报道采用活性酯法,首先使用N-羟基琥珀酰亚胺和2,2’-二环已基碳二亚胺处理甲氨蝶呤得到甲氨蝶呤活性酯,然后与白蛋白交联。这样,不仅性质稳定,连接数目较多的药物分子,而且能保持较好的水溶性。
, http://www.100md.com
我们采用生物磁液,选用十二烷基油酸钠作为表面活性剂,它有非极性的疏水碳氢链部分和极性的亲水基团共同构成,且两部分分别处于两端,形成不对称结构,其疏水基团与Fe3O4粒子结合,在粒子表面减少其张力。亲水基团为离子型活性剂,可使磁微粒能稳定地悬浮于载液中,并能与可溶性药物基团结合。在SPDP及DCC等交联作用下,与白蛋白、甲氨蝶呤化学偶联,避免加温过高造成的药物作用下降,且使药物微球粒径在1 μm以下,符合体内药物静脉及动脉注射应用的要求〔8〕。
FM-MTX制成后,首先要对其各组成成份进行检测, 包括MTX含量、白蛋白含量、Fe3O4含量;并对其理化性能及稳定性进行测定。这是甲氨蝶呤磁性药物制剂质量控制的重要特性参数。
甲氨蝶呤紫外光谱扫描显示,其盐酸溶液在244 nm、306 nm波长处有最大吸收,在234 nm、262 nm波长处有最小吸收(图1)。中国药典(1985)规定,采用PC层析后,再用紫外分光光度法测定。但该方法既费时间,误差又大。为提高检测方法的灵敏度和准确性,中国药典(1990)将本品测定方法改为HPLC法〔7〕,其灵敏度为2 ng,标准差为0.39 ng。
, 百拇医药
我们利用MTX的上述特性,分别进行了紫外分光光度计法测定,反相高效液相色谱法测定结果以HPLC法较佳。测得FM-MTX中MTX含量为260 mg/L。Fe3O4含量采用浓硝酸水解后,其水溶液应用原子吸收光谱法测定铁离子的含量,再推算出Fe3O4的含量,并按分子量推算其克分子摩尔比。
基金项目:国家自然科学基金资助项目 39070871
国家新药基金资助项目 93-(62)-N-42
参考文献:
[1]Widder KJ,Morris RM,Poore G,et al.Tumor remission in Yoshida sarcoma-bearing rats by selective targeting of magnetic albumin microspheres containing doxorubicin.Proc Natl Acad Sci USA,1981,78:579
, 百拇医药
[2]王平康.磁性药物载体及其制造方法.发明专利公开说明书,901083852
[3]Leuy C,Lefebvre S,Andry MC,et al.Fourier transform infrared spectroscopic studies of crosslinked human serum albumin microcapsules.J Pharma Sci,1994,83:419
[4]Gallo JM,Hung CT,Perrier DG,et al.Analysis of albumin microspheres preparation. Int J Pharm,1984,22:63
[5]Gupta PK.Drug trageting in cancer chemotherapy:A Clinical Perspective J Pharm Sci,1990,79:949
, 百拇医药
[6]王佾先,张能芳,张琴芬,等.生物液中MTX及其代谢产物7-OH-MTX的分离与检测.药学学报,1982,17:647
[7]Iven H,Bartels H,High-performance liquid chromatographic and enzyme inhibition assays of MTX concentrations in serum from patients receiving high-dose therapy.Cancer Treatment Report,1985,69:825
[8]中华人民共和国药典二部.北京:人民卫生出版社,1990。
[9]Ibrahim A,Coureur P,Roland M,et al.New magnetic drug carrier.J Pharm Pharmacal,1983,35:59
[10]Devineni D,Blanton C D,Gallo J M.Preparation and in vitro evaluation of magnetic microsphere-methotrexate conjugate durg delivery system.Bioconjugate Chem,1995,6:203
收稿日期:1998-08-24
修改日期:1999-11-01, http://www.100md.com
单位:张皖清(第四军医大学口腔医学院,710032;现在304医院工作);毛天球(第四军医大学口腔医学院,710032;);孙玉鹏(第四军医大学口腔医学院,710032);何远辉(西南应用磁学研究所);王文学(第四军医大学毒理教研室)
关键词:甲氨蝶呤;磁微球;靶向给药系统;高效液相色谱法
实用口腔医学杂志000120 摘 要:目的:应用化学交联法研制磁导向甲氨蝶呤缓释药物。方法:采用碳二亚胺、活化酯及SPDP法将甲氨蝶呤(MTX)与中间载体人血清白蛋白(HSA)交联,并活化MTX非药理活性基团,与生物磁液结合,制成胶态偶联物—甲氨蝶呤磁性抗癌药FM-MTX。应用光谱及色谱法检测其药物含量。结果:化学交联法制备出磁导向甲氨蝶呤白蛋白缓释药物,其性质及药物含量稳定。结论:以化学交联法研制磁导向甲氨蝶呤缓释药物方法可行,药物含量以高效液相色谱法检测最准确。
, http://www.100md.com
分类号:R739.8 文献标识码:A
文章编号:1001-3733(2000)01-0061-04
Preparation and determination of the contents of ferromagnetic methotrexate albumin microspheres
Zhang Wanqing Mao Tianqiu Sun Yupeng et al.
(Stomatological Hospital,Fourth Military Medical University,Xi'an 710032)
Abstract:Objective:To prepare ferromagnetic albumin methotrexate conjugate(FM-MTX) as a slow release and magnetic targeted antitumor drug.Methods:The FM-MTX was conjugated step by step with carbodiimide,active ester,heterobifunctional reagent SPDP.The reversed-phase ion-pairing high performance liquid chromatography (HPLC) and ultraviolet spectrophotometry were used to purify the preparation and to measure the content of MTX in the conjugate.Results:The prepared FM-MTX was colloidal.The content (mg/L) of MTX in FM-MTX were 250 and 260 measured with HPLC and ultraviolet spectrophotometry respectively.Conclusion:The method of chemical conjugation of FMMTX is reliable and the HPLC is precise for determination of the contents of FM-MTX.
, 百拇医药
Key words:Methotrexate; Magnetic microspheres; Targeting drug delivery system;High performance liquid chromatography
恶性肿瘤已成为当今世界最主要的死亡原因之一。化学药物治疗,经历了半个多世纪的不断发展和完善,已成为恶性肿瘤综合治疗的主要手段之一。但几乎所有的抗癌药物在杀伤肿瘤细胞的同时,也杀伤正常组织细胞。临床应用时常引起严重的毒副反应。寻求既能保护正常组织器官,又具有最大可能杀伤肿瘤细胞的治疗途径和方法,是广大医药工作者研究的热门课题。
抗癌药物磁性微球载体系统是七十年代末期开始研究的一种新型剂型〔1〕。它是将药物与具有磁响应物质结合构成完整的药理体系〔2,3〕。将磁性药物注入体内,同时在肿瘤外部施加一定场强的外磁场,利用磁性药物的流动性能和磁场诱导性能,将磁性药物载体固定于肿瘤靶区内。在靶区药物以受控的方式从载体中释放。由于它能提高靶区的药物浓度,并能延长药物在靶区的作用时间,使药物在靶组织的细胞或亚细胞水平发挥药效作用,而对正常组织细胞无太大影响〔4,5〕。
, http://www.100md.com
本研究选用抗瘤谱较广、生化药理机制最为清楚的抗癌药甲氨蝶呤,根据甲氨蝶呤分子结构的特点,采用碳二亚胺法、活化酯法及SPDP异型双功能试剂法将甲氨蝶呤(MTX)与中间载体人血清白蛋白交联,并活化MTX非药理活性基团,与含有超微磁粒的生物磁液结合,制备出胶态偶联物甲氨蝶呤磁性白蛋白微球载体系统(FM-MTX)。并分别利用高效液相色谱法及紫外光谱法检测其理化性能及药物含量。
1 材料与方法
1.1 主要实验试剂
甲氨蝶呤原料药由上海第十二制药厂提供,纯度为99.7%;人血清白蛋白(上海生物制品研究所);N-羟基琥珀酰亚胺(Fluka chemie AG);3-(2-吡啶二巯基)丙酸-N-琥珀酰亚胺酯(SPDP)(第四军医大学毒理教研室);碘化-1-环己基-3-(3-三甲氨丙基)碳二亚胺(上海东风试剂厂);2,2’—二环己基碳二亚胺(DCC)(军事医学科学院);氨水、氯化胺(西安试剂厂);十二烷基油酸钠(西安试剂厂);FeCl2 、FeCl3(成都试剂厂)
, 百拇医药
1.2 生物磁液的制备
将氯化亚铁及氯化铁按1∶2比例分别制成溶液后混匀,加氨水、氢氧化钠、碳酸钠、进行沉淀反应。调节液体的pH值为10,使铁离子完全沉淀为止。制得黑色四氧化三铁胶体溶液放置澄清后,用虹吸方法进行沉淀分离。用蒸馏水洗涤沉淀物数遍,洗至无酸根离子。向沉淀物中加入表面活性剂十二烷基油酸钠,在86~90 ℃恒温条件下进行半小时吸附反应,使硫酸离子吸附在沉淀物四氧化三铁表面,冷却后加入稀盐酸,调溶液pH值等于5,让被油酸阴离子包裹的胶体粒子絮凝下来。絮凝物用蒸馏水洗至无氯离子,其沉淀部分放在抽气漏斗中过滤,即得到含水分的覆盖油酸的四氧化三铁滤饼。取出滤饼,放真空干燥箱内80 ℃烘干,即制得四氧化三铁超精细微粒。将磁粒与基液按一定体积重量比,充分混合研磨,促进四氧化三铁胶体微粉充分分散在基液中,即得到界面稳定的生物磁液。
1.3 MTX活化酯的制备
MTX原料药1 000 mg、DCC 480 mg溶于40 ml二甲基甲酰胺溶液中,4 ℃反应18 h后,于反应混合物中加入NHS 280 mg、吡啶320 μl,继续在4 ℃反应6h,反应混合物离心(10 000 r/min,20 min),收集上清,-30 ℃冷冻干燥保存。
, 百拇医药
1.4 磁性甲氨蝶呤缓释剂的制备
人血清白蛋白HSA首先通过Sephadex G-150以去除HSA双体,40 ml HSA(10 g/L)室温下与5倍过量SPDP(溶于二甲基甲酰胺中)反应,1 h后过Sephadex G-25柱,去除未反应的试剂,得到暴露巯基的人血清白蛋白HSA-SH。加入MTX活化酯二甲基甲酰胺溶液,以0.2 mol/L氢氧化钠调pH至8.0,4 ℃反应18 h,反应混合物过Sephadex G-25柱,去除游离甲氨蝶呤。在生物磁液中加入EDCI 40 g/L,搅拌加入HS-HSA-MTX交联物,超声振动5 min,置4 ℃搅拌3 h,磁场吸附3 h,透析72 h,过Sephadex 4B柱,浓缩分装后冷冻干燥保存或封装保存。
1.5 磁性甲氨蝶呤缓释药物含量检测
1.5.1 紫外分光光度法MTX含量检测〔6〕
, http://www.100md.com
精密称取标准品MTX 5 mg两份,分别置于100 ml容量瓶中,用1.5 ml 2 g/L Na2CO3溶解,然后用0.1 mol/L HCl稀释至刻度。此溶液仍用0.1 mol/L HCl分别稀释成含12.5,6.25,3.125,1.562 5,0.781 25 mg/L,在306 nm处测定其吸光度。将测得的数据按回归法处理得标准曲线方程,并绘出吸光度-浓度曲线。
精密吸取FM-MTX 1 ml 3份,按等比浓度稀释1∶10,1∶100,1∶1 000,分别测定306 nm处吸光度,在吸光度-浓度标准曲线上推算其含量浓度。
1.5.2 高效液相色谱法MTX含量检测〔7〕
精密称取MTX标准品1 mg,放置于20 ml容量瓶中,终浓度为50 mg/L。再依次稀释成5、4、3、2、1 mg/L。各吸取0.1 ml上样,在高效液相色谱仪(HPLC)上检测306 nm处的MTX峰值及峰面积(色谱柱150 mm×4 mm,填料YWG-C18,直径10 μm;流动相:甲醇-pH6.0磷酸缓冲液40份∶60份,流速1.0 ml/min)。以峰高为纵坐标,MTX浓度为横坐标,拟合标准曲线方程。
, http://www.100md.com
精密吸取FM-MTX 0.1 ml,分别稀释成10、100、1 000 ml。各取0.1 ml上样,在HPLC上检测MTX特征峰,以峰高及面积在标准曲线上求得MTX药物浓度。
1.5.3 原子吸收光谱法Fe3O4含量检测
精密吸取FM-MTX 0.1 ml3 份,加10 ml HNO3-HCIO4(4∶1)消化液,盖上表面皿,置电垫板上低温消化至液体透明,大火蒸干,无碳化时取下,加体积分数为0.2%的HNO3溶解残渣 ,用去离子水定容至10 ml,在原子吸收光谱仪上进行Fe原子测定。灯电流15 mA,波长为248.3 nm,空气压力156.89 kPa,乙炔气压力25.49kPa,按三份样品计算均值标准差,按Fe分子量55.847,O分子量15.999 4,计算Fe3O4含量=1.382×Fe含量。
, http://www.100md.com
2 结 果
2.1 生物磁液及FM-MTX特性
Fe3+及Fe2+高度弥散于水基液态载液中,构成一种高稳定性的胶体溶液。微粒与载液通过界面活性剂十二烷基油酸钠制成的这种微乳磁液,即使在重力场、电场、磁场作用下也能长期稳定存在,不产生沉淀和分离。制得的磁液经高速离心和梯度磁场处理,测得其磁化曲线呈光滑对称的“S”形,无矫顽力及剩磁,呈超顺磁性。稀释12~20倍后仍呈同样曲线,仅其磁化强度缩小12~20倍。
甲氨蝶呤经过活化酯反应,在SPDP双功能试剂的作用下与暴露巯基-SH的HSA氨基反应,制得SH-HSA-MTX交联物,在EDCI和4-DMAP的作用下与生物磁液反应,制备出稳定的FM-MTX结合物。冷冻干燥后直接封装安瓿保存,无结构特性改变。
, http://www.100md.com
2.2 MTX含量测定结果
2.2.1 紫外光谱检测
在盐酸溶液稀释下,紫外光谱扫描显示,在306 nm波长处有最大吸收峰,MTX的特性吸收曲线不变。(图1)

图1 MTX紫外光谱306 nm吸收图谱
按MTX标准品12.5、6.25、3.125、1.5625、及0.781 25 mg/L在306 nm处测得的光吸收度,绘制标准曲线(图2)。r=0.997,在0.8~12 mg/L区间光吸收度与MTX浓度呈直线关系。FM-MTX用HCl等比浓度1∶100稀释后,测定306 nm处吸光度0.12。从标准曲线上推算出FM-MTX中MTX的含量为250 mg/L。

, http://www.100md.com
图2 MTX紫外光谱306 nm吸收标准曲线
2.2.2 高效液相色谱测定结果
MTX分子量恒定,其极性结构在甲醇洗脱液中为恒定峰。MTX标准品在反相高效液相色谱仪上呈现恒定单峰型,样品出峰时间一致,为8.9 min。现配的MTX标准品1、2、3、4、5 mg/L在HPLC上显示的峰高及峰型如图3所示。

图3 MTX标准品峰型
以MTX为横座标,峰高为纵座标,绘制MTX标准曲线(图4)。其标准曲线方程为:Y=9.34X+3.30(r=0.99986,AUFs=0.01)。

, 百拇医药
图4 MTX HPLC标准曲线
FM-MTX样品HPLC峰型及出峰时间与MTX标准品一致。稀释100倍的样品,以离心后过滤膜,在HPLC测得的峰高在HPLC MTX标准曲线上求得MTX含量为260 mg/L;从而证实FM-MTX样品原药中MTX含量为260 mg/L。
2.3 FM-MTX中Fe3O4含量测定结果
取FM-MTX样品3份,每份在原子吸收光谱仪上测定3次,Fe元素含量为(47.97±0.52) mg/L,即F33O4平均含量为66.29 mg/L。
3 讨 论
抗癌药物磁性微球载体是将药物与具有磁响应的物质结合构成的一种新剂型。为使磁性药物微球具有足够的磁响应力,强磁材料中以Fe3O4铁氧体为最佳〔1〕。采用10 nm以下Fe3O4微粒能稳定地分散在水和油中,形成磁性胶体溶液,在重力场作用下也不会发生凝聚和沉淀。作为药物载体,以Fe3O4为基核的强磁材料优于纯铁粉、羰基铁、钴铁合金、钡锶铁氧体及钕铁硼等稀土材料。在表面活性剂存在下,Fe3O4无机物表面有机化,制备成亲水或疏水极性的生物磁液。这是可以制备磁性药物载体的分子基础。
, 百拇医药
制备缓释药物,Widder等〔1〕采用热固化法制成阿霉素磁性白蛋白微球,将Fe3O4药物水溶液加入棉籽油中,加热至105~120 ℃,热固定10 min,使药物固定于白蛋白基质中。由于热固定方法温度太高,药物容易分解破坏。后又采用戊二醛或甲醛硬化微球,避免了阿霉素药理活性丧失。制得的药物微球直径1~3 μm,可供动脉和静脉注射应用。
王平康等〔2〕采用氧化铁,加入IV族元素,在700 ℃高温烧结后粉碎净化,与阿拉伯胶、水解明胶及药物混合,加入液体石蜡及Span等活性剂,加温至30~60 ℃进行搅拌,冷却后得到直径为8 μm以下的磁性药物载体。由于明胶微球稳定性欠佳,达不到药用标准。
有关甲氨蝶呤与白蛋白连接的方法很多。Leuy等〔3〕报道采用重氮反应法,使甲氨蝶呤的胺基与亚硝酸反应得到重氮盐。然后直接交联在蛋白质中酪氨酸残基酚羟基的邻位,成为一个偶氮化合物。采用此方法,易形成大量沉淀,难于得到具有活性的结合物。Ibrahim等〔9〕采用碳二亚胺法替代重氮化反应,水溶性碳二亚胺可激活羧基,形成中间产物酰异脲及酐,再与蛋白质胺基反应形成酰胺链。但是,由于甲氨蝶呤及蛋白质中存在羧基和胺基,会形成分子内和分子间交联,影响生物活性。Devineni等〔10〕报道采用活性酯法,首先使用N-羟基琥珀酰亚胺和2,2’-二环已基碳二亚胺处理甲氨蝶呤得到甲氨蝶呤活性酯,然后与白蛋白交联。这样,不仅性质稳定,连接数目较多的药物分子,而且能保持较好的水溶性。
, http://www.100md.com
我们采用生物磁液,选用十二烷基油酸钠作为表面活性剂,它有非极性的疏水碳氢链部分和极性的亲水基团共同构成,且两部分分别处于两端,形成不对称结构,其疏水基团与Fe3O4粒子结合,在粒子表面减少其张力。亲水基团为离子型活性剂,可使磁微粒能稳定地悬浮于载液中,并能与可溶性药物基团结合。在SPDP及DCC等交联作用下,与白蛋白、甲氨蝶呤化学偶联,避免加温过高造成的药物作用下降,且使药物微球粒径在1 μm以下,符合体内药物静脉及动脉注射应用的要求〔8〕。
FM-MTX制成后,首先要对其各组成成份进行检测, 包括MTX含量、白蛋白含量、Fe3O4含量;并对其理化性能及稳定性进行测定。这是甲氨蝶呤磁性药物制剂质量控制的重要特性参数。
甲氨蝶呤紫外光谱扫描显示,其盐酸溶液在244 nm、306 nm波长处有最大吸收,在234 nm、262 nm波长处有最小吸收(图1)。中国药典(1985)规定,采用PC层析后,再用紫外分光光度法测定。但该方法既费时间,误差又大。为提高检测方法的灵敏度和准确性,中国药典(1990)将本品测定方法改为HPLC法〔7〕,其灵敏度为2 ng,标准差为0.39 ng。
, 百拇医药
我们利用MTX的上述特性,分别进行了紫外分光光度计法测定,反相高效液相色谱法测定结果以HPLC法较佳。测得FM-MTX中MTX含量为260 mg/L。Fe3O4含量采用浓硝酸水解后,其水溶液应用原子吸收光谱法测定铁离子的含量,再推算出Fe3O4的含量,并按分子量推算其克分子摩尔比。
基金项目:国家自然科学基金资助项目 39070871
国家新药基金资助项目 93-(62)-N-42
参考文献:
[1]Widder KJ,Morris RM,Poore G,et al.Tumor remission in Yoshida sarcoma-bearing rats by selective targeting of magnetic albumin microspheres containing doxorubicin.Proc Natl Acad Sci USA,1981,78:579
, 百拇医药
[2]王平康.磁性药物载体及其制造方法.发明专利公开说明书,901083852
[3]Leuy C,Lefebvre S,Andry MC,et al.Fourier transform infrared spectroscopic studies of crosslinked human serum albumin microcapsules.J Pharma Sci,1994,83:419
[4]Gallo JM,Hung CT,Perrier DG,et al.Analysis of albumin microspheres preparation. Int J Pharm,1984,22:63
[5]Gupta PK.Drug trageting in cancer chemotherapy:A Clinical Perspective J Pharm Sci,1990,79:949
, 百拇医药
[6]王佾先,张能芳,张琴芬,等.生物液中MTX及其代谢产物7-OH-MTX的分离与检测.药学学报,1982,17:647
[7]Iven H,Bartels H,High-performance liquid chromatographic and enzyme inhibition assays of MTX concentrations in serum from patients receiving high-dose therapy.Cancer Treatment Report,1985,69:825
[8]中华人民共和国药典二部.北京:人民卫生出版社,1990。
[9]Ibrahim A,Coureur P,Roland M,et al.New magnetic drug carrier.J Pharm Pharmacal,1983,35:59
[10]Devineni D,Blanton C D,Gallo J M.Preparation and in vitro evaluation of magnetic microsphere-methotrexate conjugate durg delivery system.Bioconjugate Chem,1995,6:203
收稿日期:1998-08-24
修改日期:1999-11-01, http://www.100md.com