氨基胍抑制糖基化终产物促进大鼠胰星状细胞增殖和基质合成的作用
作者:刘乃丰
单位:南京铁道医学院附属医院心内科,江苏南京210009
关键词:氨基胍;高级糖基化终产物;糖尿病;培养的细胞;细胞外基质;纤连蛋白类
中国新药与临床杂志990601 摘要 目的:探讨抗糖基化药物氨基胍(AG)对高级糖基化终产物(AG Es)促进大鼠胰星状细胞(PSC)增殖和基质合成的干预作用。方法:用非同位素的溴脱氧尿苷(BrdU)掺入法和时间分辨免疫荧光法测定PSC的增殖过程,以时间分辨免疫荧光法和免疫细胞化学法观察了AGEs 对大鼠PSC纤连蛋白合成的作用,并观察了氨基胍对上述效应的干预作用。结果:AGEs能以浓度相关的方式明显增强PSC的增殖和纤连蛋白的合成, AG处理的AGEs上述效应明显减弱。结论:AG对AGEs促进PSC增殖和基质合成有明显的抑制作用。
Aminoguanidine in inhibiting proliferation and matrix synthe sis of cultured rat pancriatic stellate cells stimulated by advanced glycosylati on end products
, 百拇医药
LIU Nai-Feng
(Department of Cardiology, Affiliated Hospital, Nanjing Rail way Medical College, Nanjing JIANGSU 210009)
ABSTRACT AIM: To investigate effects of aminoguanidine on ad vanced glycosylation end products(AGEs) in proliferation and matrix synthesis of cultured rat pancriatic stellate cells(PSC). METHODS: Proliferation of PSC was estimated by bromodeoxyuridine(BrdU) with time-resolved fluoroimmunoassay (TR-FI A). The fibronectin synthesis of rat PSC were observed by immunocyto chemistry and by TR-FIA. RESULTS: It was found that AGEs-BSA significantly stimulated prolife ration of PSC in a dose-related manner. The total fibronectin synthesis of PSC w as also increased by AGEs-BSA in a concentration-related manner. AGEs-BSA glyc osylated in the presence of aminoguanidine under anaerobic conditions showed red uced or no significant effects on cellular proliferation and fibronectin synthes is. CONCLUSION: Our result is that AG can inhibit the proliferation and matrix synthesis of PSC stimulated by AGEs.
, 百拇医药
KEY WORDS aminoguanidine; advanced glycosylation end products; diabetes mellitus; cultured cells; fibronectins
持续的高血糖状态会导致体内许多结构和功能蛋白质糖基化。这种转录后修饰过程,先形成可逆的早期糖基化产物、Schiff碱和Amadori产物,如临床常用的监测血糖控制指标糖化血红蛋白HbA1c便属其一。如反应继续,则分子重排形成一大类有高度活性的高级糖基化终产物(advanced glycosylation end-products,AGEs)。这类物质的共同特征是,形成缓慢,但不可逆,具有棕黄色素和特征性荧光光谱,能形成蛋白间的交链,与氧化修饰密切相关,能与特异胞膜受体结合介导各种细胞异常反应,因此在糖尿病慢性并发症的发生中占有重要地位[1]。糖尿病并发症共同的病理过程是纤维化,以间质细胞的增殖和基质的大量合成为特征。胰星状细胞(PSC)是胰腺组织中的主要间质细胞[2]。抗糖基化药物氨基胍(AG)在糖尿病慢性并发症的防治中有很好的前景。我们在培养的大鼠PSC上观察了AG对AGEs诱导的增殖和基质合成的影响。
, 百拇医药
材料与方法
材料 细胞培养基(Dulbecco's modified eagle medium,DMEM, Bioch rom), 牛血清清蛋白(BSA, Sigma), 小牛血清(Boehringer Mannhein), 葡萄糖(Merck), 鼠抗溴脱氧尿核苷单克隆抗体(DAKO), 生物素标记兔抗鼠IgG抗体(DAKO), 镧标记链抗生物素蛋白(Eu-streptavidn,Wallac), 兔抗人纤连蛋白类多克隆抗体(Behring), 镧标记抗兔IgG 抗体(Wallac), 纤连蛋白对照品(Behring), 荧光染料(Bis-benzimid)和牛胸腺DNA对照品 (Sigma)。氨基胍(aminoguanidine, Sigma)。
高级糖基化终产物(AGEs-BSA)的制备 将牛血清清蛋白与200 mmol.L -1的葡萄糖在37℃无菌条件下孵育8 wk后,对磷酸盐缓冲溶液(PBS)充分透析去除游离糖。再通过0.22 μ m的滤器除菌过滤,4℃保存备用。部分AGEs-BSA在糖基化过程中加入终浓度为 100, 200 mm ol.L-1的AG或10 μmol.L-1乙二胺四乙酸(EDTA)。
, 百拇医药
大鼠胰间质细胞的分离培养 采用组织贴块外生长法。先将新鲜分离的大鼠胰腺组织在PBS中洗去血液和其他附着物,剪切为1 mm3的小组织块,置于6孔板中,用D MEM培养基,加10 %小牛血清、抗生素和谷氨酰胺,在37℃,5% CO2条件下静置培养。5~ 7 d后可见细胞从组织块边缘向外生长,融合约60%时传代。
免疫细胞化学 将传代后的细胞种植于6孔板中,内置3~4片载玻片,融合至60%时,换新鲜培养液,加指定浓度的AGEs-BSA或AG处理的AGEs-BSA继续培养24 h后取出,用PBS漂洗,预冷的丙酮固定细胞。经PBS和小牛血清混合液阻断非特异性结合后,分别加抗纤连蛋白(FN)抗体(均为1∶50稀释),孵育1 h,再加生物素标记的相应第二抗体和荧光素标记链抗生物素蛋白,间以充分的PBS漂洗,荧光显微镜下观察、摄影记录。
细胞增殖状态测定 用非同位素的溴脱氧尿苷(Br dU)掺入法。第4~8代细胞用于实验。细胞传代后种植于24孔培养板中,待融合至80%时,换含 0.5%小牛血清的培养基培养24 h,使大多数细胞进入G0期。然后换为含指定浓度BSA和AGEs-BSA培养基,并加入BrdU继续培养24 h。细胞经PBS清洗后,用乙醇和冰醋酸(95/5)固定。加甲酰胺 250 μl 在80℃水浴中孵育45 min,使胞内DNA断裂,易被抗体识别。依次加入抗BrdU抗体(1∶500 )、生物素标记抗小鼠IgG抗体(1∶1000)、镧(Eu)标记链抗生物素蛋白(1∶1000)和镧增强液分别作用1 h,在Wallac 1232 DELFIA时间分辩免疫荧光仪上测Eu计数。
, 百拇医药
纤连蛋白的测定 先用含0.1% 明胶的包被缓冲液4℃包被96孔板过夜,再用清洗缓冲液洗3次。将FN对照品储存液从5000 mg.L-1分步稀释到19.5 mg.L- 1,每孔加100 μl作为标准曲线。细胞上清液稀释20倍后,加100 μL为待测样本。经37 ℃振荡孵育1 h后,用自动洗板机洗3次。分别加1∶200 稀释的多克隆兔抗人FN抗体100 μ L 和1∶200稀释的镧标记抗兔IgG抗体各孵育1 h后,再加镧增强液作用1 h。用时间分辩免疫荧光测定仪计数,计算机应用程序拟合标准曲线,并计算出样本中FN浓度。所有测量均为复管,复管间变异系数小于10%。实验重复3次。
数据和统计学处理 数据表示为 ±s 。用计算机统计程序Statistic Graphic方差分析(ANOVA)比较组间差异,P<0.05为显著性检验标准。
±s 。用计算机统计程序Statistic Graphic方差分析(ANOVA)比较组间差异,P<0.05为显著性检验标准。
, 百拇医药
结 果
AGEs-BSA促进PSC基质合成的免疫组织化学特征 PSC经鉴定,符合其形态学和免疫组织化学特征。如图1所示,用AG处理的AGEs-BSA刺激FN合成的作用明显减弱。
图1 AGEs对PSC纤连蛋白表达的免疫细胞化学观察(×400倍)
A:对照组,含0.5%小牛血清;B:BSA 200 mg.L-1; C: AGEs-BSA 200 mg.L-1加AG 100 mmol.L-1; D:AGEs-BSA 200 mg.L-1
AG抑制BSA糖基化过程中的荧光值 当BSA与500 mmol.L-1葡萄糖孵育后产生明显的荧光,AG 100 mmol.L-1能明显抑制荧光的发生,EDTA 10 μmol .L-1也有部分抑制作用(图2)。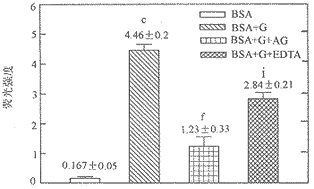
, 百拇医药
图2 AG和EDTA对BSA糖基化过程中产生荧光的影响
葡萄糖(G, 500 mmol.L-1), AG(100 mmol.L-1), EDTA(10 mol.L-1)。BSA+G组与BSA组相比经t检验,cP<0.01; BSA+G+AG组与BSA+G组相比经t检验,fP<0.01; BSA+G+EDTA组与BSA+G组相比经t检验,iP<0.01( ±s, n=3)。
±s, n=3)。
AG抑制AGEs对PSC合成FN的作用 当PSC与AGEs-BSA 50, 200, 400 mg.L-1共同作用24 h后,FN的合成显著增加, 呈浓度依赖性。相同浓度但用AG 100 mmol.L-1处理的AGEs--BSA刺激FN合成的作用明显减弱(图3)。
, 百拇医药
图3 AG对AGEs-BSA介导PSC合成纤连蛋白的影响
AGEs-BSA 200 mg.L-1组或AGEs-BSA 400 mg.L[-1]组与对照组比较,经t检验,bP<0.05; AGEs-BSA 200 mg.L-1+AG组或AGEs-BSA 400 mg.-1+AG组与相应的AGEs-BSA组相比,经t检验,fP<0.01( ±s, n=3)。
±s, n=3)。
AG抑制AGEs对PSC的促增殖作用 当细胞与AGEs-BSA 100, 200 mg.L -1作用24 h后, 增殖过程明显增强,用AG 100 mmol.L-1处理的AGEs-BSA刺激作用略有减弱,AG 200 mmol.L-1处理的AGEs-BSA刺激作用显著减弱(图4)。
, 百拇医药
图4 AG预处理的AGEs-BSA对PSC增殖过程的影响
AGEs-BSA组或 AGEs-BSA+AG 组与对照组比,经t检验,bP<0.05;AGEs-BSA+AG 200 mmol.L-1组与AGEs-BSA组或AGEs-BSA+AG 100 mmol.L-1组比,经t检验,cP<0.01( ±s, n=3)。
±s, n=3)。
讨 论
糖尿病人的AGEs水平显著增高,特别是伴终末期肾衰者,可较同龄对照组高8倍。衰老过程中AGEs也逐渐积聚于长寿蛋白质上,尤以血管胶原和肾小球基底膜上为甚,且可捕获大分子如低密度脂蛋白与之交联。糖尿病大鼠模型和人主动脉粥样硬化病灶中都能捡出 AGEs[3]。 AGEs还出现在短寿命蛋白和脂质成分、甚至核酸上。我们已发现大鼠血管平滑肌细胞(VSMC) 表达AGEs受体,AGEs明显促进SMC增殖,而且伴有胞浆游离钙增高[4],可能AGEs与其受体结合改变了胞内信号转导,促进胞内钙释放通道开放。我们还证实了AGEs促进人单核巨噬细胞和大鼠VSMC表达c-sis,VSMC也可能通过自分泌和旁分泌改变其功能,由收缩型转化为合成型并分泌基质,而间质细胞是否有这种变化,值得探讨。
, 百拇医药
糖尿病的心血管和肾脏并发症一直倍受注目。消化系统并发症,特别是纤维化病变,因为无明显的临床症状而易被忽视。近年发现,肝、胰等脏器纤维化在糖尿病人中的出现机率明显增高。糖尿病人肝活检标本显示纤维化和基底膜样物质积聚[5]。在纤维化过程中起关键作用的肝脏、胰星状细胞具有被刺激后大量增殖并合成基质的潜力,所以各种病理性因素对该细胞增殖和基质合成的影响是一个很有意义的问题。
胞外基质(extracellular matrix,ECM)不仅仅是细胞合成分泌到胞外的支架,生理条件下参与调控细胞周期及增殖反应,维持细胞间通讯及信号转导,且与胞膜及核有复杂的相互作用,对血管发育和维持结构与功能的完整性非常重要[6]。近年来ECM在血管重构和多种脏器纤维化中的作用也受到高度重视。已发现AGEs可上调肾系膜细胞胶原、Lamini n的mRNA和蛋白质表达。AGEs促进间质细胞增殖并合成ECM的分子细胞学机制及其在糖尿病并发症中的地位还未搞清,这对多种脏器的纤维化有重要的病理意义。
, http://www.100md.com
本研究所用的葡萄糖 ( 500 mmol ) 、 BSA ( 20 g .L-1)、pH 7.4 PBS 在3 7℃下共同避光孵育90 d可用做体外非酶糖化实验和筛选抗AGEs药物的满意的体外非酶糖化系统。AGEs-BSA 被糖基化修饰过程中同步加入氨基胍,其荧光值明显降低,且呈浓度依赖, 200 mmol.L -1氨基胍对AGEs-BSA荧光值抑制率达88 %, 说明氨基胍和EDTA能明显抑制AGEs-BSA的生成,这为寻找抗AGEs积聚的有效药物提供了很好的启示。氨基胍是一种亲核的羟嗪化合物,无显著的螯合、还原和抗氧化活性,其主要通过与反应性中间产物结合而抑制糖氧化反应和 Amadori产物进一步交联。Fu等[7]认为抗氧化剂及氨基胍等均能抑制糖氧化产物形成、荧光产生和蛋白质交联,而对蛋白质糖基化无明显影响。有作者发现AG主要抑制早期糖基化反应[8]。动物模型发现,AG治疗可以明显减轻糖尿病大鼠的TGF-β1和胶原的基因表达[9]和动脉壁的胶原交链[10]。寻找有效、安全的抗糖基化药物是今后一个非常重要的研究领域。
, http://www.100md.com
参考文献
1 Brownlee M. Advanced protein glycosylation in diabetes and ag ing. Annu Rev Med 1995; 46: 223-4.
2 Falchuk KR, Conlin D. The intestinal and liver complications of diabetes mell itus. Adv Intern Med 1993; 38: 269-86.
3 Schleicher ED, Wagner E, Nerlich AG. Increased accumulation of the glycoxidat ion product N(epsilon)-(carboxymethyl)lysine in human tissues in diabetes and a ging. J Clin Invest 1997; 99: 457-68.
, 百拇医药
4 Jin H, Liu NF, Tang R. Effects of advanced glycosylation end products on proli feration and cytosolic free calcium in cultured rat aortic smooth muscle cells. Acta Pharmacol Sin 1997; 18: 422-5.
5 Latry P, Bioulac Sage P, Echinard E, et al. Perisinusoidal fibro sis and basement membrane-like material in the livers of diabetic patients. Hum Pathol 1987; 18: 775-80.
6 Gressner AM, Bachem MG. Cellular communications and cell-matrix interactions in the pathogenesis of fibroproliferative diseases: liver fibrosis as a paradig m. Ann Biol Clin Paris 1994; 52: 205-26.
, http://www.100md.com
7 Fu MX, Wells-Knecht KJ, Blackledge JA, et al. Glycation, glycoxid ation, and cross-linking of collagen by glucose. Kinetic, mechanisms, and inhibition of la te stages of the Maillard reaction. Diabetes 1994; 43: 676-83.
8 Booth AA, Khalifah RG, Todd P, et al. In vitro kinetic studies of formation o f antigenic advanced glycation end products (AGEs). Novel inhibition of post-Ama dori glycation pathway. J Biol Chem 1997; 272: 5430-7.
, 百拇医药
9 Brownlee M, Vlassara H, Kooney A, et al. Aminoguanidine prevents diab etes-induced arterial wall protein cross-linking. Science 1986; 232: 1629-32.
10 Rumble JR, Cooper ME, Soulis T, et al. Vascular hypertrophy in e xperimental diabetes. Role of advanced glycation end products. J Clin Invest 1997; 99: 1016-27.
Chin J New Drugs Clin Remedies 1999 Nov; 18(6):339-342.
1999年4月19日收稿 1999年7月19日接受, 百拇医药
单位:南京铁道医学院附属医院心内科,江苏南京210009
关键词:氨基胍;高级糖基化终产物;糖尿病;培养的细胞;细胞外基质;纤连蛋白类
中国新药与临床杂志990601 摘要 目的:探讨抗糖基化药物氨基胍(AG)对高级糖基化终产物(AG Es)促进大鼠胰星状细胞(PSC)增殖和基质合成的干预作用。方法:用非同位素的溴脱氧尿苷(BrdU)掺入法和时间分辨免疫荧光法测定PSC的增殖过程,以时间分辨免疫荧光法和免疫细胞化学法观察了AGEs 对大鼠PSC纤连蛋白合成的作用,并观察了氨基胍对上述效应的干预作用。结果:AGEs能以浓度相关的方式明显增强PSC的增殖和纤连蛋白的合成, AG处理的AGEs上述效应明显减弱。结论:AG对AGEs促进PSC增殖和基质合成有明显的抑制作用。
Aminoguanidine in inhibiting proliferation and matrix synthe sis of cultured rat pancriatic stellate cells stimulated by advanced glycosylati on end products
, 百拇医药
LIU Nai-Feng
(Department of Cardiology, Affiliated Hospital, Nanjing Rail way Medical College, Nanjing JIANGSU 210009)
ABSTRACT AIM: To investigate effects of aminoguanidine on ad vanced glycosylation end products(AGEs) in proliferation and matrix synthesis of cultured rat pancriatic stellate cells(PSC). METHODS: Proliferation of PSC was estimated by bromodeoxyuridine(BrdU) with time-resolved fluoroimmunoassay (TR-FI A). The fibronectin synthesis of rat PSC were observed by immunocyto chemistry and by TR-FIA. RESULTS: It was found that AGEs-BSA significantly stimulated prolife ration of PSC in a dose-related manner. The total fibronectin synthesis of PSC w as also increased by AGEs-BSA in a concentration-related manner. AGEs-BSA glyc osylated in the presence of aminoguanidine under anaerobic conditions showed red uced or no significant effects on cellular proliferation and fibronectin synthes is. CONCLUSION: Our result is that AG can inhibit the proliferation and matrix synthesis of PSC stimulated by AGEs.
, 百拇医药
KEY WORDS aminoguanidine; advanced glycosylation end products; diabetes mellitus; cultured cells; fibronectins
持续的高血糖状态会导致体内许多结构和功能蛋白质糖基化。这种转录后修饰过程,先形成可逆的早期糖基化产物、Schiff碱和Amadori产物,如临床常用的监测血糖控制指标糖化血红蛋白HbA1c便属其一。如反应继续,则分子重排形成一大类有高度活性的高级糖基化终产物(advanced glycosylation end-products,AGEs)。这类物质的共同特征是,形成缓慢,但不可逆,具有棕黄色素和特征性荧光光谱,能形成蛋白间的交链,与氧化修饰密切相关,能与特异胞膜受体结合介导各种细胞异常反应,因此在糖尿病慢性并发症的发生中占有重要地位[1]。糖尿病并发症共同的病理过程是纤维化,以间质细胞的增殖和基质的大量合成为特征。胰星状细胞(PSC)是胰腺组织中的主要间质细胞[2]。抗糖基化药物氨基胍(AG)在糖尿病慢性并发症的防治中有很好的前景。我们在培养的大鼠PSC上观察了AG对AGEs诱导的增殖和基质合成的影响。
, 百拇医药
材料与方法
材料 细胞培养基(Dulbecco's modified eagle medium,DMEM, Bioch rom), 牛血清清蛋白(BSA, Sigma), 小牛血清(Boehringer Mannhein), 葡萄糖(Merck), 鼠抗溴脱氧尿核苷单克隆抗体(DAKO), 生物素标记兔抗鼠IgG抗体(DAKO), 镧标记链抗生物素蛋白(Eu-streptavidn,Wallac), 兔抗人纤连蛋白类多克隆抗体(Behring), 镧标记抗兔IgG 抗体(Wallac), 纤连蛋白对照品(Behring), 荧光染料(Bis-benzimid)和牛胸腺DNA对照品 (Sigma)。氨基胍(aminoguanidine, Sigma)。
高级糖基化终产物(AGEs-BSA)的制备 将牛血清清蛋白与200 mmol.L -1的葡萄糖在37℃无菌条件下孵育8 wk后,对磷酸盐缓冲溶液(PBS)充分透析去除游离糖。再通过0.22 μ m的滤器除菌过滤,4℃保存备用。部分AGEs-BSA在糖基化过程中加入终浓度为 100, 200 mm ol.L-1的AG或10 μmol.L-1乙二胺四乙酸(EDTA)。
, 百拇医药
大鼠胰间质细胞的分离培养 采用组织贴块外生长法。先将新鲜分离的大鼠胰腺组织在PBS中洗去血液和其他附着物,剪切为1 mm3的小组织块,置于6孔板中,用D MEM培养基,加10 %小牛血清、抗生素和谷氨酰胺,在37℃,5% CO2条件下静置培养。5~ 7 d后可见细胞从组织块边缘向外生长,融合约60%时传代。
免疫细胞化学 将传代后的细胞种植于6孔板中,内置3~4片载玻片,融合至60%时,换新鲜培养液,加指定浓度的AGEs-BSA或AG处理的AGEs-BSA继续培养24 h后取出,用PBS漂洗,预冷的丙酮固定细胞。经PBS和小牛血清混合液阻断非特异性结合后,分别加抗纤连蛋白(FN)抗体(均为1∶50稀释),孵育1 h,再加生物素标记的相应第二抗体和荧光素标记链抗生物素蛋白,间以充分的PBS漂洗,荧光显微镜下观察、摄影记录。
细胞增殖状态测定 用非同位素的溴脱氧尿苷(Br dU)掺入法。第4~8代细胞用于实验。细胞传代后种植于24孔培养板中,待融合至80%时,换含 0.5%小牛血清的培养基培养24 h,使大多数细胞进入G0期。然后换为含指定浓度BSA和AGEs-BSA培养基,并加入BrdU继续培养24 h。细胞经PBS清洗后,用乙醇和冰醋酸(95/5)固定。加甲酰胺 250 μl 在80℃水浴中孵育45 min,使胞内DNA断裂,易被抗体识别。依次加入抗BrdU抗体(1∶500 )、生物素标记抗小鼠IgG抗体(1∶1000)、镧(Eu)标记链抗生物素蛋白(1∶1000)和镧增强液分别作用1 h,在Wallac 1232 DELFIA时间分辩免疫荧光仪上测Eu计数。
, 百拇医药
纤连蛋白的测定 先用含0.1% 明胶的包被缓冲液4℃包被96孔板过夜,再用清洗缓冲液洗3次。将FN对照品储存液从5000 mg.L-1分步稀释到19.5 mg.L- 1,每孔加100 μl作为标准曲线。细胞上清液稀释20倍后,加100 μL为待测样本。经37 ℃振荡孵育1 h后,用自动洗板机洗3次。分别加1∶200 稀释的多克隆兔抗人FN抗体100 μ L 和1∶200稀释的镧标记抗兔IgG抗体各孵育1 h后,再加镧增强液作用1 h。用时间分辩免疫荧光测定仪计数,计算机应用程序拟合标准曲线,并计算出样本中FN浓度。所有测量均为复管,复管间变异系数小于10%。实验重复3次。
数据和统计学处理 数据表示为
 ±s 。用计算机统计程序Statistic Graphic方差分析(ANOVA)比较组间差异,P<0.05为显著性检验标准。
±s 。用计算机统计程序Statistic Graphic方差分析(ANOVA)比较组间差异,P<0.05为显著性检验标准。, 百拇医药
结 果
AGEs-BSA促进PSC基质合成的免疫组织化学特征 PSC经鉴定,符合其形态学和免疫组织化学特征。如图1所示,用AG处理的AGEs-BSA刺激FN合成的作用明显减弱。

图1 AGEs对PSC纤连蛋白表达的免疫细胞化学观察(×400倍)
A:对照组,含0.5%小牛血清;B:BSA 200 mg.L-1; C: AGEs-BSA 200 mg.L-1加AG 100 mmol.L-1; D:AGEs-BSA 200 mg.L-1
AG抑制BSA糖基化过程中的荧光值 当BSA与500 mmol.L-1葡萄糖孵育后产生明显的荧光,AG 100 mmol.L-1能明显抑制荧光的发生,EDTA 10 μmol .L-1也有部分抑制作用(图2)。

, 百拇医药
图2 AG和EDTA对BSA糖基化过程中产生荧光的影响
葡萄糖(G, 500 mmol.L-1), AG(100 mmol.L-1), EDTA(10 mol.L-1)。BSA+G组与BSA组相比经t检验,cP<0.01; BSA+G+AG组与BSA+G组相比经t检验,fP<0.01; BSA+G+EDTA组与BSA+G组相比经t检验,iP<0.01(
 ±s, n=3)。
±s, n=3)。AG抑制AGEs对PSC合成FN的作用 当PSC与AGEs-BSA 50, 200, 400 mg.L-1共同作用24 h后,FN的合成显著增加, 呈浓度依赖性。相同浓度但用AG 100 mmol.L-1处理的AGEs--BSA刺激FN合成的作用明显减弱(图3)。

, 百拇医药
图3 AG对AGEs-BSA介导PSC合成纤连蛋白的影响
AGEs-BSA 200 mg.L-1组或AGEs-BSA 400 mg.L[-1]组与对照组比较,经t检验,bP<0.05; AGEs-BSA 200 mg.L-1+AG组或AGEs-BSA 400 mg.-1+AG组与相应的AGEs-BSA组相比,经t检验,fP<0.01(
 ±s, n=3)。
±s, n=3)。AG抑制AGEs对PSC的促增殖作用 当细胞与AGEs-BSA 100, 200 mg.L -1作用24 h后, 增殖过程明显增强,用AG 100 mmol.L-1处理的AGEs-BSA刺激作用略有减弱,AG 200 mmol.L-1处理的AGEs-BSA刺激作用显著减弱(图4)。

, 百拇医药
图4 AG预处理的AGEs-BSA对PSC增殖过程的影响
AGEs-BSA组或 AGEs-BSA+AG 组与对照组比,经t检验,bP<0.05;AGEs-BSA+AG 200 mmol.L-1组与AGEs-BSA组或AGEs-BSA+AG 100 mmol.L-1组比,经t检验,cP<0.01(
 ±s, n=3)。
±s, n=3)。讨 论
糖尿病人的AGEs水平显著增高,特别是伴终末期肾衰者,可较同龄对照组高8倍。衰老过程中AGEs也逐渐积聚于长寿蛋白质上,尤以血管胶原和肾小球基底膜上为甚,且可捕获大分子如低密度脂蛋白与之交联。糖尿病大鼠模型和人主动脉粥样硬化病灶中都能捡出 AGEs[3]。 AGEs还出现在短寿命蛋白和脂质成分、甚至核酸上。我们已发现大鼠血管平滑肌细胞(VSMC) 表达AGEs受体,AGEs明显促进SMC增殖,而且伴有胞浆游离钙增高[4],可能AGEs与其受体结合改变了胞内信号转导,促进胞内钙释放通道开放。我们还证实了AGEs促进人单核巨噬细胞和大鼠VSMC表达c-sis,VSMC也可能通过自分泌和旁分泌改变其功能,由收缩型转化为合成型并分泌基质,而间质细胞是否有这种变化,值得探讨。
, 百拇医药
糖尿病的心血管和肾脏并发症一直倍受注目。消化系统并发症,特别是纤维化病变,因为无明显的临床症状而易被忽视。近年发现,肝、胰等脏器纤维化在糖尿病人中的出现机率明显增高。糖尿病人肝活检标本显示纤维化和基底膜样物质积聚[5]。在纤维化过程中起关键作用的肝脏、胰星状细胞具有被刺激后大量增殖并合成基质的潜力,所以各种病理性因素对该细胞增殖和基质合成的影响是一个很有意义的问题。
胞外基质(extracellular matrix,ECM)不仅仅是细胞合成分泌到胞外的支架,生理条件下参与调控细胞周期及增殖反应,维持细胞间通讯及信号转导,且与胞膜及核有复杂的相互作用,对血管发育和维持结构与功能的完整性非常重要[6]。近年来ECM在血管重构和多种脏器纤维化中的作用也受到高度重视。已发现AGEs可上调肾系膜细胞胶原、Lamini n的mRNA和蛋白质表达。AGEs促进间质细胞增殖并合成ECM的分子细胞学机制及其在糖尿病并发症中的地位还未搞清,这对多种脏器的纤维化有重要的病理意义。
, http://www.100md.com
本研究所用的葡萄糖 ( 500 mmol ) 、 BSA ( 20 g .L-1)、pH 7.4 PBS 在3 7℃下共同避光孵育90 d可用做体外非酶糖化实验和筛选抗AGEs药物的满意的体外非酶糖化系统。AGEs-BSA 被糖基化修饰过程中同步加入氨基胍,其荧光值明显降低,且呈浓度依赖, 200 mmol.L -1氨基胍对AGEs-BSA荧光值抑制率达88 %, 说明氨基胍和EDTA能明显抑制AGEs-BSA的生成,这为寻找抗AGEs积聚的有效药物提供了很好的启示。氨基胍是一种亲核的羟嗪化合物,无显著的螯合、还原和抗氧化活性,其主要通过与反应性中间产物结合而抑制糖氧化反应和 Amadori产物进一步交联。Fu等[7]认为抗氧化剂及氨基胍等均能抑制糖氧化产物形成、荧光产生和蛋白质交联,而对蛋白质糖基化无明显影响。有作者发现AG主要抑制早期糖基化反应[8]。动物模型发现,AG治疗可以明显减轻糖尿病大鼠的TGF-β1和胶原的基因表达[9]和动脉壁的胶原交链[10]。寻找有效、安全的抗糖基化药物是今后一个非常重要的研究领域。
, http://www.100md.com
参考文献
1 Brownlee M. Advanced protein glycosylation in diabetes and ag ing. Annu Rev Med 1995; 46: 223-4.
2 Falchuk KR, Conlin D. The intestinal and liver complications of diabetes mell itus. Adv Intern Med 1993; 38: 269-86.
3 Schleicher ED, Wagner E, Nerlich AG. Increased accumulation of the glycoxidat ion product N(epsilon)-(carboxymethyl)lysine in human tissues in diabetes and a ging. J Clin Invest 1997; 99: 457-68.
, 百拇医药
4 Jin H, Liu NF, Tang R. Effects of advanced glycosylation end products on proli feration and cytosolic free calcium in cultured rat aortic smooth muscle cells. Acta Pharmacol Sin 1997; 18: 422-5.
5 Latry P, Bioulac Sage P, Echinard E, et al. Perisinusoidal fibro sis and basement membrane-like material in the livers of diabetic patients. Hum Pathol 1987; 18: 775-80.
6 Gressner AM, Bachem MG. Cellular communications and cell-matrix interactions in the pathogenesis of fibroproliferative diseases: liver fibrosis as a paradig m. Ann Biol Clin Paris 1994; 52: 205-26.
, http://www.100md.com
7 Fu MX, Wells-Knecht KJ, Blackledge JA, et al. Glycation, glycoxid ation, and cross-linking of collagen by glucose. Kinetic, mechanisms, and inhibition of la te stages of the Maillard reaction. Diabetes 1994; 43: 676-83.
8 Booth AA, Khalifah RG, Todd P, et al. In vitro kinetic studies of formation o f antigenic advanced glycation end products (AGEs). Novel inhibition of post-Ama dori glycation pathway. J Biol Chem 1997; 272: 5430-7.
, 百拇医药
9 Brownlee M, Vlassara H, Kooney A, et al. Aminoguanidine prevents diab etes-induced arterial wall protein cross-linking. Science 1986; 232: 1629-32.
10 Rumble JR, Cooper ME, Soulis T, et al. Vascular hypertrophy in e xperimental diabetes. Role of advanced glycation end products. J Clin Invest 1997; 99: 1016-27.
Chin J New Drugs Clin Remedies 1999 Nov; 18(6):339-342.
1999年4月19日收稿 1999年7月19日接受, 百拇医药