人粒细胞杀菌蛋白的制备与体内外鉴定
作者:张海鹰 李新建 孟宪钧
单位:(解放军总医院实验外科,北京 100853)
关键词:杀菌蛋白;脓毒症;内毒素;细胞因子;单克隆抗体
人粒细胞杀菌蛋白的制备与体内外鉴定 摘要 目的:制备与鉴定人类天然杀菌及通透性增强蛋白,寻找抗LPS新药。方法:自慢性粒细胞性增生患者全血提取人粒细胞杀菌蛋白(BP)。SDS-PEGE电泳测定分子量,水解法测定氨基酸组成,普通细胞菌培养检测对O111B4大肠杆菌的杀伤作用。体内鉴定采用腹腔脓毒症小鼠模型,与抗内毒素单克隆抗体1A比较。观察指标:血LPS使用定量的鲎试剂分析法。血细胞因子活性:IL-1采用小鼠胸腺细胞增值法;IL-6采用小鼠淋巴细胞系7TD1细胞增值法;TNF采用L929细胞溶解法。结果:得到55KD蛋白,具有杀菌和中和LPS特性。该蛋白体外中和LPS的能力强于1A。小鼠脓毒症模型血LPS水平:BP和1A组明显低于NS组(P<0.05)。血细胞因子活性:BP组的抑制作用较强,IL-1,IL-6和TNF活性均低于NS组,有显著性差异(P<0.05);1A只对IL-6有抑制作用(P<0.05)。结论:BP在阻断LPS和抑制炎症反应方面优于抗LPS单抗。
, 百拇医药
PURIFICATION AND CHARACTERIZATION OF HUMAN PROTEIN WITH
ENDOTOXIN-NEUTROLIZING AND BACTERICIDAL PROPERTIES
Zhang Haiying,Li Xinjian,Meng Xianjun
(Department of Experimental Surgery,General Hospital of PLA,Beijing 100853)
ABSTRACT OBJECTIVE:In search for new anti-LPS agent,an human protein with bactericidal and permeability-increasing proteins has been purified and characterized.METHODS:The human bactericidal protein(BP)was extracted from blood of patients with chronic myelocytic leukemia,and its molecular weight,amino-acid compositions,and bactericidal ability for E.coli O111B4 were determined by SDS-PEGE,hydrolysis,and co-culture with BP respectively.Its endotoxin-neutrolizing property was determined quantitatively by limulus amebocyte lysate test.Its in vivo characterization was conducted in model of NH1 male mice with abdominal infection in comparison with monoclonal antibody 1A.Activities of cytokines of IL-1,IL-6,and TNF for septic mice were measured by enhancing mitogenic response of thymocytes to Con A,IL-6-dependent murine hybridoma cell line 7TD1 and L929 cytolutic assay respectively.RESULTS:A 55KD protein with bactericidal and LPS-neutralizing properties was obtained.Its in vitro ability to neutralize LPS was stronger than that of 1A.The blood LPS level in 1A and BP groups was significantly lower than that of NS(P<0.05).BP was much stronger in in vivo and in vitro endotoxin-neutralizing ability than that of 1A.CONCLUSION:The results suggested that BP might be a more powerful anti-inflammatory agent in treatment of bacterial infections in comparison with anti-LPS antibodies.
, 百拇医药
KEY WORDS Bactericidal protein(BP);Sepsis;Endotoxin;LPS;Monoclonal antibody
用抗内毒素单克隆抗体治疗脓毒症已经进入Ⅲ期临床试验,没有获得预想的疗效[1]。杀菌及通透性增强蛋白(bactericidal and permeability increasing protein,BP)是另一种有希望的内毒素脂多糖(LPS)阻断剂。它与抗LPS单抗比较,与LPS的结合是化学性的。最近的动物实验和临床研究证明,它在中和LPS的特异性和亲和性上、以及控制炎性细胞因子等诸多方面优于单克隆抗体。为此,我们自行制备了人粒细胞杀菌蛋白,并对其杀菌和中和内毒素作用加以鉴定,现将结果报告如下。
材料与方法
1 主要仪器与试剂
慢性粒细胞增生患者全血(本院低温研究室提供);抗LPS单抗1A(IgM, 饱和硫酸铵沉淀纯化,本室制备) ;重组人IL-1,IL-6和TNF标准品(北京邦定生物公司);1640培养基(美国GIBCO公司);新生小牛血清(NBS,天津生物制品所);鲎试剂盒II型(购于上海医学化验研究所);低温层析冷柜(解放军军事医学科学院制造);葡聚糖凝胶SepHadex G75(40~120 μm,Pharmacia);CM50阳离子交换树脂(匈牙利产)。
, 百拇医药
2 动物
脓毒症模型采用NH1雄性小鼠,10周龄,ip O111B4大肠杆菌生理盐水悬液0.5ml,浓度为4.6×107~5.6×107个/ml (1/2 LD90),bid,q12h。
3 方法
3.1 分离纯化[2~4] ① 多核粒细胞的分离:慢性粒细胞增生患者全血加入梯度Ficoll液离心管中(含Ficoll上层16%,下层25%),1 500 r/min离心15 min,吸取下层,加3倍体积的4℃生理盐水,混匀后500 r/min离心8 min,弃上清液,共3次。② 多核粒细胞提取物的制备:以0.1 mol/L,pH 4.0醋酸钠稀释细胞浓度为2×106/ml,4℃恒温12 h,恒温摇床摇动频率60次/min,低温25 000 r/min离心30 min,留取上清液。③ 纯化:SepHadex G75柱(2.6 cm×78 cm),洗脱流速5 ml/h,以磷酸盐缓冲液淋洗,紫外检测仅有一个蛋白峰。再经CM50离子交换柱层析(2.6 cm×20 cm),使用0.1 mol/L,pH 5.0醋酸/醋酸钠缓冲体系,2.0 mol/L NaCl溶液连续梯度洗涤,收集到4个蛋白峰,按序编号为1#~4#。整个操作在4℃层析柜内进行。
, http://www.100md.com
3.2 分子量鉴定[4] CM50分离的各蛋白峰经SDS-PEGE电泳。
3.3 杀菌活性 O111B4大肠杆菌经普通琼脂平板培养,收集后以生理盐水洗3次,比浊法设定细菌初浓度为6×106/ml,10倍等比稀释6管;取层析前后各样品加入24孔板,初浓度为1.0 mg/ml,倍比稀释2次(1/2,1/4);每一蛋白浓度加入等比稀释的细菌悬液,每孔0.5 ml。37℃恒温2 h,各取10 μl接种于普通琼脂平板,37℃恒温12 h,记录菌落数。判断标准如下:与单纯载体(0.1 mol/L醋酸钠缓冲液,pH 7.0)比较,菌落数之比≥0.75为“-”,≤0.758“+”,≤0.50“++≤0.25“+++”,≤0.10“+++”。
3.4 中和LPS活性 使用鲎试剂盒II型,待测样品和稀释度同杀菌活性检测,与抗LPS单抗1A比较。
, 百拇医药
3.5 氨基酸组成[3] 6 mol/L盐酸水解,110℃恒温22 h,用BECKMAN 6300高效氨基酸分析仪测定。
3.6 治疗方案 脓毒症模型小鼠50只,随机分为3组,每组16~17只,各组分别给予:1A 1.0 mg,BP 0.1mg,生理盐水(NS),注射液体积0.5ml,均为每鼠剂量,于第一次攻击同时ip给药。
3.7 观察指标 血细胞因子活性及LPS水平定量分析。标本采集:每时间点每组6只小鼠,于第2次攻击后1,3,12 h采集3次血样。
3.7.1 血浆LPS水平 使用鲎试剂法,同上。
3.7.2 细胞因子活性检测[5] IL-1活性检测采用Con A协同的小鼠胸腺细胞增殖法:6周龄NH1小鼠胸腺,用200 μm钢网研磨,收集细胞悬液,1 000 r/min离心8 min,弃上清液,用生理盐水、Hank's液洗,各反复洗2次,以含10%NBS,ConA 0.1 μg/ml的1 640(完全配基)调整细胞浓度为6×105~7×105个/ml;向96孔细胞培养板内加入完全配基40 μl,第1孔加入标本40 μl,等倍稀释4孔,设无标本阴性对照,重组人IL-1作为阳性标准。标本加入完毕后,每孔添加完全配基100 μl,CO2培养箱内培养48 h,每孔加入2%MTT 40 μl,继续培养4~6 h,2 000 r/min离心20 min,弃上清液,每孔加入二甲基亚砜100 μl,20 min后在酶联仪上读取OD540。
, 百拇医药
IL-6活性检测采用IL-6依赖性小鼠淋巴细胞系7TD1细胞增值法:以含10%NBS的1640配基调整7TD1细胞浓度为5×105~6×105个/ml,以后步骤同IL-1。
TNF活性检测采用在放线菌素D增敏的L929细胞溶解法:以含10%NBS的1640(含ConA)完全配基调整L929细胞浓度为5×105~6×105个/ml,以后步骤同IL-1。最后将OD540值换算成细胞裂解百分比,公式为:
细胞裂解百分比(%)=(1-样本OD540/阴性对照OD540)×100%
4 统计方法
使用计算机统计软件SAS,利用方差分析计算各组细胞因子活性以及LPS水平的差异。
, 百拇医药
结 果
1 分子量
各蛋白峰经SDS-PEGE电泳,可见清晰的55KD电泳带,见图1。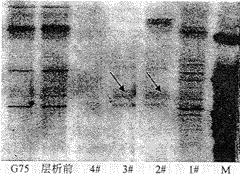
1#~4#为各蛋白峰,箭头处为55KD电泳带,M为分子量标准
图1 SDS-PEGE电泳图谱
2 杀菌活性
与G75层析样本比较,CM50的2#和3#样本有较强的杀菌能力,见表1。
, 百拇医药
表1 样本的杀菌活性
样本
蛋白浓度
0.5 mg/ml
细菌浓度(数/ml)
6×106
6×105
6×104
6×103
6×102
6×101
, 百拇医药
层析前
1.0×
-
-
±
-
-
+
0.5×
-
-
-
±
-
, 百拇医药
+
0.25×
-
-
-
-
-
-
G75
1.0×
-
±
-
-
, http://www.100md.com
+
+
0.5×
-
-
-
-
-
-
0.25×
-
-
-
-
, http://www.100md.com
-
±
2#
1.0×
-
-
±
+
+
0.5×
-
±
-
, 百拇医药
-
±
+
0.25×
-
-
±
+
±
3#
1.0×
±
-
, 百拇医药
-
±
+
0.5×
-
-
±
-
±
+
0.25×
-
-
, 百拇医药
-
-
±
+
3 中和LPS活性 结果显示,各样本均有不同程度中和内毒素活性,其中以3#最强;1A有一定中和能力,见图2。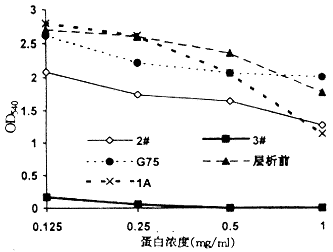
图2 各样本中和内毒素活性曲线
4 氨基酸组成
因为3#样品杀菌及中和LPS能力最强,因此选用3#样品测定其游离和非游离氨基酸,结果未见游离氨基酸吸收峰;以浓盐酸水解法测定非游离氨基酸,得到清晰的吸收峰,同时测量各种氨基酸组成,结果如下:天冬氨酸9.214%;苏氨酸4.752%;丝氨酸8.046%;谷氨酸12.774%;脯氨酸4.170%;甘氨酸10.472%;丙氨酸10.123%;缬氨酸7.594%;蛋氨酸0.795%;异亮氨酸3.050%;亮氨酸8.231%;酪氨酸1.739%;苯丙氨酸3.017%;组氨酸3.635%;赖氨酸8.731%;精氨酸3.657%。
, 百拇医药
5 血浆LPS水平
1A组和BP组的血LPS水平明显低于NS组(P<0.05),见图3。
图3 各组血LPS变化
6 血浆细胞因子活性
BP组对细胞因子的抑制作用较强,分别在不同时间点低于NS组,有显著性差异(P<0.05);1A只在一个时间点对IL-6有抑制作用(P<0.05),见图4~6。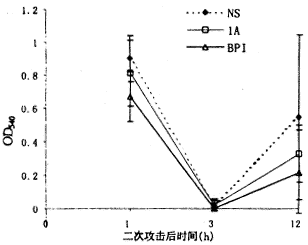
, 百拇医药
图4 各组血浆IL-1变化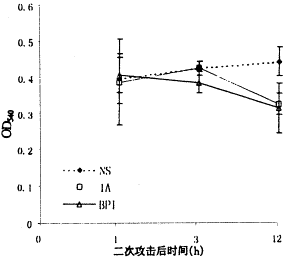
图5 各组血浆IL-6变化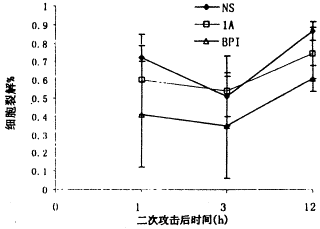
图6 各组血浆TNF变化
讨 论
BP是一种从中性粒细胞嗜天青颗粒分离的阳离子蛋白,它的分离和提纯主要是通过离子交换的方法。本实验使用分子筛分离的效果不佳,可能与所用的凝胶颗粒等级较低有关。离子交换层析是决定性技术,对照离子交换层析前后样本的电泳结果,BP对此方法比较合适。3#峰与其他峰比较,分离效果尚好,但在其前方仍存在一条弱带,分子量大约60KD,可能是一条杂蛋白带;另一方面,在氨基酸组成分析结果中也与以往文献稍有不同,可能是杂带影响,对此,国外也有不同氨基酸组成结果的报道,分子量从55KD,57KD和60KD等均有存在。
, http://www.100md.com
抗LPS单抗和BP的比较:在特异性抗炎症制剂的研究中,抗LPS单抗进入临床后未获成功。原因可能是免疫球蛋白、特别是IgM的非特异性结合力。抗LPS单抗存在特异性亲和能力有限,BP在以上项目具有优势。本实验中,BP组的多个细胞因子活性低于NS组,而抗LPS单抗对细胞因子的抑制作用明显不如BP。本实验通过纯化前后的各样品比较BP的杀菌和中和内毒素活性,3#峰均最高,表明其杀菌和中和作用同时兼备。由于这些基本特性,使BP具备较强的抑制TNF分泌及中性粒细胞补体受体的功能上调,同时封闭了LPS的释放;另外,BP与LBP的分子构型同源性很强,与LPB竞争性结合LPS和CD14,从而减弱其启动炎症反应的作用。
参考文献
1 Charles J,Fisher Jr,Zheng Yunli,et al.Potential strategies for inflammatory mediator manipulation: retrospect and prospect. World J Surg,1996,20(4)∶447
, http://www.100md.com
2 Marian NM, Craig G, Wilde,et al.Bactericidal permeability increasing protein has endotoxin neutralizing activity.J Immuno,1990,144(2)∶662
3 孙志贤.现代生物化学理论与研究技术.北京:军事医学科学院出版社,1995.366
4 方福德,周吕,丁濂,等.现代医学实验技巧全书.北京:北京医科大学中国协和医科大学联合出版社,1995.493
5 Ammons WS,Kohn FR ,Kung AHC.Protective effects of an N-terminal fragment of bactericidal permeability increasing protein in rodent models of gram-negative sepsis: role of bactericidal properties.J Inf Dis,1994,170(6)∶1473
(收稿:1998-02-20 修回:1998-12-21), 百拇医药
单位:(解放军总医院实验外科,北京 100853)
关键词:杀菌蛋白;脓毒症;内毒素;细胞因子;单克隆抗体
人粒细胞杀菌蛋白的制备与体内外鉴定 摘要 目的:制备与鉴定人类天然杀菌及通透性增强蛋白,寻找抗LPS新药。方法:自慢性粒细胞性增生患者全血提取人粒细胞杀菌蛋白(BP)。SDS-PEGE电泳测定分子量,水解法测定氨基酸组成,普通细胞菌培养检测对O111B4大肠杆菌的杀伤作用。体内鉴定采用腹腔脓毒症小鼠模型,与抗内毒素单克隆抗体1A比较。观察指标:血LPS使用定量的鲎试剂分析法。血细胞因子活性:IL-1采用小鼠胸腺细胞增值法;IL-6采用小鼠淋巴细胞系7TD1细胞增值法;TNF采用L929细胞溶解法。结果:得到55KD蛋白,具有杀菌和中和LPS特性。该蛋白体外中和LPS的能力强于1A。小鼠脓毒症模型血LPS水平:BP和1A组明显低于NS组(P<0.05)。血细胞因子活性:BP组的抑制作用较强,IL-1,IL-6和TNF活性均低于NS组,有显著性差异(P<0.05);1A只对IL-6有抑制作用(P<0.05)。结论:BP在阻断LPS和抑制炎症反应方面优于抗LPS单抗。
, 百拇医药
PURIFICATION AND CHARACTERIZATION OF HUMAN PROTEIN WITH
ENDOTOXIN-NEUTROLIZING AND BACTERICIDAL PROPERTIES
Zhang Haiying,Li Xinjian,Meng Xianjun
(Department of Experimental Surgery,General Hospital of PLA,Beijing 100853)
ABSTRACT OBJECTIVE:In search for new anti-LPS agent,an human protein with bactericidal and permeability-increasing proteins has been purified and characterized.METHODS:The human bactericidal protein(BP)was extracted from blood of patients with chronic myelocytic leukemia,and its molecular weight,amino-acid compositions,and bactericidal ability for E.coli O111B4 were determined by SDS-PEGE,hydrolysis,and co-culture with BP respectively.Its endotoxin-neutrolizing property was determined quantitatively by limulus amebocyte lysate test.Its in vivo characterization was conducted in model of NH1 male mice with abdominal infection in comparison with monoclonal antibody 1A.Activities of cytokines of IL-1,IL-6,and TNF for septic mice were measured by enhancing mitogenic response of thymocytes to Con A,IL-6-dependent murine hybridoma cell line 7TD1 and L929 cytolutic assay respectively.RESULTS:A 55KD protein with bactericidal and LPS-neutralizing properties was obtained.Its in vitro ability to neutralize LPS was stronger than that of 1A.The blood LPS level in 1A and BP groups was significantly lower than that of NS(P<0.05).BP was much stronger in in vivo and in vitro endotoxin-neutralizing ability than that of 1A.CONCLUSION:The results suggested that BP might be a more powerful anti-inflammatory agent in treatment of bacterial infections in comparison with anti-LPS antibodies.
, 百拇医药
KEY WORDS Bactericidal protein(BP);Sepsis;Endotoxin;LPS;Monoclonal antibody
用抗内毒素单克隆抗体治疗脓毒症已经进入Ⅲ期临床试验,没有获得预想的疗效[1]。杀菌及通透性增强蛋白(bactericidal and permeability increasing protein,BP)是另一种有希望的内毒素脂多糖(LPS)阻断剂。它与抗LPS单抗比较,与LPS的结合是化学性的。最近的动物实验和临床研究证明,它在中和LPS的特异性和亲和性上、以及控制炎性细胞因子等诸多方面优于单克隆抗体。为此,我们自行制备了人粒细胞杀菌蛋白,并对其杀菌和中和内毒素作用加以鉴定,现将结果报告如下。
材料与方法
1 主要仪器与试剂
慢性粒细胞增生患者全血(本院低温研究室提供);抗LPS单抗1A(IgM, 饱和硫酸铵沉淀纯化,本室制备) ;重组人IL-1,IL-6和TNF标准品(北京邦定生物公司);1640培养基(美国GIBCO公司);新生小牛血清(NBS,天津生物制品所);鲎试剂盒II型(购于上海医学化验研究所);低温层析冷柜(解放军军事医学科学院制造);葡聚糖凝胶SepHadex G75(40~120 μm,Pharmacia);CM50阳离子交换树脂(匈牙利产)。
, 百拇医药
2 动物
脓毒症模型采用NH1雄性小鼠,10周龄,ip O111B4大肠杆菌生理盐水悬液0.5ml,浓度为4.6×107~5.6×107个/ml (1/2 LD90),bid,q12h。
3 方法
3.1 分离纯化[2~4] ① 多核粒细胞的分离:慢性粒细胞增生患者全血加入梯度Ficoll液离心管中(含Ficoll上层16%,下层25%),1 500 r/min离心15 min,吸取下层,加3倍体积的4℃生理盐水,混匀后500 r/min离心8 min,弃上清液,共3次。② 多核粒细胞提取物的制备:以0.1 mol/L,pH 4.0醋酸钠稀释细胞浓度为2×106/ml,4℃恒温12 h,恒温摇床摇动频率60次/min,低温25 000 r/min离心30 min,留取上清液。③ 纯化:SepHadex G75柱(2.6 cm×78 cm),洗脱流速5 ml/h,以磷酸盐缓冲液淋洗,紫外检测仅有一个蛋白峰。再经CM50离子交换柱层析(2.6 cm×20 cm),使用0.1 mol/L,pH 5.0醋酸/醋酸钠缓冲体系,2.0 mol/L NaCl溶液连续梯度洗涤,收集到4个蛋白峰,按序编号为1#~4#。整个操作在4℃层析柜内进行。
, http://www.100md.com
3.2 分子量鉴定[4] CM50分离的各蛋白峰经SDS-PEGE电泳。
3.3 杀菌活性 O111B4大肠杆菌经普通琼脂平板培养,收集后以生理盐水洗3次,比浊法设定细菌初浓度为6×106/ml,10倍等比稀释6管;取层析前后各样品加入24孔板,初浓度为1.0 mg/ml,倍比稀释2次(1/2,1/4);每一蛋白浓度加入等比稀释的细菌悬液,每孔0.5 ml。37℃恒温2 h,各取10 μl接种于普通琼脂平板,37℃恒温12 h,记录菌落数。判断标准如下:与单纯载体(0.1 mol/L醋酸钠缓冲液,pH 7.0)比较,菌落数之比≥0.75为“-”,≤0.758“+”,≤0.50“++≤0.25“+++”,≤0.10“+++”。
3.4 中和LPS活性 使用鲎试剂盒II型,待测样品和稀释度同杀菌活性检测,与抗LPS单抗1A比较。
, 百拇医药
3.5 氨基酸组成[3] 6 mol/L盐酸水解,110℃恒温22 h,用BECKMAN 6300高效氨基酸分析仪测定。
3.6 治疗方案 脓毒症模型小鼠50只,随机分为3组,每组16~17只,各组分别给予:1A 1.0 mg,BP 0.1mg,生理盐水(NS),注射液体积0.5ml,均为每鼠剂量,于第一次攻击同时ip给药。
3.7 观察指标 血细胞因子活性及LPS水平定量分析。标本采集:每时间点每组6只小鼠,于第2次攻击后1,3,12 h采集3次血样。
3.7.1 血浆LPS水平 使用鲎试剂法,同上。
3.7.2 细胞因子活性检测[5] IL-1活性检测采用Con A协同的小鼠胸腺细胞增殖法:6周龄NH1小鼠胸腺,用200 μm钢网研磨,收集细胞悬液,1 000 r/min离心8 min,弃上清液,用生理盐水、Hank's液洗,各反复洗2次,以含10%NBS,ConA 0.1 μg/ml的1 640(完全配基)调整细胞浓度为6×105~7×105个/ml;向96孔细胞培养板内加入完全配基40 μl,第1孔加入标本40 μl,等倍稀释4孔,设无标本阴性对照,重组人IL-1作为阳性标准。标本加入完毕后,每孔添加完全配基100 μl,CO2培养箱内培养48 h,每孔加入2%MTT 40 μl,继续培养4~6 h,2 000 r/min离心20 min,弃上清液,每孔加入二甲基亚砜100 μl,20 min后在酶联仪上读取OD540。
, 百拇医药
IL-6活性检测采用IL-6依赖性小鼠淋巴细胞系7TD1细胞增值法:以含10%NBS的1640配基调整7TD1细胞浓度为5×105~6×105个/ml,以后步骤同IL-1。
TNF活性检测采用在放线菌素D增敏的L929细胞溶解法:以含10%NBS的1640(含ConA)完全配基调整L929细胞浓度为5×105~6×105个/ml,以后步骤同IL-1。最后将OD540值换算成细胞裂解百分比,公式为:
细胞裂解百分比(%)=(1-样本OD540/阴性对照OD540)×100%
4 统计方法
使用计算机统计软件SAS,利用方差分析计算各组细胞因子活性以及LPS水平的差异。
, 百拇医药
结 果
1 分子量
各蛋白峰经SDS-PEGE电泳,可见清晰的55KD电泳带,见图1。

1#~4#为各蛋白峰,箭头处为55KD电泳带,M为分子量标准
图1 SDS-PEGE电泳图谱
2 杀菌活性
与G75层析样本比较,CM50的2#和3#样本有较强的杀菌能力,见表1。
, 百拇医药
表1 样本的杀菌活性
样本
蛋白浓度
0.5 mg/ml
细菌浓度(数/ml)
6×106
6×105
6×104
6×103
6×102
6×101
, 百拇医药
层析前
1.0×
-
-
±
-
-
+
0.5×
-
-
-
±
-
, 百拇医药
+
0.25×
-
-
-
-
-
-
G75
1.0×
-
±
-
-
, http://www.100md.com
+
+
0.5×
-
-
-
-
-
-
0.25×
-
-
-
-
, http://www.100md.com
-
±
2#
1.0×
-
-
±
+
+
0.5×
-
±
-
, 百拇医药
-
±
+
0.25×
-
-
±
+
±
3#
1.0×
±
-
, 百拇医药
-
±
+
0.5×
-
-
±
-
±
+
0.25×
-
-
, 百拇医药
-
-
±
+
3 中和LPS活性 结果显示,各样本均有不同程度中和内毒素活性,其中以3#最强;1A有一定中和能力,见图2。

图2 各样本中和内毒素活性曲线
4 氨基酸组成
因为3#样品杀菌及中和LPS能力最强,因此选用3#样品测定其游离和非游离氨基酸,结果未见游离氨基酸吸收峰;以浓盐酸水解法测定非游离氨基酸,得到清晰的吸收峰,同时测量各种氨基酸组成,结果如下:天冬氨酸9.214%;苏氨酸4.752%;丝氨酸8.046%;谷氨酸12.774%;脯氨酸4.170%;甘氨酸10.472%;丙氨酸10.123%;缬氨酸7.594%;蛋氨酸0.795%;异亮氨酸3.050%;亮氨酸8.231%;酪氨酸1.739%;苯丙氨酸3.017%;组氨酸3.635%;赖氨酸8.731%;精氨酸3.657%。
, 百拇医药
5 血浆LPS水平
1A组和BP组的血LPS水平明显低于NS组(P<0.05),见图3。

图3 各组血LPS变化
6 血浆细胞因子活性
BP组对细胞因子的抑制作用较强,分别在不同时间点低于NS组,有显著性差异(P<0.05);1A只在一个时间点对IL-6有抑制作用(P<0.05),见图4~6。

, 百拇医药
图4 各组血浆IL-1变化

图5 各组血浆IL-6变化

图6 各组血浆TNF变化
讨 论
BP是一种从中性粒细胞嗜天青颗粒分离的阳离子蛋白,它的分离和提纯主要是通过离子交换的方法。本实验使用分子筛分离的效果不佳,可能与所用的凝胶颗粒等级较低有关。离子交换层析是决定性技术,对照离子交换层析前后样本的电泳结果,BP对此方法比较合适。3#峰与其他峰比较,分离效果尚好,但在其前方仍存在一条弱带,分子量大约60KD,可能是一条杂蛋白带;另一方面,在氨基酸组成分析结果中也与以往文献稍有不同,可能是杂带影响,对此,国外也有不同氨基酸组成结果的报道,分子量从55KD,57KD和60KD等均有存在。
, http://www.100md.com
抗LPS单抗和BP的比较:在特异性抗炎症制剂的研究中,抗LPS单抗进入临床后未获成功。原因可能是免疫球蛋白、特别是IgM的非特异性结合力。抗LPS单抗存在特异性亲和能力有限,BP在以上项目具有优势。本实验中,BP组的多个细胞因子活性低于NS组,而抗LPS单抗对细胞因子的抑制作用明显不如BP。本实验通过纯化前后的各样品比较BP的杀菌和中和内毒素活性,3#峰均最高,表明其杀菌和中和作用同时兼备。由于这些基本特性,使BP具备较强的抑制TNF分泌及中性粒细胞补体受体的功能上调,同时封闭了LPS的释放;另外,BP与LBP的分子构型同源性很强,与LPB竞争性结合LPS和CD14,从而减弱其启动炎症反应的作用。
参考文献
1 Charles J,Fisher Jr,Zheng Yunli,et al.Potential strategies for inflammatory mediator manipulation: retrospect and prospect. World J Surg,1996,20(4)∶447
, http://www.100md.com
2 Marian NM, Craig G, Wilde,et al.Bactericidal permeability increasing protein has endotoxin neutralizing activity.J Immuno,1990,144(2)∶662
3 孙志贤.现代生物化学理论与研究技术.北京:军事医学科学院出版社,1995.366
4 方福德,周吕,丁濂,等.现代医学实验技巧全书.北京:北京医科大学中国协和医科大学联合出版社,1995.493
5 Ammons WS,Kohn FR ,Kung AHC.Protective effects of an N-terminal fragment of bactericidal permeability increasing protein in rodent models of gram-negative sepsis: role of bactericidal properties.J Inf Dis,1994,170(6)∶1473
(收稿:1998-02-20 修回:1998-12-21), 百拇医药