提高药品审评水平 保障人民用药安全有效——在1999年第一次全国药品审评会议上的讲话
作者:郑筱萸
单位:国家药品监督管理局,北京 100810
关键词:
中国新药杂志990801
我国的新药审批工作自1985年集中由卫生部审批,到1998年8月19日归入国家药品监督管理局审批以来,已有14个年头。审评工作从原来简单粗放式的行政规定管理逐步过渡到通过国家法律、法规进行的科学化法制化管理。
原卫生部药政局建立的一整套法规和技术指导原则,经过实践现正在国家药品监督管理局领导下,逐步进行修订与补充。原4届审评委员会已圆满完成任务。国家药品监督管理局组建了药品审评专家库:第一批专家591名,其中化学药品专家262名,中药专家212名,生物制品专家117名。1996~1998年对全国26个省、市、自治区申报的临床药理基地(105个医院,21个研究所,553个专业)进行了考核,第一、二批81个医院378个专业被批准,第三批6个医院112个专业正待批准,他们将按GCP的统一要求,在我国新药审评中发挥重要的作用。
, 百拇医药
我国新药(西药)申报情况和现状
1 14年来,我国受理新药和批准新药(临床和生产)情况
从图1中看出新药申报的数量呈直线上升趋势,与1985年相比增加了近百倍。批准生产的新药数量亦呈直线上升趋势,与1986年相比增加了50多倍。说明自1985年新药审评和审批工作从地方集中到中央以来,无论是申报新药数量或批准生产的数量,均是惊人的和令人鼓舞的。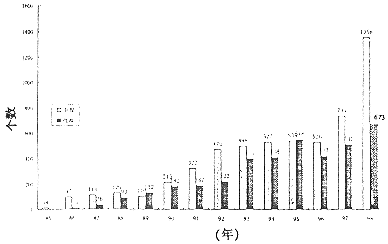
图1 1985~1998年我国受理新药(西药)和批准新药情况
2 近5年来各类新药(西药)申报情况
表1显示:近5年内申报新药总量共达3 678个,1997年和1998年2年申报量约达2 090个,约占5年总量的57%,仅1998年1年申报量占5年总量的37%。从数量上看,四类药居第1位,5年总量达2 159个左右,二类药居第2,5年总量达756个左右。从增长速度上看,近3年一类新药申报相对增长较快。
, 百拇医药
表1 近5年各类新药(西药)申报情况 年份
类 别
总计
一
二
三
四
五
1994
13
134
81
294
, http://www.100md.com
5
527
1995
27
132
96
275
5
535
1996
28
104
71
, 百拇医药 310
13
526
1997
33
162
112
426
1
734
1998
53
224
205
, 百拇医药
854
20
1356
合计
154
756
565
2 159
44
3678
近3年申报的一类药共有8大类:抗肿瘤药14个(3个),内分泌系统用药8个(4个),心脑血管用药11个(5个),消化及肝炎用药6个(3个),驱虫药3个(2个),抗感染药6个(5个),放射性药4个,其他8个(2个),其中括号内为国外公司来中国申报的一类药,占申报化学合成的一类新药的40%,国产一类药有一大部分是从动物中提取的生化药。
, http://www.100md.com
3 近5年来批准各类新药(生产+临床)情况
从表2中可以显示:① 5年总计批准新药生产约2 065个。四类药最多,占5年总量60%以上,二类药第2,三类药第3。② 进口原料药作制剂是一条新药开发途径,尤其国内急需但原料药尚未能生产的品种,将国外原料药进口到中国制备制剂,可降低成本。表2 近5年卫生部批准新药(生产+临床)类别情况 年份
类 别
进口原料药作制剂
批临床数
批临床+批生产
一
二
三
, http://www.100md.com
四
五
总计
1994
18
50
19
207
8
302
71
106
408
1995
, http://www.100md.com
7
137
37
262
2
445
80
103
548
1996
7
81
25
204
, http://www.100md.com
15
332
141
85
417
1997
14
75
49
274
9
421
63
, 百拇医药 86
507
1998
20
126
28
386
5
565
25a
108
673
合计
, 百拇医药
66
469
158
1 333
39
2 065
488
2 553
a:1998年8月19日后由国家药品监督管理局批准;根据卫生部批准新药品种公报
4 药审中心受理新药品种情况
这几年来,药审中心复审后,发出的补充资料相当多,申报资料离具体技术要求还有一段距离。
, http://www.100md.com
表3 4年来药审中心受理新药情况(按收审号计) 年份
一临
一生
二临
二生
三临
三生
四临
四生
五临/五生
总计
补充
补充/收审
, 百拇医药
1995
21
6
73
59
45
51
7
268
5
535
433
81%
1996
, 百拇医药
13
15
59
45
35
36
4
306
13
526
421
81%
1997
24
, http://www.100md.com
9
118
45
67
44
35
391
1
734
419
57%
1998
51
2
, 百拇医药
159
65
152
53
23
831
10/10
1356
432
a
临:申请新药临床研究(临床验证);生:申请新药生产;补充:收理补充资料;a:因只限1998年6月前受理品种,不能相对统计。
申报及审评中存在的问题
, 百拇医药
1 我国的新药研制以仿制为主
我国新药的研制中,二类、三类、四类绝大部分均为仿制药,近5年中申报的新药中仿制药占96%以上(包括改剂型药)。仅1996,1997两年批准的新药97%以上是仿制药和改剂型药,所以创新药极少,品种更少。
2 低水平重复
由于我国原申报要求中规定,凡第1家申报单位尚未得到批准其新药,那么其他研制该新药的任何单位均可申报。因此,同时申报同一品种的厂家很多:如在审评第一、二、三代喹诺酮类抗生素过程中,前来备案或申报的竟达280多家;国内仿制含有伪麻黄碱的复方制剂(美国作为抗感冒OTC药)的厂家达60多个;大环内酯类抗生素有120多家申报。
1997年后重复品种面更大,涉及到抗过敏药、心血管用药等。药审中心的备案中近60%以上为已批准生产的品种,有的甚至一个城市就有3~4家同时申报同一品种。
, 百拇医药
3 新药研制上立题依据不足
3.1 缺乏国内外近期临床评价 这一条在审评中非常关键,即使国外最新药典上有收载,若国际上无近10年文献报道,也较难审评通过,如:噻唑烷酸,日本12版(最新版)药局方已收载,但经检索无近10年的有关文献报道,消化药物专业委员会临床专家们认为,目前临床上疗效不定,审评通不过。
3.2 缺乏对药物作用机制的周密考虑 目前,心血管疾病用药,有的研制单位设想作成缓释剂型,在我国心血管疾病用药尤其高血压患者用药大多数均因人而异,趋于“个体化”,有些药物本身体内半衰期比较长,没必要作成缓释剂型,如:抗高血压药某转换酶抑制剂,临床上按常规6.5~12.5 mg/d,分2次服就能维持血压正常。据临床监测,该药对抑制酶作用可维持24h。因此,药物在体内抑制作用强度不完全取决于血药浓度,也即不能仅从人体生物利用度反映出来,但是前来申报的药制成了37.5 mg/片缓释片,并仍须日服2次,从药物本身作用机制讲,作成此类剂型无意义,与普通片相比,又无任何特点,使Cmax更高,还可能造成更多不良反应,所以,类似此类药物研究剂型花了很大力气,但达不到预期效果。又如:抗生素类药作用对象是细菌、真菌、病毒,而不象其他药物作用于机体、细胞组织、受体等。国内有些抗生素类药物专家认为任何一种抗菌药物应一次性打击作用对象,一般情况不适宜作成缓释制剂,尤其是作成缓释剂型后控释浓度在该药MIC以下,虽然与普通片比能达到生物等效,但由于在最低抑菌浓度以下,慢慢释放反而造成诱导耐药菌产生。
, http://www.100md.com
又如:选用美国药典(22版)己收载的乙酰水杨酸缓冲剂,从选题看有一定的依据。因乙酰水杨酸(阿司匹林)对胃有刺激,在处方中加入弱酸弱碱组成的缓冲系统局部降低酸度,减少刺激性。但是,从文献报道看缓冲系统组成五花八门,有的甚至造成吸收量(AUC)比普通片增加很多。另一方面,由于缓冲系统使吸收环境由呈酸性转成碱性,尿液被碱化,反而加快乙酰水杨酸的排泄。因此,在研究该类药物制剂时必须详细研究多次给药人体生物利用度的稳态分布情况,否则很难通过该缓释剂型的申请,亦很难确定今后临床上使用剂量。
又如:喹诺酮类药物主要作用机制是抑制细菌DNA合成从而抑制细菌生长。有的喹诺酮类药物主要作用在G-菌,其本身无抗真菌作用且水溶性差,做成制剂酸度较强,对皮肤刺激性很强。因此,该类药物申请抗真菌外用药是极其不合理的,是选题上的严重错误。
3.3 不注意药物不良反应,不考虑使用对象 氨基糖苷类药物,对耳、肾有一定毒性,尤其这一类药物中新霉素的不良反应最大,但有的研制单位把它混在辅料中作儿童扑粉,治疗尿湿症。由于药物可通过粘膜而被吸收,尤其婴儿粘膜吸收更快,一旦造成耳聋后果不堪设想。
, 百拇医药
又如:非甾体类抗炎药加上胃粘膜保护剂,试图克服非甾体类药胃肠道不良反应,而组方结果反而引起严重腹痛、腹泻等不良反应。
3.4 复方制剂合理性差 复方制剂使药物服用量比单方低,复方中各活性成份起到互补、增强作用,减少不良反应,这是一条研制途径。但新药必须有详细具体试验数据来证明,以达到合理的结论。如:抗生素类药,有的研制单位将抗G-和G+菌抗生素组成复方,从表面看复方组成了广谱抗生素,但是对患者并不合理,由G-致病菌引起感染的患者没必要服用抗G+菌抗生素,同时,也造成了体内菌群混乱,助长耐药菌的产生。
盐酸普鲁卡因和利多卡因组成的复方麻醉药:从疗效评价,所组成的复方没有超过单方利多卡因;从不良反应评价,盐酸普鲁卡因本身过敏反应仍未克服,并且已逐步趋于淘汰。就整个临床麻醉来看,一般均“个体化”给药。因此,复方研究必须注意整体发展趋势,注意咨询专家(复方制剂不合理性造成退审的例子很多,待以后专题分析)。
, 百拇医药
3.5 缺乏与现有已上市相同适应证的药物横向比较,无特点 如:1993年“沙星热”(喹诺酮类药物),其原料药和制剂280多家来申报;1994年和1995年“伪麻热”(其为美国含伪麻黄碱复方抗感冒的OTC药),近60多家申报;1996年大环内酯类抗生素申报者有200多家。但并不是所有品种均有特点,如沙星类(喹诺酮类药物)按发现先后分为第一代、第二代、第三代产品,但不等于第二代比第一代好,第三代比第二代强。某研制单位研制了第三代产品,但经横向比较抗菌作用没有比第一代强,毒性反应却有所增加。
3.6 选用药物特点与其申报资料中结果数据不吻合 将某药物由片剂改成口服乳剂,预期目的是提高生物利用度,但申报资料结果却与普通片剂生物利用度等效;某一生化药品预期目的是治疗中、重症慢性支气管炎,但申报资料中对该病症常见咳、痰、喘、炎等观察指标评价结果却为阴性。因此,一定要把研制药物的治疗特点定位,定位后试验数据指标要作出来。
3.7 其他 某些申报药物稳定性差、有效期短、包装运输条件苛刻,很难成为特殊商品。仿制国外现成处方,处方不适合我国患者。口服途径改成注射途径,经常在毒性和质控上出现问题。
, 百拇医药
4 申报资料重复性太高
由于我国同一品种研究有时分散在很多研制单位,具体工作各自进行,所以,申报资料中虽然数据略有差别,但结果是一致的,因而,造成很多不必要的重复劳动。如:对氧氟沙星、环丙沙星原料药各自共作了10多个LD50,10多个药效学研究,其结论完全是一致的。因此,联想到在我国设立DMF(Drug Master File)的必要性,如:有几家前来申报洛美沙星注射液,该类药物偏酸性才能溶解,因此,肌注刺激性很大,一般均做成静脉用注射剂,但该类药物对光很不稳定,光解后产生降解物,据文献报道该降解物有一定毒性,因此,必须了解光解后产物的毒性情况,第1家研制单位在这方面作了详细的研制工作,提取了光解后产物,专门做了毒性试验,所以这份资料可以进入DMF中,其他申请生产洛美沙星注射液的单位需要这份申报资料,只要经研制单位同意后即可从DMF中调出,这样避免了重复审评,节约了时间、人力、财力。
5 申报技术资料不符合目前规定的对技术的基本要求
, 百拇医药
5.1 药学方面
5.1.1 结构确证完成不好 新药结构确证主要手段是用元素分析和色谱测定(红外、紫外、核磁共振、质谱)。由于仪器性能差,分辨率低,达不到结构确证的目的;测试结果的图谱上找不到质子、分子碎片、基团等的相应归属,因此很难定出结构。在红外光谱测定的结果图谱中尤其指纹区(800~1 800 nm),坐标很密,由于除光学异构体及长链烷烃同系物外几乎没有2种化合物在红外吸收图谱指纹区是相同的,所以,这个区域的结果判断结构很关键,但是往往在申报资料中这一段没有完成好。在紫外分光光度测定中,主要是利用化合物结构中分子轨道上电子的能级跃迁所产生的吸收光谱,由于溶剂pH不同,使吸收波长向长波方向或短波方向位移产生红移或蓝移效应,所以,要求在酸性、碱性及中性3种溶剂中进行测定,但往往申报资料中只完成1种溶剂测定即交卷。在核磁共振谱测试中往往漏测了有利于结构分析的活泼氢的存在。在质谱测定中没有测到分子离子峰,也没有对裂解图进行分析。高分辨质谱有时可代替元素分析,但对含结晶水分子结构,高分辨质谱仅能说明有结晶水,不能定量显示结晶水数,所以仍须进行元素分析,近来发现元素分析经常漏测卤族元素F,Cl等。所测元素结果比理论值计算>0.3%,因此须引起注意。结构确证中忽略的另一个最大问题是对照品选择。对照品须可靠可信,来源清楚,得到公认,质控严格。近期又发现晶型问题较多,许多物质由于晶型不同,人体生物利用度差别很大,因此必须重视这方面研究,创新药应尽量进行单晶-X射线衍射。
, 百拇医药
5.1.2 生产工艺资料不完善,处方组成问题较多 生产工艺中须有详细试制路线,尤其末步的精制方法,各步的反应条件和中间体的质控应尽量以文献值为对照,但申报资料往往不完善,不详细,甚至各步中间体无质控指标。制剂中处方组成依据不足,所采用辅料来源不清,或无药用规格标准,或局部用药辅料量简单地移植到全身用药辅料量,所加辅料作用用途不明,尤其复方制剂的处方存在问题较多。主要有:① 组方中存在毒性较大物质;② 组方中主活性成分为地方标准,但经查阅药效不定;③ 组方中某活性物质未作过该组方形成的剂型,如:A,B,C组成的复方制剂,其中地方标准主活性成分A原作为注射剂,现作为复方中一活性成分,却又作成了片剂,口服途径药效无试验和数据证明;④ 药物本身不宜做成某剂型。如:氨基糖苷类抗生素对腹泻很有效,其在胃、肠内主要通过局部的直接作用。但研制单位设想制成口含片,通过粘膜吸收,作用于全身;⑤ 组方中活性成分在国际上已走下坡路,不良反应大;⑥ 组方中各组分剂量高于单方剂量,有的甚至高于药典对该品种规定量的数倍;⑦ 处方中某些组分含量极低,难以控制均匀度;⑧ 组方中加入质量不明香料。
, 百拇医药
由于以上种种原因,对复方制剂退审较多。
5.1.3 新药研制中对质量标准把握不严
5.1.3.1 关于溶出度测定中溶出量的计算 一般此方法与含量测定方法一致,但有的含测方法(微生物测定法)太复杂,需要重新筛选,可采用快速简便化学显色法,但申报资料中经常缺少方法学筛选资料。难溶性物质溶出介质选择亦存在问题,有的甚至过多地加入有机溶媒,缺少选择依据。溶出度测定中普遍存在的另一问题是对均一性试验方法不明确,其要求用同一批样品作一次试验(6杯6片),记录规定时间间隔溶出情况,数据列表作图,分析一批6片均一性情况。在这项测定中还忽视了一个重要问题,即溶出量的限度考察至少达到标示量的90%以上,对溶出数据的统计学处理应要求每个时间点即片与片溶出量之间的标准差<5%,但往往申报资料仅考察到70%,无计算标准差。
5.1.3.2 有关物质的检查 某些药物不稳定,遇光、热、湿易分解;有的在合成中未反应完全的中间体带入最终产品,有的在合成过程中产生副产物,如异构体,甚至有的杂质活性恰恰相反,如:枸橼酸他莫昔芬,有E型和Z型二种构型,Z型是研究的抗癌药物,E型却是工艺中带来的致癌杂质,所以对有关物质必须严格控制,但是申报资料对控制方法学未进行详细研究,以至方法的灵敏度、专属性、重复性无数据或无可靠结论。因方法不可靠,有关物质的检查结果就不能说明问题。
, 百拇医药
对合成工艺中所采用的有机溶媒,在最终产品中进行残留溶剂的检查须引起重视,检查方法须注意要有一定的对检出溶剂灵敏度以及相应标准品。
5.1.3.3 关于含量测定 本项是质量标准中核心部分,主要问题亦是方法学考核问题。尤其是专属性方面存在问题较多,某些药物须规定主药与临近主杂质达到一定的分离度;另一个主要存在问题是对照品无详细来源又无严格的质控指标,有的甚至用常数E值来进行紫外分光光度测定。
5.1.3.4 关于有效期 必须根据室温留样考察结果。忽视注意考察模拟上市的包装。
5.1.4 关于药物的稳定性研究 对本项研究目的不清,仅按技术指导原则机械完成,尤其对降解产物考察方法其灵敏度、分离度均无考核,亦无图谱,考核指标不齐全,尤其对降解产物检查不认真,不具体更无相应的有关结果图谱。有的甚至考核注射液在75%,95%湿度下的稳定性;有的对光的稳定性考察机械化按指导原则2 000~4 000Lx表示,无具体光照度数据,对具体情况缺乏具体分析;原料药和制剂稳定性考核相脱离,原料药考核结果未提供制剂工艺、包装、运输、储存的依据。
, 百拇医药
5.2 药理方面 新药一般药理研究试验中主要存在的问题:① 没采用拟推荐临床应用的给药途径;② 所试药物剂量低于起主要药效作用的剂量;或仅采用1个剂量(按常规应选择产生主要药效作用的2~3个剂量);③ 未设相应溶剂对照组。
5.3 药效学方面 新药的主要药效学考察必须用2种模型2个途径,其中一个途径应采用拟推荐的临床用药途径,剂量至少3~5个,每剂量至少5~10只动物。试验中存在主要问题:① 模型与拟临床用适应证不一致或根本未正确选用模型,或模型尚未得到公认;② 给药途径与拟临床推荐给药途径不一致,如:临床用为口服途径,药效学试验却静脉注射;③ 阳性对照药选的不对,如考核一个新药减轻脑水肿功能,对照品用某某地平,但该对照药的适应证尚未经过审评,也未经行政部门批准认可;④ 试验结果无量效关系,甚至结果颠倒,并未进行详细分析;⑤ 新药及阳性对照药剂量的确定不慎重,资料中无给药依据,各剂量之间距无适当的理由;⑥ 观察指标不正确或不全面,如:申报免疫抑制剂新药却未测试佐剂性关节炎,大鼠免疫功能和细胞因子变化的各项指标;⑦ 抗生素药物研制中缺少近一、二年临床分离菌的药敏试验结果。
, 百拇医药
5.4 毒理学方面 试验中存在的问题:
5.4.1 实验设计不合理 如一个一类药用不同种族动物来进行长毒试验,采用相同的剂量及其剂距进行,试验结果大鼠和犬未发现毒性,但在猴身上发现严重毒性反应,因此应考虑可能是大鼠和犬剂量设定不合理。一般尚须考虑人与动物剂量参数(如有的专家认为大鼠为1∶7;猴为1∶1.5左右)。
5.4.2 受试剂量偏低和试验动物数量不够 长毒试验剂量分为低、中、高三组,低剂量应高于整体动物最佳用药剂量(在此剂量下动物应不出现毒性反应,属基本安全剂量)。高剂量应使动物产生明显的或严重的毒性反应,或个别动物死亡。但是往往在申报资料中出现低剂量比起主要药效作用剂量还低,所谓高剂量动物仍无毒性反应,更找不到毒性靶器官。
5.4.3 给药方法与临床用药途径不一致 临床用药途径为静注,长毒试验却用了口服途径。
, http://www.100md.com 5.4.4 检测项目不全 尤其是关键性指标,如血液学指标,血液生化指标等。
5.4.5 未进行恢复期观察 最后一次给药后24h,将动物全部活杀,检测各项指标,但未留下部分动物继续观察2~4周,再活杀检查了解毒性反应的可逆程度和可能出现的延迟毒性反应。
5.4.6 给药剂量单位不统一,同一试验药物,剂量单位不统一 在同一申报药物的动物试验上用了u/kg,μg/kg,u/只,u/ml等单位,造成全面正确地评价一个药困难。
6 临床试验方面的问题
6.1 一期临床试验中主要存在问题 目的:确定可用于临床的安全药效剂量及合理给药方案,是在人体进行新药试验的起始期。包括药物的耐受性试验与药代动力学、生物利用度研究。
6.1.1 在耐受性试验中主要存在问题 给药剂量不合适。给药剂量应由有经验的临床药理研究人员和临床医生参考动物实验的剂量(如半数有效量,半数致死量和慢性毒性剂量以及药代动力学参数等)估计一个预测剂量,然后以预测量的分数(一般<1/10)
, 百拇医药
为人用起始剂量。国际上常用Blach well法:初试剂量不超过最敏感动物LD50或最小有效剂量的1/600或最小有效剂量的1/60;改良Blach well法:2种动物LD50的1/600及2种动物长毒试验中出现毒性剂量1/60这四者中取其最低量;Dollery法:最敏感动物的最有效剂量的1%~2%及同类药物临床治疗量的1/10。
对有明显活性(药理作用)起始剂量更低些。试验设计方面还要注意单人单次原则及逐步递增原则。此外耐受性试验结论应为确定可耐受的最大剂量出现毒性反应的最小剂量。
申报资料中初试剂量最大试验剂量设置无依据。预计最大耐受量时一般以临床应用该类药物单次最大剂量、用动物在长毒试验中引起功能或脏器可逆性损害的剂量的1/10或动物最大耐受量的1/5~1/2。
6.1.2 药代动力学研究中主要存在问题 生物标本测定方法缺少灵敏度、专属性、重复性、回收率、线性范围等试验数据;参比制剂的选择不规范;药代参数不全或参数分析不全面,未能详尽介绍体内过程,甚至有的一类药总排泄量仅为10%,90%量趋向不明,对代谢产物也缺少分析。
, http://www.100md.com
6.1.3 生物利用度试验中经常存在问题 如① 对试验的目的不够清楚。生物利用度试验目的是确定药品体内释放行为,以及这种行为是否受食物的影响;提供体内药物的吸收模型和建立体内吸收与体外溶出度相关性,为控制制剂质量提供依据。缓释制剂多剂量连续给药试验目的是了解缓释制剂血药浓度的波动程度,并进一步考察其生物利用度。② 参比制剂选择不当。应选择药典收载品种列入部颁标准的已上市公认或国外相同剂型的品种及药物的水溶液或混悬液等条件选择参比制剂。③ 采集生物标本的频度不够。一般要求时间至少3~5个半衰期,若半衰期未知应持续到血药峰浓度的1/10~1/20。
缓释制剂的多剂量给药,一定要在稳态时测血药浓度,一般情况下,口服给药进行血药浓度测定时,在吸收相及平衡相各采样2~3次,在消除相采样至少4~10次。
6.2 二期临床试验中主要存在问题
6.2.1 临床方案制定与临床试验实践不符合
, 百拇医药
6.2.2 试验中诊断标准无依据、不明确或无严格执行 如细菌阳性率等问题。
6.2.3 受试者选择不当 ① 儿童、老年人、孕妇、哺乳期妇女、依从性差者不能入选;② 应排除或剔除的病例未排除或剔除。
6.2.4 试验设计方法不清 ① 随意分组而不是随机分组,应符合随机表要求;② 不设对照组或无自身对照(如抗高血压药);③ 非正确的双盲试验,仅把两药物编号而未从外形、药味改建对照药或进行双模拟方法。
6.2.5 对照药选择不当 ① 对照药疗效不肯定,地方标准品种,国际上走下坡品种;② 对照药适应证与试验药不完全符合,如抗菌药一定要选择抗菌谱相同或接近抗菌药;③ 西药用中药作对照;④ 医院制剂作对照药;⑤ 同一药品临床试验中,各试验医院无统一对照药;⑥ 联合用药中,基础治疗各不相同;⑦ 对照药和试验药作用机制差别大,如抗过敏药试验药为白三烯拮抗剂而对照药却选用选择性β2-受体拮抗剂。
, 百拇医药
6.2.6 观察项目不完善,尤其主要观察项目 如:抗乙肝药物缺乏病毒血清学检查(必要时必须做肝活检病理观察);平喘药未做肺功能测定;抗感染药不做细菌学培养及转阴率、清除率计算;抗溃疡药缺乏胃镜检查;对不良反应观察与动物长毒试验结果相脱离等。
6.2.7 无可比性分析,或分析方法错误
6.2.8 随机对照试验结果与开放观察资料混在一起 试验组+开放组与对照组进行可比性分析;试验组+开放组与对照组进行疗效分析。
6.2.9 混淆了2种不良反应数据 不良反应发生人数/观察人数;不良反应按症状发生例次/观察人数。
6.2.10 总总结与分总结脱节 无统一标准;病例数不吻合;判断标准有差距。
(收稿:1999-05-30), 百拇医药
单位:国家药品监督管理局,北京 100810
关键词:
中国新药杂志990801
我国的新药审批工作自1985年集中由卫生部审批,到1998年8月19日归入国家药品监督管理局审批以来,已有14个年头。审评工作从原来简单粗放式的行政规定管理逐步过渡到通过国家法律、法规进行的科学化法制化管理。
原卫生部药政局建立的一整套法规和技术指导原则,经过实践现正在国家药品监督管理局领导下,逐步进行修订与补充。原4届审评委员会已圆满完成任务。国家药品监督管理局组建了药品审评专家库:第一批专家591名,其中化学药品专家262名,中药专家212名,生物制品专家117名。1996~1998年对全国26个省、市、自治区申报的临床药理基地(105个医院,21个研究所,553个专业)进行了考核,第一、二批81个医院378个专业被批准,第三批6个医院112个专业正待批准,他们将按GCP的统一要求,在我国新药审评中发挥重要的作用。
, 百拇医药
我国新药(西药)申报情况和现状
1 14年来,我国受理新药和批准新药(临床和生产)情况
从图1中看出新药申报的数量呈直线上升趋势,与1985年相比增加了近百倍。批准生产的新药数量亦呈直线上升趋势,与1986年相比增加了50多倍。说明自1985年新药审评和审批工作从地方集中到中央以来,无论是申报新药数量或批准生产的数量,均是惊人的和令人鼓舞的。

图1 1985~1998年我国受理新药(西药)和批准新药情况
2 近5年来各类新药(西药)申报情况
表1显示:近5年内申报新药总量共达3 678个,1997年和1998年2年申报量约达2 090个,约占5年总量的57%,仅1998年1年申报量占5年总量的37%。从数量上看,四类药居第1位,5年总量达2 159个左右,二类药居第2,5年总量达756个左右。从增长速度上看,近3年一类新药申报相对增长较快。
, 百拇医药
表1 近5年各类新药(西药)申报情况 年份
类 别
总计
一
二
三
四
五
1994
13
134
81
294
, http://www.100md.com
5
527
1995
27
132
96
275
5
535
1996
28
104
71
, 百拇医药 310
13
526
1997
33
162
112
426
1
734
1998
53
224
205
, 百拇医药
854
20
1356
合计
154
756
565
2 159
44
3678
近3年申报的一类药共有8大类:抗肿瘤药14个(3个),内分泌系统用药8个(4个),心脑血管用药11个(5个),消化及肝炎用药6个(3个),驱虫药3个(2个),抗感染药6个(5个),放射性药4个,其他8个(2个),其中括号内为国外公司来中国申报的一类药,占申报化学合成的一类新药的40%,国产一类药有一大部分是从动物中提取的生化药。
, http://www.100md.com
3 近5年来批准各类新药(生产+临床)情况
从表2中可以显示:① 5年总计批准新药生产约2 065个。四类药最多,占5年总量60%以上,二类药第2,三类药第3。② 进口原料药作制剂是一条新药开发途径,尤其国内急需但原料药尚未能生产的品种,将国外原料药进口到中国制备制剂,可降低成本。表2 近5年卫生部批准新药(生产+临床)类别情况 年份
类 别
进口原料药作制剂
批临床数
批临床+批生产
一
二
三
, http://www.100md.com
四
五
总计
1994
18
50
19
207
8
302
71
106
408
1995
, http://www.100md.com
7
137
37
262
2
445
80
103
548
1996
7
81
25
204
, http://www.100md.com
15
332
141
85
417
1997
14
75
49
274
9
421
63
, 百拇医药 86
507
1998
20
126
28
386
5
565
25a
108
673
合计
, 百拇医药
66
469
158
1 333
39
2 065
488
2 553
a:1998年8月19日后由国家药品监督管理局批准;根据卫生部批准新药品种公报
4 药审中心受理新药品种情况
这几年来,药审中心复审后,发出的补充资料相当多,申报资料离具体技术要求还有一段距离。
, http://www.100md.com
表3 4年来药审中心受理新药情况(按收审号计) 年份
一临
一生
二临
二生
三临
三生
四临
四生
五临/五生
总计
补充
补充/收审
, 百拇医药
1995
21
6
73
59
45
51
7
268
5
535
433
81%
1996
, 百拇医药
13
15
59
45
35
36
4
306
13
526
421
81%
1997
24
, http://www.100md.com
9
118
45
67
44
35
391
1
734
419
57%
1998
51
2
, 百拇医药
159
65
152
53
23
831
10/10
1356
432
a
临:申请新药临床研究(临床验证);生:申请新药生产;补充:收理补充资料;a:因只限1998年6月前受理品种,不能相对统计。
申报及审评中存在的问题
, 百拇医药
1 我国的新药研制以仿制为主
我国新药的研制中,二类、三类、四类绝大部分均为仿制药,近5年中申报的新药中仿制药占96%以上(包括改剂型药)。仅1996,1997两年批准的新药97%以上是仿制药和改剂型药,所以创新药极少,品种更少。
2 低水平重复
由于我国原申报要求中规定,凡第1家申报单位尚未得到批准其新药,那么其他研制该新药的任何单位均可申报。因此,同时申报同一品种的厂家很多:如在审评第一、二、三代喹诺酮类抗生素过程中,前来备案或申报的竟达280多家;国内仿制含有伪麻黄碱的复方制剂(美国作为抗感冒OTC药)的厂家达60多个;大环内酯类抗生素有120多家申报。
1997年后重复品种面更大,涉及到抗过敏药、心血管用药等。药审中心的备案中近60%以上为已批准生产的品种,有的甚至一个城市就有3~4家同时申报同一品种。
, 百拇医药
3 新药研制上立题依据不足
3.1 缺乏国内外近期临床评价 这一条在审评中非常关键,即使国外最新药典上有收载,若国际上无近10年文献报道,也较难审评通过,如:噻唑烷酸,日本12版(最新版)药局方已收载,但经检索无近10年的有关文献报道,消化药物专业委员会临床专家们认为,目前临床上疗效不定,审评通不过。
3.2 缺乏对药物作用机制的周密考虑 目前,心血管疾病用药,有的研制单位设想作成缓释剂型,在我国心血管疾病用药尤其高血压患者用药大多数均因人而异,趋于“个体化”,有些药物本身体内半衰期比较长,没必要作成缓释剂型,如:抗高血压药某转换酶抑制剂,临床上按常规6.5~12.5 mg/d,分2次服就能维持血压正常。据临床监测,该药对抑制酶作用可维持24h。因此,药物在体内抑制作用强度不完全取决于血药浓度,也即不能仅从人体生物利用度反映出来,但是前来申报的药制成了37.5 mg/片缓释片,并仍须日服2次,从药物本身作用机制讲,作成此类剂型无意义,与普通片相比,又无任何特点,使Cmax更高,还可能造成更多不良反应,所以,类似此类药物研究剂型花了很大力气,但达不到预期效果。又如:抗生素类药作用对象是细菌、真菌、病毒,而不象其他药物作用于机体、细胞组织、受体等。国内有些抗生素类药物专家认为任何一种抗菌药物应一次性打击作用对象,一般情况不适宜作成缓释制剂,尤其是作成缓释剂型后控释浓度在该药MIC以下,虽然与普通片比能达到生物等效,但由于在最低抑菌浓度以下,慢慢释放反而造成诱导耐药菌产生。
, http://www.100md.com
又如:选用美国药典(22版)己收载的乙酰水杨酸缓冲剂,从选题看有一定的依据。因乙酰水杨酸(阿司匹林)对胃有刺激,在处方中加入弱酸弱碱组成的缓冲系统局部降低酸度,减少刺激性。但是,从文献报道看缓冲系统组成五花八门,有的甚至造成吸收量(AUC)比普通片增加很多。另一方面,由于缓冲系统使吸收环境由呈酸性转成碱性,尿液被碱化,反而加快乙酰水杨酸的排泄。因此,在研究该类药物制剂时必须详细研究多次给药人体生物利用度的稳态分布情况,否则很难通过该缓释剂型的申请,亦很难确定今后临床上使用剂量。
又如:喹诺酮类药物主要作用机制是抑制细菌DNA合成从而抑制细菌生长。有的喹诺酮类药物主要作用在G-菌,其本身无抗真菌作用且水溶性差,做成制剂酸度较强,对皮肤刺激性很强。因此,该类药物申请抗真菌外用药是极其不合理的,是选题上的严重错误。
3.3 不注意药物不良反应,不考虑使用对象 氨基糖苷类药物,对耳、肾有一定毒性,尤其这一类药物中新霉素的不良反应最大,但有的研制单位把它混在辅料中作儿童扑粉,治疗尿湿症。由于药物可通过粘膜而被吸收,尤其婴儿粘膜吸收更快,一旦造成耳聋后果不堪设想。
, 百拇医药
又如:非甾体类抗炎药加上胃粘膜保护剂,试图克服非甾体类药胃肠道不良反应,而组方结果反而引起严重腹痛、腹泻等不良反应。
3.4 复方制剂合理性差 复方制剂使药物服用量比单方低,复方中各活性成份起到互补、增强作用,减少不良反应,这是一条研制途径。但新药必须有详细具体试验数据来证明,以达到合理的结论。如:抗生素类药,有的研制单位将抗G-和G+菌抗生素组成复方,从表面看复方组成了广谱抗生素,但是对患者并不合理,由G-致病菌引起感染的患者没必要服用抗G+菌抗生素,同时,也造成了体内菌群混乱,助长耐药菌的产生。
盐酸普鲁卡因和利多卡因组成的复方麻醉药:从疗效评价,所组成的复方没有超过单方利多卡因;从不良反应评价,盐酸普鲁卡因本身过敏反应仍未克服,并且已逐步趋于淘汰。就整个临床麻醉来看,一般均“个体化”给药。因此,复方研究必须注意整体发展趋势,注意咨询专家(复方制剂不合理性造成退审的例子很多,待以后专题分析)。
, 百拇医药
3.5 缺乏与现有已上市相同适应证的药物横向比较,无特点 如:1993年“沙星热”(喹诺酮类药物),其原料药和制剂280多家来申报;1994年和1995年“伪麻热”(其为美国含伪麻黄碱复方抗感冒的OTC药),近60多家申报;1996年大环内酯类抗生素申报者有200多家。但并不是所有品种均有特点,如沙星类(喹诺酮类药物)按发现先后分为第一代、第二代、第三代产品,但不等于第二代比第一代好,第三代比第二代强。某研制单位研制了第三代产品,但经横向比较抗菌作用没有比第一代强,毒性反应却有所增加。
3.6 选用药物特点与其申报资料中结果数据不吻合 将某药物由片剂改成口服乳剂,预期目的是提高生物利用度,但申报资料结果却与普通片剂生物利用度等效;某一生化药品预期目的是治疗中、重症慢性支气管炎,但申报资料中对该病症常见咳、痰、喘、炎等观察指标评价结果却为阴性。因此,一定要把研制药物的治疗特点定位,定位后试验数据指标要作出来。
3.7 其他 某些申报药物稳定性差、有效期短、包装运输条件苛刻,很难成为特殊商品。仿制国外现成处方,处方不适合我国患者。口服途径改成注射途径,经常在毒性和质控上出现问题。
, 百拇医药
4 申报资料重复性太高
由于我国同一品种研究有时分散在很多研制单位,具体工作各自进行,所以,申报资料中虽然数据略有差别,但结果是一致的,因而,造成很多不必要的重复劳动。如:对氧氟沙星、环丙沙星原料药各自共作了10多个LD50,10多个药效学研究,其结论完全是一致的。因此,联想到在我国设立DMF(Drug Master File)的必要性,如:有几家前来申报洛美沙星注射液,该类药物偏酸性才能溶解,因此,肌注刺激性很大,一般均做成静脉用注射剂,但该类药物对光很不稳定,光解后产生降解物,据文献报道该降解物有一定毒性,因此,必须了解光解后产物的毒性情况,第1家研制单位在这方面作了详细的研制工作,提取了光解后产物,专门做了毒性试验,所以这份资料可以进入DMF中,其他申请生产洛美沙星注射液的单位需要这份申报资料,只要经研制单位同意后即可从DMF中调出,这样避免了重复审评,节约了时间、人力、财力。
5 申报技术资料不符合目前规定的对技术的基本要求
, 百拇医药
5.1 药学方面
5.1.1 结构确证完成不好 新药结构确证主要手段是用元素分析和色谱测定(红外、紫外、核磁共振、质谱)。由于仪器性能差,分辨率低,达不到结构确证的目的;测试结果的图谱上找不到质子、分子碎片、基团等的相应归属,因此很难定出结构。在红外光谱测定的结果图谱中尤其指纹区(800~1 800 nm),坐标很密,由于除光学异构体及长链烷烃同系物外几乎没有2种化合物在红外吸收图谱指纹区是相同的,所以,这个区域的结果判断结构很关键,但是往往在申报资料中这一段没有完成好。在紫外分光光度测定中,主要是利用化合物结构中分子轨道上电子的能级跃迁所产生的吸收光谱,由于溶剂pH不同,使吸收波长向长波方向或短波方向位移产生红移或蓝移效应,所以,要求在酸性、碱性及中性3种溶剂中进行测定,但往往申报资料中只完成1种溶剂测定即交卷。在核磁共振谱测试中往往漏测了有利于结构分析的活泼氢的存在。在质谱测定中没有测到分子离子峰,也没有对裂解图进行分析。高分辨质谱有时可代替元素分析,但对含结晶水分子结构,高分辨质谱仅能说明有结晶水,不能定量显示结晶水数,所以仍须进行元素分析,近来发现元素分析经常漏测卤族元素F,Cl等。所测元素结果比理论值计算>0.3%,因此须引起注意。结构确证中忽略的另一个最大问题是对照品选择。对照品须可靠可信,来源清楚,得到公认,质控严格。近期又发现晶型问题较多,许多物质由于晶型不同,人体生物利用度差别很大,因此必须重视这方面研究,创新药应尽量进行单晶-X射线衍射。
, 百拇医药
5.1.2 生产工艺资料不完善,处方组成问题较多 生产工艺中须有详细试制路线,尤其末步的精制方法,各步的反应条件和中间体的质控应尽量以文献值为对照,但申报资料往往不完善,不详细,甚至各步中间体无质控指标。制剂中处方组成依据不足,所采用辅料来源不清,或无药用规格标准,或局部用药辅料量简单地移植到全身用药辅料量,所加辅料作用用途不明,尤其复方制剂的处方存在问题较多。主要有:① 组方中存在毒性较大物质;② 组方中主活性成分为地方标准,但经查阅药效不定;③ 组方中某活性物质未作过该组方形成的剂型,如:A,B,C组成的复方制剂,其中地方标准主活性成分A原作为注射剂,现作为复方中一活性成分,却又作成了片剂,口服途径药效无试验和数据证明;④ 药物本身不宜做成某剂型。如:氨基糖苷类抗生素对腹泻很有效,其在胃、肠内主要通过局部的直接作用。但研制单位设想制成口含片,通过粘膜吸收,作用于全身;⑤ 组方中活性成分在国际上已走下坡路,不良反应大;⑥ 组方中各组分剂量高于单方剂量,有的甚至高于药典对该品种规定量的数倍;⑦ 处方中某些组分含量极低,难以控制均匀度;⑧ 组方中加入质量不明香料。
, 百拇医药
由于以上种种原因,对复方制剂退审较多。
5.1.3 新药研制中对质量标准把握不严
5.1.3.1 关于溶出度测定中溶出量的计算 一般此方法与含量测定方法一致,但有的含测方法(微生物测定法)太复杂,需要重新筛选,可采用快速简便化学显色法,但申报资料中经常缺少方法学筛选资料。难溶性物质溶出介质选择亦存在问题,有的甚至过多地加入有机溶媒,缺少选择依据。溶出度测定中普遍存在的另一问题是对均一性试验方法不明确,其要求用同一批样品作一次试验(6杯6片),记录规定时间间隔溶出情况,数据列表作图,分析一批6片均一性情况。在这项测定中还忽视了一个重要问题,即溶出量的限度考察至少达到标示量的90%以上,对溶出数据的统计学处理应要求每个时间点即片与片溶出量之间的标准差<5%,但往往申报资料仅考察到70%,无计算标准差。
5.1.3.2 有关物质的检查 某些药物不稳定,遇光、热、湿易分解;有的在合成中未反应完全的中间体带入最终产品,有的在合成过程中产生副产物,如异构体,甚至有的杂质活性恰恰相反,如:枸橼酸他莫昔芬,有E型和Z型二种构型,Z型是研究的抗癌药物,E型却是工艺中带来的致癌杂质,所以对有关物质必须严格控制,但是申报资料对控制方法学未进行详细研究,以至方法的灵敏度、专属性、重复性无数据或无可靠结论。因方法不可靠,有关物质的检查结果就不能说明问题。
, 百拇医药
对合成工艺中所采用的有机溶媒,在最终产品中进行残留溶剂的检查须引起重视,检查方法须注意要有一定的对检出溶剂灵敏度以及相应标准品。
5.1.3.3 关于含量测定 本项是质量标准中核心部分,主要问题亦是方法学考核问题。尤其是专属性方面存在问题较多,某些药物须规定主药与临近主杂质达到一定的分离度;另一个主要存在问题是对照品无详细来源又无严格的质控指标,有的甚至用常数E值来进行紫外分光光度测定。
5.1.3.4 关于有效期 必须根据室温留样考察结果。忽视注意考察模拟上市的包装。
5.1.4 关于药物的稳定性研究 对本项研究目的不清,仅按技术指导原则机械完成,尤其对降解产物考察方法其灵敏度、分离度均无考核,亦无图谱,考核指标不齐全,尤其对降解产物检查不认真,不具体更无相应的有关结果图谱。有的甚至考核注射液在75%,95%湿度下的稳定性;有的对光的稳定性考察机械化按指导原则2 000~4 000Lx表示,无具体光照度数据,对具体情况缺乏具体分析;原料药和制剂稳定性考核相脱离,原料药考核结果未提供制剂工艺、包装、运输、储存的依据。
, 百拇医药
5.2 药理方面 新药一般药理研究试验中主要存在的问题:① 没采用拟推荐临床应用的给药途径;② 所试药物剂量低于起主要药效作用的剂量;或仅采用1个剂量(按常规应选择产生主要药效作用的2~3个剂量);③ 未设相应溶剂对照组。
5.3 药效学方面 新药的主要药效学考察必须用2种模型2个途径,其中一个途径应采用拟推荐的临床用药途径,剂量至少3~5个,每剂量至少5~10只动物。试验中存在主要问题:① 模型与拟临床用适应证不一致或根本未正确选用模型,或模型尚未得到公认;② 给药途径与拟临床推荐给药途径不一致,如:临床用为口服途径,药效学试验却静脉注射;③ 阳性对照药选的不对,如考核一个新药减轻脑水肿功能,对照品用某某地平,但该对照药的适应证尚未经过审评,也未经行政部门批准认可;④ 试验结果无量效关系,甚至结果颠倒,并未进行详细分析;⑤ 新药及阳性对照药剂量的确定不慎重,资料中无给药依据,各剂量之间距无适当的理由;⑥ 观察指标不正确或不全面,如:申报免疫抑制剂新药却未测试佐剂性关节炎,大鼠免疫功能和细胞因子变化的各项指标;⑦ 抗生素药物研制中缺少近一、二年临床分离菌的药敏试验结果。
, 百拇医药
5.4 毒理学方面 试验中存在的问题:
5.4.1 实验设计不合理 如一个一类药用不同种族动物来进行长毒试验,采用相同的剂量及其剂距进行,试验结果大鼠和犬未发现毒性,但在猴身上发现严重毒性反应,因此应考虑可能是大鼠和犬剂量设定不合理。一般尚须考虑人与动物剂量参数(如有的专家认为大鼠为1∶7;猴为1∶1.5左右)。
5.4.2 受试剂量偏低和试验动物数量不够 长毒试验剂量分为低、中、高三组,低剂量应高于整体动物最佳用药剂量(在此剂量下动物应不出现毒性反应,属基本安全剂量)。高剂量应使动物产生明显的或严重的毒性反应,或个别动物死亡。但是往往在申报资料中出现低剂量比起主要药效作用剂量还低,所谓高剂量动物仍无毒性反应,更找不到毒性靶器官。
5.4.3 给药方法与临床用药途径不一致 临床用药途径为静注,长毒试验却用了口服途径。
, http://www.100md.com 5.4.4 检测项目不全 尤其是关键性指标,如血液学指标,血液生化指标等。
5.4.5 未进行恢复期观察 最后一次给药后24h,将动物全部活杀,检测各项指标,但未留下部分动物继续观察2~4周,再活杀检查了解毒性反应的可逆程度和可能出现的延迟毒性反应。
5.4.6 给药剂量单位不统一,同一试验药物,剂量单位不统一 在同一申报药物的动物试验上用了u/kg,μg/kg,u/只,u/ml等单位,造成全面正确地评价一个药困难。
6 临床试验方面的问题
6.1 一期临床试验中主要存在问题 目的:确定可用于临床的安全药效剂量及合理给药方案,是在人体进行新药试验的起始期。包括药物的耐受性试验与药代动力学、生物利用度研究。
6.1.1 在耐受性试验中主要存在问题 给药剂量不合适。给药剂量应由有经验的临床药理研究人员和临床医生参考动物实验的剂量(如半数有效量,半数致死量和慢性毒性剂量以及药代动力学参数等)估计一个预测剂量,然后以预测量的分数(一般<1/10)
, 百拇医药
为人用起始剂量。国际上常用Blach well法:初试剂量不超过最敏感动物LD50或最小有效剂量的1/600或最小有效剂量的1/60;改良Blach well法:2种动物LD50的1/600及2种动物长毒试验中出现毒性剂量1/60这四者中取其最低量;Dollery法:最敏感动物的最有效剂量的1%~2%及同类药物临床治疗量的1/10。
对有明显活性(药理作用)起始剂量更低些。试验设计方面还要注意单人单次原则及逐步递增原则。此外耐受性试验结论应为确定可耐受的最大剂量出现毒性反应的最小剂量。
申报资料中初试剂量最大试验剂量设置无依据。预计最大耐受量时一般以临床应用该类药物单次最大剂量、用动物在长毒试验中引起功能或脏器可逆性损害的剂量的1/10或动物最大耐受量的1/5~1/2。
6.1.2 药代动力学研究中主要存在问题 生物标本测定方法缺少灵敏度、专属性、重复性、回收率、线性范围等试验数据;参比制剂的选择不规范;药代参数不全或参数分析不全面,未能详尽介绍体内过程,甚至有的一类药总排泄量仅为10%,90%量趋向不明,对代谢产物也缺少分析。
, http://www.100md.com
6.1.3 生物利用度试验中经常存在问题 如① 对试验的目的不够清楚。生物利用度试验目的是确定药品体内释放行为,以及这种行为是否受食物的影响;提供体内药物的吸收模型和建立体内吸收与体外溶出度相关性,为控制制剂质量提供依据。缓释制剂多剂量连续给药试验目的是了解缓释制剂血药浓度的波动程度,并进一步考察其生物利用度。② 参比制剂选择不当。应选择药典收载品种列入部颁标准的已上市公认或国外相同剂型的品种及药物的水溶液或混悬液等条件选择参比制剂。③ 采集生物标本的频度不够。一般要求时间至少3~5个半衰期,若半衰期未知应持续到血药峰浓度的1/10~1/20。
缓释制剂的多剂量给药,一定要在稳态时测血药浓度,一般情况下,口服给药进行血药浓度测定时,在吸收相及平衡相各采样2~3次,在消除相采样至少4~10次。
6.2 二期临床试验中主要存在问题
6.2.1 临床方案制定与临床试验实践不符合
, 百拇医药
6.2.2 试验中诊断标准无依据、不明确或无严格执行 如细菌阳性率等问题。
6.2.3 受试者选择不当 ① 儿童、老年人、孕妇、哺乳期妇女、依从性差者不能入选;② 应排除或剔除的病例未排除或剔除。
6.2.4 试验设计方法不清 ① 随意分组而不是随机分组,应符合随机表要求;② 不设对照组或无自身对照(如抗高血压药);③ 非正确的双盲试验,仅把两药物编号而未从外形、药味改建对照药或进行双模拟方法。
6.2.5 对照药选择不当 ① 对照药疗效不肯定,地方标准品种,国际上走下坡品种;② 对照药适应证与试验药不完全符合,如抗菌药一定要选择抗菌谱相同或接近抗菌药;③ 西药用中药作对照;④ 医院制剂作对照药;⑤ 同一药品临床试验中,各试验医院无统一对照药;⑥ 联合用药中,基础治疗各不相同;⑦ 对照药和试验药作用机制差别大,如抗过敏药试验药为白三烯拮抗剂而对照药却选用选择性β2-受体拮抗剂。
, 百拇医药
6.2.6 观察项目不完善,尤其主要观察项目 如:抗乙肝药物缺乏病毒血清学检查(必要时必须做肝活检病理观察);平喘药未做肺功能测定;抗感染药不做细菌学培养及转阴率、清除率计算;抗溃疡药缺乏胃镜检查;对不良反应观察与动物长毒试验结果相脱离等。
6.2.7 无可比性分析,或分析方法错误
6.2.8 随机对照试验结果与开放观察资料混在一起 试验组+开放组与对照组进行可比性分析;试验组+开放组与对照组进行疗效分析。
6.2.9 混淆了2种不良反应数据 不良反应发生人数/观察人数;不良反应按症状发生例次/观察人数。
6.2.10 总总结与分总结脱节 无统一标准;病例数不吻合;判断标准有差距。
(收稿:1999-05-30), 百拇医药