解酒灵对乙醇致鼠肝急性损伤的保护作用及机制的探讨
作者:邓源 袁伯俊 张淑英
单位:上海第二军医大学新药评价中心,上海 200433
关键词:解酒灵;急性肝损伤;脂质过氧化物;超氧化物歧化酶;组织形态学
中国新药杂志000612 【摘要】 目的:探讨解酒灵解酒作用的机制。方法:利用自动生化分析仪、TBA显色法、邻苯三酚自氧化法分别测定血清中ALT和AST活性及肝匀浆中丙二醛(MDA)和超氧化物歧化酶(SOD)活性;用HE染色法、PAS染色法观察肝组织形态学的病变。结果:解酒灵能抑制乙醇所致的ALT及AST活性的升高和脂质过氧化物的升高(P<0.01),能诱导SOD活性。结论:解酒灵对乙醇所致鼠肝急性损伤的保护作用机制与抗自由基的产生和提高SOD活性有关。
【中图分类号】R575 【文献标识码】A
, http://www.100md.com 【文章编号】1003-3734(2000)06-0388-04
Study of the protective effect of Jiejiouling on mice with acute hepatic injuries induced by alcohol and its mechanism
DENG Yuan,YUAN Bo-jun,ZHANG Shu-ying
(Center of New Drug Evaluation,The Secondary Military Medical University,Shanghai 200433)
【Abstract】 Objectives:To explore the de-inebriating mechanism of Jiejiouling.Methods:The activities of serum ALT & AST and the activities of MDA & SOD in liver homogenate were measured and the histological and morphological changes in liver tissue were observed.Results:The increase in ALT & AST activities and increase in level of lipid peroxides induced by alcohol can be inhibited by Jiejiouling. Conclusions:Acute hepatic injuries in mice induced by alcohol can be protected by Jiejiouling and its mechanism may related to decrease in free radical and increase in SOD activities.
, 百拇医药
【Key words】 detoxication of alcohol;acute liver injury;LPO;SOD; histomorphology
为探讨解酒灵抗乙醇所致急性肝损伤的机制,我们采用乙醇致鼠急性肝损伤模型,研究解酒灵解酒保肝作用及其对肝组织超氧化物歧化酶(SOD)以及脂质过氧化终产物丙二醛(MDA)的影响,并进行了肝细胞组织形态学的观察。
材料与方法
1 材料
1.1 药品与试剂 解酒灵(第二军医大学长海医院药学部,批号98070),95%医用酒精(上海益慧办公设备经营部,批号980721),酒宝(北京龙王食品有限公司,批号980110),ALT及AST测定试剂盒(卫生部上海生物制品研究所),0.4mol/L NaOH溶液,硫代巴比妥酸(TBA,上海试剂二厂), 四甲氧基丙烷(TMP,Sigma公司),新生小牛血清(杭州四季青生物工程材料研究所),邻苯三酚(贵州遵义化工厂,分析纯),Tris-HCl缓冲液,其他试剂均为国产分析纯。
, http://www.100md.com
1.2 主要仪器 LXJ-II型离心沉淀机(上海医用分析仪器厂),S648电热恒温水浴箱(上海医疗器械七厂),721分光光度计(上海第三分析仪器厂),ZHF-1高速分散器(上海宝达生化仪器厂),752紫外光栅分光光度计(上海第二分析仪器厂)。
1.3 动物 昆明种小鼠(第二军医大学实验动物中心),体重22~24g。
2 方法
2.1 小鼠血清ALT,AST活性的测定
2.1.1 动物处理 昆明种小鼠60只,均为雄性,按体重大小随机分成空白对照组, 模型组,阳性对照组及不同剂量给药组。给药组分别灌胃不同剂量(0.99,0.49,0.25g/kg)的解酒灵,阳性对照组灌胃酒宝(0.3g/kg),模型组灌胃等量的生理盐水。灌量均为0.2ml,连续灌胃1周。0.5h后,各组均灌胃40%(8g/kg)的乙醇0.2ml,空白组灌胃等量的30%的葡萄糖。
, 百拇医药
2.1.2 样本处理及检测 末次给药12h后开始禁食,不禁水,24h后眼眶采血,经离心取上清液测定,用赖氏比色法[1]测定血清中ALT,AST的活性。
2.2 解酒灵对小鼠肝脏脂质过氧化物的影响
2.2.1 动物处理 同“2.1.1”。
2.2.2 样本制备及检测 小鼠断头放血后,立即剖腹取肝,放在冰生理盐水中漂洗2次,吸干,称取肝组织约1g,用0.1mol/L磷酸盐缓冲液制备成1∶10的匀浆。按TBA显色法[2]测肝脏脂质过氧化终产物MDA含量,以牛血清白蛋白为标准品,按Lowrys法[3]测定肝匀浆蛋白质含量。
2.2.3 MDA测定 取1%的匀浆0.1ml,加1μl 1%TBA溶液和1ml 20%醋酸,混合均匀后煮沸加热1h,迅速以自来水冷却,3000r/min离心10min,吸取上清液于532nm测定吸收度。用等量的生理盐水做空白,等体积的10nmol/L TMP作为标准。Lowrys法测定蛋白质含量。
, http://www.100md.com
2.3 解酒灵对小鼠肝脏SOD活性的影响
2.3.1 动物处理 同“2.1.1”。
2.3.2 样本制备及检测 末次给药后1h,禁食,24h断头处死,制备肝匀浆,按邻苯三酚自氧化法[4] 测定肝脏SOD的活性。
2.3.3 SOD活性的测定 在试管中加入4.5ml pH8.2的50mmol/L-Tris-HCl缓冲液,然后加入0.01ml的肝匀浆液,同体积的生理盐水为标准管,再加入预热的45mmol/L的邻苯三酚溶液0.01ml,迅速摇匀倒入1cm比色杯中,在325nm下,每隔30s测吸收度1次,测3min,计算A/3min。要求邻苯三酚的自氧化率控制在0.07A/min。按下式计算SOD活性。
, http://www.100md.com 2.4 解酒灵对小鼠肝细胞组织形态学的影响
2.4.1 动物处理 同“2.1.1”。
2.4.2 动物处理及样本制备 小鼠断头放血后立刻剖腹取肝脏,固定于10%的福尔马林溶液中,常规脱水,石蜡包埋,切片。
2.4.3 检测方法 HE染色,在光镜下观察;95%乙醇溶液固定,做PAS染色,检测糖原。
3 统计学处理
数据均以( ±s)表示,组间差异采用t检验。结 果
±s)表示,组间差异采用t检验。结 果
1 解酒灵对小鼠血清ALT,AST,SOD活性及MDA含量的影响
, 百拇医药 见表1。
表1 解酒灵对小鼠血清ALT,AST,肝脏SOD活性及MDA含量的影响 ( ±s,n=10) 组 别
±s,n=10) 组 别
剂 量
ALT(nmol*s-1/L)
AST(nmol*s-1/L)
SOD(U/mg)蛋白
MDA(μmol/g蛋白)
空白对照组
30%葡萄糖
, 百拇医药
429.2±101.3
561.1±59.5
3.16±0.19
58.5±2.87
模 型 组
8g/kg
601.0±56.2d
748.2±110.7d
2.49±0.36d
64.1±2.69d
阳性对照组
, 百拇医药
0.3g/kg+8g/kg
477.6±73.5b
651.3±89.0a
2.93±0.38a
60.6±2.87a
解 酒 灵
0.99g/kg+8g/kg
454.2±88.9b
601.2±105.6b
3.12±0.32b
, 百拇医药
59.6±3.29a
解 酒 灵
0.49g/kg+8g/kg
460.9±98.1b
612.9±81.8b
3.01±0.31b
60.9±2.32a
解 酒 灵
0.25g/kg+8g/kg
489.3±109.4a
, 百拇医药
641.3±80.4a
2.93±0.37a
62.3±3.06a
与模型组比,a:P<0.05,b:P<0.01;与空白对照组比,d:P<0.01
由表1可知,解酒灵能抑制灌胃乙醇小鼠ALT和AST升高,明显降低乙醇所致的MDA含量的升高,扭转乙醇所致的鼠肝脏SOD活性的降低,且有剂量依赖趋势;阳性药酒保的疗效介于解酒灵的中、小剂量组之间。
2 解酒灵对小鼠肝脏组织形态学的影响
从肝脏外观来看,模型组肝脏外观色黄;给药组、阳性组色泽略红,与空白对照组相比无明显差异。
, 百拇医药
HE染色组织学所见,空白对照组:肝小叶结构清晰,肝细胞索排列整齐,包浆着色均匀,包浆颗粒弥散分布,窦隙清晰,包浆呈粉红色(图1a)。模型组:肝小叶绝大部分重度水样性变形,肝细胞肿胀,包浆空虚,肝细胞排列零乱大部分肝窦变窄或消失(图1b)。解酒灵组:绝大部分肝细胞恢复正常,包浆颗粒分布均匀,肝窦清晰,肝细胞索排列整齐,少部分可见肿胀变性的肝细胞(图1c)。阳性对照组:区域性肝细胞中度或轻度水样变性,肝细胞排列轻度紊乱,窦隙较窄(图1d)。上述形态学结果表明了解酒灵对乙醇所致鼠肝脏损伤的保护作用。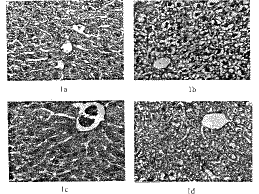
图1 HE染色的组织形态学
PAS(糖原)染色组织学所见,空白对照组:肝小叶绝大部分肝细胞呈糖原阳性反应。肝细胞内含丰富的糖原,颗粒密集,呈全包浆分布或部分包浆分布。(糖原呈红色颗 粒,核未衬染)(图2a)。模型组:肝小叶绝大部分肝细胞糖原颗粒枯竭消失,呈阴性反应(图2b)。解酒灵组:与正常组相接近,肝小叶绝大部分肝细胞呈糖原阳性反应。单个细胞中糖原呈全包浆膜密集分布(图2c)。阳性对照组:阳性细胞弥漫分布,以包浆外带膜型分布为主,中内带颗粒较稀疏,颗粒细小(图2d)。PAS染色的组织形态学观察也表明了解酒灵对乙醇所致的鼠肝损伤的保护作用。
, http://www.100md.com
图2 PAS染色的组织形态学
讨 论
据文献报道[5,6],乙醇急性或慢性中毒会导致肝损伤,其主要机制之一是通过激活O2产生氧自由基,导致肝细胞膜脂质过氧化及肝细胞损伤。MDA为脂质过氧化终产物,该值的升降反映着脂质过氧化程度的强弱。机体对脂质过氧化有两类防御系统,其中一类即酶促防御系统,它可以有效地清除O·2 等活性氧并有终止自由基链琐反应的作用。若SOD活性降低,则清除体内氧自由基能力下降。而肝组织细胞的损伤与自由基毒性反应关系极为密切[7],若体内自由基生成增加,从而破坏靶细胞的生物大分子。脂质过氧化物的生成增多,又可引起肝组织结构的损伤。当损伤程度超过了代偿或丧失修复能力时,导致肝脏正常生理功能的紊乱。本研究结果表明,小鼠口服乙醇后,肝匀浆脂质过氧化物含量显著增高,而此时伴随有SOD活性明显降低,而解酒灵预处理组则能明显逆转上述指标的改变,改善肝功能。同时,组织病理学观察也显示解酒灵对肝脏的损伤有保护作用。
, 百拇医药
【参考文献】
[1] 陈奇. 中药药理研究方法学[M].北京:人民卫生出版社,1994.832~834
[2] Ohkawa H,Ohishi N,Yaykn K,et al .Assay for lipid peroxides in animaltissues by thiobarbituric acid reaction[J]. Annal Biochem,1979,95∶351~357
[3] 徐叔云,陈修. 药理实验方法学[M].第2版. 北京:人民卫生出版社,1994.490~491
[4] 谢卫华,袁勤生. 邻苯三酚自氧化法测定超氧化物歧化酶活性的改进[J].医药工业,1988,19(5)∶217~219
[5] Strubelt O ,Chung AS,Bruk RF,et al. Recent progress in alcoholic liver diseases[J].Toxicology, 1987,45∶213~215
, 百拇医药
[6] Boveris A ,Yamaucchi M,Maezawa Y,et al.Alcohol and the liver[J].Arch Biochim Biophys,1983,227(2)∶534~535
[7] Vaienznela A,Uchiyama M,Ellman G ,et al.Alcohol ingestion ,liver glutathione and lipoperoxidation,metabolic interelations and pathological implications[J]. Biochem Pharmacol,1985,34∶2209~2213
(收稿:2000-01-07 修回:2000-03-27), 百拇医药
单位:上海第二军医大学新药评价中心,上海 200433
关键词:解酒灵;急性肝损伤;脂质过氧化物;超氧化物歧化酶;组织形态学
中国新药杂志000612 【摘要】 目的:探讨解酒灵解酒作用的机制。方法:利用自动生化分析仪、TBA显色法、邻苯三酚自氧化法分别测定血清中ALT和AST活性及肝匀浆中丙二醛(MDA)和超氧化物歧化酶(SOD)活性;用HE染色法、PAS染色法观察肝组织形态学的病变。结果:解酒灵能抑制乙醇所致的ALT及AST活性的升高和脂质过氧化物的升高(P<0.01),能诱导SOD活性。结论:解酒灵对乙醇所致鼠肝急性损伤的保护作用机制与抗自由基的产生和提高SOD活性有关。
【中图分类号】R575 【文献标识码】A
, http://www.100md.com 【文章编号】1003-3734(2000)06-0388-04
Study of the protective effect of Jiejiouling on mice with acute hepatic injuries induced by alcohol and its mechanism
DENG Yuan,YUAN Bo-jun,ZHANG Shu-ying
(Center of New Drug Evaluation,The Secondary Military Medical University,Shanghai 200433)
【Abstract】 Objectives:To explore the de-inebriating mechanism of Jiejiouling.Methods:The activities of serum ALT & AST and the activities of MDA & SOD in liver homogenate were measured and the histological and morphological changes in liver tissue were observed.Results:The increase in ALT & AST activities and increase in level of lipid peroxides induced by alcohol can be inhibited by Jiejiouling. Conclusions:Acute hepatic injuries in mice induced by alcohol can be protected by Jiejiouling and its mechanism may related to decrease in free radical and increase in SOD activities.
, 百拇医药
【Key words】 detoxication of alcohol;acute liver injury;LPO;SOD; histomorphology
为探讨解酒灵抗乙醇所致急性肝损伤的机制,我们采用乙醇致鼠急性肝损伤模型,研究解酒灵解酒保肝作用及其对肝组织超氧化物歧化酶(SOD)以及脂质过氧化终产物丙二醛(MDA)的影响,并进行了肝细胞组织形态学的观察。
材料与方法
1 材料
1.1 药品与试剂 解酒灵(第二军医大学长海医院药学部,批号98070),95%医用酒精(上海益慧办公设备经营部,批号980721),酒宝(北京龙王食品有限公司,批号980110),ALT及AST测定试剂盒(卫生部上海生物制品研究所),0.4mol/L NaOH溶液,硫代巴比妥酸(TBA,上海试剂二厂), 四甲氧基丙烷(TMP,Sigma公司),新生小牛血清(杭州四季青生物工程材料研究所),邻苯三酚(贵州遵义化工厂,分析纯),Tris-HCl缓冲液,其他试剂均为国产分析纯。
, http://www.100md.com
1.2 主要仪器 LXJ-II型离心沉淀机(上海医用分析仪器厂),S648电热恒温水浴箱(上海医疗器械七厂),721分光光度计(上海第三分析仪器厂),ZHF-1高速分散器(上海宝达生化仪器厂),752紫外光栅分光光度计(上海第二分析仪器厂)。
1.3 动物 昆明种小鼠(第二军医大学实验动物中心),体重22~24g。
2 方法
2.1 小鼠血清ALT,AST活性的测定
2.1.1 动物处理 昆明种小鼠60只,均为雄性,按体重大小随机分成空白对照组, 模型组,阳性对照组及不同剂量给药组。给药组分别灌胃不同剂量(0.99,0.49,0.25g/kg)的解酒灵,阳性对照组灌胃酒宝(0.3g/kg),模型组灌胃等量的生理盐水。灌量均为0.2ml,连续灌胃1周。0.5h后,各组均灌胃40%(8g/kg)的乙醇0.2ml,空白组灌胃等量的30%的葡萄糖。
, 百拇医药
2.1.2 样本处理及检测 末次给药12h后开始禁食,不禁水,24h后眼眶采血,经离心取上清液测定,用赖氏比色法[1]测定血清中ALT,AST的活性。
2.2 解酒灵对小鼠肝脏脂质过氧化物的影响
2.2.1 动物处理 同“2.1.1”。
2.2.2 样本制备及检测 小鼠断头放血后,立即剖腹取肝,放在冰生理盐水中漂洗2次,吸干,称取肝组织约1g,用0.1mol/L磷酸盐缓冲液制备成1∶10的匀浆。按TBA显色法[2]测肝脏脂质过氧化终产物MDA含量,以牛血清白蛋白为标准品,按Lowrys法[3]测定肝匀浆蛋白质含量。
2.2.3 MDA测定 取1%的匀浆0.1ml,加1μl 1%TBA溶液和1ml 20%醋酸,混合均匀后煮沸加热1h,迅速以自来水冷却,3000r/min离心10min,吸取上清液于532nm测定吸收度。用等量的生理盐水做空白,等体积的10nmol/L TMP作为标准。Lowrys法测定蛋白质含量。
, http://www.100md.com
2.3 解酒灵对小鼠肝脏SOD活性的影响
2.3.1 动物处理 同“2.1.1”。
2.3.2 样本制备及检测 末次给药后1h,禁食,24h断头处死,制备肝匀浆,按邻苯三酚自氧化法[4] 测定肝脏SOD的活性。
2.3.3 SOD活性的测定 在试管中加入4.5ml pH8.2的50mmol/L-Tris-HCl缓冲液,然后加入0.01ml的肝匀浆液,同体积的生理盐水为标准管,再加入预热的45mmol/L的邻苯三酚溶液0.01ml,迅速摇匀倒入1cm比色杯中,在325nm下,每隔30s测吸收度1次,测3min,计算A/3min。要求邻苯三酚的自氧化率控制在0.07A/min。按下式计算SOD活性。

, http://www.100md.com 2.4 解酒灵对小鼠肝细胞组织形态学的影响
2.4.1 动物处理 同“2.1.1”。
2.4.2 动物处理及样本制备 小鼠断头放血后立刻剖腹取肝脏,固定于10%的福尔马林溶液中,常规脱水,石蜡包埋,切片。
2.4.3 检测方法 HE染色,在光镜下观察;95%乙醇溶液固定,做PAS染色,检测糖原。
3 统计学处理
数据均以(
 ±s)表示,组间差异采用t检验。结 果
±s)表示,组间差异采用t检验。结 果1 解酒灵对小鼠血清ALT,AST,SOD活性及MDA含量的影响
, 百拇医药 见表1。
表1 解酒灵对小鼠血清ALT,AST,肝脏SOD活性及MDA含量的影响 (
 ±s,n=10) 组 别
±s,n=10) 组 别剂 量
ALT(nmol*s-1/L)
AST(nmol*s-1/L)
SOD(U/mg)蛋白
MDA(μmol/g蛋白)
空白对照组
30%葡萄糖
, 百拇医药
429.2±101.3
561.1±59.5
3.16±0.19
58.5±2.87
模 型 组
8g/kg
601.0±56.2d
748.2±110.7d
2.49±0.36d
64.1±2.69d
阳性对照组
, 百拇医药
0.3g/kg+8g/kg
477.6±73.5b
651.3±89.0a
2.93±0.38a
60.6±2.87a
解 酒 灵
0.99g/kg+8g/kg
454.2±88.9b
601.2±105.6b
3.12±0.32b
, 百拇医药
59.6±3.29a
解 酒 灵
0.49g/kg+8g/kg
460.9±98.1b
612.9±81.8b
3.01±0.31b
60.9±2.32a
解 酒 灵
0.25g/kg+8g/kg
489.3±109.4a
, 百拇医药
641.3±80.4a
2.93±0.37a
62.3±3.06a
与模型组比,a:P<0.05,b:P<0.01;与空白对照组比,d:P<0.01
由表1可知,解酒灵能抑制灌胃乙醇小鼠ALT和AST升高,明显降低乙醇所致的MDA含量的升高,扭转乙醇所致的鼠肝脏SOD活性的降低,且有剂量依赖趋势;阳性药酒保的疗效介于解酒灵的中、小剂量组之间。
2 解酒灵对小鼠肝脏组织形态学的影响
从肝脏外观来看,模型组肝脏外观色黄;给药组、阳性组色泽略红,与空白对照组相比无明显差异。
, 百拇医药
HE染色组织学所见,空白对照组:肝小叶结构清晰,肝细胞索排列整齐,包浆着色均匀,包浆颗粒弥散分布,窦隙清晰,包浆呈粉红色(图1a)。模型组:肝小叶绝大部分重度水样性变形,肝细胞肿胀,包浆空虚,肝细胞排列零乱大部分肝窦变窄或消失(图1b)。解酒灵组:绝大部分肝细胞恢复正常,包浆颗粒分布均匀,肝窦清晰,肝细胞索排列整齐,少部分可见肿胀变性的肝细胞(图1c)。阳性对照组:区域性肝细胞中度或轻度水样变性,肝细胞排列轻度紊乱,窦隙较窄(图1d)。上述形态学结果表明了解酒灵对乙醇所致鼠肝脏损伤的保护作用。

图1 HE染色的组织形态学
PAS(糖原)染色组织学所见,空白对照组:肝小叶绝大部分肝细胞呈糖原阳性反应。肝细胞内含丰富的糖原,颗粒密集,呈全包浆分布或部分包浆分布。(糖原呈红色颗 粒,核未衬染)(图2a)。模型组:肝小叶绝大部分肝细胞糖原颗粒枯竭消失,呈阴性反应(图2b)。解酒灵组:与正常组相接近,肝小叶绝大部分肝细胞呈糖原阳性反应。单个细胞中糖原呈全包浆膜密集分布(图2c)。阳性对照组:阳性细胞弥漫分布,以包浆外带膜型分布为主,中内带颗粒较稀疏,颗粒细小(图2d)。PAS染色的组织形态学观察也表明了解酒灵对乙醇所致的鼠肝损伤的保护作用。

, http://www.100md.com
图2 PAS染色的组织形态学
讨 论
据文献报道[5,6],乙醇急性或慢性中毒会导致肝损伤,其主要机制之一是通过激活O2产生氧自由基,导致肝细胞膜脂质过氧化及肝细胞损伤。MDA为脂质过氧化终产物,该值的升降反映着脂质过氧化程度的强弱。机体对脂质过氧化有两类防御系统,其中一类即酶促防御系统,它可以有效地清除O·2 等活性氧并有终止自由基链琐反应的作用。若SOD活性降低,则清除体内氧自由基能力下降。而肝组织细胞的损伤与自由基毒性反应关系极为密切[7],若体内自由基生成增加,从而破坏靶细胞的生物大分子。脂质过氧化物的生成增多,又可引起肝组织结构的损伤。当损伤程度超过了代偿或丧失修复能力时,导致肝脏正常生理功能的紊乱。本研究结果表明,小鼠口服乙醇后,肝匀浆脂质过氧化物含量显著增高,而此时伴随有SOD活性明显降低,而解酒灵预处理组则能明显逆转上述指标的改变,改善肝功能。同时,组织病理学观察也显示解酒灵对肝脏的损伤有保护作用。
, 百拇医药
【参考文献】
[1] 陈奇. 中药药理研究方法学[M].北京:人民卫生出版社,1994.832~834
[2] Ohkawa H,Ohishi N,Yaykn K,et al .Assay for lipid peroxides in animaltissues by thiobarbituric acid reaction[J]. Annal Biochem,1979,95∶351~357
[3] 徐叔云,陈修. 药理实验方法学[M].第2版. 北京:人民卫生出版社,1994.490~491
[4] 谢卫华,袁勤生. 邻苯三酚自氧化法测定超氧化物歧化酶活性的改进[J].医药工业,1988,19(5)∶217~219
[5] Strubelt O ,Chung AS,Bruk RF,et al. Recent progress in alcoholic liver diseases[J].Toxicology, 1987,45∶213~215
, 百拇医药
[6] Boveris A ,Yamaucchi M,Maezawa Y,et al.Alcohol and the liver[J].Arch Biochim Biophys,1983,227(2)∶534~535
[7] Vaienznela A,Uchiyama M,Ellman G ,et al.Alcohol ingestion ,liver glutathione and lipoperoxidation,metabolic interelations and pathological implications[J]. Biochem Pharmacol,1985,34∶2209~2213
(收稿:2000-01-07 修回:2000-03-27), 百拇医药