单纯疱疹病毒I型胸苷激酶基因在大肠杆菌中的融合表达*
作者:陈伟 喻启桂 薛采芳 甄荣芬 樊荣
单位:第四军医大学基础部抗感染研究室,710032,西安
关键词:单纯疱疹病毒;胸苷激酶;基因表达
细胞与分子免疫学杂志990204摘 要:用EcoRⅠ和HindⅢ双酶切已构建的含单纯疱疹病毒I型胸苷激酶(HSV-1TK)基因的pUC18/TK质粒,将切出的TK基因片段克隆入原核表达载体pWR450-1中,构建成HSV-1TK基因重组表达质粒pWR450-1/TK。以HSV-1TK特异性引物TK1For和TK2Rev进行PCR鉴定可扩增出预期的503bp的TK基因编码区部分序列;EcoRⅠ和HindⅢ双酶切质粒pWR450-1/TK,可切出约1150bp的DNA片段,表明重组质粒中已插入HSV-1TK基因片段。用IPTG诱导pWR450-1/TK/JM109,表达出相对分子质量(Mr)约为97000的TK和β-半乳糖苷酶(Mr55000)融合蛋白。薄层扫描显示,该融合蛋白含量占菌体蛋白总量的27.47%。
, 百拇医药
中国图书资料分类号:R392.11
Construction and expression of herpes simplex virus type
I thymidine kinase fusion protein in E.coli
Chen Wei, Yu qigui, Xue Caifang, Zheng Rongfen ,Fan Rong
(Laboratory of Anti-infectious Disease, the Fourth Military Medical University, Xi'an 710032)
Keywords: herpes simplex virus thymidine kinase gene expression
, 百拇医药
Abstract:The recombinant plasmid pUC18/TK containing the full-length cDNA coding herpes simplex virus type I(HSV-1) thymidine kinase was digested by the EcoR I and the Hind III restriction endonucleases. The HSV-1TK gene was cloned into the expression vector pWR 450-1. The recombinant expression vector pWR450-1/TK was identified by PCR and digested with restriction enzymes. The results showed that the HSV-1 TK gene had been correctly inserted into the pWR450-1 vector. The expression of HSV-1 TK gene as a 97000(Mr) fusion protein(fused to β-galactosidase) was induced in E.coli. by IPTG that comprises 27.47% of total bacterial protein.
, http://www.100md.com
单纯疱疹病毒I型(herpes simplex virus typeI,HSV-1)胸苷激酶(thymidine kinase,TK)基因是HSV早期基因。其编码的TK可使抗疱疹病毒类药物,如:无环鸟苷(acyclovir,ACV)和丙氧鸟苷(gancic-lovir,GCV)等磷酸化,后者经宿主细胞的激酶作用,可转化成三磷酸核苷类似物,从而通过终止核酸链的合成而抑制宿主细胞DNA的复制使细胞死亡。TK基因是肿瘤基因治疗中应用最多最重要的药物敏感靶基因之一。将HSV-1TK基因克隆入逆转录病毒或腺病毒载体中,通过脂质体和电穿孔等方法转染肿瘤细胞,使TK基因整合到肿瘤细胞基因组DNA中,从而使肿瘤细胞成为ACV或GCV等的靶细胞,达到杀伤肿瘤细胞的目的。HSV-1TK基因/逆转录病毒载体系统和HSV-1TK基因/腺病毒载体系统,已被成功地应用在多种动物模型中对多种肿瘤进行治疗[1-4],并已开始用于对人脑肿瘤的基因治疗[5]。本文将HSV-1TK基因克隆入原核表达载体,在大肠杆菌中进行表达,为制备抗TK免疫血清和单克隆抗体(mAb),以及进行更为深入地研究奠定了实验基础。
, 百拇医药
1 材料和方法
1.1 重组质粒pUC18/TK的构建 将HSV-1 17syn+株全长TK基因cDNA克隆入pUC18质粒中,克隆的TK基因5′端插入EcoRI酶切位点,3′端插入Hind Ⅲ酶切位点。经转化感受态大肠杆菌JM109增菌后,以WizardTM Minipreps DNA Purification System(Promega公司产品)按说明书纯化,并进行紫外分光光度法定量。
1.2 原核表达载体pWR450-1 由本室制备保存。pWR450-1是1种带有lac启动子的融合蛋白表达载体,自身所编码的β-半乳糖苷酶相对分子质量(Mr)约55000,多克隆酶切位点含有EcoR I和Hind III酶切位点。
1.3 HSV-1TK基因原核表达载体的构建 质粒pUC18/TK或载体pWR450-1各2μg,分别经EcoRI和HindIII酶切后,在含0.5mg/L溴化乙锭(EB)的10g/L琼脂糖凝胶中电泳,紫外灯下观察结果。于10g/L低熔点琼脂糖凝胶中回收TK片段和载体片段,用EmbiTec公司生产的SurePure DNA Extraction Kit纯化回收DNA片段。用T4DNA连接酶,将纯化的TK基因片段和载体pWR450-1于15℃水浴连接16h,然后按常规转化新鲜制备的感受态大肠杆菌JM109,涂布于含100mg/L氨苄青霉素LB平板,于37℃培养15h后,挑选菌落进行鉴定。重组表达质粒命名为pWR450-1/TK。
, 百拇医药
1.4 PCR鉴定重组表达载体pWR450-1/TK 按McGeoch等报道的HSV-1末端序列[7],设计并合成一对扩增HSV-1TK基因编码区部分序列(503bp)的PCR引物TK1For和TK2Rev。引物的序列如下:
TK1For:5′-CGGAATTCATGGCTTCGTACCCCTGCCATCA-3′
TK2Rev:5′-TACTGCAGATGGCGGTCGAAGATGAGGGTGA-3′
随机挑选3个无色菌落接种于LB液体培养基增菌,以常规碱裂解法制备质粒。PCR反应体系:质粒pWR450-1/TK 100ng,引物TK1For和TK2Rev各0.5 μmol/L,4种dNTP各加200 μmol/L,1.5 mmol/L MgCl2,2 μl 10×PCR缓冲液,总体积20μl。PCR反应液经100℃煮沸变性5min后,每管加入Taq聚合酶1U,以20μl液体石蜡油封面,于PCR仪上94℃变性1min,68℃复性1min,72℃延伸90s,共进行35个循环,然后于72℃延伸10min。设质粒pUC18/TK作为阳性对照。取20μlPCR产物,在含0.5mg/L溴化乙锭(EB)的10g/L琼脂糖凝胶中电泳,于紫外灯下观察结果。
, http://www.100md.com
1.5 酶切鉴定重组表达载体pWR450-1/TK 酶切反应体系:取经PCR鉴定阳性的3个重组质粒pWR450-1/TK各1μg,EcoRI9U,Hind Ⅲ 6U及缓冲液B1.5μl,总体积15μl,同时设质粒pUC18/TK作为阳性对照。于37℃水浴2h后,于10g/L琼脂糖凝胶中电泳,紫外灯下观察结果。
1.6 HSV-1TK基因融合蛋白的诱导表达 挑取已鉴定的pWR450-1/TKJM109单一菌落,接种于5mlLB培养基中(含100mg/L氨苄青霉素),37℃震荡15h。取上述活化菌液,按1:100接种入新鲜LB培养基中(含100mg/L氨苄青霉素),37℃摇床4h,测A590nm约为0.65左右。加入终浓度为1mmol/L的IPTG(Promega公司产品),37℃摇床继续培养4h,并同时诱导载体pWR450-1。取200μl菌液离心集菌,弃上清,分别加50μl纯水和50μl2×样品缓冲液(含2-巯基乙醇),混匀,于100℃煮沸2min后,上样进行SDSPAGE电泳检测表达情况(浓缩胶为60g/L,分离胶浓度为80g/L),以考马斯亮蓝R-250染色。将染色的凝胶置于双波长薄层扫描仪(日本岛律公司产品)进行扫描,计算TK融合蛋白占菌体蛋白总量的百分比。
, http://www.100md.com
2 结果
2.1 PCR鉴定重组质粒pWR450-1/TK 用引物TK1 For和TK2 Rev,从3个克隆提取的质粒中,均可扩增出预期的503bp片段,结果见图1。
图1 重组质粒pWR450-1/TK的PCR扩增
Fig1 PCRamplificationofrecombinantplasmidpWR450-1/TK
1,2,3:pWR450-1/TKclones①,②and③;4:DNAmarker;5:Positivecontrol(pUC18/TKplasmid)
2.2 酶切鉴定重组质粒pWR450-1/TK 将PCR鉴定为阳性的3个重组质粒,用EcoRⅠ和HindIII双酶切鉴定,均可切出约为1150bp的片段,结果见图2。
, http://www.100md.com
图2 重组质粒pWR450-1/TK的酶切鉴定
Fig2 RestrictionanalysisofthepWR450-1/TKvector
1,2,3:pWR450-1/TKclones①,②and③;4:DNAmarker;
5:Positivecontrol(pUC18/TKplasmid)
2.3 HSV-1TK基因融合蛋白的表达 以IPTG诱导pWR450-1/TK/JM109,可表达Mr约为97000的融合蛋白。空载体pWR450-1/JM109表达Mr约为55000的蛋白,结果见图3。双波长薄层扫描分析显示,TK基因融合蛋白含量占菌体蛋白总量的27.47%。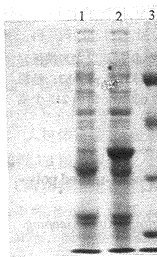

, http://www.100md.com
图3 HSV-1TK基因融合蛋白表达产物的SDS-PAGE分析
Fig3 SDS-PAGEoftheexpressionproductsofHSV-1TKgene fusionprotein
1:Non-inducedpWR450-1/JM109;2:pWR450-1/JM109inducedwithIPTG;3:Proteinmarker;
4:Non-inducedpWR450-1/TK/JM109;5:pWR450-1/TK/JM109inducedwithIPTG
3 讨论
自1986年,Moolten等报道TK基因转移可使肿瘤细胞获得对化学药物的敏感性以来[8],TK基因作为药敏基因在肿瘤基因治疗中越来越受到重视,已成为肿瘤基因治疗中一项引人注目的方案。然而,由于目前尚无抗TK的免疫血清和其mAb出售,给观察和研究TK基因在真核细胞中的表达带来了一定困难。虽然可通过鉴定转染细胞基因组DNA和RNA来证实TK基因的存在,但由于真核细胞基因表达调控的复杂性和一些未知因素的影响,即使能证实TK基因确实存在,也可能出现不表达的情况[10],这将导致TK基因治疗效果的降低,甚至无效。因此,从蛋白质水平分析TK基因的表达则显得更为重要。由于融合表达具有基因操作比较简单,表达产物在细菌内比较稳定,容易实现高效表达等优点,所以本文将HSV-1TK基因克隆入原核表达载体pWR450-1,构建了表达HSV-1TK基因的重组质粒pWR450-1/TK,经PCR和酶切鉴定证实,3个转化克隆均含有HSV-1TK基因插入片段。所用表达载体pWR450-1是一种带有lac启动子的融合蛋白表达载体,由lac启动子及编码β-半乳糖苷酶N端部分氨基酸的lacZ结构基因等组成,所编码的β-半乳糖苷酶Mr约为55000。在结构基因的下游有一多克隆酶切位点可供插入外源基因,其中含有EcoRI和HindIII酶切位点。在读框一致的情况下,可表达出含β-半乳糖苷酶(447个氨基酸)和外源蛋白的融合蛋白。以IPTG诱导所构建的pWR450-1/TK/JM109,可表达出Mr约为97000的融合蛋白,与预期的TK与β-半乳糖苷酶融合蛋白大小相似。表达产物的纯化、复性和活性鉴定工作正在进行中。薄层扫描表明,该融合蛋白含量占菌体蛋白总量的27.47%。根据融合蛋白和β-半乳糖苷酶的Mr估算,TK实际产率约占菌体蛋白总量的11.90%。HSV-1TK基因在原核表达的成功,为进一步制备抗TK的免疫血清和其mAb,以及鉴定TK基因在真核细胞中的表达奠定了实验基础。
, 百拇医药
*国家自然科学基金资助项目,No,39570807
作者简介:陈伟,男,36岁,硕士。西安市长乐西路17号,Tel.(029)3374536
参考文献
[1]Qian C, Idoate M, Bilbao R, et al. Gene transfer and therapy with adenoviral vector in rats with diethylnitrosamine-induced hepatocellular carcinoma. Human Gene Therapy, 1997;8:349~358
[2]Wills KN,Huang W, Harris MP, et al. Gene therapy for hepatocellular carcinoma: chemosensitivity conferred by adenovirus-mediated transfer of HSV-1 thymidine kinase gene. Cancer Gene Therapy,1995;2(3):191~197
, 百拇医药
[3]Barba D, Hardin J, Sadelain M, et al. Development of anti- tumor immunity following thymidine kinase- mediated killing of experimental brain tumor. Proc Natl Acad Sci ,1994;91(10):4348~4352
[4]Culver KW,Ram Z, Wallbridge S, et al. In vivo gene transfer with retroviral vector producer cells for treatment of experimental brain tumors. Science,1992; 256:1550 1552
[5]Kun LE, Gajjar A, Muhlbauer M, et al. Stereotactic injection of herpes simplex thymidine kinase vector producer(PA317- G1TK1SvNa.7) and intravenous ganciclovir for the treatment of progressive or recurrent primary supratentorial pediatric malignant brain tumors. Human Gene Therapy, 1995; 6(9):1231~ 1255
, http://www.100md.com
[6]喻启桂,胡宁婕,薛采芳,等.单纯庖疹病毒I型胸苷激酶基因的扩增、克隆和测序.第四军医大学学报,1998;19(3):257~260
[7]McGeoch DJ, Dalrymple M A, Davison A J, et al. The complete sequence of the long unique region in the genome of herpes simplex virus type- 1. J Gen Virol,1988; 69(7):1531~ 1574
[8]Moolten FL. Tumor chemosensitivity conferred by inserted herpes thymidine kinase genes: paradigm for a prospective cancer control strategy. Cancer Res, 1986; 46(10):5276~ 5281
, 百拇医药
[9]Freeman S M, Smabboud C N,Whartendy K A, et al. The “ bystander effect” :tumor regression when a fraction of the tumor mass is genetically modified. Cancer Res,1993; 53(21):5274~ 5283
[10]Xu Li, Yee J-K, Wolff JA , et al. Factors affecting long-term stability of Moloney murine leukemia virus-based vectors. Virol,1989; 171:331~ 341
收稿:1998-12-21
修回:1999-03-22, 百拇医药
单位:第四军医大学基础部抗感染研究室,710032,西安
关键词:单纯疱疹病毒;胸苷激酶;基因表达
细胞与分子免疫学杂志990204摘 要:用EcoRⅠ和HindⅢ双酶切已构建的含单纯疱疹病毒I型胸苷激酶(HSV-1TK)基因的pUC18/TK质粒,将切出的TK基因片段克隆入原核表达载体pWR450-1中,构建成HSV-1TK基因重组表达质粒pWR450-1/TK。以HSV-1TK特异性引物TK1For和TK2Rev进行PCR鉴定可扩增出预期的503bp的TK基因编码区部分序列;EcoRⅠ和HindⅢ双酶切质粒pWR450-1/TK,可切出约1150bp的DNA片段,表明重组质粒中已插入HSV-1TK基因片段。用IPTG诱导pWR450-1/TK/JM109,表达出相对分子质量(Mr)约为97000的TK和β-半乳糖苷酶(Mr55000)融合蛋白。薄层扫描显示,该融合蛋白含量占菌体蛋白总量的27.47%。
, 百拇医药
中国图书资料分类号:R392.11
Construction and expression of herpes simplex virus type
I thymidine kinase fusion protein in E.coli
Chen Wei, Yu qigui, Xue Caifang, Zheng Rongfen ,Fan Rong
(Laboratory of Anti-infectious Disease, the Fourth Military Medical University, Xi'an 710032)
Keywords: herpes simplex virus thymidine kinase gene expression
, 百拇医药
Abstract:The recombinant plasmid pUC18/TK containing the full-length cDNA coding herpes simplex virus type I(HSV-1) thymidine kinase was digested by the EcoR I and the Hind III restriction endonucleases. The HSV-1TK gene was cloned into the expression vector pWR 450-1. The recombinant expression vector pWR450-1/TK was identified by PCR and digested with restriction enzymes. The results showed that the HSV-1 TK gene had been correctly inserted into the pWR450-1 vector. The expression of HSV-1 TK gene as a 97000(Mr) fusion protein(fused to β-galactosidase) was induced in E.coli. by IPTG that comprises 27.47% of total bacterial protein.
, http://www.100md.com
单纯疱疹病毒I型(herpes simplex virus typeI,HSV-1)胸苷激酶(thymidine kinase,TK)基因是HSV早期基因。其编码的TK可使抗疱疹病毒类药物,如:无环鸟苷(acyclovir,ACV)和丙氧鸟苷(gancic-lovir,GCV)等磷酸化,后者经宿主细胞的激酶作用,可转化成三磷酸核苷类似物,从而通过终止核酸链的合成而抑制宿主细胞DNA的复制使细胞死亡。TK基因是肿瘤基因治疗中应用最多最重要的药物敏感靶基因之一。将HSV-1TK基因克隆入逆转录病毒或腺病毒载体中,通过脂质体和电穿孔等方法转染肿瘤细胞,使TK基因整合到肿瘤细胞基因组DNA中,从而使肿瘤细胞成为ACV或GCV等的靶细胞,达到杀伤肿瘤细胞的目的。HSV-1TK基因/逆转录病毒载体系统和HSV-1TK基因/腺病毒载体系统,已被成功地应用在多种动物模型中对多种肿瘤进行治疗[1-4],并已开始用于对人脑肿瘤的基因治疗[5]。本文将HSV-1TK基因克隆入原核表达载体,在大肠杆菌中进行表达,为制备抗TK免疫血清和单克隆抗体(mAb),以及进行更为深入地研究奠定了实验基础。
, 百拇医药
1 材料和方法
1.1 重组质粒pUC18/TK的构建 将HSV-1 17syn+株全长TK基因cDNA克隆入pUC18质粒中,克隆的TK基因5′端插入EcoRI酶切位点,3′端插入Hind Ⅲ酶切位点。经转化感受态大肠杆菌JM109增菌后,以WizardTM Minipreps DNA Purification System(Promega公司产品)按说明书纯化,并进行紫外分光光度法定量。
1.2 原核表达载体pWR450-1 由本室制备保存。pWR450-1是1种带有lac启动子的融合蛋白表达载体,自身所编码的β-半乳糖苷酶相对分子质量(Mr)约55000,多克隆酶切位点含有EcoR I和Hind III酶切位点。
1.3 HSV-1TK基因原核表达载体的构建 质粒pUC18/TK或载体pWR450-1各2μg,分别经EcoRI和HindIII酶切后,在含0.5mg/L溴化乙锭(EB)的10g/L琼脂糖凝胶中电泳,紫外灯下观察结果。于10g/L低熔点琼脂糖凝胶中回收TK片段和载体片段,用EmbiTec公司生产的SurePure DNA Extraction Kit纯化回收DNA片段。用T4DNA连接酶,将纯化的TK基因片段和载体pWR450-1于15℃水浴连接16h,然后按常规转化新鲜制备的感受态大肠杆菌JM109,涂布于含100mg/L氨苄青霉素LB平板,于37℃培养15h后,挑选菌落进行鉴定。重组表达质粒命名为pWR450-1/TK。
, 百拇医药
1.4 PCR鉴定重组表达载体pWR450-1/TK 按McGeoch等报道的HSV-1末端序列[7],设计并合成一对扩增HSV-1TK基因编码区部分序列(503bp)的PCR引物TK1For和TK2Rev。引物的序列如下:
TK1For:5′-CGGAATTCATGGCTTCGTACCCCTGCCATCA-3′
TK2Rev:5′-TACTGCAGATGGCGGTCGAAGATGAGGGTGA-3′
随机挑选3个无色菌落接种于LB液体培养基增菌,以常规碱裂解法制备质粒。PCR反应体系:质粒pWR450-1/TK 100ng,引物TK1For和TK2Rev各0.5 μmol/L,4种dNTP各加200 μmol/L,1.5 mmol/L MgCl2,2 μl 10×PCR缓冲液,总体积20μl。PCR反应液经100℃煮沸变性5min后,每管加入Taq聚合酶1U,以20μl液体石蜡油封面,于PCR仪上94℃变性1min,68℃复性1min,72℃延伸90s,共进行35个循环,然后于72℃延伸10min。设质粒pUC18/TK作为阳性对照。取20μlPCR产物,在含0.5mg/L溴化乙锭(EB)的10g/L琼脂糖凝胶中电泳,于紫外灯下观察结果。
, http://www.100md.com
1.5 酶切鉴定重组表达载体pWR450-1/TK 酶切反应体系:取经PCR鉴定阳性的3个重组质粒pWR450-1/TK各1μg,EcoRI9U,Hind Ⅲ 6U及缓冲液B1.5μl,总体积15μl,同时设质粒pUC18/TK作为阳性对照。于37℃水浴2h后,于10g/L琼脂糖凝胶中电泳,紫外灯下观察结果。
1.6 HSV-1TK基因融合蛋白的诱导表达 挑取已鉴定的pWR450-1/TKJM109单一菌落,接种于5mlLB培养基中(含100mg/L氨苄青霉素),37℃震荡15h。取上述活化菌液,按1:100接种入新鲜LB培养基中(含100mg/L氨苄青霉素),37℃摇床4h,测A590nm约为0.65左右。加入终浓度为1mmol/L的IPTG(Promega公司产品),37℃摇床继续培养4h,并同时诱导载体pWR450-1。取200μl菌液离心集菌,弃上清,分别加50μl纯水和50μl2×样品缓冲液(含2-巯基乙醇),混匀,于100℃煮沸2min后,上样进行SDSPAGE电泳检测表达情况(浓缩胶为60g/L,分离胶浓度为80g/L),以考马斯亮蓝R-250染色。将染色的凝胶置于双波长薄层扫描仪(日本岛律公司产品)进行扫描,计算TK融合蛋白占菌体蛋白总量的百分比。
, http://www.100md.com
2 结果
2.1 PCR鉴定重组质粒pWR450-1/TK 用引物TK1 For和TK2 Rev,从3个克隆提取的质粒中,均可扩增出预期的503bp片段,结果见图1。

图1 重组质粒pWR450-1/TK的PCR扩增
Fig1 PCRamplificationofrecombinantplasmidpWR450-1/TK
1,2,3:pWR450-1/TKclones①,②and③;4:DNAmarker;5:Positivecontrol(pUC18/TKplasmid)
2.2 酶切鉴定重组质粒pWR450-1/TK 将PCR鉴定为阳性的3个重组质粒,用EcoRⅠ和HindIII双酶切鉴定,均可切出约为1150bp的片段,结果见图2。

, http://www.100md.com
图2 重组质粒pWR450-1/TK的酶切鉴定
Fig2 RestrictionanalysisofthepWR450-1/TKvector
1,2,3:pWR450-1/TKclones①,②and③;4:DNAmarker;
5:Positivecontrol(pUC18/TKplasmid)
2.3 HSV-1TK基因融合蛋白的表达 以IPTG诱导pWR450-1/TK/JM109,可表达Mr约为97000的融合蛋白。空载体pWR450-1/JM109表达Mr约为55000的蛋白,结果见图3。双波长薄层扫描分析显示,TK基因融合蛋白含量占菌体蛋白总量的27.47%。


, http://www.100md.com
图3 HSV-1TK基因融合蛋白表达产物的SDS-PAGE分析
Fig3 SDS-PAGEoftheexpressionproductsofHSV-1TKgene fusionprotein
1:Non-inducedpWR450-1/JM109;2:pWR450-1/JM109inducedwithIPTG;3:Proteinmarker;
4:Non-inducedpWR450-1/TK/JM109;5:pWR450-1/TK/JM109inducedwithIPTG
3 讨论
自1986年,Moolten等报道TK基因转移可使肿瘤细胞获得对化学药物的敏感性以来[8],TK基因作为药敏基因在肿瘤基因治疗中越来越受到重视,已成为肿瘤基因治疗中一项引人注目的方案。然而,由于目前尚无抗TK的免疫血清和其mAb出售,给观察和研究TK基因在真核细胞中的表达带来了一定困难。虽然可通过鉴定转染细胞基因组DNA和RNA来证实TK基因的存在,但由于真核细胞基因表达调控的复杂性和一些未知因素的影响,即使能证实TK基因确实存在,也可能出现不表达的情况[10],这将导致TK基因治疗效果的降低,甚至无效。因此,从蛋白质水平分析TK基因的表达则显得更为重要。由于融合表达具有基因操作比较简单,表达产物在细菌内比较稳定,容易实现高效表达等优点,所以本文将HSV-1TK基因克隆入原核表达载体pWR450-1,构建了表达HSV-1TK基因的重组质粒pWR450-1/TK,经PCR和酶切鉴定证实,3个转化克隆均含有HSV-1TK基因插入片段。所用表达载体pWR450-1是一种带有lac启动子的融合蛋白表达载体,由lac启动子及编码β-半乳糖苷酶N端部分氨基酸的lacZ结构基因等组成,所编码的β-半乳糖苷酶Mr约为55000。在结构基因的下游有一多克隆酶切位点可供插入外源基因,其中含有EcoRI和HindIII酶切位点。在读框一致的情况下,可表达出含β-半乳糖苷酶(447个氨基酸)和外源蛋白的融合蛋白。以IPTG诱导所构建的pWR450-1/TK/JM109,可表达出Mr约为97000的融合蛋白,与预期的TK与β-半乳糖苷酶融合蛋白大小相似。表达产物的纯化、复性和活性鉴定工作正在进行中。薄层扫描表明,该融合蛋白含量占菌体蛋白总量的27.47%。根据融合蛋白和β-半乳糖苷酶的Mr估算,TK实际产率约占菌体蛋白总量的11.90%。HSV-1TK基因在原核表达的成功,为进一步制备抗TK的免疫血清和其mAb,以及鉴定TK基因在真核细胞中的表达奠定了实验基础。
, 百拇医药
*国家自然科学基金资助项目,No,39570807
作者简介:陈伟,男,36岁,硕士。西安市长乐西路17号,Tel.(029)3374536
参考文献
[1]Qian C, Idoate M, Bilbao R, et al. Gene transfer and therapy with adenoviral vector in rats with diethylnitrosamine-induced hepatocellular carcinoma. Human Gene Therapy, 1997;8:349~358
[2]Wills KN,Huang W, Harris MP, et al. Gene therapy for hepatocellular carcinoma: chemosensitivity conferred by adenovirus-mediated transfer of HSV-1 thymidine kinase gene. Cancer Gene Therapy,1995;2(3):191~197
, 百拇医药
[3]Barba D, Hardin J, Sadelain M, et al. Development of anti- tumor immunity following thymidine kinase- mediated killing of experimental brain tumor. Proc Natl Acad Sci ,1994;91(10):4348~4352
[4]Culver KW,Ram Z, Wallbridge S, et al. In vivo gene transfer with retroviral vector producer cells for treatment of experimental brain tumors. Science,1992; 256:1550 1552
[5]Kun LE, Gajjar A, Muhlbauer M, et al. Stereotactic injection of herpes simplex thymidine kinase vector producer(PA317- G1TK1SvNa.7) and intravenous ganciclovir for the treatment of progressive or recurrent primary supratentorial pediatric malignant brain tumors. Human Gene Therapy, 1995; 6(9):1231~ 1255
, http://www.100md.com
[6]喻启桂,胡宁婕,薛采芳,等.单纯庖疹病毒I型胸苷激酶基因的扩增、克隆和测序.第四军医大学学报,1998;19(3):257~260
[7]McGeoch DJ, Dalrymple M A, Davison A J, et al. The complete sequence of the long unique region in the genome of herpes simplex virus type- 1. J Gen Virol,1988; 69(7):1531~ 1574
[8]Moolten FL. Tumor chemosensitivity conferred by inserted herpes thymidine kinase genes: paradigm for a prospective cancer control strategy. Cancer Res, 1986; 46(10):5276~ 5281
, 百拇医药
[9]Freeman S M, Smabboud C N,Whartendy K A, et al. The “ bystander effect” :tumor regression when a fraction of the tumor mass is genetically modified. Cancer Res,1993; 53(21):5274~ 5283
[10]Xu Li, Yee J-K, Wolff JA , et al. Factors affecting long-term stability of Moloney murine leukemia virus-based vectors. Virol,1989; 171:331~ 341
收稿:1998-12-21
修回:1999-03-22, 百拇医药