小鼠endostatin基因的克隆、表达及表达产物的活性鉴定
作者:屈延 章翔 吴景文 柴玉波 吴元明 高大宽
单位:屈延(第四军医大学全军神经外科研究所, 陕西 西安 710033);章翔(第四军医大学全军神经外科研究所, 陕西 西安 710033);吴景文(第四军医大学全军神经外科研究所, 陕西 西安 710033);柴玉波(第四军医大学全军神经外科研究所, 陕西 西安 710033);吴元明(第四军医大学全军神经外科研究所, 陕西 西安 710033);高大宽(第四军医大学全军神经外科研究所, 陕西 西安 710033)
关键词:内皮抑素;反转录-聚合酶链式反应;基因克隆;基因表达;鸡胚绒毛尿囊
摘 要摘 要:目的 克隆并表达小鼠endostatin基因,并初步检测其血管生长抑制 功 能,为胶质瘤的基因治疗探索新的途径. 方法 从小鼠肝组织用RT-PCR法 扩增 endostatin基因,重组入pUC19质粒, 经测序证实无误后,重组入表达载体pDH,经温度诱导 表达,并用鸡胚绒毛尿囊膜(CAM)实验检测表达产物活性. 结果 从小鼠肝组 织中成功扩增到endostatin基因,测序与报道序列一致. 重组进pDH后经温度诱导表达,在S DS-PAGE电泳上得到一条新的蛋白表达带,分子质量为20 ku. 纯化后的蛋白能明显抑制CAM 的 血管生长. 结论 成功构建了小鼠endostatin cDNA的重组克隆pDH-Endo,并 在大肠杆菌中获得高效表达. 在CAM 实验中表明纯化后的蛋白具 有明显血管抑制作用. 为利用endostatin进行脑胶质瘤等实体瘤的基因治疗奠定了实验基础 .
, 百拇医药
膜实验
中图号:Q784 文献标识码: A
文章编号:1000-2790(2000)04-0456-04
Cloning and expression of mouse endostatin gene and identification of its biolog ical activity
QU Yan, ZHANG Xiang, WU Jing-Wen, CHAI Yu-Bo, WU Yuan-Ming, GAO Da-Kuan
(Chinese PLA Institute of Neurosurgery, Fourth Military Medical University, Xi'an 710033, China)
, 百拇医药
Abstract:AIM To clone and to express mouse endostatin g ene and identifica tion of in vitro activity of recombinant endostatin protein to explore new g en e therapy methods for gliomas. METHODS The cDNA encoding mouse endostatin gene was ampl ified and cloned into vector pUC19 and was sequenced. Then the DNA fragment was cloned into expression vector pDH. The pDH-Endo was induced at 42℃ to express the target protein. After the purification and refolding, the biological activit y of the recombinant protein was identified by the CAM experiment. RESULTS The sequence of the amplified DNA fragment consisted with that of the known gene. After the induction, a new band corresponding to the 20 ku protein was observed in the bacteria carrying pDH-Endo on SDS-PAGE gel. Biological assay results in di cated that the recombinant endostatin protein could suppress the new blood vesse l formation in CAM in vitro. CONCLUSION The recombinant pDH -Endo has been succ essfully constructed and highly expressed in Escherichia coli. In the CAM, t he r ecombinant protein has high suppressive effects on the vessels in chick embryo c horioallantoic membrane.
, 百拇医药
Keywords:endostatin; RT-PCR; gene amplification; clon ing; chick embryo; chorioallantoic membrane assay (CAM)
0 引言
胶质瘤是危害人类生命的常见肿瘤,临床上虽采取积极的治疗,但疗效不佳,死 亡率很高. 近年来,胶质瘤的基因治疗受到高度重视. 由于胶质瘤的发生和发展必须依赖大 量的血管生成,因此,选择肿瘤血管作为治疗靶,从而抑制肿瘤生长,即可达到治疗胶质瘤 目的,此项研究成为近年胶质瘤治疗的热点. Endostatin是O′Reilly等[1] 在 治疗实体瘤研 究中发现的, 它具有强烈抑制血管内皮细胞增殖的作用. 在小鼠皮下重复注射该重组表达蛋白,在没有毒 性或耐药性的情况下几乎完全抑制了该鼠皮下Lewis肺癌、T241纤维肉瘤和B16F10黑色素瘤 生长. 作为一种新的血管生成抑制因子,endostatin在脑胶质瘤治疗方面具有广阔前景.
, 百拇医药
1 材料和方法
1.1 材料 克隆载体pUC19,表达质粒pDH,E.coli DH5α由本校生物化学与 分子生物学教研室提供. 限制性内切酶,T4 DNA ligase,Tag DNA聚合酶, RNaseA 等 分别购自华美公司、美 国Biolabs公司和Promega公司. 测序试剂盒、RNA提取试剂盒和PCR纯化试剂盒分别购自美国 ABI公司、Gibco公司和Clontech公司. 其他试剂均为国产. 2只体质量15~20 g的雄性昆明种 小白鼠,由本校实验动物中心提供.
1.2 方法
1.2.1 引物设计与合成 根据已知小鼠endostatin基因编码序列,在其两端设计一 对引物并在上下游5′端引入EcoRI和SalI酶切位点.
E 1: 5′ ATGAATTCATGCATACTCATCAGGACTTTC 3′
, 百拇医药
E 2: 5′ ATGTCGACTTATTTGGAGAAAGAGGTCATG 3′
引物由北京赛百盛生物工程公司合成.
1.2.2 RT-PCR扩增endostatin基因 从小鼠肝组织提取总RNA,反转录获得 cDNA,方法 参照文献[2]. 以所获cDNA为模板,应用引物E1,E2扩增Endostatin 基因. PCR反 应条件为94℃ 30 s,58℃ 45 s和72℃ 30 s,循环30次. PCR反应体系为:小鼠肝组织cDNA 模板5 μL,20 pmol.L-1引物各1 μL,10 mmol.L-1 dNTP 2 μL,10×PCR 反应缓冲液5 μL和Taq DNA 聚 合酶33.34 pmol.S-1,加水至总体积50 μL. 扩增产物用Clontech DNA纯化试剂盒 回收纯化.
, 百拇医药
1.2.3 Endostatin基因的克隆及序列测定 纯化的扩增产物和pUC19载体以EcoR I和 SalI双酶切,T4 DNA ligase连接后,转化DH5α中;加入X-gal, IPTG,挑选白色克隆 . 碱裂解法小量提取质粒. 用EcoRI和SalI双酶切鉴定. ABI373自动测序仪测定DNA序 列.
1.2.4 Endostatin原核表达质粒的构建与表达鉴定 经测序证实的质粒DNA以 E coRI和SalI双酶切纯化后,与同样处理的pDH经T4 DNA ligase相连接,转化大肠杆菌 DH5 α中,挑选阳性克隆(pDH-endostatin,简称pDH-Endo). 碱裂解法小量提取质粒,用E coRI和SalI双酶切鉴定. 阳性克隆重新转接含氨苄青霉素(100 mg.L-1)的L B中 ,32℃培养至A600 nm≈0.6左右,转入42℃水浴中快速振摇5 h后收菌. 与诱导前 细菌同时进行SDS-PAGE电泳.
, 百拇医药
1.2.5 Endostatin蛋白纯化与鉴定 取上述endostatin表达菌种接种于含氨 苄青霉素(100 mg.L-1)1 L LB中诱导, 收集菌体用50 mL裂菌液(300 g.L- 1蔗糖、5 g.L-1 DOC, 100 mmol.L-1 pH 8.0 NaCl)悬浮,超声裂菌,离 心10 000 g 共20 min, 取上清和沉淀,分别作蛋白 电泳,确定目的蛋白存在于包涵体中. 沉淀经20 g.L-1DOC洗涤2遍, 2 mol.L- 1Urea洗涤1次,弃上清,加入变性液( 50 mmol.L-1 Tris.HCl,2 mmol.L -1 EDTA,7 mol.L-1尿素, 5 g.L-1β-巯基乙醇, pH=8.0 )室温放置 3 h以上, 离心去沉淀,测蛋白浓度. 在 变性条件下过阳离子交换柱. 将变性蛋白浓度调至0. 5 g.L-1装入透析袋(截留分子质量8 ku)用50 g.L-1甘油透析48 h,冷冻 干燥. 取样进行SDS-PAGE电泳鉴定.
, 百拇医药
1.2.6 Endostatin表达蛋白活性检测 采用CAM实验进行,孵育7 d的受精鸡胚, 蛋 壳开1 cm2左右窗口,纯化重组endostatin蛋白加样于灭菌滤纸片上,放置于CAM上,在恒 温恒湿培养箱37℃下培养48 h,观察血管生长情况.
2 结果
2.1 Endostatin基因扩增 以小鼠肝脏cDNA为模板,PCR扩增endosta ti n基因,所获扩增产物在15 g.L-1琼脂糖凝胶电泳观察,与预期551 bp基本一致(Fi g 1).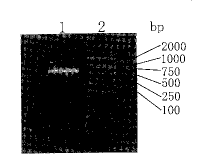
图 1 目的基因的PCR扩增
, 百拇医药
Fig 1 Amplification of endostatin gene
1: PCR product; 2: PCR marker (DL2000,Takara).
2.2 Endostatin重组克隆的酶切鉴定和测序 上述基因 片段和质粒pUC19经EcoRI和SalI双 酶切、连接后转化DH5α,挑选白色克隆进行同样双酶切鉴定. 15 g.L-1琼脂糖 凝胶电泳 显示:切出大小约551 bp片段. 应用通用引物测序,所获基因序列与文献[3]报道 序列完全一致.
2.3 pDH-Endo原核表达载体的构建 用EcoRI和 SalI双酶切质粒pUC19-endostatin,琼脂 糖凝胶电泳分离,回收551 bp片段;与相同酶切消化的大肠杆菌表达载体pDH连接,转化DH5 α. 挑取正确克隆,将其命名为pDH-Endo(Fig 2).
, http://www.100md.com
2.4 重组pDH-Endo在大肠杆菌中的表达与纯化 pDH-En do重组质粒在E.coli DH5α宿主菌内进行 温度诱导, 作SDS-PAGE,与未诱导pDH/DH5α对照菌株比较,工程菌在分子质量20 ku处出 现 一条明显的新生蛋白带(Fig 3). 表达菌体裂解上清和沉淀各部分进行120 g.L-1SDS -PAGE分析,表明pDH-Endo的表达产物为包涵体. 经纯化及复性后,作SDS-PAGE,获纯 度98%以上的目的蛋白(Fig 4).
图 2 pDH-Endo重组克隆酶切鉴定
Fig 2 Restriction mapping of recombinant plasmid pDH-Endo
, 百拇医药
1: Recombinant plasmid pDH-Endo; 2: pDH plasmid;3: Marker (DL2000,TAKARA).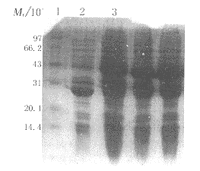
图 3 pDH-Endo重组克隆表达产物蛋白电泳结果
Fig 3 SDS-PAGE of expressed endostatin in E.coli DH5α
1: Protein weight marker(MG0041,SABC); 2: Non-induced engineered bacteria with pDH-Endo; 3: Induced engineered bacteria with pDH-Endo.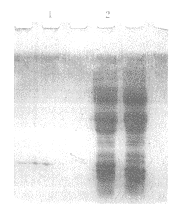
, 百拇医药
图 4 纯化及复性后的重组内皮抑素电泳结果
Fig 4 Purification and re-folder of the expression r-endostat ion
1: Non- purification and re-folder; 2: After purification and re-folder.
2.5 重组endostatin活性测定 0.1~10 μg endo statin加样于灭菌滤纸小片,置于孵育7 d鸡胚的CAM上,37℃继续孵育48 h,剥开蛋壳观察 结果,未加endostatin对照组CAM血管呈叶状分布,实验组1 μg endostatin即可抑制CAM血 管生长,血管密度明显降低(Fig 5).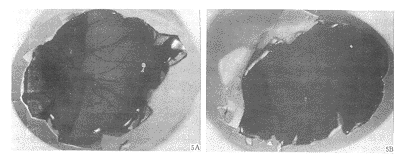
, 百拇医药
图 5 CAM实验结果
Fig 5 CAM assay
A: Non-induced(positive angiogenic response); B: Induced with 100 ng endostatin (negative angiogenic response).
3 讨论
许多研究发现,血管生成是恶性肿瘤侵袭生长的必要条件. 为了刺激血管生成,恶性肿 瘤 能产生多种促血管生长因子,如成纤维细胞生长因子(FGF)和血管内皮细胞生长因子(VEG F)等[4]. 少数恶性肿瘤还能产生血管生成抑制因子[5],如Angiostatin 和Thrombospondin[6] 等. 这些研究证实,肿瘤的血管生成是上述因子相互作 用的结果[7]. Endostatin是肿瘤产生的另一种血管生成抑制因子,可直接作用于血管内皮细胞,阻断其G1 期增殖,而完全抑制内皮细胞生长. Endostatin优于其他血管形成抑制因子,如VEGF抗体、 反义VEGF和反义PDGF基因,因为肿瘤可以通过遗传突变产生其他血管形成因子,而血管内皮 细胞在遗传上相对稳定且很少突变. Endostatin最初是从鼠血管内皮瘤细胞系(EOMA)分离得 到的,经证实它是内生性胶原XVⅢ的C末端终末序列,分子质量为20 ku. 但由于endostatin 不存在于正常机体,不能直接提取,难以满足实验研究和临床应用的需要;而采用基因工程 技术生产的重组内皮抑素能大量生产、纯度高、活性稳定、质量容易控制,明显优于从组织 中提取,所以是内皮抑素研究和应用发展的必然方向.
, http://www.100md.com
因此,我们选用大肠杆菌非融合表达质粒pDH作为重组载体,将从鼠肝脏组织中直接扩 增 出的endostatin基因序列克隆入pDH中,在大肠杆菌中获得了高效表达. 这样,可以在体 外 直接获取这种蛋白. 同时,纯化、复性后的蛋白在CAM实验中显示了强烈的血管生成抑制作 用 ,证明体外重组endostatin具有良好的生物活性. 在后继实验中,该重组表达蛋白有望用于 治疗C6鼠脑胶质瘤等实体瘤研究中,这项研究为抗血管生成基因治疗实体瘤开辟了新途径.
基金项目:国家自然科学基金资助项目(39970854)
作者简介:屈延(1974-),男(汉族),陕西省西安市人. 硕士研究生(导师章翔). Tel.(029)3375330
参考文献:
[1] O′Reilly MS, Boehm T, Shing Y et al. Endostatin: An end ogen ous inhibitor of angiogenesis and tumor growth[J]. Cell, 1997; 88(2):27 7-285.
, 百拇医药
[2] Sambrook J, Fritsich EF, Maniatis T. Molecular Cloning, a Labora tory Manual[M]. Column 1. 2nd. New york: Cold Spring Harbor Laboratory Pr ess, 1989: 60-87.
[3] Dhanabal M, Ramchandran R, Volk R et al. Endostatin: Yeast pro duct ion, mutants, and antitumor effect in renal cell carcinoma[J]. Cancer Res, 1999;59(1):189-197.
[4] Kandel J, Bossy-Wetzel E, Radvanyi F et al. Neovascularizatio n is associ ated with a switch to the export of bFGF in the multistep development of fibrosa rcoma[J]. Cell, 1991;66(6):1095-1104.
, 百拇医药
[5] Chen C, Parangi S, Tolentino MJ et al. A strategy to discover circulati ng angiogenesis inhibitors generated by human tumors[J]. Cancer Res, 1995; 55(19):4230-4233.
[6] Good DJ, Polverini PJ, Rastinejad F et al. A tumor suppressor dependent inhibitor of angiogenesis is immunologically and functionally indist inguishable from a fragment of thrombospondin[J]. Proc Natl Acad Sci USA, 1990;87:6624-6628.
[7] Rastinejad F, Polverini PJ, Bouck NP. Regulation of the activity o f a new inhibitor of angiogenesis by a cancer suppressor gene[J]. Cell, 19 89;56(3):345-355.
收稿日期:1999-10-21; 修回日期:2000-01-11, http://www.100md.com
单位:屈延(第四军医大学全军神经外科研究所, 陕西 西安 710033);章翔(第四军医大学全军神经外科研究所, 陕西 西安 710033);吴景文(第四军医大学全军神经外科研究所, 陕西 西安 710033);柴玉波(第四军医大学全军神经外科研究所, 陕西 西安 710033);吴元明(第四军医大学全军神经外科研究所, 陕西 西安 710033);高大宽(第四军医大学全军神经外科研究所, 陕西 西安 710033)
关键词:内皮抑素;反转录-聚合酶链式反应;基因克隆;基因表达;鸡胚绒毛尿囊
摘 要摘 要:目的 克隆并表达小鼠endostatin基因,并初步检测其血管生长抑制 功 能,为胶质瘤的基因治疗探索新的途径. 方法 从小鼠肝组织用RT-PCR法 扩增 endostatin基因,重组入pUC19质粒, 经测序证实无误后,重组入表达载体pDH,经温度诱导 表达,并用鸡胚绒毛尿囊膜(CAM)实验检测表达产物活性. 结果 从小鼠肝组 织中成功扩增到endostatin基因,测序与报道序列一致. 重组进pDH后经温度诱导表达,在S DS-PAGE电泳上得到一条新的蛋白表达带,分子质量为20 ku. 纯化后的蛋白能明显抑制CAM 的 血管生长. 结论 成功构建了小鼠endostatin cDNA的重组克隆pDH-Endo,并 在大肠杆菌中获得高效表达. 在CAM 实验中表明纯化后的蛋白具 有明显血管抑制作用. 为利用endostatin进行脑胶质瘤等实体瘤的基因治疗奠定了实验基础 .
, 百拇医药
膜实验
中图号:Q784 文献标识码: A
文章编号:1000-2790(2000)04-0456-04
Cloning and expression of mouse endostatin gene and identification of its biolog ical activity
QU Yan, ZHANG Xiang, WU Jing-Wen, CHAI Yu-Bo, WU Yuan-Ming, GAO Da-Kuan
(Chinese PLA Institute of Neurosurgery, Fourth Military Medical University, Xi'an 710033, China)
, 百拇医药
Abstract:AIM To clone and to express mouse endostatin g ene and identifica tion of in vitro activity of recombinant endostatin protein to explore new g en e therapy methods for gliomas. METHODS The cDNA encoding mouse endostatin gene was ampl ified and cloned into vector pUC19 and was sequenced. Then the DNA fragment was cloned into expression vector pDH. The pDH-Endo was induced at 42℃ to express the target protein. After the purification and refolding, the biological activit y of the recombinant protein was identified by the CAM experiment. RESULTS The sequence of the amplified DNA fragment consisted with that of the known gene. After the induction, a new band corresponding to the 20 ku protein was observed in the bacteria carrying pDH-Endo on SDS-PAGE gel. Biological assay results in di cated that the recombinant endostatin protein could suppress the new blood vesse l formation in CAM in vitro. CONCLUSION The recombinant pDH -Endo has been succ essfully constructed and highly expressed in Escherichia coli. In the CAM, t he r ecombinant protein has high suppressive effects on the vessels in chick embryo c horioallantoic membrane.
, 百拇医药
Keywords:endostatin; RT-PCR; gene amplification; clon ing; chick embryo; chorioallantoic membrane assay (CAM)
0 引言
胶质瘤是危害人类生命的常见肿瘤,临床上虽采取积极的治疗,但疗效不佳,死 亡率很高. 近年来,胶质瘤的基因治疗受到高度重视. 由于胶质瘤的发生和发展必须依赖大 量的血管生成,因此,选择肿瘤血管作为治疗靶,从而抑制肿瘤生长,即可达到治疗胶质瘤 目的,此项研究成为近年胶质瘤治疗的热点. Endostatin是O′Reilly等[1] 在 治疗实体瘤研 究中发现的, 它具有强烈抑制血管内皮细胞增殖的作用. 在小鼠皮下重复注射该重组表达蛋白,在没有毒 性或耐药性的情况下几乎完全抑制了该鼠皮下Lewis肺癌、T241纤维肉瘤和B16F10黑色素瘤 生长. 作为一种新的血管生成抑制因子,endostatin在脑胶质瘤治疗方面具有广阔前景.
, 百拇医药
1 材料和方法
1.1 材料 克隆载体pUC19,表达质粒pDH,E.coli DH5α由本校生物化学与 分子生物学教研室提供. 限制性内切酶,T4 DNA ligase,Tag DNA聚合酶, RNaseA 等 分别购自华美公司、美 国Biolabs公司和Promega公司. 测序试剂盒、RNA提取试剂盒和PCR纯化试剂盒分别购自美国 ABI公司、Gibco公司和Clontech公司. 其他试剂均为国产. 2只体质量15~20 g的雄性昆明种 小白鼠,由本校实验动物中心提供.
1.2 方法
1.2.1 引物设计与合成 根据已知小鼠endostatin基因编码序列,在其两端设计一 对引物并在上下游5′端引入EcoRI和SalI酶切位点.
E 1: 5′ ATGAATTCATGCATACTCATCAGGACTTTC 3′
, 百拇医药
E 2: 5′ ATGTCGACTTATTTGGAGAAAGAGGTCATG 3′
引物由北京赛百盛生物工程公司合成.
1.2.2 RT-PCR扩增endostatin基因 从小鼠肝组织提取总RNA,反转录获得 cDNA,方法 参照文献[2]. 以所获cDNA为模板,应用引物E1,E2扩增Endostatin 基因. PCR反 应条件为94℃ 30 s,58℃ 45 s和72℃ 30 s,循环30次. PCR反应体系为:小鼠肝组织cDNA 模板5 μL,20 pmol.L-1引物各1 μL,10 mmol.L-1 dNTP 2 μL,10×PCR 反应缓冲液5 μL和Taq DNA 聚 合酶33.34 pmol.S-1,加水至总体积50 μL. 扩增产物用Clontech DNA纯化试剂盒 回收纯化.
, 百拇医药
1.2.3 Endostatin基因的克隆及序列测定 纯化的扩增产物和pUC19载体以EcoR I和 SalI双酶切,T4 DNA ligase连接后,转化DH5α中;加入X-gal, IPTG,挑选白色克隆 . 碱裂解法小量提取质粒. 用EcoRI和SalI双酶切鉴定. ABI373自动测序仪测定DNA序 列.
1.2.4 Endostatin原核表达质粒的构建与表达鉴定 经测序证实的质粒DNA以 E coRI和SalI双酶切纯化后,与同样处理的pDH经T4 DNA ligase相连接,转化大肠杆菌 DH5 α中,挑选阳性克隆(pDH-endostatin,简称pDH-Endo). 碱裂解法小量提取质粒,用E coRI和SalI双酶切鉴定. 阳性克隆重新转接含氨苄青霉素(100 mg.L-1)的L B中 ,32℃培养至A600 nm≈0.6左右,转入42℃水浴中快速振摇5 h后收菌. 与诱导前 细菌同时进行SDS-PAGE电泳.
, 百拇医药
1.2.5 Endostatin蛋白纯化与鉴定 取上述endostatin表达菌种接种于含氨 苄青霉素(100 mg.L-1)1 L LB中诱导, 收集菌体用50 mL裂菌液(300 g.L- 1蔗糖、5 g.L-1 DOC, 100 mmol.L-1 pH 8.0 NaCl)悬浮,超声裂菌,离 心10 000 g 共20 min, 取上清和沉淀,分别作蛋白 电泳,确定目的蛋白存在于包涵体中. 沉淀经20 g.L-1DOC洗涤2遍, 2 mol.L- 1Urea洗涤1次,弃上清,加入变性液( 50 mmol.L-1 Tris.HCl,2 mmol.L -1 EDTA,7 mol.L-1尿素, 5 g.L-1β-巯基乙醇, pH=8.0 )室温放置 3 h以上, 离心去沉淀,测蛋白浓度. 在 变性条件下过阳离子交换柱. 将变性蛋白浓度调至0. 5 g.L-1装入透析袋(截留分子质量8 ku)用50 g.L-1甘油透析48 h,冷冻 干燥. 取样进行SDS-PAGE电泳鉴定.
, 百拇医药
1.2.6 Endostatin表达蛋白活性检测 采用CAM实验进行,孵育7 d的受精鸡胚, 蛋 壳开1 cm2左右窗口,纯化重组endostatin蛋白加样于灭菌滤纸片上,放置于CAM上,在恒 温恒湿培养箱37℃下培养48 h,观察血管生长情况.
2 结果
2.1 Endostatin基因扩增 以小鼠肝脏cDNA为模板,PCR扩增endosta ti n基因,所获扩增产物在15 g.L-1琼脂糖凝胶电泳观察,与预期551 bp基本一致(Fi g 1).

图 1 目的基因的PCR扩增
, 百拇医药
Fig 1 Amplification of endostatin gene
1: PCR product; 2: PCR marker (DL2000,Takara).
2.2 Endostatin重组克隆的酶切鉴定和测序 上述基因 片段和质粒pUC19经EcoRI和SalI双 酶切、连接后转化DH5α,挑选白色克隆进行同样双酶切鉴定. 15 g.L-1琼脂糖 凝胶电泳 显示:切出大小约551 bp片段. 应用通用引物测序,所获基因序列与文献[3]报道 序列完全一致.
2.3 pDH-Endo原核表达载体的构建 用EcoRI和 SalI双酶切质粒pUC19-endostatin,琼脂 糖凝胶电泳分离,回收551 bp片段;与相同酶切消化的大肠杆菌表达载体pDH连接,转化DH5 α. 挑取正确克隆,将其命名为pDH-Endo(Fig 2).
, http://www.100md.com
2.4 重组pDH-Endo在大肠杆菌中的表达与纯化 pDH-En do重组质粒在E.coli DH5α宿主菌内进行 温度诱导, 作SDS-PAGE,与未诱导pDH/DH5α对照菌株比较,工程菌在分子质量20 ku处出 现 一条明显的新生蛋白带(Fig 3). 表达菌体裂解上清和沉淀各部分进行120 g.L-1SDS -PAGE分析,表明pDH-Endo的表达产物为包涵体. 经纯化及复性后,作SDS-PAGE,获纯 度98%以上的目的蛋白(Fig 4).

图 2 pDH-Endo重组克隆酶切鉴定
Fig 2 Restriction mapping of recombinant plasmid pDH-Endo
, 百拇医药
1: Recombinant plasmid pDH-Endo; 2: pDH plasmid;3: Marker (DL2000,TAKARA).

图 3 pDH-Endo重组克隆表达产物蛋白电泳结果
Fig 3 SDS-PAGE of expressed endostatin in E.coli DH5α
1: Protein weight marker(MG0041,SABC); 2: Non-induced engineered bacteria with pDH-Endo; 3: Induced engineered bacteria with pDH-Endo.

, 百拇医药
图 4 纯化及复性后的重组内皮抑素电泳结果
Fig 4 Purification and re-folder of the expression r-endostat ion
1: Non- purification and re-folder; 2: After purification and re-folder.
2.5 重组endostatin活性测定 0.1~10 μg endo statin加样于灭菌滤纸小片,置于孵育7 d鸡胚的CAM上,37℃继续孵育48 h,剥开蛋壳观察 结果,未加endostatin对照组CAM血管呈叶状分布,实验组1 μg endostatin即可抑制CAM血 管生长,血管密度明显降低(Fig 5).

, 百拇医药
图 5 CAM实验结果
Fig 5 CAM assay
A: Non-induced(positive angiogenic response); B: Induced with 100 ng endostatin (negative angiogenic response).
3 讨论
许多研究发现,血管生成是恶性肿瘤侵袭生长的必要条件. 为了刺激血管生成,恶性肿 瘤 能产生多种促血管生长因子,如成纤维细胞生长因子(FGF)和血管内皮细胞生长因子(VEG F)等[4]. 少数恶性肿瘤还能产生血管生成抑制因子[5],如Angiostatin 和Thrombospondin[6] 等. 这些研究证实,肿瘤的血管生成是上述因子相互作 用的结果[7]. Endostatin是肿瘤产生的另一种血管生成抑制因子,可直接作用于血管内皮细胞,阻断其G1 期增殖,而完全抑制内皮细胞生长. Endostatin优于其他血管形成抑制因子,如VEGF抗体、 反义VEGF和反义PDGF基因,因为肿瘤可以通过遗传突变产生其他血管形成因子,而血管内皮 细胞在遗传上相对稳定且很少突变. Endostatin最初是从鼠血管内皮瘤细胞系(EOMA)分离得 到的,经证实它是内生性胶原XVⅢ的C末端终末序列,分子质量为20 ku. 但由于endostatin 不存在于正常机体,不能直接提取,难以满足实验研究和临床应用的需要;而采用基因工程 技术生产的重组内皮抑素能大量生产、纯度高、活性稳定、质量容易控制,明显优于从组织 中提取,所以是内皮抑素研究和应用发展的必然方向.
, http://www.100md.com
因此,我们选用大肠杆菌非融合表达质粒pDH作为重组载体,将从鼠肝脏组织中直接扩 增 出的endostatin基因序列克隆入pDH中,在大肠杆菌中获得了高效表达. 这样,可以在体 外 直接获取这种蛋白. 同时,纯化、复性后的蛋白在CAM实验中显示了强烈的血管生成抑制作 用 ,证明体外重组endostatin具有良好的生物活性. 在后继实验中,该重组表达蛋白有望用于 治疗C6鼠脑胶质瘤等实体瘤研究中,这项研究为抗血管生成基因治疗实体瘤开辟了新途径.
基金项目:国家自然科学基金资助项目(39970854)
作者简介:屈延(1974-),男(汉族),陕西省西安市人. 硕士研究生(导师章翔). Tel.(029)3375330
参考文献:
[1] O′Reilly MS, Boehm T, Shing Y et al. Endostatin: An end ogen ous inhibitor of angiogenesis and tumor growth[J]. Cell, 1997; 88(2):27 7-285.
, 百拇医药
[2] Sambrook J, Fritsich EF, Maniatis T. Molecular Cloning, a Labora tory Manual[M]. Column 1. 2nd. New york: Cold Spring Harbor Laboratory Pr ess, 1989: 60-87.
[3] Dhanabal M, Ramchandran R, Volk R et al. Endostatin: Yeast pro duct ion, mutants, and antitumor effect in renal cell carcinoma[J]. Cancer Res, 1999;59(1):189-197.
[4] Kandel J, Bossy-Wetzel E, Radvanyi F et al. Neovascularizatio n is associ ated with a switch to the export of bFGF in the multistep development of fibrosa rcoma[J]. Cell, 1991;66(6):1095-1104.
, 百拇医药
[5] Chen C, Parangi S, Tolentino MJ et al. A strategy to discover circulati ng angiogenesis inhibitors generated by human tumors[J]. Cancer Res, 1995; 55(19):4230-4233.
[6] Good DJ, Polverini PJ, Rastinejad F et al. A tumor suppressor dependent inhibitor of angiogenesis is immunologically and functionally indist inguishable from a fragment of thrombospondin[J]. Proc Natl Acad Sci USA, 1990;87:6624-6628.
[7] Rastinejad F, Polverini PJ, Bouck NP. Regulation of the activity o f a new inhibitor of angiogenesis by a cancer suppressor gene[J]. Cell, 19 89;56(3):345-355.
收稿日期:1999-10-21; 修回日期:2000-01-11, http://www.100md.com