腺病毒介导的p16对胆管癌细胞的生长抑制作用
作者:鲁建国 林晨 黄志强 吴金生 付明 张雪艳 梁萧 要秀 吴旻
单位:鲁建国(第四军医大学唐都医院普外科,陕西 西安 710038);吴金生(第四军医大学唐都医院普外科,陕西 西安 710038);要秀(第四军医大学唐都医院普外科,陕西 西安 710038);林晨(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室);付明(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室);张雪艳(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室)
关键词:胆管癌;p16基因;腺病毒;基因治疗;凋亡
第四军医大学学报000402 摘 要: 目的 研究p16基因对胆管癌细胞的作用. 方法 将重组 体 腺病毒p16转移到人胆管癌细胞QBC939, 对p16基因的表达、细胞的生长抑制及机制进行分析 . 结果 用Ad-LacZ进行 重组体腺病毒转导效率的检测,发现当MOI为100以上时,重组体腺病毒可使90%以上的培养 的人胆管癌QBC939细胞被转导. 用RT-PCR方法检测,在胆管癌QBC939细胞系中p16呈低表达 . 重组体腺病毒能介导外源基因p16在胆管癌QBC939细胞系中高效表达. 重组体腺病毒介导 的p16在QBC939细胞中表达, 能抑制QBC939细胞的生长和集落形成. 流式细胞计数和细胞DN A Ladder, 证实p16能诱导QBC939细胞发生凋亡并导致其发生G1期阻滞. 结论 p16基因通过诱导肿瘤细胞凋亡及G1期阻滞在肿瘤的基因治疗方面发挥作用.
, http://www.100md.com
中图号:R575.7 文献标识码:A
文章编号:1000-2790(2000)04-0394-05
Inhibitory effects of recombinant adenoviruses p16 transduction on human cholang iocarcinoma cell line
LU Jian-Guo YAO Xiu WU Jin-Sheng
(Department of General Surgery, Tangdu Hospital, Fourth Military Medical U niversity, X i'an 710038, China)
LIN Chen FU Ming ZHANG Xue-Yan LIANG Xiao WU Ming
, 百拇医药
(National Laboratory of Molecular Oncology, Cancer Institute, Chinese Xiehe Medical University,Chinese Academy of Medical Sciences)
HUANG Zhi-Qiang
(Inst itute of General Surgery,General Hospital of Chinese PLA)
Abstract: AIM To evaluate the inhibitory effect of p16 on human cholangiocarcinoma cell line. METHODS The effects of Ad-p16 on the growth of QBC93 9 cell in vitro. RESULTS The QBC939 cell line transducted with recombinant adenoviruses LacZ (Ad-LacZ) at MOI of 100 or greater exhibite d more than 90% transduction rate. p16 expression was low in QBC939 cells but hi gh levels of p16 expressions were observed in QBC939 cell lines infected with re combinant adenoviruses p16(Ad-p16). The growth rates of QBC939 cells transducte d by Ad-p16 at MOI of 100 were inhibited and reduced by 30.0% (on 6 day) or by 35.1% (on 8 day) respectively, compared with that of Ad-LacZ-infected cells. C olony formation in these Ad-p16-infected cells greatly decreased compared with Ad-LacZ infected cells. The Ad-p16 transfected cells induced QBC939 cells apo ptosis and G1 blockade, which was comfirmed by the flow cytometry and DNA Ladder . CONCLUSION The suppression effects mediated by the expressio n of exogenous p16 in tumor cells result mainly from apoptosis and G1 blockade.
, http://www.100md.com
Keywords:cholangiocarcinoma; p16 gene; adenovirus; gene therapy; apoptosis
0 引言
胆管癌早期缺乏典型的症状及体征,早期诊断非常困难,待患者出现梗阻性黄疸就诊时 ,多已属中晚期. 手术危险性较大,手术死 亡率高(10%~25%),而且复发率很高,预后较差. 近年来,随着DNA重组技术、分子生物学 理 论和技术的飞速发展,使肿瘤的基因治疗成为可能,为肿瘤的治疗带来了新的契机. 我们将重组体腺病毒p16转移到人胆管癌细胞QBC939中,证实p16基因可以抑制该细胞 的生长并诱导其凋亡.
1 材料和方法
1.1 材料 重组腺病毒Ad-p16及Ad-LacZ由中国医学科学院肿瘤研究所分子肿 瘤学国家重点实验室构建. 人胆管癌细胞系QBC939细胞由第三军医大学西南 医院肝胆外科王曙光教授惠 赠. 培养条件为RPMI 1640培养基,含100 ml.L-1胎牛血清,37℃,50 mL.L-1 CO2. PCR引物由上海Sangon公司合成. p16(扩增产物350 bp): 上游: 5′-CATGATGA
, 百拇医药
TGGGCAGCGCC-3′,下游: 5′-CAGGGTTTCTCA
GAGCCT-3′. tubulin(扩增产物410 bp); 上游: 5′-CTCATCACAGGCAAGGAAGAT-3′, 下游: 5′- TTAAGGTAAGTGTAGGTTGGG-3′.
1.2 方法 重组体腺病毒的繁殖、纯化、滴度测定按Graham等[1]的方法进行. 于感染病毒前1 d接种一定量的细胞,按一定的MOI(multiplicity of infection)计算所需病毒量. 感染时,加上一定体积的用无血清培养基 RPMI 1640稀释好 的病毒液,37℃作用30 min~1 h,每间隔5 min摇晃1次. 之后加入完全培养基,放入37℃ 培养箱中. 用带有LacZ报告基因的重组腺病毒Ad-LacZ,按25,50 ,100,200 MOI感染细胞,对照组加PBS, 37℃培养48 h,2.5 g.L -1戊二醛固定10 min. X-gal染, 显微镜下观察被染成蓝色的细胞即为LacZ基因表达的阳性细胞. 计数蓝色细胞百分率即重组 腺病毒的转导效率. 细胞存活率测定,先在96孔板上接种QBC939细胞,4000~6000个/孔, 同 时作3个平行 孔. 37℃,CO2培养箱中培养过夜. 按上述程序感染细胞. 到测定时,弃去培养基,每 孔加入 0.5 g.L-1 MTT溶液 (用无血清培养基配制)150 μL,37℃作用4 h. 之后 弃去MTT液, 加DMSO 100 μL/孔,放水平摇床上摇10 min. 用酶标仪测A570 nm,绘制生长曲线.
, http://www.100md.com
1.2.1 克隆形成实验 在Eppendorf管中先用一定感染强度的病毒感染被测细胞,3 7℃摇床摇2 h. 将感染细胞按300个/平皿的数量再种到60 mm平皿上,每组3个平行皿. 置培 养箱中培 养10~14 d,弃培养基,结晶紫染色. 在显微镜下,记数 大于50个细胞的克隆数,以Ad-LacZ为对照,计算相应的克隆形成率及抑制率.
1.2.2 流式细胞仪分析细胞周期及凋亡 先用病毒感染细胞 (细胞数>10 万个). 24 h时后,收集所有悬浮和贴壁细胞,800~1000 r.min-1,5 min, 离心 去培养基,用PBS洗1次,同法离心,留PBS 1.5 mL重悬细胞,然后加入750 mL.L- 1乙醇 (4℃预冷)4 mL加入细胞悬液中, 边混匀. 4℃固定18 h以上. 固定后, 通过800~1000 r.min-1离心去乙醇并用PBS 将细胞洗1次. 沉淀用PBS 0.55 mL悬浮后转入Eppendorf管中,加RNA酶, 37℃水浴反应1 ~2 h,立即 放入冰浴中,终止RNA酶的作用. 再加入0.05 g.L-1碘化乙锭 ,在 冰浴中暗处染色0.5 h以上,在流式细胞仪进行检测. 数据用Multicycle分析软件进行分析.
, http://www.100md.com
1.2.3 RT-PCR分析 采用Life Technologies Inc的总RNA提取试剂盒Trizal R eage nt提取细胞总RNA. 其操作步骤如下: 将细胞培养基弃去, 用PBS洗1次,然后按每 10 cm2面积加入Trizal Reagent 0.6 mL. 室温作用5~10 min后,加入氯仿, 充分混合15 s并室温作用2~3 min. 用12 000 g,4℃离心15 min. 吸取上层水相至另一管中,加入异丙醇沉淀RNA,室温放 置10 min . 然后用大于12 000 g,4℃离心10 min. RNA沉淀用750 mL.L-1乙醇洗1次,离 心、干 燥,用一定量的水(DEPC处理过)溶解RNA. 用紫外分光光度计定量. -70℃保存. 用DEPC水稀释RNA至1 g.L-1;取RNA 10 μL加入oligo dT(15 bases,25 0 mg.L-1)1 μL, DEPC水13 μL, 70℃ 10 min;之后立即转入冰浴;待完全冷 却后加入逆转录反应试剂,反应体系40 μL (10 μg RNA, 0.25 μg,oligo dT 10 mol.L -1,DTT 0.5 mmol.L-1, dNTP 400 U, M-MLV, buffer), 37℃ 1 h, 95℃ 5 min行逆转录. PCR反应体系25 μL(每种引物2 μmol.L-1, 400 μmol.L -1 dNTP, 1 U Taq酶, buffer 2.5 μL, RT反应产物2 μL)反应条件视不同 的 扩增产物而定;扩增p16反应条件: 95℃ 5 min, 94℃ 30 s, 65℃ 1 min, 72℃ 1 mi n, 72℃ 1 min, 26个循环. 扩增产物经15 g.L-1琼脂糖凝胶电泳分离. 然后用荧 光成像系统扫描定量.
, http://www.100md.com
1.2.4 细胞DNA片段化分析 收集细胞,用PBS洗1次,转入一Eppe ndorf管中. 然后每106个细胞用PBS 20 μL重悬. 加入裂解液10 mL.L-1 NP40, 20 mol.L-1 EDTA,50 mol.L-1 Tris HCl (pH 7.5) 400 μL,混匀,反应 10 s. 用10 000 g离心5 min,收集上清至另一Eppendorf管中. 加入 SDS至10 mL.L-1浓度,并用RNA酶 (终质量浓度500 mg.L-1) 56℃作用1~2 h . 然后加入蛋白酶k至终质量浓度2.5 g.L-1, 37℃处理2 h或过夜. 用乙醇沉淀DNA ,用10~20 μL TE溶解DNA,在10 g.L-1Agarose凝胶中电泳, 紫外灯下观察照相.
, 百拇医药
2 结果
重组腺病毒纯化后的滴度分别为Ad-p16: 2.0×1013 pfu.L-1,Ad-La cZ:1.0×10 13 pfu.L-1. 在MOI大于100的感染强度时,重组体腺病毒即可达到90%以上的 转导效率(Fig 1). 我们将重组体腺病毒Ad-p16按MOI 100的感染量感 染QBC939细胞. 结果为Ad-p16对QBC939细胞有抑制作用.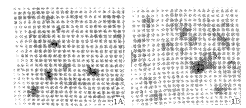
图 1 重组体腺病毒的转导效率
Fig 1 Transduction efficiency of Ad-LacZ-infected-QBC939
, 百拇医药
A:Control; B:Ad-LacZ100MOI
2.1 Ad-p16感染QBC939后p16基因的表达 提取Ad-p 16 感染 (MOI为100) 2~4 d的QBC939细胞的总RNA,经紫外可见分光光度计定量,取10 μg进行 反 转录,然后行PCR分析,扫描定量. 可见(Fig 2). Ad-p16使QBC939细胞中p16mRNA的水平明 显升高,感染前QBC939细胞中p16 mRNA的水平很弱,扫描定量为零, 2 d及4 d扫描定量分 别为1.29和0.74.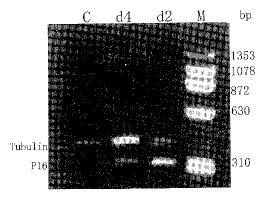
图 2 RT-PCR 分析Ad-p16 感染前后的QBC939细胞的表达
Fig 2 RT-PCR analysis of p16 expression mediated by adenovirus in QBC939
, 百拇医药
C:Control; M:Marker
2.2 Ad-p16对QBC939细胞生长的影响 用MTT 法检测 了 感染Ad-p16和Ad-LacZ (MOI 50和100) 后的QBC939 细胞的生长情况. 外源性p16基因在QB C939细胞中表达后,以Ad-LacZ为 对照,细胞的生长抑制率可达到30%(6 d)和35%(8 d),与对照组及Ad-LacZ组比较,有 显著差异(P<0.01).
2.3 Ad-p16对QBC939细胞克隆形成能力的影响 克隆 形成实验结果表明,感染Ad-p16的 细胞所形成的克隆明显少于对照组形成的克隆. 与Ad-LacZ进行比较,Ad-p16克隆抑制率 为50%. 与对照组及Ad-LacZ组比较,有显著差异(P<0.01),大大降低了QBC939细胞 的克隆形成能力.
2.4 Ad-p16对QBC939细胞形态的影响 QBC939细胞感 染Ad-p16后,2 d左右见细胞开 始变圆,胞质中有空泡,结构紊乱,胞膜不完整,并且细胞发生融合, 随后脱落悬于培养 基中. 其严重程度表现有剂量与时间依赖性. 当Ad-LacZ的感染量超过200MOI时, 细胞亦 会有一定程度的形态学改变,这说明感染大剂量的腺病毒本身也有细胞毒性(Fig 3).
, 百拇医药
图 3 Ad-16感染QBC939 细胞后形态变化
Fig 3 Phase-contrast photomicrographs of Ad-LacZ-transfected (A) and A d-p16-transfected (B) QBC939 cells at MOI of 100, 3 d after infection
2.5 Ad-p16对细胞周期和诱导QBC939细胞凋亡的阻滞 对感染Ad-p16与A d-LacZ的QB C939细胞进行FCM分析,可见明显的G1期阻滞和细胞凋亡,后者表现为细胞周期 前面的凋亡峰(Tab 1). 提取感染细胞的DNA进行电泳分析的结果,亦有典型的DNA 梯形裂缝 现象 (Fig 4).
表 1 流式细胞仪分析Ad-p16对QBC939细胞周期的作用
Tab 1 Effects of Ad-p16 on cell cycle of QBC939 mediated by FCM an alysis (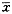 ±s) Group(4 d)
±s) Group(4 d)
, 百拇医药
G1
S
G 2/M
Control
0.23±0.04
0.44±0.02
0.34±0.03
Ad-LacZ(100MOI)
0.36±0.03
0.36±0.04
0.28±0.05
Ad-p16(100MOI)
, 百拇医药
0.48±0.06a
0.18±0.04a
0.33±0.05
aP<0.05 vs control, Ad-LacZ.3 讨论
我们采用了复制缺陷型腺病毒构建的重组的p16基因 (Ad-p16)及具有同样结构的Ad -LacZ . 腺病毒作为基因治疗的载体,较其他载体具有明显的优势. 腺病毒的宿主细胞广泛,转导 效率高,表达水平高,易繁殖和纯化,有可能收集到很高滴度的病毒,适合于在体内使用, 不整合到宿主细胞基因组中,近年已成为基因转移载体研究和应用的一个热点[ 2-4 ]. 在我们的实验中,当MOI达到100时,培养细胞的Ad-LacZ转导效率即可达到90%以上.
, http://www.100md.com
图 4 QBC939 细胞转染重组腺病毒Ad-p16后体外DNA片段化分析
Fig 4 DNA fragmentation analysis of QBC939 cells transfected with recombina nt adenoviruses
C:control, 2,4,6 d: Ad-p16 infection for 2,4,6 d, M: φX174 DNA/Hae Ⅲ Marker.
癌基因被激活和抑癌基因失活是肿瘤发生的最基本的分子机制,其中抑癌基因的失 活为 肿瘤发生的最为关键的一个环节[4-8]. p16基因作为细胞周期的抑制因子,其突 变、缺失与 失活也是许多肿瘤常见的事件之一,如黑色素瘤、乳腺癌、结肠癌、胆管癌、胃癌等p16基 因失活高达30%~90%[6, 9-13],基因的改变是肿瘤发生过程中的一个常见和 重要的事件 ,我们用免疫组化研究也显示国人胆管癌p16有56.9%的缺失,因此,重建p16基因功能成为 肿瘤基因治疗所追求的一个基本目标. 已有研究表明给一些p16基因失活的肿瘤细胞导入野生型p16基因,能抑制肿瘤细胞的生 长和致瘤能力[14,15] . 我们用RT-PCR方法检测未转导p16基因的QBC939细胞 中p16 mRNA 的水平,结果显示p16 mRNA水平很低,扫描定量为零. 本结果显示了p16基因的抑瘤 效应,说明p16基因也能抑制p16基因弱表达的肿瘤细胞的生长和致瘤能力. Ad-p16对胆管 癌 QBC939细胞生长有明显的抑制作用,体外的生长抑制率为35%,根据体外一些实验结果的 观察,我们推测这种抑瘤活性可能是导致了细胞生长阻滞和凋亡的结果. 为证实这种推测, 我们采用流式细胞计数技术、细胞DNA片段化分析进行了分析,结果显示Ad-16转导的QBC93 9细胞有显著的细胞凋亡现象和G1期阻滞.
, 百拇医药
G1期调控是细胞周期调控最重要的部分[16],肿瘤细胞表现为增殖、分化 和凋亡的失控 ,其主要原因就是细胞周期G1期重要调控因子的异常;甚至可以认为癌变过程主要就是正常 的细胞周期调控被改变的过程[17]. 一些抑癌基因既是凋亡的诱导者,又是细胞周 期的负调 控因子[9,16]. 细胞凋亡往往发生于G1期阻滞的细胞. p16基因是CDK4/CDK6 的特异抑制因 子. 通过抑制CDK4/CDK6与CyclinD的结合,阻止pRb磷酸化,使转录因子TF不能结合一 些与 转录有关的基因的启动子,从而抑制这些基因的转录和表达[14],使细胞生长停滞 于G1期[ 12,13]. 有研究也表明p16基因的高表达引起肿瘤细胞的凋亡[18], 我们推测 p16蛋白很可 能是通过使细胞阻滞于G1期,在其他凋亡诱导因子的协同作用下,诱发肿瘤细胞发生凋亡. 我们的实验也证明了这一点,结果显示Ad-p16和Ad-p53及顺铂具有协同作用(另文报道 ). 提示基因治疗具有良好的临床应用前景.
, 百拇医药
基金项目:863高科学技术发展资助项目(Z20-01-02)
作者简介:鲁建国(1963-),男(汉族),湖北省武昌市人. 博士(导师黄志强 ),主治医师. Tel.(029)3577732(O);3577548(H) Email.ljguo(@)fmmu.edu.cn
梁萧(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室)
吴旻(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室)
黄志强(解放军总医院普外研究所)
参考文献:
[1] Graham FL, Prevec L. Gene transfer and expression protocols [A]. In: Murray ZJ,ed. Methods in molecular biology[M], Vol 7.Clifton NJ: Humane Press , 1991: 109-128.
, http://www.100md.com
[2] Ali M, Lemoine NR, Ring CJ. The use of DNA viruses as vectors for gene therapy[J]. Gene Ther, 1994; 1(6): 367-384.
[3] Jolly D. Viral vector systems for gene therapy[J]. Cancer Gen e Ther,1994; 1(1):51-64.
[4] Levine AJ. The molecular biology of adenovirus. In:Bercoff RP e d. The molecular basis of viral replication[M]. Plenum Press, 1987: 483-498.
[5] 吴 曰 文, 肿瘤 细胞生物 学基础, 现代肿瘤学[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1993:101 -151.
, 百拇医药
[6] Leberman DA, Hoffman B, Steinman RA et al. Molecular control of growth arrest and apoptosis: p53-dependent and independent pathways[J]. Oncogene , 1995; 11(1):199-210.
[7] Jacks T, Weinberg RA. Cell-cycle control and its watchman[J]. Nature, 1996; 381(6584):643-644.
[8] Levine AJ. p53, the cellular gatekeeper for growth and division[J ]. Cell, 1997; 88(3):323-331.
[9] Luca M, Xie S, Gutman M. Abnormalities in the CDKN2 (p16INK4/M TS-1) gene in human melanoma cells: Relevance to tumor growth and metastasis[J]. Oncog ene,1995; 11(7): 1399-1402.
, 百拇医药
[10] Serrano M, Hannon GJ, Beach D et al. A new regulatory motif in cell- cyc le control causing specific inhibition of cyclinD/CDK4[J]. Nature, 1993; 366(6456):704-707.
[11] 吕有勇, 高崇峰, 崔建涛 et al. 胃癌中MTS1/p16基因缺失及表达异常的研究 [J]. 中华肿瘤杂志, 1996; 18(3): 189-191.
[12] Lgaki H, Sasaki H, Tachimori Y et al. Mutation frequency of p16/CDKN 2 gene in primary cancer in the upper digestive tract[J]. Cancer Res, 19 95; 55(15): 3421-3423.
, http://www.100md.com
[13] Gonzalez ZM, Bender CM, Yang AS et al. Methylation of the 5 ′ - CpG island of the p16/CDKN2 tumor suppressor gene in normal and transformed human tissues correlates with gene silencing[J]. Cancer Res, 1995; 55 (2 0): 4531-4535.
[14] Liggett WHJ, Sidransky D. Role of the p16 tumor suppressor gene in cancer[J]. J Clin Oncol, 1998; 16(3):1197-1206.
[15] Grana X, Reddy EP. Cell cycle control in mammalian cells:Role of cyclins, cyclin-dependent kinases (CDKs), growth suppressor genes and cyclin-dependent kinase inhibitors(CKIs)[J]. Oncogene,1995; 11 (2):211-219.
, 百拇医药
[16] Herman JG, Merlo A, Mao L et al. Inactivation of the CDKN2/p16 /MTS Lgen e is frequently associated with aberrant DNA methylation in all common human can cers[J]. Cancer Res, 1995; 55(4):4525-4530.
[17] Larsen CJ. p16INK4a: A gene with a dual capacity to encode unrelated prot eins that inhibit cell cycle progression[J]. Oncogene, 1996; 12 (10):2041- 2044.
[18] Naruse I, Heike Y, Hama S et al. High concentrations of recombinant a denovirus expressing p16 gene induces apoptosis in lung cancer cell lines[J]. Anticancer Res, 1998; 18(6A):4275-4282.
收稿日期:1999-09-30; 修回日期:1999-11-16, 百拇医药
单位:鲁建国(第四军医大学唐都医院普外科,陕西 西安 710038);吴金生(第四军医大学唐都医院普外科,陕西 西安 710038);要秀(第四军医大学唐都医院普外科,陕西 西安 710038);林晨(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室);付明(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室);张雪艳(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室)
关键词:胆管癌;p16基因;腺病毒;基因治疗;凋亡
第四军医大学学报000402 摘 要: 目的 研究p16基因对胆管癌细胞的作用. 方法 将重组 体 腺病毒p16转移到人胆管癌细胞QBC939, 对p16基因的表达、细胞的生长抑制及机制进行分析 . 结果 用Ad-LacZ进行 重组体腺病毒转导效率的检测,发现当MOI为100以上时,重组体腺病毒可使90%以上的培养 的人胆管癌QBC939细胞被转导. 用RT-PCR方法检测,在胆管癌QBC939细胞系中p16呈低表达 . 重组体腺病毒能介导外源基因p16在胆管癌QBC939细胞系中高效表达. 重组体腺病毒介导 的p16在QBC939细胞中表达, 能抑制QBC939细胞的生长和集落形成. 流式细胞计数和细胞DN A Ladder, 证实p16能诱导QBC939细胞发生凋亡并导致其发生G1期阻滞. 结论 p16基因通过诱导肿瘤细胞凋亡及G1期阻滞在肿瘤的基因治疗方面发挥作用.
, http://www.100md.com
中图号:R575.7 文献标识码:A
文章编号:1000-2790(2000)04-0394-05
Inhibitory effects of recombinant adenoviruses p16 transduction on human cholang iocarcinoma cell line
LU Jian-Guo YAO Xiu WU Jin-Sheng
(Department of General Surgery, Tangdu Hospital, Fourth Military Medical U niversity, X i'an 710038, China)
LIN Chen FU Ming ZHANG Xue-Yan LIANG Xiao WU Ming
, 百拇医药
(National Laboratory of Molecular Oncology, Cancer Institute, Chinese Xiehe Medical University,Chinese Academy of Medical Sciences)
HUANG Zhi-Qiang
(Inst itute of General Surgery,General Hospital of Chinese PLA)
Abstract: AIM To evaluate the inhibitory effect of p16 on human cholangiocarcinoma cell line. METHODS The effects of Ad-p16 on the growth of QBC93 9 cell in vitro. RESULTS The QBC939 cell line transducted with recombinant adenoviruses LacZ (Ad-LacZ) at MOI of 100 or greater exhibite d more than 90% transduction rate. p16 expression was low in QBC939 cells but hi gh levels of p16 expressions were observed in QBC939 cell lines infected with re combinant adenoviruses p16(Ad-p16). The growth rates of QBC939 cells transducte d by Ad-p16 at MOI of 100 were inhibited and reduced by 30.0% (on 6 day) or by 35.1% (on 8 day) respectively, compared with that of Ad-LacZ-infected cells. C olony formation in these Ad-p16-infected cells greatly decreased compared with Ad-LacZ infected cells. The Ad-p16 transfected cells induced QBC939 cells apo ptosis and G1 blockade, which was comfirmed by the flow cytometry and DNA Ladder . CONCLUSION The suppression effects mediated by the expressio n of exogenous p16 in tumor cells result mainly from apoptosis and G1 blockade.
, http://www.100md.com
Keywords:cholangiocarcinoma; p16 gene; adenovirus; gene therapy; apoptosis
0 引言
胆管癌早期缺乏典型的症状及体征,早期诊断非常困难,待患者出现梗阻性黄疸就诊时 ,多已属中晚期. 手术危险性较大,手术死 亡率高(10%~25%),而且复发率很高,预后较差. 近年来,随着DNA重组技术、分子生物学 理 论和技术的飞速发展,使肿瘤的基因治疗成为可能,为肿瘤的治疗带来了新的契机. 我们将重组体腺病毒p16转移到人胆管癌细胞QBC939中,证实p16基因可以抑制该细胞 的生长并诱导其凋亡.
1 材料和方法
1.1 材料 重组腺病毒Ad-p16及Ad-LacZ由中国医学科学院肿瘤研究所分子肿 瘤学国家重点实验室构建. 人胆管癌细胞系QBC939细胞由第三军医大学西南 医院肝胆外科王曙光教授惠 赠. 培养条件为RPMI 1640培养基,含100 ml.L-1胎牛血清,37℃,50 mL.L-1 CO2. PCR引物由上海Sangon公司合成. p16(扩增产物350 bp): 上游: 5′-CATGATGA
, 百拇医药
TGGGCAGCGCC-3′,下游: 5′-CAGGGTTTCTCA
GAGCCT-3′. tubulin(扩增产物410 bp); 上游: 5′-CTCATCACAGGCAAGGAAGAT-3′, 下游: 5′- TTAAGGTAAGTGTAGGTTGGG-3′.
1.2 方法 重组体腺病毒的繁殖、纯化、滴度测定按Graham等[1]的方法进行. 于感染病毒前1 d接种一定量的细胞,按一定的MOI(multiplicity of infection)计算所需病毒量. 感染时,加上一定体积的用无血清培养基 RPMI 1640稀释好 的病毒液,37℃作用30 min~1 h,每间隔5 min摇晃1次. 之后加入完全培养基,放入37℃ 培养箱中. 用带有LacZ报告基因的重组腺病毒Ad-LacZ,按25,50 ,100,200 MOI感染细胞,对照组加PBS, 37℃培养48 h,2.5 g.L -1戊二醛固定10 min. X-gal染, 显微镜下观察被染成蓝色的细胞即为LacZ基因表达的阳性细胞. 计数蓝色细胞百分率即重组 腺病毒的转导效率. 细胞存活率测定,先在96孔板上接种QBC939细胞,4000~6000个/孔, 同 时作3个平行 孔. 37℃,CO2培养箱中培养过夜. 按上述程序感染细胞. 到测定时,弃去培养基,每 孔加入 0.5 g.L-1 MTT溶液 (用无血清培养基配制)150 μL,37℃作用4 h. 之后 弃去MTT液, 加DMSO 100 μL/孔,放水平摇床上摇10 min. 用酶标仪测A570 nm,绘制生长曲线.
, http://www.100md.com
1.2.1 克隆形成实验 在Eppendorf管中先用一定感染强度的病毒感染被测细胞,3 7℃摇床摇2 h. 将感染细胞按300个/平皿的数量再种到60 mm平皿上,每组3个平行皿. 置培 养箱中培 养10~14 d,弃培养基,结晶紫染色. 在显微镜下,记数 大于50个细胞的克隆数,以Ad-LacZ为对照,计算相应的克隆形成率及抑制率.
1.2.2 流式细胞仪分析细胞周期及凋亡 先用病毒感染细胞 (细胞数>10 万个). 24 h时后,收集所有悬浮和贴壁细胞,800~1000 r.min-1,5 min, 离心 去培养基,用PBS洗1次,同法离心,留PBS 1.5 mL重悬细胞,然后加入750 mL.L- 1乙醇 (4℃预冷)4 mL加入细胞悬液中, 边混匀. 4℃固定18 h以上. 固定后, 通过800~1000 r.min-1离心去乙醇并用PBS 将细胞洗1次. 沉淀用PBS 0.55 mL悬浮后转入Eppendorf管中,加RNA酶, 37℃水浴反应1 ~2 h,立即 放入冰浴中,终止RNA酶的作用. 再加入0.05 g.L-1碘化乙锭 ,在 冰浴中暗处染色0.5 h以上,在流式细胞仪进行检测. 数据用Multicycle分析软件进行分析.
, http://www.100md.com
1.2.3 RT-PCR分析 采用Life Technologies Inc的总RNA提取试剂盒Trizal R eage nt提取细胞总RNA. 其操作步骤如下: 将细胞培养基弃去, 用PBS洗1次,然后按每 10 cm2面积加入Trizal Reagent 0.6 mL. 室温作用5~10 min后,加入氯仿, 充分混合15 s并室温作用2~3 min. 用12 000 g,4℃离心15 min. 吸取上层水相至另一管中,加入异丙醇沉淀RNA,室温放 置10 min . 然后用大于12 000 g,4℃离心10 min. RNA沉淀用750 mL.L-1乙醇洗1次,离 心、干 燥,用一定量的水(DEPC处理过)溶解RNA. 用紫外分光光度计定量. -70℃保存. 用DEPC水稀释RNA至1 g.L-1;取RNA 10 μL加入oligo dT(15 bases,25 0 mg.L-1)1 μL, DEPC水13 μL, 70℃ 10 min;之后立即转入冰浴;待完全冷 却后加入逆转录反应试剂,反应体系40 μL (10 μg RNA, 0.25 μg,oligo dT 10 mol.L -1,DTT 0.5 mmol.L-1, dNTP 400 U, M-MLV, buffer), 37℃ 1 h, 95℃ 5 min行逆转录. PCR反应体系25 μL(每种引物2 μmol.L-1, 400 μmol.L -1 dNTP, 1 U Taq酶, buffer 2.5 μL, RT反应产物2 μL)反应条件视不同 的 扩增产物而定;扩增p16反应条件: 95℃ 5 min, 94℃ 30 s, 65℃ 1 min, 72℃ 1 mi n, 72℃ 1 min, 26个循环. 扩增产物经15 g.L-1琼脂糖凝胶电泳分离. 然后用荧 光成像系统扫描定量.
, http://www.100md.com
1.2.4 细胞DNA片段化分析 收集细胞,用PBS洗1次,转入一Eppe ndorf管中. 然后每106个细胞用PBS 20 μL重悬. 加入裂解液10 mL.L-1 NP40, 20 mol.L-1 EDTA,50 mol.L-1 Tris HCl (pH 7.5) 400 μL,混匀,反应 10 s. 用10 000 g离心5 min,收集上清至另一Eppendorf管中. 加入 SDS至10 mL.L-1浓度,并用RNA酶 (终质量浓度500 mg.L-1) 56℃作用1~2 h . 然后加入蛋白酶k至终质量浓度2.5 g.L-1, 37℃处理2 h或过夜. 用乙醇沉淀DNA ,用10~20 μL TE溶解DNA,在10 g.L-1Agarose凝胶中电泳, 紫外灯下观察照相.
, 百拇医药
2 结果
重组腺病毒纯化后的滴度分别为Ad-p16: 2.0×1013 pfu.L-1,Ad-La cZ:1.0×10 13 pfu.L-1. 在MOI大于100的感染强度时,重组体腺病毒即可达到90%以上的 转导效率(Fig 1). 我们将重组体腺病毒Ad-p16按MOI 100的感染量感 染QBC939细胞. 结果为Ad-p16对QBC939细胞有抑制作用.

图 1 重组体腺病毒的转导效率
Fig 1 Transduction efficiency of Ad-LacZ-infected-QBC939
, 百拇医药
A:Control; B:Ad-LacZ100MOI
2.1 Ad-p16感染QBC939后p16基因的表达 提取Ad-p 16 感染 (MOI为100) 2~4 d的QBC939细胞的总RNA,经紫外可见分光光度计定量,取10 μg进行 反 转录,然后行PCR分析,扫描定量. 可见(Fig 2). Ad-p16使QBC939细胞中p16mRNA的水平明 显升高,感染前QBC939细胞中p16 mRNA的水平很弱,扫描定量为零, 2 d及4 d扫描定量分 别为1.29和0.74.

图 2 RT-PCR 分析Ad-p16 感染前后的QBC939细胞的表达
Fig 2 RT-PCR analysis of p16 expression mediated by adenovirus in QBC939
, 百拇医药
C:Control; M:Marker
2.2 Ad-p16对QBC939细胞生长的影响 用MTT 法检测 了 感染Ad-p16和Ad-LacZ (MOI 50和100) 后的QBC939 细胞的生长情况. 外源性p16基因在QB C939细胞中表达后,以Ad-LacZ为 对照,细胞的生长抑制率可达到30%(6 d)和35%(8 d),与对照组及Ad-LacZ组比较,有 显著差异(P<0.01).
2.3 Ad-p16对QBC939细胞克隆形成能力的影响 克隆 形成实验结果表明,感染Ad-p16的 细胞所形成的克隆明显少于对照组形成的克隆. 与Ad-LacZ进行比较,Ad-p16克隆抑制率 为50%. 与对照组及Ad-LacZ组比较,有显著差异(P<0.01),大大降低了QBC939细胞 的克隆形成能力.
2.4 Ad-p16对QBC939细胞形态的影响 QBC939细胞感 染Ad-p16后,2 d左右见细胞开 始变圆,胞质中有空泡,结构紊乱,胞膜不完整,并且细胞发生融合, 随后脱落悬于培养 基中. 其严重程度表现有剂量与时间依赖性. 当Ad-LacZ的感染量超过200MOI时, 细胞亦 会有一定程度的形态学改变,这说明感染大剂量的腺病毒本身也有细胞毒性(Fig 3).

, 百拇医药
图 3 Ad-16感染QBC939 细胞后形态变化
Fig 3 Phase-contrast photomicrographs of Ad-LacZ-transfected (A) and A d-p16-transfected (B) QBC939 cells at MOI of 100, 3 d after infection
2.5 Ad-p16对细胞周期和诱导QBC939细胞凋亡的阻滞 对感染Ad-p16与A d-LacZ的QB C939细胞进行FCM分析,可见明显的G1期阻滞和细胞凋亡,后者表现为细胞周期 前面的凋亡峰(Tab 1). 提取感染细胞的DNA进行电泳分析的结果,亦有典型的DNA 梯形裂缝 现象 (Fig 4).
表 1 流式细胞仪分析Ad-p16对QBC939细胞周期的作用
Tab 1 Effects of Ad-p16 on cell cycle of QBC939 mediated by FCM an alysis (
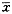 ±s) Group(4 d)
±s) Group(4 d), 百拇医药
G1
S
G 2/M
Control
0.23±0.04
0.44±0.02
0.34±0.03
Ad-LacZ(100MOI)
0.36±0.03
0.36±0.04
0.28±0.05
Ad-p16(100MOI)
, 百拇医药
0.48±0.06a
0.18±0.04a
0.33±0.05
aP<0.05 vs control, Ad-LacZ.3 讨论
我们采用了复制缺陷型腺病毒构建的重组的p16基因 (Ad-p16)及具有同样结构的Ad -LacZ . 腺病毒作为基因治疗的载体,较其他载体具有明显的优势. 腺病毒的宿主细胞广泛,转导 效率高,表达水平高,易繁殖和纯化,有可能收集到很高滴度的病毒,适合于在体内使用, 不整合到宿主细胞基因组中,近年已成为基因转移载体研究和应用的一个热点[ 2-4 ]. 在我们的实验中,当MOI达到100时,培养细胞的Ad-LacZ转导效率即可达到90%以上.

, http://www.100md.com
图 4 QBC939 细胞转染重组腺病毒Ad-p16后体外DNA片段化分析
Fig 4 DNA fragmentation analysis of QBC939 cells transfected with recombina nt adenoviruses
C:control, 2,4,6 d: Ad-p16 infection for 2,4,6 d, M: φX174 DNA/Hae Ⅲ Marker.
癌基因被激活和抑癌基因失活是肿瘤发生的最基本的分子机制,其中抑癌基因的失 活为 肿瘤发生的最为关键的一个环节[4-8]. p16基因作为细胞周期的抑制因子,其突 变、缺失与 失活也是许多肿瘤常见的事件之一,如黑色素瘤、乳腺癌、结肠癌、胆管癌、胃癌等p16基 因失活高达30%~90%[6, 9-13],基因的改变是肿瘤发生过程中的一个常见和 重要的事件 ,我们用免疫组化研究也显示国人胆管癌p16有56.9%的缺失,因此,重建p16基因功能成为 肿瘤基因治疗所追求的一个基本目标. 已有研究表明给一些p16基因失活的肿瘤细胞导入野生型p16基因,能抑制肿瘤细胞的生 长和致瘤能力[14,15] . 我们用RT-PCR方法检测未转导p16基因的QBC939细胞 中p16 mRNA 的水平,结果显示p16 mRNA水平很低,扫描定量为零. 本结果显示了p16基因的抑瘤 效应,说明p16基因也能抑制p16基因弱表达的肿瘤细胞的生长和致瘤能力. Ad-p16对胆管 癌 QBC939细胞生长有明显的抑制作用,体外的生长抑制率为35%,根据体外一些实验结果的 观察,我们推测这种抑瘤活性可能是导致了细胞生长阻滞和凋亡的结果. 为证实这种推测, 我们采用流式细胞计数技术、细胞DNA片段化分析进行了分析,结果显示Ad-16转导的QBC93 9细胞有显著的细胞凋亡现象和G1期阻滞.
, 百拇医药
G1期调控是细胞周期调控最重要的部分[16],肿瘤细胞表现为增殖、分化 和凋亡的失控 ,其主要原因就是细胞周期G1期重要调控因子的异常;甚至可以认为癌变过程主要就是正常 的细胞周期调控被改变的过程[17]. 一些抑癌基因既是凋亡的诱导者,又是细胞周 期的负调 控因子[9,16]. 细胞凋亡往往发生于G1期阻滞的细胞. p16基因是CDK4/CDK6 的特异抑制因 子. 通过抑制CDK4/CDK6与CyclinD的结合,阻止pRb磷酸化,使转录因子TF不能结合一 些与 转录有关的基因的启动子,从而抑制这些基因的转录和表达[14],使细胞生长停滞 于G1期[ 12,13]. 有研究也表明p16基因的高表达引起肿瘤细胞的凋亡[18], 我们推测 p16蛋白很可 能是通过使细胞阻滞于G1期,在其他凋亡诱导因子的协同作用下,诱发肿瘤细胞发生凋亡. 我们的实验也证明了这一点,结果显示Ad-p16和Ad-p53及顺铂具有协同作用(另文报道 ). 提示基因治疗具有良好的临床应用前景.
, 百拇医药
基金项目:863高科学技术发展资助项目(Z20-01-02)
作者简介:鲁建国(1963-),男(汉族),湖北省武昌市人. 博士(导师黄志强 ),主治医师. Tel.(029)3577732(O);3577548(H) Email.ljguo(@)fmmu.edu.cn
梁萧(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室)
吴旻(中国医学科学院,中国协和 医科大学肿瘤研究所分子肿瘤学国家重点实验室)
黄志强(解放军总医院普外研究所)
参考文献:
[1] Graham FL, Prevec L. Gene transfer and expression protocols [A]. In: Murray ZJ,ed. Methods in molecular biology[M], Vol 7.Clifton NJ: Humane Press , 1991: 109-128.
, http://www.100md.com
[2] Ali M, Lemoine NR, Ring CJ. The use of DNA viruses as vectors for gene therapy[J]. Gene Ther, 1994; 1(6): 367-384.
[3] Jolly D. Viral vector systems for gene therapy[J]. Cancer Gen e Ther,1994; 1(1):51-64.
[4] Levine AJ. The molecular biology of adenovirus. In:Bercoff RP e d. The molecular basis of viral replication[M]. Plenum Press, 1987: 483-498.
[5] 吴 曰 文, 肿瘤 细胞生物 学基础, 现代肿瘤学[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1993:101 -151.
, 百拇医药
[6] Leberman DA, Hoffman B, Steinman RA et al. Molecular control of growth arrest and apoptosis: p53-dependent and independent pathways[J]. Oncogene , 1995; 11(1):199-210.
[7] Jacks T, Weinberg RA. Cell-cycle control and its watchman[J]. Nature, 1996; 381(6584):643-644.
[8] Levine AJ. p53, the cellular gatekeeper for growth and division[J ]. Cell, 1997; 88(3):323-331.
[9] Luca M, Xie S, Gutman M. Abnormalities in the CDKN2 (p16INK4/M TS-1) gene in human melanoma cells: Relevance to tumor growth and metastasis[J]. Oncog ene,1995; 11(7): 1399-1402.
, 百拇医药
[10] Serrano M, Hannon GJ, Beach D et al. A new regulatory motif in cell- cyc le control causing specific inhibition of cyclinD/CDK4[J]. Nature, 1993; 366(6456):704-707.
[11] 吕有勇, 高崇峰, 崔建涛 et al. 胃癌中MTS1/p16基因缺失及表达异常的研究 [J]. 中华肿瘤杂志, 1996; 18(3): 189-191.
[12] Lgaki H, Sasaki H, Tachimori Y et al. Mutation frequency of p16/CDKN 2 gene in primary cancer in the upper digestive tract[J]. Cancer Res, 19 95; 55(15): 3421-3423.
, http://www.100md.com
[13] Gonzalez ZM, Bender CM, Yang AS et al. Methylation of the 5 ′ - CpG island of the p16/CDKN2 tumor suppressor gene in normal and transformed human tissues correlates with gene silencing[J]. Cancer Res, 1995; 55 (2 0): 4531-4535.
[14] Liggett WHJ, Sidransky D. Role of the p16 tumor suppressor gene in cancer[J]. J Clin Oncol, 1998; 16(3):1197-1206.
[15] Grana X, Reddy EP. Cell cycle control in mammalian cells:Role of cyclins, cyclin-dependent kinases (CDKs), growth suppressor genes and cyclin-dependent kinase inhibitors(CKIs)[J]. Oncogene,1995; 11 (2):211-219.
, 百拇医药
[16] Herman JG, Merlo A, Mao L et al. Inactivation of the CDKN2/p16 /MTS Lgen e is frequently associated with aberrant DNA methylation in all common human can cers[J]. Cancer Res, 1995; 55(4):4525-4530.
[17] Larsen CJ. p16INK4a: A gene with a dual capacity to encode unrelated prot eins that inhibit cell cycle progression[J]. Oncogene, 1996; 12 (10):2041- 2044.
[18] Naruse I, Heike Y, Hama S et al. High concentrations of recombinant a denovirus expressing p16 gene induces apoptosis in lung cancer cell lines[J]. Anticancer Res, 1998; 18(6A):4275-4282.
收稿日期:1999-09-30; 修回日期:1999-11-16, 百拇医药