G-CSF基因治疗对大剂量化疗小鼠造血功能的影响
作者:孙延平 曹雪涛△ 王全兴△ 王元和 施靖华 高 瀚
单位:
关键词:粒细胞集落刺激因子;基因治疗;结肠肿瘤;5-氟尿嘧啶;造血功能恢复
摘要 目的摘要 目的:研究成纤维细胞介导的G-CSF基因治疗对于大剂量化疗后结肠癌小鼠造血功能的影响。方法:分别将重组人G-CSF(rhG-CSF)及分泌G-CSF的成纤维细胞埋植于接受大剂量化疗后的结肠癌小鼠腹腔内,观察结肠癌小鼠造血功能的改变。结果:rhG-CSF注射疗法及G-CSF基因疗法不但均可明显提高结肠癌小鼠外周血白细胞数量(P<0.05),还能明显减轻大剂量化疗后荷瘤小鼠外周血白细胞的降低程度;G-CSF基因治疗后,大剂量化疗后结肠癌小鼠外周血血小板数量降低程度也轻于对照小鼠,但其恢复过程比较缓慢;并能明显提高化疗及未经化疗的结肠癌小鼠的脾脏质量(P<0.01),促进化疗后小鼠脾脏和骨髓CFU-GM,CFU-MK,CFU-S水平的恢复。结论:G-CSF基因治疗较rhG-CSF注射疗法更显著地减轻大剂量化疗后外周血白细胞的降低程度、促进骨髓和脾脏造血功能的恢复、提高化疗小鼠外周血白细胞和血小板的数量。
, 百拇医药
中国图书资料分类法分类号 R 730.51
Effects of G-CSF gene therapy on hematopoiesis in colon adenocarcinoma-bearing mice receiving high-dose chemotherapy
Sun Yanping, Cao Xuetao, Wang Quanxing, Wang Yuanhe, Shi Jinghua, Gao Han (Department of General Surgery, Changzheng Hospital,Second Military Medical University, Shanghai, 200003)
Abstratct Objective: To study the effects of rhG-CSF injection and fibroblast-mediated G-CSF gene therapy on hematopoiesis in C-26 colon adenocarcinoma-bearing mice receiving high-dose chemotherapy. Methods: C-26 colon adenocarcinoma-bearing mice was sc injected with rhG-CSF or ip implanted with fibroblast secreting G-CSF after receiving high-dose chemotherapy. Results: After the treatment, it was found that both rhG-CSF injection and G-CSF gene therapy can slow down the 5-Fu-induced decreasing of peripheral WBCs , accelerate their recovery and increase the weight of the spleen. G-CSF gene therapy can also promote the recovery of the platelets, elevate the CFU-GM,CFU-MK,CFU-S derived from the splenocytes and bone marrow cells of the C-26-bearing mice receiving high-dose chemotherapy. Conclusion: The results suggest that fibroblast-mediated G-CSF gene therapy could reduce the hematopoietic damage resulting from chemotherapy to less extent more effectively, and accelerate hematopoietic recovery from suppression, elevate the numbers of peripheral WBCs and platelets in the C-26-bearing mice receiving high-dose chemotherapy.
, 百拇医药
Key words granulocyte colony-stimulating factor; gene therapy; colon neoplasms; 5-fluorouracil; hematopoietic function recovery
化疗是目前治疗肿瘤的3大常规疗法之一,对于清除手术后体内残留肿瘤细胞、预防复发等具有较好的疗效。但大剂量化疗常引起粒细胞缺乏症而使患者易遭严重感染,无法接受再次化疗,因而如何减轻白细胞降低程度或快速提高化疗后白细胞的数量,对提高肿瘤患者化疗效果至关重要。粒细胞集落刺激因子(G-CSF)具有明显的促进粒系造血前体细胞分化成熟的作用,可有效地提高外周血中性粒细胞数量,已被临床用于治疗先天性粒细胞缺乏症(SCN)、慢性粒细胞缺乏症以及由抗肿瘤化疗药物所致的粒细胞减少症[1] ,疗效显著。我们在另文中报道了成纤维细胞介导的G-CSF基因治疗、配合大剂量化疗后,可明显抑制结肠癌生长,延长结肠癌小鼠的存活期[2]。本实验着重探讨G-CSF基因治疗对大剂量化疗后结肠癌小鼠造血功能的影响。
, 百拇医药
1 材料和方法
1.1 主要试剂 rhG-CSF(Filgrastim, 300 μg/支)购自日本麒麟株式会社;5-氟尿嘧啶(5-Fu)、甲基纤维素购自Sigma;红细胞生成素(EPO)购自Amgen;M-CSF购自Genzyme;马血清购自军事医学科学院基础医学研究所;琼脂和牛血清清蛋白购自Promega。
1.2 动物 雄性BALB/c小鼠,6~8周龄,购自上海西普尔-必凯实验动物有限公司。
1.3 治疗方法 将皮下接种1×105个C-26细胞的荷瘤小鼠随机分为7组(每组10只),3 d后分别进行以下治疗:A组荷瘤小鼠腹腔内注射(ip)DMEM培养基 0.5 ml;B组腹腔内移植1×107个NIH3T3-Neo细胞;C组ip 5-Fu (150 mg/kg);D组皮下注射(sc) rhG-CSF(2 μg/次×14 d);E组腹腔内移植1×107个NIH3T3-G-CSF细胞;F组ip 5-Fu (150 mg/kg),24 h后sc rhG-CSF(2 μg/次×14 d);G组ip 5-Fu (150 mg/kg), 24 h后移植1×107个NIH3T3-G-CSF细胞。治疗后动态观察小鼠外周血白细胞数量及分类和血小板计数,并于治疗结束后第2天进行脾脏和骨髓造血功能的检测。
, 百拇医药
1.4 外周血血细胞数检测 取小鼠尾静脉血,按常规方法进行细胞计数及涂片分类计数。
1.5 粒细胞-巨噬细胞克隆形成单位(CFU-GM)的检测 取脾脏或骨髓细胞置于含有20%马血清、20%双倍DMEM,20%DMEM,10%M-CSF,0.3%琼脂的培养体系中,混匀后移入35 mm培养孔中,使每孔中含有0.5×105个脾脏或骨髓有核细胞,置37℃,5%CO2 培养箱中,6~7 d后于倒置显微镜下观察结果,并计数由8~50个细胞组成的CFU-GM集落数。
1.6 巨核细胞克隆形成单位(CFU-MK)检测 取脾脏或骨髓细胞,加入含30%马血清、5%PHA刺激白细胞的条件培养液、0.9%甲基纤维素、5×10-5 mol/L巯基乙醇的DMEM培养体系中,混匀后移至24孔培养板中,每孔含1×105个脾脏或骨髓有核细胞,置37℃,5%CO2中培养6~7 d,于倒置显微镜下计数3个以上巨核细胞组成的CFU-MK集落数。
, 百拇医药
1.7 红系克隆形成单位(CFU-E)的检测 取脾脏或骨髓细胞,加于含终体积分数20%的马血清,10%BSA,10 U/ml的EPO及0.8%甲基纤维素的DMEM体系中,细胞浓度为1×106个/ml,混匀后取0.5 ml移至24孔培养板中,37℃,5%CO2 培养2 d后,计数8~50个细胞组成的CFU-E集落数。
1.8 脾脏克隆形成单位(CFU-S)的检测 给BALB/c小鼠照射致死剂量(8 Gy)的60Co γ射线,4 h后由尾静脉分别注射1×105个实验组小鼠、对照组小鼠的脾细胞,10 d 后取出小鼠脾脏,经Bouin固定液处理后,计数脾脏表面形成的克隆数。
1.9 统计学处理 采用不配对资料的t检验。
2 结 果
, 百拇医药 2.1 对结肠癌小鼠外周血白细胞及中性粒细胞比例的影响 结肠癌小鼠ip大剂量5-Fu后,外周血白细胞数明显减少,于7~10 d时降至最低点。sc rhG-CSF后,10~14 d白细胞数量开始显著回升, 回升程度明显高于对照组。G-CSF基因治疗后,7~10 d时白细胞数量开始显著回升,10 d后已明显高于对照组(图1A,P<0.01);且外周血中性粒细胞比例逐渐升高,可占白细胞总数的90%以上。
2.2 对外周血血小板数量的影响 图1B所示, 结肠癌小鼠ip大剂量5-Fu后, 外周血血小板数量明显减少, 于10~12 d降至最低点, 而G-CSF基因治疗后, 不仅可以明显提高结肠癌小鼠外周血血小板数量, 还可减轻大剂量化疗后的小鼠血小板数降低程度, 但其恢复过程比较缓慢, 直至第14天时才明显高于化疗组(P<0.05); 而结肠癌小鼠sc rhG-CSF后, 对化疗小鼠外周血血小板无明显影响。
2.3 对结肠癌小鼠脾脏质量的影响 如表1所示,结肠癌小鼠sc rhG-CSF后,能提高化疗及未经化疗的结肠癌小鼠的脾脏质量。经G-CSF基因治疗后,可更明显地提高化疗及未经化疗的结肠癌小鼠的脾脏质量(P<0.01),至第10天时,脾质量比正常小鼠增加3倍以上,而腹腔移植胶原包裹的NIH3T3-Neo的小鼠脾质量虽有增加,但仍无统计学意义,表明脾质量的增加是由于G-CSF基因治疗后体内持续分泌的G-CSF作用的结果。
, 百拇医药
2.4 对脾脏和骨髓CFU-GM,CFU-MK,CFU-E,CFU-S形成的影响 结肠癌小鼠ip大剂量5-Fu后,脾脏和骨髓CFU-GM,CFU-MK,CFU-S的数量明显低于未经化疗组(P<0.01),表明大剂量化疗可明显造成骨髓造血损伤。经rhG-CSF及G-CSF基因治疗后,不但均能非常明显提高未化疗的荷瘤小鼠脾脏和骨髓CFU-GM,脾脏CFU-MK及
图1 G-CSF基因治疗促进结肠癌小鼠白细胞(A)和血小板(B)数量的恢复
Fig 1 Enhancing effect of G-CSF gene therapy on the recovery of peripheral
, http://www.100md.com WBC (A) and platelet (B) count in C-26-bearing mice
△ PBS; □ plasmid DNA; ○ 5-Fu; ◇ rhG-CSF;▲ G-CSF DNA; ● 5-Fu+rhG-CSF; ■ 5-Fu+G-CSF DNA
CFU-S的水平,并能明显增强化疗后荷瘤小鼠脾脏和骨髓CFU-GM,脾脏CFU-MK及CFU-S的恢复(P<0.01,表2),但对小鼠脾脏和骨髓的CFU-E的水平均无明显影响。
表1 G-CSF基因治疗后结肠癌小鼠脾脏质量的变化
Tab 1 Dynamic changes of spleen mass in C-26-bearing mice after G-CSF gene therapy( n=8,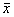 ±s, m/mg)
±s, m/mg)
, 百拇医药
Group
Time after treatment (t/d)
3
5
7
10
14
A (PBS)
121.2±20.1
122.8±18.9
122.9±19.8
124.4±21.1
, http://www.100md.com
124.4±19.8
B(NIH3T3-Neo)
128.4±22.8
130.9±21.0
132.6±23.6
133.1±24.2
135.8±21.9
C (5-Fu)
116.2±19.1
115.8±18.2
114.9±16.8
, 百拇医药
115.4±18.1
114.4±17.6
D(rhG-CSF)
141.2±20.1
172.4±24.6*
232.3±21.9*
284.3±22.1*
311.6±29.4△△
E(G-CSF DNA)
266.2±35.2*
, http://www.100md.com
356.5±46.5△△
445.4±47.8△△
485.7±68.3△△
499.1±66.6△△
F(5-Fu+rhG-CSF)
141.6±21.3
158.9±19.0
221.5±22.2*
268.4±25.7*
294.3±34.5△△
, 百拇医药
G(5Fu+G-CSF DNA)
246.1±35.2*
332.8±43.2△△
425.8±46.6△△
445.6±58.8△△
452.1±56.2△△
*P<0.05 vs group A,B or C; △△P<0.01 vs group A,B or C
表2 G-CSF基因治疗对结肠癌小鼠CFU-GM,CFU-MK和CFU-S水平的影响
, 百拇医药
Tab 2 Enhancing effects of G-CSF gene therapy on the CFU-GM,CFU-MK and CFU-S levels in C-26-bearing mice(n=8,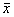 ±s)
±s)
Group
CFU-GM
CFU-MK
CFU-S
BM cell
Splenocyte
, 百拇医药 BM cell
Splenocyte
Splenocyte
A (PBS)
38.6±4.1
66.7±5.8
28.6±3.7
33.2±4.8
11.4±4.8
B(NIH3T3-Neo)
39.2±4.8
67.4±6.6
, 百拇医药
29.4±3.6
34.2±4.3
12.8±2.9
C (5-Fu)
23.2±4.1*
40.2±5.2*
10.9±2.8*
17.6±3.2*
7.4±2.6*
D(rhG-CSF)
, 百拇医药 54.2±6.9**
96.4±8.6**
36.3±5.3
61.2±8.0**
46.6±8.4**
E(G-CSF DNA)
71.6±6.2**
132.8±9.8**
41.4±6.8**
68.6±10**
, http://www.100md.com
68.1±9.6**
F(5-Fu+rhG-CSF)
56.6±8.3
86.2±7.2
31.5±7.2
53.6±9.6
38.3±6.5
G(5-Fu+G-CSF DNA)
71.1±9.2△△
133.8±10.6△△
32.6±7.0
, 百拇医药
54.2±8.0
56.6±6.2△△
*P<0.05 vs group A; ** P<0.01 vs group A,B or C; △△P<0.01 vs group F
3 讨 论
许多实验已证实小鼠或人体化疗后,连续应用大剂量rhG-CSF(2~5 μg*kg-1*d-1)7~10 d后,可改变由化疗引起的白细胞降低趋势,使白细胞数量恢复,但停药后则作用很快消失[3]。G-CSF基因疗法可使体内持续分泌较高水平的G-CSF,因此明显减轻化疗后白细胞数量的减少程度,并可缩短化疗引起的白细胞缺乏期。
, 百拇医药
G-CSF对血小板的作用目前有不同的研究结果。有的认为G-CSF对血小板的作用不明显;但Sheridan等[4]的研究证实,rG-CSF可明显促进大剂量化疗后的小鼠血小板数量的恢复。有些研究表明,成纤维细胞介导的G -CSF基因疗法可显著提高外周血中血小板的数量[5~8]。我们的研究结果也表明,G-CSF基因疗法可显著提高由于化疗引起的血小板数减少,但作用较缓慢。
对G-CSF基因治疗提高外周血白细胞和血小板数量的机制研究表明,G-CSF基因治疗通过体内持续较大量分泌G-CSF作用于脾脏和骨髓,促进化疗后小鼠脾脏和骨髓CFU-GM,CFU-MK,CFU-S的形成,有效地刺激机体以粒单和巨核为主的造血前体细胞的分化、成熟,从而增加外周血白细胞,特别是中性粒细胞的数量,并增加外周血血小板数量。但其对血小板的作用不如对白细胞明显,确切的机制有待进一步研究。
参 考 文 献
, 百拇医药
1 Diaz MJ,Lorente L,Martinez R,et al. Autotransplantation of peripheral blood stem cells mobilized by G-CSF in hematological malignancies: evidence for rapid and long-term sustained hematopoietic reconstitution. Leuk Lymphoma,1996,20(3): 327
2 孙延平,曹雪涛,王全兴,等. G-CSF基因治疗及配合大剂量化疗对结肠癌小鼠的治疗作用.中国肿瘤生物治疗杂志, 1996,3(2):108
3 Venturini M, Astro LD,Melioli G, et al. Release of peripheral blood progenitor cells during standard dose Cy, epidoxorubicin,5-Fu regiment plus G-CSF for breast cancer therapy. Cancer, 1994,74(8):2300
, http://www.100md.com
4 Sheridan WP, Begley G, Juttner CA, et al. Effect of peripheral blood progenitor cells mobilized by filgrastim (G-CSF) on platelet recovery after high-dose chemotherapy. Lancet, 1992,339(8793):640
5 Kanji T,Ohamuna T,Nagafji K, et al. Megakaryocytes produce the receptor for granulocyte colony-stimulating factor. Blood,1995,85(18):3359
6 Molineux G, Hartley C, McElroy P,et al. Megakaryocyte growth and development factor accelerates platelet recovery in peripheral blood progenitor cell transplant recipients. Blood, 1996,88(1): 366
, 百拇医药
7 Lemoli RM, Fortuna A, Fogli M, et al. Proliferative response of human marrow myeloid progenitor cells to in vivo treatment with granulocyte colony-stimulating factor alone and in combination with interleukin-3 after autologous bone marrow transplantation. Exp Hematol,1995,23(14): 1520
8 Shimoda K, Okamura S, Harada N, et al. Identification of a functional receptor for granulocyte colony-stimulating factor on platelets. J Clin Invest, 1993, 91(9): 1310
(1997-09-20收稿,1997-12-20修回), http://www.100md.com
单位:
关键词:粒细胞集落刺激因子;基因治疗;结肠肿瘤;5-氟尿嘧啶;造血功能恢复
摘要 目的摘要 目的:研究成纤维细胞介导的G-CSF基因治疗对于大剂量化疗后结肠癌小鼠造血功能的影响。方法:分别将重组人G-CSF(rhG-CSF)及分泌G-CSF的成纤维细胞埋植于接受大剂量化疗后的结肠癌小鼠腹腔内,观察结肠癌小鼠造血功能的改变。结果:rhG-CSF注射疗法及G-CSF基因疗法不但均可明显提高结肠癌小鼠外周血白细胞数量(P<0.05),还能明显减轻大剂量化疗后荷瘤小鼠外周血白细胞的降低程度;G-CSF基因治疗后,大剂量化疗后结肠癌小鼠外周血血小板数量降低程度也轻于对照小鼠,但其恢复过程比较缓慢;并能明显提高化疗及未经化疗的结肠癌小鼠的脾脏质量(P<0.01),促进化疗后小鼠脾脏和骨髓CFU-GM,CFU-MK,CFU-S水平的恢复。结论:G-CSF基因治疗较rhG-CSF注射疗法更显著地减轻大剂量化疗后外周血白细胞的降低程度、促进骨髓和脾脏造血功能的恢复、提高化疗小鼠外周血白细胞和血小板的数量。
, 百拇医药
中国图书资料分类法分类号 R 730.51
Effects of G-CSF gene therapy on hematopoiesis in colon adenocarcinoma-bearing mice receiving high-dose chemotherapy
Sun Yanping, Cao Xuetao, Wang Quanxing, Wang Yuanhe, Shi Jinghua, Gao Han (Department of General Surgery, Changzheng Hospital,Second Military Medical University, Shanghai, 200003)
Abstratct Objective: To study the effects of rhG-CSF injection and fibroblast-mediated G-CSF gene therapy on hematopoiesis in C-26 colon adenocarcinoma-bearing mice receiving high-dose chemotherapy. Methods: C-26 colon adenocarcinoma-bearing mice was sc injected with rhG-CSF or ip implanted with fibroblast secreting G-CSF after receiving high-dose chemotherapy. Results: After the treatment, it was found that both rhG-CSF injection and G-CSF gene therapy can slow down the 5-Fu-induced decreasing of peripheral WBCs , accelerate their recovery and increase the weight of the spleen. G-CSF gene therapy can also promote the recovery of the platelets, elevate the CFU-GM,CFU-MK,CFU-S derived from the splenocytes and bone marrow cells of the C-26-bearing mice receiving high-dose chemotherapy. Conclusion: The results suggest that fibroblast-mediated G-CSF gene therapy could reduce the hematopoietic damage resulting from chemotherapy to less extent more effectively, and accelerate hematopoietic recovery from suppression, elevate the numbers of peripheral WBCs and platelets in the C-26-bearing mice receiving high-dose chemotherapy.
, 百拇医药
Key words granulocyte colony-stimulating factor; gene therapy; colon neoplasms; 5-fluorouracil; hematopoietic function recovery
化疗是目前治疗肿瘤的3大常规疗法之一,对于清除手术后体内残留肿瘤细胞、预防复发等具有较好的疗效。但大剂量化疗常引起粒细胞缺乏症而使患者易遭严重感染,无法接受再次化疗,因而如何减轻白细胞降低程度或快速提高化疗后白细胞的数量,对提高肿瘤患者化疗效果至关重要。粒细胞集落刺激因子(G-CSF)具有明显的促进粒系造血前体细胞分化成熟的作用,可有效地提高外周血中性粒细胞数量,已被临床用于治疗先天性粒细胞缺乏症(SCN)、慢性粒细胞缺乏症以及由抗肿瘤化疗药物所致的粒细胞减少症[1] ,疗效显著。我们在另文中报道了成纤维细胞介导的G-CSF基因治疗、配合大剂量化疗后,可明显抑制结肠癌生长,延长结肠癌小鼠的存活期[2]。本实验着重探讨G-CSF基因治疗对大剂量化疗后结肠癌小鼠造血功能的影响。
, 百拇医药
1 材料和方法
1.1 主要试剂 rhG-CSF(Filgrastim, 300 μg/支)购自日本麒麟株式会社;5-氟尿嘧啶(5-Fu)、甲基纤维素购自Sigma;红细胞生成素(EPO)购自Amgen;M-CSF购自Genzyme;马血清购自军事医学科学院基础医学研究所;琼脂和牛血清清蛋白购自Promega。
1.2 动物 雄性BALB/c小鼠,6~8周龄,购自上海西普尔-必凯实验动物有限公司。
1.3 治疗方法 将皮下接种1×105个C-26细胞的荷瘤小鼠随机分为7组(每组10只),3 d后分别进行以下治疗:A组荷瘤小鼠腹腔内注射(ip)DMEM培养基 0.5 ml;B组腹腔内移植1×107个NIH3T3-Neo细胞;C组ip 5-Fu (150 mg/kg);D组皮下注射(sc) rhG-CSF(2 μg/次×14 d);E组腹腔内移植1×107个NIH3T3-G-CSF细胞;F组ip 5-Fu (150 mg/kg),24 h后sc rhG-CSF(2 μg/次×14 d);G组ip 5-Fu (150 mg/kg), 24 h后移植1×107个NIH3T3-G-CSF细胞。治疗后动态观察小鼠外周血白细胞数量及分类和血小板计数,并于治疗结束后第2天进行脾脏和骨髓造血功能的检测。
, 百拇医药
1.4 外周血血细胞数检测 取小鼠尾静脉血,按常规方法进行细胞计数及涂片分类计数。
1.5 粒细胞-巨噬细胞克隆形成单位(CFU-GM)的检测 取脾脏或骨髓细胞置于含有20%马血清、20%双倍DMEM,20%DMEM,10%M-CSF,0.3%琼脂的培养体系中,混匀后移入35 mm培养孔中,使每孔中含有0.5×105个脾脏或骨髓有核细胞,置37℃,5%CO2 培养箱中,6~7 d后于倒置显微镜下观察结果,并计数由8~50个细胞组成的CFU-GM集落数。
1.6 巨核细胞克隆形成单位(CFU-MK)检测 取脾脏或骨髓细胞,加入含30%马血清、5%PHA刺激白细胞的条件培养液、0.9%甲基纤维素、5×10-5 mol/L巯基乙醇的DMEM培养体系中,混匀后移至24孔培养板中,每孔含1×105个脾脏或骨髓有核细胞,置37℃,5%CO2中培养6~7 d,于倒置显微镜下计数3个以上巨核细胞组成的CFU-MK集落数。
, 百拇医药
1.7 红系克隆形成单位(CFU-E)的检测 取脾脏或骨髓细胞,加于含终体积分数20%的马血清,10%BSA,10 U/ml的EPO及0.8%甲基纤维素的DMEM体系中,细胞浓度为1×106个/ml,混匀后取0.5 ml移至24孔培养板中,37℃,5%CO2 培养2 d后,计数8~50个细胞组成的CFU-E集落数。
1.8 脾脏克隆形成单位(CFU-S)的检测 给BALB/c小鼠照射致死剂量(8 Gy)的60Co γ射线,4 h后由尾静脉分别注射1×105个实验组小鼠、对照组小鼠的脾细胞,10 d 后取出小鼠脾脏,经Bouin固定液处理后,计数脾脏表面形成的克隆数。
1.9 统计学处理 采用不配对资料的t检验。
2 结 果
, 百拇医药 2.1 对结肠癌小鼠外周血白细胞及中性粒细胞比例的影响 结肠癌小鼠ip大剂量5-Fu后,外周血白细胞数明显减少,于7~10 d时降至最低点。sc rhG-CSF后,10~14 d白细胞数量开始显著回升, 回升程度明显高于对照组。G-CSF基因治疗后,7~10 d时白细胞数量开始显著回升,10 d后已明显高于对照组(图1A,P<0.01);且外周血中性粒细胞比例逐渐升高,可占白细胞总数的90%以上。
2.2 对外周血血小板数量的影响 图1B所示, 结肠癌小鼠ip大剂量5-Fu后, 外周血血小板数量明显减少, 于10~12 d降至最低点, 而G-CSF基因治疗后, 不仅可以明显提高结肠癌小鼠外周血血小板数量, 还可减轻大剂量化疗后的小鼠血小板数降低程度, 但其恢复过程比较缓慢, 直至第14天时才明显高于化疗组(P<0.05); 而结肠癌小鼠sc rhG-CSF后, 对化疗小鼠外周血血小板无明显影响。
2.3 对结肠癌小鼠脾脏质量的影响 如表1所示,结肠癌小鼠sc rhG-CSF后,能提高化疗及未经化疗的结肠癌小鼠的脾脏质量。经G-CSF基因治疗后,可更明显地提高化疗及未经化疗的结肠癌小鼠的脾脏质量(P<0.01),至第10天时,脾质量比正常小鼠增加3倍以上,而腹腔移植胶原包裹的NIH3T3-Neo的小鼠脾质量虽有增加,但仍无统计学意义,表明脾质量的增加是由于G-CSF基因治疗后体内持续分泌的G-CSF作用的结果。
, 百拇医药
2.4 对脾脏和骨髓CFU-GM,CFU-MK,CFU-E,CFU-S形成的影响 结肠癌小鼠ip大剂量5-Fu后,脾脏和骨髓CFU-GM,CFU-MK,CFU-S的数量明显低于未经化疗组(P<0.01),表明大剂量化疗可明显造成骨髓造血损伤。经rhG-CSF及G-CSF基因治疗后,不但均能非常明显提高未化疗的荷瘤小鼠脾脏和骨髓CFU-GM,脾脏CFU-MK及

图1 G-CSF基因治疗促进结肠癌小鼠白细胞(A)和血小板(B)数量的恢复
Fig 1 Enhancing effect of G-CSF gene therapy on the recovery of peripheral
, http://www.100md.com WBC (A) and platelet (B) count in C-26-bearing mice
△ PBS; □ plasmid DNA; ○ 5-Fu; ◇ rhG-CSF;▲ G-CSF DNA; ● 5-Fu+rhG-CSF; ■ 5-Fu+G-CSF DNA
CFU-S的水平,并能明显增强化疗后荷瘤小鼠脾脏和骨髓CFU-GM,脾脏CFU-MK及CFU-S的恢复(P<0.01,表2),但对小鼠脾脏和骨髓的CFU-E的水平均无明显影响。
表1 G-CSF基因治疗后结肠癌小鼠脾脏质量的变化
Tab 1 Dynamic changes of spleen mass in C-26-bearing mice after G-CSF gene therapy( n=8,
, 百拇医药
Group
Time after treatment (t/d)
3
5
7
10
14
A (PBS)
121.2±20.1
122.8±18.9
122.9±19.8
124.4±21.1
, http://www.100md.com
124.4±19.8
B(NIH3T3-Neo)
128.4±22.8
130.9±21.0
132.6±23.6
133.1±24.2
135.8±21.9
C (5-Fu)
116.2±19.1
115.8±18.2
114.9±16.8
, 百拇医药
115.4±18.1
114.4±17.6
D(rhG-CSF)
141.2±20.1
172.4±24.6*
232.3±21.9*
284.3±22.1*
311.6±29.4△△
E(G-CSF DNA)
266.2±35.2*
, http://www.100md.com
356.5±46.5△△
445.4±47.8△△
485.7±68.3△△
499.1±66.6△△
F(5-Fu+rhG-CSF)
141.6±21.3
158.9±19.0
221.5±22.2*
268.4±25.7*
294.3±34.5△△
, 百拇医药
G(5Fu+G-CSF DNA)
246.1±35.2*
332.8±43.2△△
425.8±46.6△△
445.6±58.8△△
452.1±56.2△△
*P<0.05 vs group A,B or C; △△P<0.01 vs group A,B or C
表2 G-CSF基因治疗对结肠癌小鼠CFU-GM,CFU-MK和CFU-S水平的影响
, 百拇医药
Tab 2 Enhancing effects of G-CSF gene therapy on the CFU-GM,CFU-MK and CFU-S levels in C-26-bearing mice(n=8,
Group
CFU-GM
CFU-MK
CFU-S
BM cell
Splenocyte
, 百拇医药 BM cell
Splenocyte
Splenocyte
A (PBS)
38.6±4.1
66.7±5.8
28.6±3.7
33.2±4.8
11.4±4.8
B(NIH3T3-Neo)
39.2±4.8
67.4±6.6
, 百拇医药
29.4±3.6
34.2±4.3
12.8±2.9
C (5-Fu)
23.2±4.1*
40.2±5.2*
10.9±2.8*
17.6±3.2*
7.4±2.6*
D(rhG-CSF)
, 百拇医药 54.2±6.9**
96.4±8.6**
36.3±5.3
61.2±8.0**
46.6±8.4**
E(G-CSF DNA)
71.6±6.2**
132.8±9.8**
41.4±6.8**
68.6±10**
, http://www.100md.com
68.1±9.6**
F(5-Fu+rhG-CSF)
56.6±8.3
86.2±7.2
31.5±7.2
53.6±9.6
38.3±6.5
G(5-Fu+G-CSF DNA)
71.1±9.2△△
133.8±10.6△△
32.6±7.0
, 百拇医药
54.2±8.0
56.6±6.2△△
*P<0.05 vs group A; ** P<0.01 vs group A,B or C; △△P<0.01 vs group F
3 讨 论
许多实验已证实小鼠或人体化疗后,连续应用大剂量rhG-CSF(2~5 μg*kg-1*d-1)7~10 d后,可改变由化疗引起的白细胞降低趋势,使白细胞数量恢复,但停药后则作用很快消失[3]。G-CSF基因疗法可使体内持续分泌较高水平的G-CSF,因此明显减轻化疗后白细胞数量的减少程度,并可缩短化疗引起的白细胞缺乏期。
, 百拇医药
G-CSF对血小板的作用目前有不同的研究结果。有的认为G-CSF对血小板的作用不明显;但Sheridan等[4]的研究证实,rG-CSF可明显促进大剂量化疗后的小鼠血小板数量的恢复。有些研究表明,成纤维细胞介导的G -CSF基因疗法可显著提高外周血中血小板的数量[5~8]。我们的研究结果也表明,G-CSF基因疗法可显著提高由于化疗引起的血小板数减少,但作用较缓慢。
对G-CSF基因治疗提高外周血白细胞和血小板数量的机制研究表明,G-CSF基因治疗通过体内持续较大量分泌G-CSF作用于脾脏和骨髓,促进化疗后小鼠脾脏和骨髓CFU-GM,CFU-MK,CFU-S的形成,有效地刺激机体以粒单和巨核为主的造血前体细胞的分化、成熟,从而增加外周血白细胞,特别是中性粒细胞的数量,并增加外周血血小板数量。但其对血小板的作用不如对白细胞明显,确切的机制有待进一步研究。
参 考 文 献
, 百拇医药
1 Diaz MJ,Lorente L,Martinez R,et al. Autotransplantation of peripheral blood stem cells mobilized by G-CSF in hematological malignancies: evidence for rapid and long-term sustained hematopoietic reconstitution. Leuk Lymphoma,1996,20(3): 327
2 孙延平,曹雪涛,王全兴,等. G-CSF基因治疗及配合大剂量化疗对结肠癌小鼠的治疗作用.中国肿瘤生物治疗杂志, 1996,3(2):108
3 Venturini M, Astro LD,Melioli G, et al. Release of peripheral blood progenitor cells during standard dose Cy, epidoxorubicin,5-Fu regiment plus G-CSF for breast cancer therapy. Cancer, 1994,74(8):2300
, http://www.100md.com
4 Sheridan WP, Begley G, Juttner CA, et al. Effect of peripheral blood progenitor cells mobilized by filgrastim (G-CSF) on platelet recovery after high-dose chemotherapy. Lancet, 1992,339(8793):640
5 Kanji T,Ohamuna T,Nagafji K, et al. Megakaryocytes produce the receptor for granulocyte colony-stimulating factor. Blood,1995,85(18):3359
6 Molineux G, Hartley C, McElroy P,et al. Megakaryocyte growth and development factor accelerates platelet recovery in peripheral blood progenitor cell transplant recipients. Blood, 1996,88(1): 366
, 百拇医药
7 Lemoli RM, Fortuna A, Fogli M, et al. Proliferative response of human marrow myeloid progenitor cells to in vivo treatment with granulocyte colony-stimulating factor alone and in combination with interleukin-3 after autologous bone marrow transplantation. Exp Hematol,1995,23(14): 1520
8 Shimoda K, Okamura S, Harada N, et al. Identification of a functional receptor for granulocyte colony-stimulating factor on platelets. J Clin Invest, 1993, 91(9): 1310
(1997-09-20收稿,1997-12-20修回), http://www.100md.com