Bcl-2表达与小鼠腹腔巨噬细胞凋亡的关系
作者:乔东访 黄行许 马晓冬 鲍永耀 朴英杰
单位:第一军医大学 中心实验室 ,510515 广州
关键词:巨噬细胞;细胞凋亡;Bcl-2;共聚焦激光扫描显微镜
中国医学物理学杂志000118 摘要:利用免疫荧光技术和激光扫描共聚焦显微镜(共焦镜)技术检测了地塞米松介导小鼠腹腔巨噬细胞凋亡时凋亡抑制基因Bcl-2表达的时空变化。结果显示,免疫荧光技术和共焦镜技术可对细胞内的蛋白表达作定量和定位检测,凋亡巨噬细胞内Bcl-2逐渐减少;核中Bcl-2相对量逐渐减少,胞浆中Bcl-2相对量逐渐增多;Bcl-2表达和地塞米松介导的巨噬细胞凋亡呈极显著负相关。结果表明,地塞米松介导巨噬细胞凋亡时,凋亡抑制基因Bcl-2表达发生时空改变,Bcl-2表达极显著抑制地塞米松介导巨噬细胞凋亡。免疫荧光技术结合共焦镜技术是一种理想的蛋白表达检测方法。
, 百拇医药
中图分类号:Q71 文章标识码:B 文章编号:1005-202X(2000)01-0053-02
The Relationship between Bcl-2 Expression and Apoptosis of Murine Peritoneal Macropgages
QTAO Dong-fang , HUANG Xing-xu , MA Xiao-dong , BAO Yong-yao , PIAO Ying-jie
(Central Laboratory, First Military Medical University, Guangzhou 510515,China)
Abstract: By combined using of the immunofluorescence and laser scanning confocal microscope, the space-time changes in expression of apoptosis-inhibited gene Bcl-2 in apoptotic macrophages induced by dexamethasone were examined. The results showed, the intracellular protein expression can be detected quantitatively and orientationally. Bcl-2 in the apoptotic cells decreased gradually. The relative quantities of the Bcl-2 in the nucleus of apoptotic cells decreased also. But that in the cytoplasm increased. There existed an apparent significant negative correlation between expression of Bcl-2 and macrophage apoptosis. The results indicated, there occurred space-time changes in expression of apoptosis-inhibited gene Bcl-2 in apoptotic macrophages induced by dexamethasone. The macrophage apoptosis was inhibited markedly by Bcl-2. Combined using of the immunofluorescence and laser scanning confocal microscope was an ideal method for detection of intracellular protein expression.
, 百拇医药
Key words: macrophage ; apoptosis ; Bcl-2 , Laser scanning confocal microscope
哺乳动物Bcl-2(B cell lymphoma-2,B-细胞淋巴瘤/白血病2)是凋亡抑制基因,其表达产物Bcl-2是一种膜定位蛋白,分布在核膜、内质网膜、线粒体外膜或内膜上[1]。Bcl-2通过多种途径抑制细胞凋亡,其方式主要有:(1)抑制细胞内质网内Ca2+的释放来实现对凋亡的调节[2];(2)直接或间接地与信号传递蛋白作用而调控细胞死亡[3];(3)通过抗氧化途径影响细胞凋亡[4];(4)通过抑制线粒体通透性变化抑制细胞凋亡[5]。
研究发现,巨噬细胞集落刺激因子(macrophage colony-stimulating factor, MCSF)、和IFN-(激活介导凋亡时,巨噬细胞内的Bcl-2水平不发生明显变化[6]。不过,Bcl-2与巨噬细胞凋亡的关系仍不清楚。
, http://www.100md.com
为了探讨Bcl-2与巨噬细胞凋亡的关系,本实验利用共焦镜技术结合免疫荧光技术检测大剂量地塞米松诱导巨噬细胞凋亡时,凋亡抑制基因bcl-2表达的时空变化。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 18~20 g雌性昆明小鼠,购自第一军医大学动物所。
1.1.2 实验试剂 碘化丙啶(propidium iodide, PI)、巯基乙醇酸钠(thioglycolate)、HEPES(N-[2-Hydroxyethyl]piperazine-N′-[2-ethanesulfonic acid])、地塞米松(dexamethasone)、戊二醛(glutaraldehyde),购自美国Sigma公司。鼠抗Bcl-2抗体、FITC标记羊抗鼠抗体,购自北京中山生物技术有限公司。RPMI-1640,购自德国GIBCO BRL 公司。小牛血清,购自杭
, 百拇医药
州四季青生物材料厂。其它试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞培养 18~20 g雌性昆明小鼠,按1次/天,1ml/次连续三天腹腔注射1%巯基乙醇酸钠,停一天,参照鄂征[7]等人的方法取腹腔巨噬细胞(台酚兰吞噬实验显示99%为巨噬细胞),以1×106 个/ml接种于6孔和96孔细胞培养板(Nunc,丹麦),用含10%小牛血清的RPMI-1640培养于37℃,含5%CO2孵箱(Quene System,美国)内。12小时后加入大剂量地塞米松(1×10-4 mol/L)处理细胞。
1.2.2 细胞凋亡率检测 按上述条件培养、处理的巨噬细胞,按每个样品1×106个,用细胞刮(rubber policeman)从6孔培养板上刮下,离心收集。按Schmid方法[8]制样,PI染色,Elite流式细胞仪(COULTER,美国)采集数据(激活光波长488 nm,吸收光波长633 nm),并用Multicycle分析软件分析,通过计数凋亡区(亚二倍体区)细胞数量得出凋亡率。
, 百拇医药
1.2.3 蛋白表达检测 按上述培养、处理细胞,用4%多聚甲醛-磷酸二氢钠/氢氧化钠固定液固定后,按常规免疫荧光方法,用特异性抗体标记,荧光二抗显示后,将96孔细胞培养板置于ACAS570共焦镜(Meridian,美国)载物台上,Single Image-Cell list-Scan系统选定视野,扫描并存储所获信息,Single Image-Histogram系统分析得出反映基因表达水平的细胞平均FITC荧光值及标准差。抗体效价选择:鼠抗Bcl-2抗体为:1:70, FITC标记羊抗鼠抗体为:1:100。
1.2.4 数据分析 组间差异作u检验,相关性分析以地塞米松处理不同时间的细胞凋亡率和细胞平均荧光值为变量作直线相关分析。
2 结果
2.1 地塞米松处理诱导巨噬细胞凋亡流式细胞分析术分析显示,地塞米松处理巨噬细胞出现特征性的凋亡峰,计数特征性凋亡峰内的细胞数得出细胞凋亡率(图1)。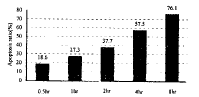
, http://www.100md.com
图1 地塞米松处理小鼠腹腔巨噬细胞不同时间的细胞凋亡率。
2.2 Bcl-2平均细胞荧光强度变化 免疫荧光技术结合激光扫描共聚焦显微镜技术检测地塞米松处理巨噬细胞Bcl-2蛋白平均细胞荧光强度变化结果(表1)。2.3 Bcl-2表达与巨噬细胞凋亡的相关性 以地塞米松处理不同时间Bcl-2的细胞平均荧光值为自变量,细胞凋亡率为因变量,作直线相关分析,r= -0.95612, P<0.01。
3 讨论
地塞米松处理诱发巨噬细胞凋亡[9],细胞凋亡率随地塞米松处理时间延长而增高。地塞米松处理时间不同Bcl-2表达水平也不同。
3.1 凋亡巨噬细胞Bcl-2表达减少
细胞凋亡时,Bcl-2表达水平下降。巨噬细胞集落刺激因子(macrophage colony-stimulating factor, MCSF)、和IFN-(激活介导凋亡时,巨噬细胞内的Bcl-2水平不发生明显变化[6]。结果显示,地塞米松诱发巨噬细胞内Bcl-2荧光强度逐渐减弱。地塞米松处理1.0 hr,荧光强度下降显著,2.0 hr后,荧光强度下降极显著。结果表明,地塞米松诱导巨噬细胞凋亡时,细胞内Bcl-2逐渐减少。
, http://www.100md.com
表1 地塞米松处理小鼠腹腔巨噬细胞不同时间每个细胞内Bcl-2平均荧光值的变化 Groups
0hr
0.5hr
1.0hr
2.0hr
4.0hr
8.0hr
WFV(X±SD)
779.26±54.28
777.80±51.24
756.62±58.53*
, http://www.100md.com
713.47±67.01**
664.64±84.25**
579.58±206.59**
NFV(X±SD)
1072.00±80.46
1059.95±66.79
1033.88±76.27**
1000.37±61.94**
939.57±103.17**
, 百拇医药
797.17±134.21**
CFV(X±SD)
748.97±72.30
748.37±52.44
734.37±57.15
719.52±61.01*
716.61±64.89*
711.66±63.51**
NFV/CFV
1.4313
, http://www.100md.com
1.4163
1.4078
1.3903
1.3111
1.1202
注 WFV:细胞内荧光值( mean fluorescence value of the whole cell). NFV:核内荧光值(mean fluorescence value of the nucleus).
CFV:胞质内荧光值(mean fluorescence value of the cytoplasm). * : 与0hr 组有显著性差异。**: 与0hr组有极显著性差异。
3.2 凋亡巨噬细胞Bcl-2分布改变
, 百拇医药
检测发现,胞浆内Bcl-2荧光强度在地塞米松处理2.0hr后开始显著降低,胞核内Bcl-2荧光强度在地塞米松处理1.0 hr后即极显著下降。地塞米松处理0.5,1.0,2.0,4.0,8.0 hr后,核质平均荧光强度值比分别下降了1.0%,1.6%,4.1%,8.4%,21.7%。表明,地塞米松诱导巨噬细胞凋亡时,细胞内Bcl-2不仅逐渐减少,并且发生分布改变,胞核中Bcl-2相对量逐渐减少,胞质中Bcl-2相对量逐渐增多。
3.3 Bcl-2表达与巨噬细胞凋亡的相关性
凋亡细胞Bcl-2水平下降。在乳腺瘤细胞中,Bcl-2表达与细胞凋亡呈负相关[10,11]。相关分析结果显示,Bcl-2表达和地塞米松介导的巨噬细胞凋亡呈极显著负相关。表明Bcl-2表达极显著抑制地塞米松介导巨噬细胞凋亡。
3.4 免疫荧光技术结合共焦镜技术是一种理想的蛋白表达检测方法
, 百拇医药
免疫组化、western blot是目前检测细胞内蛋白表达的常用方法,在实际应用时,免疫化学法可较好地作定位检测,western blot则较适于定量结果。实验结果显示,免疫荧光技术结合共焦镜技术既适于作大量的统计分析,得出定量结果,又能对单个细胞内蛋白的分布作出定位,具备了免疫组化和western blot两种方法的优点。特别是经结果分析后,可直接得出各种统计数据,具有给出信息量大的优点。此外,本方法可存储扫描所获信息,解决了原有检测方法所不能解决的难题。由此可见,免疫荧光技术结合共焦镜技术是一种理想的蛋白表达检测方法。
综上所述,免疫荧光技术结合共焦镜技术检测结果肯定了地塞米松介导巨噬细胞凋亡时,凋亡抑制基因Bcl-2的表达与分布改变,Bcl-2表达极显著抑制地塞米松介导巨噬细胞凋亡。但Bcl-2如何影响地塞米松介导的巨噬细胞凋亡还有待于探讨。
参考文献:
[1]Krajewski SS, Tanaka S, Takayama S, Schibler MJ, Fenton W, and Reed JC. Investigation of the subcellular distribution of the Bcl-2 oncoprotein: residence in the nuclear envelope, endoplasmic reticulum, and outer mitochondrial membranes. Cancer Res. 1993; 53: 4701-4714.
, http://www.100md.com
[2]Lam M, Dubyak G, Chen L, Nunez G, Miesfeld RL, and Destelhorst CW. Evidence that BCL-2 represses apoptosis by regulating endoplasmic reticulum-associated Ca2+ fluxes. Proc Natl Acad Sci USA, 1994; 91: 6569-6573.
[3]Chittenden T, Harrington EA, O′Connor R, Flemington C, Lutz RJ, Evan GI, and Guild BC. Induction of apoptosis by the Bcl-2 homologue Bak. Nature, 1995; 374: 733-736.
[4]Hockenbery DM, Oltvai ZN, Yin XM, Milliman CL, and Korsmeyer SJ. Bcl-2 functions in an antioxidant pathway to prevent apoptosis. Cell, 1993; 75: 241-251.
, 百拇医药
[5]Zamzami N, Susin SA, Marchetti P, Hirsch T, Gomez-Monterrey I, Castedo M, and Kroemer G. Mitochondrial control of nuclear apoptosis. J Exp Med, 1996a; 183: 1533-1544.
[6]Shi L, Kam CM, Powers J, Aerersold R, and Greenberg A. Purification of three cytotoxic lymphocytes granule serine proteases that induce apoptosis through distinct substrate and target cell interactions. J Exp Med, 1992; 176: 1521-1529.
[7]鄂征.组织培养技术[M].北京:人民卫生出版社,1993;185-189.
, 百拇医药
[8]Schmid I, Uittenbogaart CH, Keld B, and Giorgi JV. A rapid method for measuring apoptosis and dual-color immunofluorescence by single laser flow cytometry. J Immunol Method, 1994; 170: 145-157.
[9]黄行许,鲍永耀, 黄辉, 等.利用共焦镜检测凋亡早期巨噬细胞内pH的变化[J].第一军医大学学报,1998,18:143.
[10]Hori M, Nogami T, Itabashi M, Yoshimi F, Ono H, and Koizumi S. Expression of Bcl-2 in human breast cancer: correlation between hormone receptor status, P53 protein accumulation and DNA strand breaks associated with apoptosis. Pathol Int, 1997; 47: 757-762.
[11]Mustonen M, Raunio H, Paakko P, and Soini Y. The extent of apoptosis is inversely associated with Bcl-2 expression in premalignant and malignant breast lesions. Histopathology, 1997; 31: 347-354.
收稿日期:1998-12-23, 百拇医药
单位:第一军医大学 中心实验室 ,510515 广州
关键词:巨噬细胞;细胞凋亡;Bcl-2;共聚焦激光扫描显微镜
中国医学物理学杂志000118 摘要:利用免疫荧光技术和激光扫描共聚焦显微镜(共焦镜)技术检测了地塞米松介导小鼠腹腔巨噬细胞凋亡时凋亡抑制基因Bcl-2表达的时空变化。结果显示,免疫荧光技术和共焦镜技术可对细胞内的蛋白表达作定量和定位检测,凋亡巨噬细胞内Bcl-2逐渐减少;核中Bcl-2相对量逐渐减少,胞浆中Bcl-2相对量逐渐增多;Bcl-2表达和地塞米松介导的巨噬细胞凋亡呈极显著负相关。结果表明,地塞米松介导巨噬细胞凋亡时,凋亡抑制基因Bcl-2表达发生时空改变,Bcl-2表达极显著抑制地塞米松介导巨噬细胞凋亡。免疫荧光技术结合共焦镜技术是一种理想的蛋白表达检测方法。
, 百拇医药
中图分类号:Q71 文章标识码:B 文章编号:1005-202X(2000)01-0053-02
The Relationship between Bcl-2 Expression and Apoptosis of Murine Peritoneal Macropgages
QTAO Dong-fang , HUANG Xing-xu , MA Xiao-dong , BAO Yong-yao , PIAO Ying-jie
(Central Laboratory, First Military Medical University, Guangzhou 510515,China)
Abstract: By combined using of the immunofluorescence and laser scanning confocal microscope, the space-time changes in expression of apoptosis-inhibited gene Bcl-2 in apoptotic macrophages induced by dexamethasone were examined. The results showed, the intracellular protein expression can be detected quantitatively and orientationally. Bcl-2 in the apoptotic cells decreased gradually. The relative quantities of the Bcl-2 in the nucleus of apoptotic cells decreased also. But that in the cytoplasm increased. There existed an apparent significant negative correlation between expression of Bcl-2 and macrophage apoptosis. The results indicated, there occurred space-time changes in expression of apoptosis-inhibited gene Bcl-2 in apoptotic macrophages induced by dexamethasone. The macrophage apoptosis was inhibited markedly by Bcl-2. Combined using of the immunofluorescence and laser scanning confocal microscope was an ideal method for detection of intracellular protein expression.
, 百拇医药
Key words: macrophage ; apoptosis ; Bcl-2 , Laser scanning confocal microscope
哺乳动物Bcl-2(B cell lymphoma-2,B-细胞淋巴瘤/白血病2)是凋亡抑制基因,其表达产物Bcl-2是一种膜定位蛋白,分布在核膜、内质网膜、线粒体外膜或内膜上[1]。Bcl-2通过多种途径抑制细胞凋亡,其方式主要有:(1)抑制细胞内质网内Ca2+的释放来实现对凋亡的调节[2];(2)直接或间接地与信号传递蛋白作用而调控细胞死亡[3];(3)通过抗氧化途径影响细胞凋亡[4];(4)通过抑制线粒体通透性变化抑制细胞凋亡[5]。
研究发现,巨噬细胞集落刺激因子(macrophage colony-stimulating factor, MCSF)、和IFN-(激活介导凋亡时,巨噬细胞内的Bcl-2水平不发生明显变化[6]。不过,Bcl-2与巨噬细胞凋亡的关系仍不清楚。
, http://www.100md.com
为了探讨Bcl-2与巨噬细胞凋亡的关系,本实验利用共焦镜技术结合免疫荧光技术检测大剂量地塞米松诱导巨噬细胞凋亡时,凋亡抑制基因bcl-2表达的时空变化。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 18~20 g雌性昆明小鼠,购自第一军医大学动物所。
1.1.2 实验试剂 碘化丙啶(propidium iodide, PI)、巯基乙醇酸钠(thioglycolate)、HEPES(N-[2-Hydroxyethyl]piperazine-N′-[2-ethanesulfonic acid])、地塞米松(dexamethasone)、戊二醛(glutaraldehyde),购自美国Sigma公司。鼠抗Bcl-2抗体、FITC标记羊抗鼠抗体,购自北京中山生物技术有限公司。RPMI-1640,购自德国GIBCO BRL 公司。小牛血清,购自杭
, 百拇医药
州四季青生物材料厂。其它试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞培养 18~20 g雌性昆明小鼠,按1次/天,1ml/次连续三天腹腔注射1%巯基乙醇酸钠,停一天,参照鄂征[7]等人的方法取腹腔巨噬细胞(台酚兰吞噬实验显示99%为巨噬细胞),以1×106 个/ml接种于6孔和96孔细胞培养板(Nunc,丹麦),用含10%小牛血清的RPMI-1640培养于37℃,含5%CO2孵箱(Quene System,美国)内。12小时后加入大剂量地塞米松(1×10-4 mol/L)处理细胞。
1.2.2 细胞凋亡率检测 按上述条件培养、处理的巨噬细胞,按每个样品1×106个,用细胞刮(rubber policeman)从6孔培养板上刮下,离心收集。按Schmid方法[8]制样,PI染色,Elite流式细胞仪(COULTER,美国)采集数据(激活光波长488 nm,吸收光波长633 nm),并用Multicycle分析软件分析,通过计数凋亡区(亚二倍体区)细胞数量得出凋亡率。
, 百拇医药
1.2.3 蛋白表达检测 按上述培养、处理细胞,用4%多聚甲醛-磷酸二氢钠/氢氧化钠固定液固定后,按常规免疫荧光方法,用特异性抗体标记,荧光二抗显示后,将96孔细胞培养板置于ACAS570共焦镜(Meridian,美国)载物台上,Single Image-Cell list-Scan系统选定视野,扫描并存储所获信息,Single Image-Histogram系统分析得出反映基因表达水平的细胞平均FITC荧光值及标准差。抗体效价选择:鼠抗Bcl-2抗体为:1:70, FITC标记羊抗鼠抗体为:1:100。
1.2.4 数据分析 组间差异作u检验,相关性分析以地塞米松处理不同时间的细胞凋亡率和细胞平均荧光值为变量作直线相关分析。
2 结果
2.1 地塞米松处理诱导巨噬细胞凋亡流式细胞分析术分析显示,地塞米松处理巨噬细胞出现特征性的凋亡峰,计数特征性凋亡峰内的细胞数得出细胞凋亡率(图1)。

, http://www.100md.com
图1 地塞米松处理小鼠腹腔巨噬细胞不同时间的细胞凋亡率。
2.2 Bcl-2平均细胞荧光强度变化 免疫荧光技术结合激光扫描共聚焦显微镜技术检测地塞米松处理巨噬细胞Bcl-2蛋白平均细胞荧光强度变化结果(表1)。2.3 Bcl-2表达与巨噬细胞凋亡的相关性 以地塞米松处理不同时间Bcl-2的细胞平均荧光值为自变量,细胞凋亡率为因变量,作直线相关分析,r= -0.95612, P<0.01。
3 讨论
地塞米松处理诱发巨噬细胞凋亡[9],细胞凋亡率随地塞米松处理时间延长而增高。地塞米松处理时间不同Bcl-2表达水平也不同。
3.1 凋亡巨噬细胞Bcl-2表达减少
细胞凋亡时,Bcl-2表达水平下降。巨噬细胞集落刺激因子(macrophage colony-stimulating factor, MCSF)、和IFN-(激活介导凋亡时,巨噬细胞内的Bcl-2水平不发生明显变化[6]。结果显示,地塞米松诱发巨噬细胞内Bcl-2荧光强度逐渐减弱。地塞米松处理1.0 hr,荧光强度下降显著,2.0 hr后,荧光强度下降极显著。结果表明,地塞米松诱导巨噬细胞凋亡时,细胞内Bcl-2逐渐减少。
, http://www.100md.com
表1 地塞米松处理小鼠腹腔巨噬细胞不同时间每个细胞内Bcl-2平均荧光值的变化 Groups
0hr
0.5hr
1.0hr
2.0hr
4.0hr
8.0hr
WFV(X±SD)
779.26±54.28
777.80±51.24
756.62±58.53*
, http://www.100md.com
713.47±67.01**
664.64±84.25**
579.58±206.59**
NFV(X±SD)
1072.00±80.46
1059.95±66.79
1033.88±76.27**
1000.37±61.94**
939.57±103.17**
, 百拇医药
797.17±134.21**
CFV(X±SD)
748.97±72.30
748.37±52.44
734.37±57.15
719.52±61.01*
716.61±64.89*
711.66±63.51**
NFV/CFV
1.4313
, http://www.100md.com
1.4163
1.4078
1.3903
1.3111
1.1202
注 WFV:细胞内荧光值( mean fluorescence value of the whole cell). NFV:核内荧光值(mean fluorescence value of the nucleus).
CFV:胞质内荧光值(mean fluorescence value of the cytoplasm). * : 与0hr 组有显著性差异。**: 与0hr组有极显著性差异。
3.2 凋亡巨噬细胞Bcl-2分布改变
, 百拇医药
检测发现,胞浆内Bcl-2荧光强度在地塞米松处理2.0hr后开始显著降低,胞核内Bcl-2荧光强度在地塞米松处理1.0 hr后即极显著下降。地塞米松处理0.5,1.0,2.0,4.0,8.0 hr后,核质平均荧光强度值比分别下降了1.0%,1.6%,4.1%,8.4%,21.7%。表明,地塞米松诱导巨噬细胞凋亡时,细胞内Bcl-2不仅逐渐减少,并且发生分布改变,胞核中Bcl-2相对量逐渐减少,胞质中Bcl-2相对量逐渐增多。
3.3 Bcl-2表达与巨噬细胞凋亡的相关性
凋亡细胞Bcl-2水平下降。在乳腺瘤细胞中,Bcl-2表达与细胞凋亡呈负相关[10,11]。相关分析结果显示,Bcl-2表达和地塞米松介导的巨噬细胞凋亡呈极显著负相关。表明Bcl-2表达极显著抑制地塞米松介导巨噬细胞凋亡。
3.4 免疫荧光技术结合共焦镜技术是一种理想的蛋白表达检测方法
, 百拇医药
免疫组化、western blot是目前检测细胞内蛋白表达的常用方法,在实际应用时,免疫化学法可较好地作定位检测,western blot则较适于定量结果。实验结果显示,免疫荧光技术结合共焦镜技术既适于作大量的统计分析,得出定量结果,又能对单个细胞内蛋白的分布作出定位,具备了免疫组化和western blot两种方法的优点。特别是经结果分析后,可直接得出各种统计数据,具有给出信息量大的优点。此外,本方法可存储扫描所获信息,解决了原有检测方法所不能解决的难题。由此可见,免疫荧光技术结合共焦镜技术是一种理想的蛋白表达检测方法。
综上所述,免疫荧光技术结合共焦镜技术检测结果肯定了地塞米松介导巨噬细胞凋亡时,凋亡抑制基因Bcl-2的表达与分布改变,Bcl-2表达极显著抑制地塞米松介导巨噬细胞凋亡。但Bcl-2如何影响地塞米松介导的巨噬细胞凋亡还有待于探讨。
参考文献:
[1]Krajewski SS, Tanaka S, Takayama S, Schibler MJ, Fenton W, and Reed JC. Investigation of the subcellular distribution of the Bcl-2 oncoprotein: residence in the nuclear envelope, endoplasmic reticulum, and outer mitochondrial membranes. Cancer Res. 1993; 53: 4701-4714.
, http://www.100md.com
[2]Lam M, Dubyak G, Chen L, Nunez G, Miesfeld RL, and Destelhorst CW. Evidence that BCL-2 represses apoptosis by regulating endoplasmic reticulum-associated Ca2+ fluxes. Proc Natl Acad Sci USA, 1994; 91: 6569-6573.
[3]Chittenden T, Harrington EA, O′Connor R, Flemington C, Lutz RJ, Evan GI, and Guild BC. Induction of apoptosis by the Bcl-2 homologue Bak. Nature, 1995; 374: 733-736.
[4]Hockenbery DM, Oltvai ZN, Yin XM, Milliman CL, and Korsmeyer SJ. Bcl-2 functions in an antioxidant pathway to prevent apoptosis. Cell, 1993; 75: 241-251.
, 百拇医药
[5]Zamzami N, Susin SA, Marchetti P, Hirsch T, Gomez-Monterrey I, Castedo M, and Kroemer G. Mitochondrial control of nuclear apoptosis. J Exp Med, 1996a; 183: 1533-1544.
[6]Shi L, Kam CM, Powers J, Aerersold R, and Greenberg A. Purification of three cytotoxic lymphocytes granule serine proteases that induce apoptosis through distinct substrate and target cell interactions. J Exp Med, 1992; 176: 1521-1529.
[7]鄂征.组织培养技术[M].北京:人民卫生出版社,1993;185-189.
, 百拇医药
[8]Schmid I, Uittenbogaart CH, Keld B, and Giorgi JV. A rapid method for measuring apoptosis and dual-color immunofluorescence by single laser flow cytometry. J Immunol Method, 1994; 170: 145-157.
[9]黄行许,鲍永耀, 黄辉, 等.利用共焦镜检测凋亡早期巨噬细胞内pH的变化[J].第一军医大学学报,1998,18:143.
[10]Hori M, Nogami T, Itabashi M, Yoshimi F, Ono H, and Koizumi S. Expression of Bcl-2 in human breast cancer: correlation between hormone receptor status, P53 protein accumulation and DNA strand breaks associated with apoptosis. Pathol Int, 1997; 47: 757-762.
[11]Mustonen M, Raunio H, Paakko P, and Soini Y. The extent of apoptosis is inversely associated with Bcl-2 expression in premalignant and malignant breast lesions. Histopathology, 1997; 31: 347-354.
收稿日期:1998-12-23, 百拇医药