巨噬细胞诱发的实验性增生性玻璃体视网膜病变中的几种早期炎性细胞因子
作者:惠延年 石一宁 张新海 杨琨 宇传华
单位:710032 西安,第四军医大学西京医院眼科
关键词:增生性玻璃体视网膜病变;巨噬细胞;肿瘤坏死因子;白细胞介素-8;白细胞介素-6
巨噬细胞诱发的实验性增生性玻璃体视网膜 病变中的几种早期炎性细胞因子 惠延年 石一宁 张新海 杨琨 宇传华 【摘要】 目的 观察在增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)模型中几种早期炎性细胞因子的含量变化及其与PVR形成时相的关系。方法 采集巨噬细胞诱发的兔眼PVR模型的玻璃体液用双抗体夹心法酶联免疫吸附测试(enzyme linked immunosorbent assay,ELISA)试剂盒,检测样本中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin 8,IL-8)和白细胞介素-6(interleukin 6,IL-6)的含量,并进行多元回归拟合曲线分析。结果 TNF-α在巨噬细胞注入后7天上升,21天达高峰值,为309 pg/ml;IL-8与IL-6在7~21天也维持高水平,在14天分别达高峰值1 325 pg/ml和998 pg/ml。与对照组比较差异均有非常显著性。结论 3种早期炎性细胞因子TNF-α、IL-8和IL-6在本模型的炎症期和细胞增生期均呈明显的高水平,在瘢痕期水平降低,提示它们对眼内细胞增生具有重要的启动和调控作用。
, 百拇医药
TNF-α, IL-8 and IL-6 in the early inflammatory stage of experimental PVR model induced by macrophagesHUI Yannian, SHI Yi′ning, ZHANG Xinhai, et al. Department of Ophthalmology, Xijing Hospital, Fourth Military Medical University, Xi′an 710032
【Abstract】 Objective To observe the levels of cytokines, tumor necrosis factor-α (TNF-α), interleukin-8 (IL-8) and IL-6 in the early inflammatory stages of a rabbit proliferative vitreoretinopathy (PVR) model induced by macrophages. Methods The vitreous and venous blood of rabbit eyes of the PVR model were obtained and tested with ELISA kits of TNF-α, IL-8 and IL-6 and analyzed statistically. Results The TNF-α level increased at the 7th day after macrophage injection and reached its peak (309 pg/ml) on day 21. IL-8 and IL-6 maintained their higher levels during 7 to 21 days after macrophage injection and the peak levels were 1 325 pg/ml and 998 pg/ml on day 14 respectively. Those showed significant differences compared to control (P≤0.05). Conclusion The 3 cytokines, TNF-α, IL-8 and IL-6, present high levels in the early stage and proliferative phase of the PVR model and decrease to normal level in the regeneration (scarring) phase, indicating that these cytokines may play an important role in initiating and modulating the cellular proliferation.
, http://www.100md.com
【Key words】 Proliferative vitreoretinopathy Macrophages Tumor necrosis factor Interleukin-8 Interleukin-6
增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是重要的致盲眼病。近年已引用免疫学方法对PVR的发病机制进行了研究,在人PVR眼的玻璃体及视网膜前膜组织内检测到多种免疫活性细胞及细胞因子[1,2],但对其来源及相互关系,尤其是早期启动细胞增生的因素报道不多。我们采用巨噬细胞诱发的炎症性PVR模型,对其玻璃体液内的几种早期炎性细胞因子:肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin 8,IL-8)和白细胞介素-6(interleukin 6,IL-6)进行了定量分析和动态观察。
材料与方法
, http://www.100md.com
采用Hui[3]1987年建立的巨噬细胞诱发的兔眼PVR模型。
1.巨噬细胞的采集、纯化及其培养调理液的收集:杂色家兔,雌雄兼用,体重1.5~2.0 kg。腹部消毒后向腹膜腔注入体积分数为3%的thioglycollate溶液30 ml;4天后向腹膜腔内注入生理盐水100 ml(含肝素5 000 U),轻按摩腹部2~5 min,无菌状态下切开腹壁,抽取腹膜腔液体约50 ml,离心5 min(1 500 r/min) ,弃上清液;用含5%胎牛血清改良的Eagle培养液(Dalbeco′s modified Eagle′s medium,DMEM)制成细胞悬液,置于200 ml培养瓶中,37℃ CO2孵箱内孵育1小时,弃培养液,用Hank液冲洗去未附壁细胞;以加0.1%利多卡因的Hank液孵育30 min,解除附壁;离心洗涤后,用含5%胎牛血清DMEM培养液配制成3.8×107~5×107个细胞/ml细胞悬液。将上述细胞悬液接种于96孔细胞培养板,100 μl/孔,加DMEM液至220 μl/孔,取5个时间点,每点4孔,共20孔,分别于培养8、20、48、72及96 h后,在无菌条件下收集上清液,100 μl/孔;另设含DMEM培养液20孔作为对照,收集方法同上。抽取上清液后,此孔弃用。立即无菌贮存于0.5 ml离心管,-20℃待测。
, http://www.100md.com
2.巨噬细胞诱发PVR模型的制作、分组和标本采集:用氯胺酮50 mg/kg体重及异丙嗪25 mg/kg体重肌内注射,将动物麻醉;1%阿托品及1%托品酰胺散瞳。在角膜缘后2 mm向玻璃体腔中、后部注入巨噬细胞悬液100 μl[3]。每只兔仅1只眼注入巨噬细胞,另1只眼作为对照。分为两组,第1组共16只兔,注入巨噬细胞前(0天)抽取1次玻璃体液。在细胞注入后7、14、21及28天(每时间点4只兔),自鼻上角膜缘后2 mm抽取玻璃体液100 μl/只眼;立即贮存于0.5 ml无菌离心管中,-20℃待测;抽取标本后处死动物,摘取眼球,立即固定于10%中和甲醛液中,保存于-4℃下。第2组,4只兔连续抽取玻璃体液,即在0、7、21、28及70天连续5次抽取玻璃体液,100 μl/只眼,在70天处死,标本贮存同上法。两组对照眼同时间点同期抽取玻璃体液作为自身对照,排除神经递质样作用;0天玻璃体液作为个体眼内的细胞因子基线水平。在以上两组的各时间点均抽取兔静脉血2ml/只,高速离心60 000 r/min,共5 min,抽吸兔血清100 μl/只,贮存同上法,作为体内细胞因子基线水平。
, http://www.100md.com
3.细胞因子检测:采用第四军医大学免疫学教研室提供的双抗体夹心法酶联免疫吸附测试(enzyme linked immunosorbent assay,ELISA)试剂盒。将标准品倍比稀释8个浓度,并设阴性、空白、牛血清、正常人血清及人血白蛋白作为对照孔;测出标准品A值,绘出标准曲线,计算标本的TNF-α、IL-8及IL-6含量。
4.统计学处理:采用SPLM、SAS 6.04、EUS 2.0及HG 2.3软件对资料进行多元方差分析、裂区分析及多元回归拟合曲线分析。
结果
1.体外巨噬细胞培养上清液中的细胞因子含量及曲线:IL-8、TNF-α及IL-6分别于培养后的8、20及48小时分泌明显增加,为(122±31)、(125±22)和(26±4) pg/ml, P<0.01;前两种细胞因子于20和72小时达高峰,为(192±38)、(154±16 ) pg/ml, P<0.01;IL-6至96小时仍呈上升状态,为(28±4 ) pg/ml(图1)。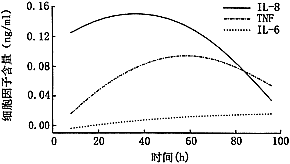
, http://www.100md.com
图1 体外活化巨噬细胞分泌的炎性细胞因子
2.第1组PVR眼玻璃体液中细胞因子含量及曲线:模型眼PVR判定采用文献[4]中报道的0、Ⅰ~Ⅳ5个级别。Ⅱ~Ⅳ级作为牵拉性视网膜脱离,7天组Ⅰ级1只眼;14 天组Ⅰ级、Ⅱ级各1只眼;21天组Ⅰ级2只眼,Ⅲ级和Ⅳ级各1只眼;28天组Ⅲ级3只眼,Ⅳ级1只眼。均无玻璃体出血。
TNF-α 7天起持续上升,21天达高峰(309 pg/ml);同时IL-8、IL-6 在此区间形成一高水平状态(584~516 pg/ml和54~251 pg/ml),并在14天分别达高峰值1 325 pg/ml和998 pg/ml(图2)。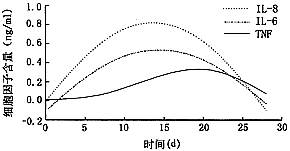
图2 巨噬细胞诱发兔PVR玻璃体液中炎性细胞因子
, 百拇医药
3.第2组PVR眼玻璃体液中细胞因子含量及曲线: TNF-α自7天起上升,21天达高峰值580 pg/ml,至70天仍维持在222 pg/ml 高水平。IL-8自7天起迅速上升,至70天呈线性上升状态,为494 pg/ml。IL-6在7~28天呈一高水平状态,为84~188 pg/ml,21天达高峰值374 pg/ml,与上一组相似(图3)。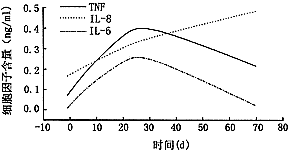
图3 连续抽取玻璃体液的PVR模型眼玻璃体液中的炎性细胞因子
4.正常血清及对照眼玻璃体液细胞因子含量:正常血清和对照眼玻璃体液TNF-α含量分别为(32±12)pg/ml、(42±5 )pg/ml,IL-8含量分别为(55±17)pg/ml、(54±38)pg/ml,IL-6含量分别为0 pg/ml、0 pg/ml。与第1组注入巨噬细胞前玻璃体液的含量波动差异无显著性(P>0.05)。
, 百拇医药
讨论
1.巨噬细胞诱发的PVR模型眼的特点及意义:在本实验的PVR模型中,仅向玻璃体内引入了巨噬细胞。巨噬细胞是一种终末细胞,不能转化和增生,但它们能分泌多种细胞因子。因此,这种模型眼内的增生细胞均来自宿主自身,它以炎症启动阶段为起点,可用于观察早期炎性细胞因子的含量变化及对细胞增生的调控作用[3,4]。
2. 细胞因子的生物学效应:以往研究已证实,TNF-α是巨噬细胞重要的早期炎性因子,对损伤修复中的炎症、增生及瘢痕化过程有着重要的调控作用[5,6]。它刺激多种细胞自分泌IL-8、IL-6等细胞因子,而这些因子的效应反过来加强了局部的免疫反应。IL-8可以加强炎性细胞和表达CD11/CD18的细胞趋化、移行作用,引起局部反应;IL-6增强对外来抗原刺激B细胞的增生作用,引起局部体液免疫反应、产生免疫球蛋白IgG等,同时还促进神经细胞分化,加强损伤后的修复。
, 百拇医药
3.本模型中细胞因子的来源:本组在模型眼玻璃体液内测出的3种因子的水平,均明显高于体外培养液上清液中的含量。其中TNF-α的高峰水平在玻璃体液内为580 pg/ml ,在巨噬细胞培养上清液中高峰值为154 pg/ml,IL-8在玻璃体液内为1 325 pg/ml,在上清液中为192 pg/ml;IL-6在玻璃体液内为998 pg/ml,在上清液中为28 pg/ml,差异均有显著性。同时对侧眼玻璃体液和血清中细胞因子含量无明显变化,由此表明这些因子是引入巨噬细胞后分泌的;眼内宿主的细胞也参与了分泌(自分泌)过程,并且不伴有内分泌和神经递质样调节。其中体内单核细胞补充进入玻璃体内可能是一个主要来源。
4.细胞因子在本模型中的动态变化:据我们以往观察,此模型在注入巨噬细胞后表现为炎症期、细胞增生期、瘢痕期[3,4]。其发展过程与本研究中玻璃体液内细胞因子的动态变化相吻合[4]。本实验测出,随着眼内TNF-α含量增加,在PVR炎症期,IL-8达较高水平,此时眼内炎症反应最明显;当TNF-α长时间呈高水平时,IL-8呈持续上升趋势。在模型10~21天,IL-6呈高水平状态,此期眼内细胞增生最活跃;进入第3周,TNF-α含量达高峰,组织内各细胞因子含量明显增加。第4周内,尽管玻璃体局部细胞因子含量迅速下降,此时模型中的成纤维细胞样细胞的间质增多,牵拉性视网膜脱离达70%以上。第2组由于多次抽取玻璃体液,其炎症反应持续时间较长,TNF-α长时间呈高水平,同时,IL-8呈持续上升趋势,IL-6与第1组的结果相似。
, 百拇医药
5. PVR的炎性及免疫机制:上述结果提示,外源性炎性细胞因子导致血-眼屏障破坏,促使炎性细胞的聚集,形成局部对损伤的炎症反应。IL-6还可能介导自身免疫反应[7];IL-8 亦可能促进视网膜内细胞增生、分化,呈现巨噬细胞样功能[8]。这些早期反应诱导内源性自分泌多种细胞因子,启动增生的负调控系统,限制细胞增生,并促进向纤维化愈合的转化[9]。
志谢 第四军医大学免疫学教研室金伯泉教授等,口腔医学院中心实验室吴军正教授等
本课题受国家自然科学基金资助(基金编号39470742)
参考文献
1 Abu EL,Asrar AM, Maimone D,et al. Cytokines in the vitreous of patients with proliferative diabetic retinopathy. Am J Ophthalmol, 1992, 114:731-736.
, 百拇医药
2 Limb GA,Franks WA,Munasinghe KR, et al. Proliferative vitreoretinopthy: an examination of the involvement of lymphocytes, adhesion molecules and HLA-DR antigens. Graefes Arch Clin Exp Ophthalmol ,1993,231:331-336.
3 Hui YN, Sorgente N, Ryan SJ. Posterior vitreous separation and retinal detachment induced by macrophage. Graefes Arch Clin Exp Ophthalmol, 1987,225:279-284.
4 Hui YN, Liang HC, Cai YS, et al. Corticosteroids and daunomycin in the prevention of experimental proliferative vitreoretinopathy induced by macrophages. Graefes Arch Clin Exp Ophthalmol ,1993,231:109-114.
, 百拇医药
5 金伯泉.细胞和分子免疫学. 北京:世界图书出版公司 , 1995.129-133.
6 周廷冲.多肽生长因子基础与临床. 北京:中国科学技术出版社,1992.509-523.
7 Grisanti S, Heimann K, Wiedemann P. Immune response to specific molecules of the retina in proliferative vitreoretinal disorders. Graefes Arch Clin Exp Ophthalmol ,1994,232:302-307.
8 Kirchhof B, Kirchhof E, Ryan SJ, et al. Vitreous modulation of migration and proliferation of retinal pigment epithelial cells in vitro. Invest Ophthalmol Vis Sci ,1989,30:1951-1957.
9 Esser P, Heimann K, Abts H, et al. CD95(FAS/APO-1) antibody- mediated apoptosis of human retinal pigment epithelial cells. Biochem Biophys Res Commun ,1995,213:1026-1034.
(收稿:1998-08-18 修回:1998-12-15), http://www.100md.com
单位:710032 西安,第四军医大学西京医院眼科
关键词:增生性玻璃体视网膜病变;巨噬细胞;肿瘤坏死因子;白细胞介素-8;白细胞介素-6
巨噬细胞诱发的实验性增生性玻璃体视网膜 病变中的几种早期炎性细胞因子 惠延年 石一宁 张新海 杨琨 宇传华 【摘要】 目的 观察在增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)模型中几种早期炎性细胞因子的含量变化及其与PVR形成时相的关系。方法 采集巨噬细胞诱发的兔眼PVR模型的玻璃体液用双抗体夹心法酶联免疫吸附测试(enzyme linked immunosorbent assay,ELISA)试剂盒,检测样本中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin 8,IL-8)和白细胞介素-6(interleukin 6,IL-6)的含量,并进行多元回归拟合曲线分析。结果 TNF-α在巨噬细胞注入后7天上升,21天达高峰值,为309 pg/ml;IL-8与IL-6在7~21天也维持高水平,在14天分别达高峰值1 325 pg/ml和998 pg/ml。与对照组比较差异均有非常显著性。结论 3种早期炎性细胞因子TNF-α、IL-8和IL-6在本模型的炎症期和细胞增生期均呈明显的高水平,在瘢痕期水平降低,提示它们对眼内细胞增生具有重要的启动和调控作用。
, 百拇医药
TNF-α, IL-8 and IL-6 in the early inflammatory stage of experimental PVR model induced by macrophagesHUI Yannian, SHI Yi′ning, ZHANG Xinhai, et al. Department of Ophthalmology, Xijing Hospital, Fourth Military Medical University, Xi′an 710032
【Abstract】 Objective To observe the levels of cytokines, tumor necrosis factor-α (TNF-α), interleukin-8 (IL-8) and IL-6 in the early inflammatory stages of a rabbit proliferative vitreoretinopathy (PVR) model induced by macrophages. Methods The vitreous and venous blood of rabbit eyes of the PVR model were obtained and tested with ELISA kits of TNF-α, IL-8 and IL-6 and analyzed statistically. Results The TNF-α level increased at the 7th day after macrophage injection and reached its peak (309 pg/ml) on day 21. IL-8 and IL-6 maintained their higher levels during 7 to 21 days after macrophage injection and the peak levels were 1 325 pg/ml and 998 pg/ml on day 14 respectively. Those showed significant differences compared to control (P≤0.05). Conclusion The 3 cytokines, TNF-α, IL-8 and IL-6, present high levels in the early stage and proliferative phase of the PVR model and decrease to normal level in the regeneration (scarring) phase, indicating that these cytokines may play an important role in initiating and modulating the cellular proliferation.
, http://www.100md.com
【Key words】 Proliferative vitreoretinopathy Macrophages Tumor necrosis factor Interleukin-8 Interleukin-6
增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是重要的致盲眼病。近年已引用免疫学方法对PVR的发病机制进行了研究,在人PVR眼的玻璃体及视网膜前膜组织内检测到多种免疫活性细胞及细胞因子[1,2],但对其来源及相互关系,尤其是早期启动细胞增生的因素报道不多。我们采用巨噬细胞诱发的炎症性PVR模型,对其玻璃体液内的几种早期炎性细胞因子:肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin 8,IL-8)和白细胞介素-6(interleukin 6,IL-6)进行了定量分析和动态观察。
材料与方法
, http://www.100md.com
采用Hui[3]1987年建立的巨噬细胞诱发的兔眼PVR模型。
1.巨噬细胞的采集、纯化及其培养调理液的收集:杂色家兔,雌雄兼用,体重1.5~2.0 kg。腹部消毒后向腹膜腔注入体积分数为3%的thioglycollate溶液30 ml;4天后向腹膜腔内注入生理盐水100 ml(含肝素5 000 U),轻按摩腹部2~5 min,无菌状态下切开腹壁,抽取腹膜腔液体约50 ml,离心5 min(1 500 r/min) ,弃上清液;用含5%胎牛血清改良的Eagle培养液(Dalbeco′s modified Eagle′s medium,DMEM)制成细胞悬液,置于200 ml培养瓶中,37℃ CO2孵箱内孵育1小时,弃培养液,用Hank液冲洗去未附壁细胞;以加0.1%利多卡因的Hank液孵育30 min,解除附壁;离心洗涤后,用含5%胎牛血清DMEM培养液配制成3.8×107~5×107个细胞/ml细胞悬液。将上述细胞悬液接种于96孔细胞培养板,100 μl/孔,加DMEM液至220 μl/孔,取5个时间点,每点4孔,共20孔,分别于培养8、20、48、72及96 h后,在无菌条件下收集上清液,100 μl/孔;另设含DMEM培养液20孔作为对照,收集方法同上。抽取上清液后,此孔弃用。立即无菌贮存于0.5 ml离心管,-20℃待测。
, http://www.100md.com
2.巨噬细胞诱发PVR模型的制作、分组和标本采集:用氯胺酮50 mg/kg体重及异丙嗪25 mg/kg体重肌内注射,将动物麻醉;1%阿托品及1%托品酰胺散瞳。在角膜缘后2 mm向玻璃体腔中、后部注入巨噬细胞悬液100 μl[3]。每只兔仅1只眼注入巨噬细胞,另1只眼作为对照。分为两组,第1组共16只兔,注入巨噬细胞前(0天)抽取1次玻璃体液。在细胞注入后7、14、21及28天(每时间点4只兔),自鼻上角膜缘后2 mm抽取玻璃体液100 μl/只眼;立即贮存于0.5 ml无菌离心管中,-20℃待测;抽取标本后处死动物,摘取眼球,立即固定于10%中和甲醛液中,保存于-4℃下。第2组,4只兔连续抽取玻璃体液,即在0、7、21、28及70天连续5次抽取玻璃体液,100 μl/只眼,在70天处死,标本贮存同上法。两组对照眼同时间点同期抽取玻璃体液作为自身对照,排除神经递质样作用;0天玻璃体液作为个体眼内的细胞因子基线水平。在以上两组的各时间点均抽取兔静脉血2ml/只,高速离心60 000 r/min,共5 min,抽吸兔血清100 μl/只,贮存同上法,作为体内细胞因子基线水平。
, http://www.100md.com
3.细胞因子检测:采用第四军医大学免疫学教研室提供的双抗体夹心法酶联免疫吸附测试(enzyme linked immunosorbent assay,ELISA)试剂盒。将标准品倍比稀释8个浓度,并设阴性、空白、牛血清、正常人血清及人血白蛋白作为对照孔;测出标准品A值,绘出标准曲线,计算标本的TNF-α、IL-8及IL-6含量。
4.统计学处理:采用SPLM、SAS 6.04、EUS 2.0及HG 2.3软件对资料进行多元方差分析、裂区分析及多元回归拟合曲线分析。
结果
1.体外巨噬细胞培养上清液中的细胞因子含量及曲线:IL-8、TNF-α及IL-6分别于培养后的8、20及48小时分泌明显增加,为(122±31)、(125±22)和(26±4) pg/ml, P<0.01;前两种细胞因子于20和72小时达高峰,为(192±38)、(154±16 ) pg/ml, P<0.01;IL-6至96小时仍呈上升状态,为(28±4 ) pg/ml(图1)。

, http://www.100md.com
图1 体外活化巨噬细胞分泌的炎性细胞因子
2.第1组PVR眼玻璃体液中细胞因子含量及曲线:模型眼PVR判定采用文献[4]中报道的0、Ⅰ~Ⅳ5个级别。Ⅱ~Ⅳ级作为牵拉性视网膜脱离,7天组Ⅰ级1只眼;14 天组Ⅰ级、Ⅱ级各1只眼;21天组Ⅰ级2只眼,Ⅲ级和Ⅳ级各1只眼;28天组Ⅲ级3只眼,Ⅳ级1只眼。均无玻璃体出血。
TNF-α 7天起持续上升,21天达高峰(309 pg/ml);同时IL-8、IL-6 在此区间形成一高水平状态(584~516 pg/ml和54~251 pg/ml),并在14天分别达高峰值1 325 pg/ml和998 pg/ml(图2)。

图2 巨噬细胞诱发兔PVR玻璃体液中炎性细胞因子
, 百拇医药
3.第2组PVR眼玻璃体液中细胞因子含量及曲线: TNF-α自7天起上升,21天达高峰值580 pg/ml,至70天仍维持在222 pg/ml 高水平。IL-8自7天起迅速上升,至70天呈线性上升状态,为494 pg/ml。IL-6在7~28天呈一高水平状态,为84~188 pg/ml,21天达高峰值374 pg/ml,与上一组相似(图3)。

图3 连续抽取玻璃体液的PVR模型眼玻璃体液中的炎性细胞因子
4.正常血清及对照眼玻璃体液细胞因子含量:正常血清和对照眼玻璃体液TNF-α含量分别为(32±12)pg/ml、(42±5 )pg/ml,IL-8含量分别为(55±17)pg/ml、(54±38)pg/ml,IL-6含量分别为0 pg/ml、0 pg/ml。与第1组注入巨噬细胞前玻璃体液的含量波动差异无显著性(P>0.05)。
, 百拇医药
讨论
1.巨噬细胞诱发的PVR模型眼的特点及意义:在本实验的PVR模型中,仅向玻璃体内引入了巨噬细胞。巨噬细胞是一种终末细胞,不能转化和增生,但它们能分泌多种细胞因子。因此,这种模型眼内的增生细胞均来自宿主自身,它以炎症启动阶段为起点,可用于观察早期炎性细胞因子的含量变化及对细胞增生的调控作用[3,4]。
2. 细胞因子的生物学效应:以往研究已证实,TNF-α是巨噬细胞重要的早期炎性因子,对损伤修复中的炎症、增生及瘢痕化过程有着重要的调控作用[5,6]。它刺激多种细胞自分泌IL-8、IL-6等细胞因子,而这些因子的效应反过来加强了局部的免疫反应。IL-8可以加强炎性细胞和表达CD11/CD18的细胞趋化、移行作用,引起局部反应;IL-6增强对外来抗原刺激B细胞的增生作用,引起局部体液免疫反应、产生免疫球蛋白IgG等,同时还促进神经细胞分化,加强损伤后的修复。
, 百拇医药
3.本模型中细胞因子的来源:本组在模型眼玻璃体液内测出的3种因子的水平,均明显高于体外培养液上清液中的含量。其中TNF-α的高峰水平在玻璃体液内为580 pg/ml ,在巨噬细胞培养上清液中高峰值为154 pg/ml,IL-8在玻璃体液内为1 325 pg/ml,在上清液中为192 pg/ml;IL-6在玻璃体液内为998 pg/ml,在上清液中为28 pg/ml,差异均有显著性。同时对侧眼玻璃体液和血清中细胞因子含量无明显变化,由此表明这些因子是引入巨噬细胞后分泌的;眼内宿主的细胞也参与了分泌(自分泌)过程,并且不伴有内分泌和神经递质样调节。其中体内单核细胞补充进入玻璃体内可能是一个主要来源。
4.细胞因子在本模型中的动态变化:据我们以往观察,此模型在注入巨噬细胞后表现为炎症期、细胞增生期、瘢痕期[3,4]。其发展过程与本研究中玻璃体液内细胞因子的动态变化相吻合[4]。本实验测出,随着眼内TNF-α含量增加,在PVR炎症期,IL-8达较高水平,此时眼内炎症反应最明显;当TNF-α长时间呈高水平时,IL-8呈持续上升趋势。在模型10~21天,IL-6呈高水平状态,此期眼内细胞增生最活跃;进入第3周,TNF-α含量达高峰,组织内各细胞因子含量明显增加。第4周内,尽管玻璃体局部细胞因子含量迅速下降,此时模型中的成纤维细胞样细胞的间质增多,牵拉性视网膜脱离达70%以上。第2组由于多次抽取玻璃体液,其炎症反应持续时间较长,TNF-α长时间呈高水平,同时,IL-8呈持续上升趋势,IL-6与第1组的结果相似。
, 百拇医药
5. PVR的炎性及免疫机制:上述结果提示,外源性炎性细胞因子导致血-眼屏障破坏,促使炎性细胞的聚集,形成局部对损伤的炎症反应。IL-6还可能介导自身免疫反应[7];IL-8 亦可能促进视网膜内细胞增生、分化,呈现巨噬细胞样功能[8]。这些早期反应诱导内源性自分泌多种细胞因子,启动增生的负调控系统,限制细胞增生,并促进向纤维化愈合的转化[9]。
志谢 第四军医大学免疫学教研室金伯泉教授等,口腔医学院中心实验室吴军正教授等
本课题受国家自然科学基金资助(基金编号39470742)
参考文献
1 Abu EL,Asrar AM, Maimone D,et al. Cytokines in the vitreous of patients with proliferative diabetic retinopathy. Am J Ophthalmol, 1992, 114:731-736.
, 百拇医药
2 Limb GA,Franks WA,Munasinghe KR, et al. Proliferative vitreoretinopthy: an examination of the involvement of lymphocytes, adhesion molecules and HLA-DR antigens. Graefes Arch Clin Exp Ophthalmol ,1993,231:331-336.
3 Hui YN, Sorgente N, Ryan SJ. Posterior vitreous separation and retinal detachment induced by macrophage. Graefes Arch Clin Exp Ophthalmol, 1987,225:279-284.
4 Hui YN, Liang HC, Cai YS, et al. Corticosteroids and daunomycin in the prevention of experimental proliferative vitreoretinopathy induced by macrophages. Graefes Arch Clin Exp Ophthalmol ,1993,231:109-114.
, 百拇医药
5 金伯泉.细胞和分子免疫学. 北京:世界图书出版公司 , 1995.129-133.
6 周廷冲.多肽生长因子基础与临床. 北京:中国科学技术出版社,1992.509-523.
7 Grisanti S, Heimann K, Wiedemann P. Immune response to specific molecules of the retina in proliferative vitreoretinal disorders. Graefes Arch Clin Exp Ophthalmol ,1994,232:302-307.
8 Kirchhof B, Kirchhof E, Ryan SJ, et al. Vitreous modulation of migration and proliferation of retinal pigment epithelial cells in vitro. Invest Ophthalmol Vis Sci ,1989,30:1951-1957.
9 Esser P, Heimann K, Abts H, et al. CD95(FAS/APO-1) antibody- mediated apoptosis of human retinal pigment epithelial cells. Biochem Biophys Res Commun ,1995,213:1026-1034.
(收稿:1998-08-18 修回:1998-12-15), http://www.100md.com