肝细胞癌中Bcl-2、C-myc表达的定量检测及其与预后的关系
作者:李华 潘承恩 刘青光 于良 马清涌
单位:李华(西安医科大学第一临床医学院肝胆外科,西安 710061);潘承恩(西安医科大学第一临床医学院肝胆外科,西安 710061);刘青光(西安医科大学第一临床医学院肝胆外科,西安 710061);于良(西安医科大学第一临床医学院肝胆外科,西安 710061);马清涌(西安医科大学第一临床医学院肝胆外科,西安 710061)
关键词:肝细胞癌;原癌基因;基因表达;免疫组织化学;预后
肝细胞癌中Bcl 〔摘要〕 目的 探讨Bcl-2及C-myc蛋白表达与肝细胞癌发生、发展及预后之间的关系,以及两者可能具有的协同性。方法 应用免疫组化双标记法(SABC)检测肝癌组织、癌周组织及正常肝组织中两者的表达,并用图像分析系统加以定量分析。结果 Bcl-2在三种组织中的表达量(PU值)分别为21.097±3.460、8.635±1.384、3.059±0.128,C-myc分别为36.702±4.961、10.585±1.263、1.547±0.043,均具显著性差异(P<0.01)。在肝细胞癌无肿瘤被膜组中具有高Bcl-2表达(P<0.05),而在肝硬化、具有门脉癌栓、无肿瘤被膜、高病理分级及高TNM分期者中具有高C-myc表达(P<0.05)。高Bcl-2或/和C-myc表达均与较差预后有关(P<0.05),经Cox比例风险模型回归分析可知C-myc为一独立的预后指标。结论 Bcl-2与肝细胞癌发生有关,C-myc与肝细胞癌发生、发展有关,并可独立判断预后。两癌基因具有一定协同致癌性。
, 百拇医药
〔中图分类号〕 R730.45;R735.7 〔文献标识码〕B
Expression of Bcl-2、C-myc protein in hepatocellular carcinoma and its relation with the prognosis
LI Hua, PAN Cheng-en, LIU Qing-guang,et al.
(Department of Hepatobiliary Surgery,The First Clinical Medical College,Xi′an Medical University,Xi′an 710061)
〔Abstract〕 Objective To evaluate the effect of the expression of Bcl-2、C-myc protein in the oncogenesis、development and prognosis in hepatocellular carcinoma(HCC),and the correlation of the two oncogenes.Methods Immunohistochemical double staining technique(SABC) was used to detect the expression of the two genes in HCC tissues、liver tissues adjacent to cancer and normal liver tissues,which was also quantitatively analysed by the image system.Results The positive unit(PU)of Bcl-2 protein in three kinds of tissues were 21.097±3.460,8.635±1.384,3.059±0.128 respectively,(P<0.01);the PU of C-myc were 36.702±4.961,10.585±1.263,1.547±0.043, respectively (P<0.01).Expression of Bcl-2 in tumor without capsule was significantly higher than that in the control(P<0.05).The higher positive-staining expression of C-myc were found in the case of cirrhosis and tumor thrombi in the portal vein (TTPV),as well as in the case of tumor without capsule,with higher pathological grade and higher TNM stage (P<0.05).Higher expression of Bcl-2 or/and C-myc were associated with shorter post-operative survival (P<0.05).C-myc expression can be regarded as an independent prognostic factor through Cox proportional hazard model.Conclusions Bcl-2 might be closely related to the occurrence of the HCC,C-myc was associated with the occurrence and development of HCC,and both could evaluate the prognosis independently.Two oncogenes have synergetic relationship in the process of occurrence of HCC.
, 百拇医药
〔Key words〕 HCC;proto-oncogene;gene expression;immunohistochemisty prognosis
原发性肝癌(HCC)的发生发展是一个多因素、多阶段、多基因变异的病变过程。我们拟在蛋白水平初步探讨Bcl-2及C-myc基因联合表达与HCC临床表现特征及预后之间的关系。
材料和方法
一、组织来源 收集我科1988年7月至1997年12月间行肝癌根治性切除,术后病理证实为肝细胞癌,临床、病理及随访资料完整的病例56例。每例存档石腊标本均经再次确认。癌周组织为距癌缘1.0cm处肝组织。正常肝组织9例取自不可逆脑外伤者。肝癌根治性切除标准:①肿瘤与肝组织之间界限尚清楚,②切缘最少与肝实质相距1cm以上,③肝十二指肠韧带旁无肿大淋巴结或行肝十二指肠韧带旁淋巴结清扫术。
, 百拇医药 二、一般资料 56例中男46例,女10例,年龄24~70岁,平均48.8岁。术前均未行放、化疗。随访期1~8年。临床TNM分期按UICC(1987)标准,其中Ⅰ期1例、Ⅱ期20例、Ⅲ期32例、ⅣA期3例、无ⅣB期。肝癌分化按Edmondson肝细胞癌分级(1956)标准,其中Ⅰ级4例、Ⅱ级20例、Ⅲ级26例、Ⅳ级6例。肿瘤最大直径12mm~20mm(83.16±37.49mm),合并肝硬化42例(75.00%),合并镜下门静脉癌栓(TTPV)35例(62.50%)。镜下TTPV评定参照Hsu等[1]的方法。
三、双重免疫组化酶标法(SABC法) 石蜡包埋组织切片4μm厚,常规脱蜡。0.3%过氧化氢甲醇室温下10分钟。PBS液充分冲洗后,浸入10mmol/L、PH6.0柠檬酸缓冲液中,微波修复10分钟,自然冷却。以1∶50正常羊血清封闭20分钟后,依次加入1∶100鼠抗人Bcl-2单抗(Dake公司)4℃过夜,1∶100生物素化羊抗鼠IgG及SABC复合物(博士德公司武汉)。DAB显色。双蒸水充分冲洗后,入0.1mol/L,H2SO4室温下冲洗30分钟。第二次染色以1∶50正常山羊血清为封闭液,1∶250兔抗人C-myc单抗(Oncogene公司)为第一抗体,1∶100生物素化山羊抗兔IgG为第二抗体,AEC显色,自然晒干后甘油胶封固。以已知Bcl-2、C-myc均强阳性表达的小细胞肺癌存档石蜡切片为阳性对照。分别以PBS液替代第二次染色中第一抗体、第二抗体及SABC复合物以三次均不出现第二染色(红)或混合色(红棕)为阴性对照,即交叉反应阴性。
, 百拇医药
四、结果评价 以细胞内出现棕褐色染色为Bcl-2阳性,出现红色染色为C-myc阳性。采用TAS-PLUS全自动图像分析系统(德国),以阳性单位(PU)表示染色强度。随机选取5个高倍视野,选择灰度参数,用公式PU=|Gα-Gβ|/Gmax×100计算出Bcl-2、C-myc染色强度,即PU值。(Gα为切片中所测内容的平均灰度,Gβ为切片中的背景灰度,Gmax为最大灰度值)。
五、统计学方法 所有数据均经SPSS for window 6.0统计软件分析。
结果
一、Bcl-2及C-myc阳性结果的形态及分布定位 Bcl-2阳性结果为棕褐色,定位于肝细胞的细胞浆和/或细胞膜处。C-myc阳性染色为红色颗粒状,定位于肝细胞的细胞核组织。部分病例切片上Bcl-2及C-myc阳性表达的细胞同时存在,绝大部分定位于不同细胞,整体上交叉分布,有部分集中趋势,偶可见同一细胞上两癌基因同时表达,未见两癌基因重叠混合染色(棕红)。阴性对照试验均无阳性信号出现。
, 百拇医药
二、Bcl-2、C-myc在不同肝组织中的定量表达 Bcl-2、C-myc在正常肝组织、癌旁组织及肝癌组织中均有阳性表达,且表达量呈递增趋势,表现出相当一致性,即正常肝组织<癌旁组织<癌组织,每两者比较有显著性差异(P<0.01)。见表1。
表1 Bcl-2及C-myc在不同肝组织中的定量表达
组别
例数
Bcl-2
C-myc
PU值( ±SD)
±SD)
, 百拇医药
P值
PU值( ±SD)
±SD)
P值
正常肝组织
9
3.059±0.128
1.547±0.043
癌旁组织
56
8.635±1.384
, 百拇医药
10.585±1.263
肝癌组织
56
21.097±3.460
<0.01*
36.702±4.961
<0.01*
注:为每两两比较结果
三、Bcl-2、C-myc在进展期HCC中的表达与临床病理特征关系 本实验中,Bcl-2及C-myc的表达量均在有无包膜组中有显著性差异(P<0.05),即包膜完整<包膜不完整<无包膜。C-myc在合并肝硬化、镜下门脉癌栓及高病理分级、高TNM分期组中有较高表达(P<0.05),而Bcl-2在以上各组中表达无显著性差异(P>0.05)。Bcl-2、C-myc表达与患者性别、年龄、血清HBsAg及肿瘤大小无关(P>0.05)。见表2。
, 百拇医药
表2 Bcl-2及C-myc在HCC中的定量表达与临床病理特征的关系
临床病
理特征
例数
Bcl-2
C-myc
PU值( ±SD)
±SD)
P值
PU值( ±SD)
±SD)
, 百拇医药
P值
性别
男
46
21.143±2.941
36.527±4.800
女
10
36.527±4.800
>0.05
36.527±4.800
>0.05
, http://www.100md.com 年龄(岁)
<50
29
21.542±3.553
36.517±3.625
≥50
27
20.658±3.010
>0.05
36.928±3.919
>0.05
血清HBsAg
, 百拇医药
+
34
21.286±3.960
37.436±4.628
-
22
21.003±3.157
>0.05
35.917±5.119
>0.05
合并肝硬化
+
, 百拇医药 42
20.843±2.972
37.796±4.082
-
14
21.179±3.645
>0.05
34.625±5.178
<0.05
最大瘤径(cm)
≤5
14
, 百拇医药 22.167±3.148
36.506±3.064
5~10
32
20.861±2.885
37.113±4.257
>10
10
21.103±3.502
>0.05*
36.682±4.041
>0.05*
, http://www.100md.com
镜下门脉癌栓
(TTPV)
+
35
21.003±1.287
38.855±5.274
-
21
21.154±3.506
>0.05
34.671±4.169
<0.05
, 百拇医药
包膜
完整
21
19.815±3.151
34.158±3.612
不完整
13
21.774±2.493
36.728±5.014
无
22
22.586±3.544
, 百拇医药
<0.05*
38.995±3.302
<0.05*
病理分级
Ⅰ~Ⅱ
24
21.293±3.457
35.057±3.285
Ⅲ~Ⅳ
32
20.861±2.804
>0.05
, http://www.100md.com
37.962±5.008
<0.05
TNM分期
Ⅰ~Ⅱ
21
20.365±2.180
34.250±4.766
Ⅲ
32
21.119±3.525
37.013±3.994
Ⅳ
, 百拇医药
3
20.838±3.491
>0.05*
38.976±5.183
<0.05*
注:者为每两两比较结果
四、HCC中Bcl-2、C-myc的表达与预后的关系
(一)Bcl-2、C-myc的表达对预后的影响 本组实验测得的进展期HCC中Bcl-2平均PU值为21.097±3.460,C-myc为36.702±4.961。分别以21.097和36.702为界分为Bcl-2高、低表达组及C-myc高、低表达组,应用Kaplan-meier法制作累积生存曲线并经log-rank检验,结果显示Bcl-2高表达组与低表达组术后生存曲线有显著性差异(P<0.05),C-myc高表达组与低表达组也有显著性差异(P<0.05)。二者均高表达预后极显著差于两者均低表达组(P<0.001)。见图1,2,3。
, 百拇医药
图1 Bcl-2表达对HCC预后的影响(P<0.05)
A:Bcl-2<21.097 B:Bcl≥21.097
图2 C-myc表达对HCC预后的影响(P<0.05)
A:C-myc<36.702 B:C-myc≥36.702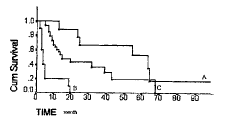
图3 Bcl-2及C-myc共同表达对HCC预后的影响(P<0.001)
, http://www.100md.com
A:Bcl-2<21.097及C-myc<36.702
B:Bcl-2≥21.097及C-myc≥36.702
C:Bcl-2≥21.097或C-myc≥36.702
(二)多因素分析(Cox模型)结果 将性别、年龄及Bcl-2、C-myc等16项指标数量化后,经Cox比例风险模型分析,结果显示有三项与预后有关的独立影响因素:肿瘤包膜、C-myc蛋白表达及镜下门脉癌栓。各因素标准回归系数均为正数,即正相关,表明无肿瘤包膜、C-myc蛋白高表达、存在镜下门脉癌栓者预后较差。见表3。
表3 多因素Cox模型分析结果
变量名称
相对危险
, 百拇医药
度(R)
回归系数
(b)
标准误差
(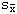 )
)
标准回归
系数(b′)
WALD
统计量
P值
肿瘤包膜
, 百拇医药
1.2271
1.1255
0.2920
3.0818
14.8578
0.0001
C-myc表达
1.1218
1.1340
0.4751
3.1081
5.6963
, http://www.100md.com
0.0170
门脉癌栓
1.1028
1.2828
0.5959
3.6067
4.6345
0.0313
方程总X2=53.251;v=3;P<0.001
讨论
肿瘤发生是由于细胞增殖与细胞凋亡间平衡失衡所致。目前已发现在HCC中有多种癌基因、抑癌基因及凋亡调控基因的异常表达[2]。Bcl-2和C-myc基因作为其中的重要代表。Bcl-2原癌基因最初是在B cell淋巴瘤中t(14;18)染色体易位点处发现的[3],实验显示其为一种抗凋亡基因,很可能与肿瘤的耐药性及抗放射敏感性有关。研究表明Bcl-2及其蛋白产物除在淋巴瘤外许多非造血系统良、恶组织中表达,如肺癌、胃癌、乳腺癌等,并与肿瘤的发生、发展有关[4]。转基因动物实验表明,表达Bcl-2的肝细胞可免于抗Fas抗体介导的肝细胞凋亡,从而诱发肿瘤发生[7]。Zhao等研究则认为,Bcl-2蛋白只在肝细胞癌组织中表达,癌旁不典型增生肝细胞并不表达,提示该基因可能与肝细胞分化、肿瘤发生无关[8]。也有学者认为Bcl-2只在胆管细胞癌中表达,在肝细胞癌中不表达[9]。本组显示出Bcl-2蛋白表达在正常肝组织、癌旁组织及肝癌组织中具有显著性差异,在肝癌组织中的高表达强烈提示该基因对HCC发生可能起促进作用。但在进展期HCC中,Bcl-2蛋白表达仅在无包膜的肿瘤组织中阳性率较高外,与肿瘤大小、门脉癌栓及病理分级,TNM分期无关,表明Bcl-2基因对HCC的发展及晚期肝癌的形成似不起决定作用。与多数在其他恶性肿瘤中的研究结果有较大差别。我们认为并不是所有的程序化死亡都可用Bcl-2来阻止,可能还有独立于Bcl-2的其它引起细胞凋亡的途径和因素[10]。这尚需进行更加深入的研究。
, 百拇医药
C-myc基因是较早发现并研究的癌基因之一,其定位于人染色体8q24,编码的核内转化蛋白P62对正常细胞生长和分化起重要调节作用。该基因除具有刺激细胞增生的功能外,还具有促进凋亡的作用,这种相互对立的作用依赖于关键性生长因子的存在与否[11]。在HCC研究中,C-myc基因异常表达可能与肿瘤的发生、发展有关,但许多研究者所得结论并不完全一致。本组实验表明在HCC癌组织及癌周组织中,C-myc阳性表达水平有显著性升高(P<0.05),显示该基因活化发生在肝癌早期,支持C-myc癌基因的激活可能参与肝细胞癌变的机理。Tiniako等研究认为肝癌组织中C-myc蛋白表达增加与肝病背景密切相关[15]。本实验支持此观点,在伴有肝硬化组中C-myc蛋白表达水平显著增高,肝硬化组织由于肝细胞反复再生,使突变机会上升,癌基因变异水平增加,致癌变发生发展。HBV是肝癌的主要病因之一,在人肝癌和癌旁组织中均发现有HBV DNA整合[16],在土拨鼠肝炎病毒(WHV)诱发土拨鼠肝癌常常可见病毒基因片段整合在myc基因的调控区。本实验选取患者外周血HBsAg,与肝组织检测有一定差别,表明外周血HBsAg阳性、阴性患者其肝癌组织C-myc表达量无显著性差异。在HCC中,C-myc在具有门脉癌栓、无肿瘤包膜、较低分化及高TNM分期者具有较高的C-myc表达水平,与大多数研究相同,同时也表明C-myc基因的异常活化在HCC发展过程中可能是决定因素之一。
, http://www.100md.com
Bcl-2与C-myc共同表达可使肿瘤获得永生化[17]。本实验Bcl-2、C-myc在正常肝组织、癌周组织及癌组织中相伴存在,表达平行增高,在多数组织中的分布有较强一致性,显示两者在致癌的启动和演变过程中可能具有协同作用。Bcl-2做为C-myc基因关键性调节因子之一,不但可阻断C-myc所诱导的凋亡而不影响其丝裂原活性,它自身所具有的抗凋亡机制在肿瘤发生中也发挥很大作用[18]。双重免疫组化染色显示Bcl-2及C-myc癌基因蛋白阳性染色大部分定位于不同细胞,整体上交叉分布,部分聚集。也可见同一细胞内二者同时表达。从其分布可推想癌基因在致癌因子的作用下,大部分分别在不同的细胞中发生变异,经不同途径发挥作用并通过某种中介达到协同致癌目的。同一细胞两癌基因同时发生变异,其致癌机理可能有所不同。
单因素分析可看到Bcl-2和/或C-myc高表达与HCC预后不良有关,两者共同高表达与共同低表达之间预后差异更加显著(P<0.001)。由图3可见远期生存曲线间有部分交叉现象,可能与长期随访病例较少有关。多因素分析则显示C-myc可作为一个独立的预后因子,其高表达者具有高死亡率,对预后作用的强度仅次于“有无门脉癌栓”。而Bcl-2尚不能作为一个独立的指标来准确判断预后,需与其它多项指标综合分析才更加准确可靠,两基因联合检测可提高其预后判断价值。
, 百拇医药
癌周组织中Bcl-2、C-myc基因表达均较正常肝组织有显著增高,这些近似“正常细胞”虽然在细胞形态上尚未出现改变,实际已处于致癌因子作用下,基因水平已非完全正常,并具备较高的潜在致癌状态。本实验所选距肿瘤1cm处的癌周组织显然已不能满足根治要求。
作者简介:李华(1969-),男,陕西西安人,博士,主治医师,从事肝胆外科,肿瘤外科专业。
参考文献
1,Hsu HC,Shen JC,Lee CS,et al.Prognostic histologic parameters in resected small hepatocellular carcinoma:a comparison with resected large hepatocellular carcinoma.Cancer,1985;56:672
2,李华,潘承恩 多基因变异与肝细胞癌.实用肿瘤学杂志,1998;12:76
, http://www.100md.com
3,Tgujimoto Y,Gorham J,Cossman J,et al.The t (14;18) chromosome translocations involoved in B cell neoplasms result from mistake in VDJ joining.Science,1985;229:1390
4,Higashiyama M,Doi O,Kodama K,et al.High prevalence of Bcl-2 oncoprotein expression in small cell lung cancer.Anticancer Res,1995;15:503
5,Lauwers GY,Scott GV,Karpeh MS.Immunohistochemical evaluation of Bcl-2 protein expression in gastric adenocarcinomas.Cancer,1995;75:2209
, 百拇医药
6,Charpin C,Garcia S,Bouvier C,et al.Automated and quantitative immunocytochemical assays of Bcl-2 protein in breast carcinomas,Br J Cancer,1997;76:340
7,闫庆国,王文亮,黄高升.原发性肝癌细胞凋亡的研究进展.国外医学外科学分册,1997;24:268
8,Zhao M,Zhang NX,Economou M,et al.Immunohistochemical detection of Bcl-2 in liver lesions:Bcl-2 protein is expressed in hepatocellular carcinoma,but not in liver cell dysplasia.Histopath,1994;25:237
, 百拇医药
9,Charlotte F, L′Hermin A, Martin N, et al. Immunohistochemical detection of Bcl-2 protein in normal and pathological human liver.Am J Pathol,1994;144:460
10,夏红,章静波.程序化细胞死亡与肿瘤.肿瘤防治研究,1995;22:54
11,Willims GT,Smith CA.Molecular regulation of apoptosis:genetic control on cell death.Cell,1993;74:777
12,Beer DG, Schwarz M, Swawada N, et al. Expression of H-ras and C-myc proto-oncogenes in isolated r-glutamyl transpeptidase-positive rat.Hepatocytes and hepatocellular carcinomas induced by diethyinitrasamine.Cancer Res,1986;46:2435
, http://www.100md.com
13,Yaswen P,Goyetta M,Shank P,et al.Expression of C-ki-ras,C-Ha-ras and C-myc in specific cell types during hepatocarcinogenesis.Mol Cell Biol,1985;5:780
14,陈子华,吕新生,文继航,等.原癌基因Jun/C-myc在原发性肝细胞癌中的表达及意义.中华实验外科杂志,1997;14:277
15,Tiniakos D,Spandidos DA,Yiagnisis M,et al.Expression of ras and C-myc onco-protein and hepatitis B surface antigen in human liver disease.Hepatogastroenterol.1993;40:56
16,Tabor. Strongly supported features of the association between hepatitis B virus and hepatocellular carcinoma.Etiology,pathology and treatment of hepatocellular carcinoma in North America.TX Portfolio:The Woodlands,1991;107
17,Martin SJ, Green DR, Cotter TG. Dicing with death:dissecting the components of the apopotosis machinery.TIBS,1994;19:26
18,Bissonnette RP,Echeverri F,Mahboubi A,et al.Apoptotic cell death induced by C-myc is inhibited by Bcl-2.Nature,1992;359:552
收稿日期:1999-4-20, 百拇医药
单位:李华(西安医科大学第一临床医学院肝胆外科,西安 710061);潘承恩(西安医科大学第一临床医学院肝胆外科,西安 710061);刘青光(西安医科大学第一临床医学院肝胆外科,西安 710061);于良(西安医科大学第一临床医学院肝胆外科,西安 710061);马清涌(西安医科大学第一临床医学院肝胆外科,西安 710061)
关键词:肝细胞癌;原癌基因;基因表达;免疫组织化学;预后
肝细胞癌中Bcl 〔摘要〕 目的 探讨Bcl-2及C-myc蛋白表达与肝细胞癌发生、发展及预后之间的关系,以及两者可能具有的协同性。方法 应用免疫组化双标记法(SABC)检测肝癌组织、癌周组织及正常肝组织中两者的表达,并用图像分析系统加以定量分析。结果 Bcl-2在三种组织中的表达量(PU值)分别为21.097±3.460、8.635±1.384、3.059±0.128,C-myc分别为36.702±4.961、10.585±1.263、1.547±0.043,均具显著性差异(P<0.01)。在肝细胞癌无肿瘤被膜组中具有高Bcl-2表达(P<0.05),而在肝硬化、具有门脉癌栓、无肿瘤被膜、高病理分级及高TNM分期者中具有高C-myc表达(P<0.05)。高Bcl-2或/和C-myc表达均与较差预后有关(P<0.05),经Cox比例风险模型回归分析可知C-myc为一独立的预后指标。结论 Bcl-2与肝细胞癌发生有关,C-myc与肝细胞癌发生、发展有关,并可独立判断预后。两癌基因具有一定协同致癌性。
, 百拇医药
〔中图分类号〕 R730.45;R735.7 〔文献标识码〕B
Expression of Bcl-2、C-myc protein in hepatocellular carcinoma and its relation with the prognosis
LI Hua, PAN Cheng-en, LIU Qing-guang,et al.
(Department of Hepatobiliary Surgery,The First Clinical Medical College,Xi′an Medical University,Xi′an 710061)
〔Abstract〕 Objective To evaluate the effect of the expression of Bcl-2、C-myc protein in the oncogenesis、development and prognosis in hepatocellular carcinoma(HCC),and the correlation of the two oncogenes.Methods Immunohistochemical double staining technique(SABC) was used to detect the expression of the two genes in HCC tissues、liver tissues adjacent to cancer and normal liver tissues,which was also quantitatively analysed by the image system.Results The positive unit(PU)of Bcl-2 protein in three kinds of tissues were 21.097±3.460,8.635±1.384,3.059±0.128 respectively,(P<0.01);the PU of C-myc were 36.702±4.961,10.585±1.263,1.547±0.043, respectively (P<0.01).Expression of Bcl-2 in tumor without capsule was significantly higher than that in the control(P<0.05).The higher positive-staining expression of C-myc were found in the case of cirrhosis and tumor thrombi in the portal vein (TTPV),as well as in the case of tumor without capsule,with higher pathological grade and higher TNM stage (P<0.05).Higher expression of Bcl-2 or/and C-myc were associated with shorter post-operative survival (P<0.05).C-myc expression can be regarded as an independent prognostic factor through Cox proportional hazard model.Conclusions Bcl-2 might be closely related to the occurrence of the HCC,C-myc was associated with the occurrence and development of HCC,and both could evaluate the prognosis independently.Two oncogenes have synergetic relationship in the process of occurrence of HCC.
, 百拇医药
〔Key words〕 HCC;proto-oncogene;gene expression;immunohistochemisty prognosis
原发性肝癌(HCC)的发生发展是一个多因素、多阶段、多基因变异的病变过程。我们拟在蛋白水平初步探讨Bcl-2及C-myc基因联合表达与HCC临床表现特征及预后之间的关系。
材料和方法
一、组织来源 收集我科1988年7月至1997年12月间行肝癌根治性切除,术后病理证实为肝细胞癌,临床、病理及随访资料完整的病例56例。每例存档石腊标本均经再次确认。癌周组织为距癌缘1.0cm处肝组织。正常肝组织9例取自不可逆脑外伤者。肝癌根治性切除标准:①肿瘤与肝组织之间界限尚清楚,②切缘最少与肝实质相距1cm以上,③肝十二指肠韧带旁无肿大淋巴结或行肝十二指肠韧带旁淋巴结清扫术。
, 百拇医药 二、一般资料 56例中男46例,女10例,年龄24~70岁,平均48.8岁。术前均未行放、化疗。随访期1~8年。临床TNM分期按UICC(1987)标准,其中Ⅰ期1例、Ⅱ期20例、Ⅲ期32例、ⅣA期3例、无ⅣB期。肝癌分化按Edmondson肝细胞癌分级(1956)标准,其中Ⅰ级4例、Ⅱ级20例、Ⅲ级26例、Ⅳ级6例。肿瘤最大直径12mm~20mm(83.16±37.49mm),合并肝硬化42例(75.00%),合并镜下门静脉癌栓(TTPV)35例(62.50%)。镜下TTPV评定参照Hsu等[1]的方法。
三、双重免疫组化酶标法(SABC法) 石蜡包埋组织切片4μm厚,常规脱蜡。0.3%过氧化氢甲醇室温下10分钟。PBS液充分冲洗后,浸入10mmol/L、PH6.0柠檬酸缓冲液中,微波修复10分钟,自然冷却。以1∶50正常羊血清封闭20分钟后,依次加入1∶100鼠抗人Bcl-2单抗(Dake公司)4℃过夜,1∶100生物素化羊抗鼠IgG及SABC复合物(博士德公司武汉)。DAB显色。双蒸水充分冲洗后,入0.1mol/L,H2SO4室温下冲洗30分钟。第二次染色以1∶50正常山羊血清为封闭液,1∶250兔抗人C-myc单抗(Oncogene公司)为第一抗体,1∶100生物素化山羊抗兔IgG为第二抗体,AEC显色,自然晒干后甘油胶封固。以已知Bcl-2、C-myc均强阳性表达的小细胞肺癌存档石蜡切片为阳性对照。分别以PBS液替代第二次染色中第一抗体、第二抗体及SABC复合物以三次均不出现第二染色(红)或混合色(红棕)为阴性对照,即交叉反应阴性。
, 百拇医药
四、结果评价 以细胞内出现棕褐色染色为Bcl-2阳性,出现红色染色为C-myc阳性。采用TAS-PLUS全自动图像分析系统(德国),以阳性单位(PU)表示染色强度。随机选取5个高倍视野,选择灰度参数,用公式PU=|Gα-Gβ|/Gmax×100计算出Bcl-2、C-myc染色强度,即PU值。(Gα为切片中所测内容的平均灰度,Gβ为切片中的背景灰度,Gmax为最大灰度值)。
五、统计学方法 所有数据均经SPSS for window 6.0统计软件分析。
结果
一、Bcl-2及C-myc阳性结果的形态及分布定位 Bcl-2阳性结果为棕褐色,定位于肝细胞的细胞浆和/或细胞膜处。C-myc阳性染色为红色颗粒状,定位于肝细胞的细胞核组织。部分病例切片上Bcl-2及C-myc阳性表达的细胞同时存在,绝大部分定位于不同细胞,整体上交叉分布,有部分集中趋势,偶可见同一细胞上两癌基因同时表达,未见两癌基因重叠混合染色(棕红)。阴性对照试验均无阳性信号出现。
, 百拇医药
二、Bcl-2、C-myc在不同肝组织中的定量表达 Bcl-2、C-myc在正常肝组织、癌旁组织及肝癌组织中均有阳性表达,且表达量呈递增趋势,表现出相当一致性,即正常肝组织<癌旁组织<癌组织,每两者比较有显著性差异(P<0.01)。见表1。
表1 Bcl-2及C-myc在不同肝组织中的定量表达
组别
例数
Bcl-2
C-myc
PU值(
, 百拇医药
P值
PU值(
P值
正常肝组织
9
3.059±0.128
1.547±0.043
癌旁组织
56
8.635±1.384
, 百拇医药
10.585±1.263
肝癌组织
56
21.097±3.460
<0.01*
36.702±4.961
<0.01*
注:为每两两比较结果
三、Bcl-2、C-myc在进展期HCC中的表达与临床病理特征关系 本实验中,Bcl-2及C-myc的表达量均在有无包膜组中有显著性差异(P<0.05),即包膜完整<包膜不完整<无包膜。C-myc在合并肝硬化、镜下门脉癌栓及高病理分级、高TNM分期组中有较高表达(P<0.05),而Bcl-2在以上各组中表达无显著性差异(P>0.05)。Bcl-2、C-myc表达与患者性别、年龄、血清HBsAg及肿瘤大小无关(P>0.05)。见表2。
, 百拇医药
表2 Bcl-2及C-myc在HCC中的定量表达与临床病理特征的关系
临床病
理特征
例数
Bcl-2
C-myc
PU值(
P值
PU值(
, 百拇医药
P值
性别
男
46
21.143±2.941
36.527±4.800
女
10
36.527±4.800
>0.05
36.527±4.800
>0.05
, http://www.100md.com 年龄(岁)
<50
29
21.542±3.553
36.517±3.625
≥50
27
20.658±3.010
>0.05
36.928±3.919
>0.05
血清HBsAg
, 百拇医药
+
34
21.286±3.960
37.436±4.628
-
22
21.003±3.157
>0.05
35.917±5.119
>0.05
合并肝硬化
+
, 百拇医药 42
20.843±2.972
37.796±4.082
-
14
21.179±3.645
>0.05
34.625±5.178
<0.05
最大瘤径(cm)
≤5
14
, 百拇医药 22.167±3.148
36.506±3.064
5~10
32
20.861±2.885
37.113±4.257
>10
10
21.103±3.502
>0.05*
36.682±4.041
>0.05*
, http://www.100md.com
镜下门脉癌栓
(TTPV)
+
35
21.003±1.287
38.855±5.274
-
21
21.154±3.506
>0.05
34.671±4.169
<0.05
, 百拇医药
包膜
完整
21
19.815±3.151
34.158±3.612
不完整
13
21.774±2.493
36.728±5.014
无
22
22.586±3.544
, 百拇医药
<0.05*
38.995±3.302
<0.05*
病理分级
Ⅰ~Ⅱ
24
21.293±3.457
35.057±3.285
Ⅲ~Ⅳ
32
20.861±2.804
>0.05
, http://www.100md.com
37.962±5.008
<0.05
TNM分期
Ⅰ~Ⅱ
21
20.365±2.180
34.250±4.766
Ⅲ
32
21.119±3.525
37.013±3.994
Ⅳ
, 百拇医药
3
20.838±3.491
>0.05*
38.976±5.183
<0.05*
注:者为每两两比较结果
四、HCC中Bcl-2、C-myc的表达与预后的关系
(一)Bcl-2、C-myc的表达对预后的影响 本组实验测得的进展期HCC中Bcl-2平均PU值为21.097±3.460,C-myc为36.702±4.961。分别以21.097和36.702为界分为Bcl-2高、低表达组及C-myc高、低表达组,应用Kaplan-meier法制作累积生存曲线并经log-rank检验,结果显示Bcl-2高表达组与低表达组术后生存曲线有显著性差异(P<0.05),C-myc高表达组与低表达组也有显著性差异(P<0.05)。二者均高表达预后极显著差于两者均低表达组(P<0.001)。见图1,2,3。

, 百拇医药
图1 Bcl-2表达对HCC预后的影响(P<0.05)
A:Bcl-2<21.097 B:Bcl≥21.097

图2 C-myc表达对HCC预后的影响(P<0.05)
A:C-myc<36.702 B:C-myc≥36.702

图3 Bcl-2及C-myc共同表达对HCC预后的影响(P<0.001)
, http://www.100md.com
A:Bcl-2<21.097及C-myc<36.702
B:Bcl-2≥21.097及C-myc≥36.702
C:Bcl-2≥21.097或C-myc≥36.702
(二)多因素分析(Cox模型)结果 将性别、年龄及Bcl-2、C-myc等16项指标数量化后,经Cox比例风险模型分析,结果显示有三项与预后有关的独立影响因素:肿瘤包膜、C-myc蛋白表达及镜下门脉癌栓。各因素标准回归系数均为正数,即正相关,表明无肿瘤包膜、C-myc蛋白高表达、存在镜下门脉癌栓者预后较差。见表3。
表3 多因素Cox模型分析结果
变量名称
相对危险
, 百拇医药
度(R)
回归系数
(b)
标准误差
(
标准回归
系数(b′)
WALD
统计量
P值
肿瘤包膜
, 百拇医药
1.2271
1.1255
0.2920
3.0818
14.8578
0.0001
C-myc表达
1.1218
1.1340
0.4751
3.1081
5.6963
, http://www.100md.com
0.0170
门脉癌栓
1.1028
1.2828
0.5959
3.6067
4.6345
0.0313
方程总X2=53.251;v=3;P<0.001
讨论
肿瘤发生是由于细胞增殖与细胞凋亡间平衡失衡所致。目前已发现在HCC中有多种癌基因、抑癌基因及凋亡调控基因的异常表达[2]。Bcl-2和C-myc基因作为其中的重要代表。Bcl-2原癌基因最初是在B cell淋巴瘤中t(14;18)染色体易位点处发现的[3],实验显示其为一种抗凋亡基因,很可能与肿瘤的耐药性及抗放射敏感性有关。研究表明Bcl-2及其蛋白产物除在淋巴瘤外许多非造血系统良、恶组织中表达,如肺癌、胃癌、乳腺癌等,并与肿瘤的发生、发展有关[4]。转基因动物实验表明,表达Bcl-2的肝细胞可免于抗Fas抗体介导的肝细胞凋亡,从而诱发肿瘤发生[7]。Zhao等研究则认为,Bcl-2蛋白只在肝细胞癌组织中表达,癌旁不典型增生肝细胞并不表达,提示该基因可能与肝细胞分化、肿瘤发生无关[8]。也有学者认为Bcl-2只在胆管细胞癌中表达,在肝细胞癌中不表达[9]。本组显示出Bcl-2蛋白表达在正常肝组织、癌旁组织及肝癌组织中具有显著性差异,在肝癌组织中的高表达强烈提示该基因对HCC发生可能起促进作用。但在进展期HCC中,Bcl-2蛋白表达仅在无包膜的肿瘤组织中阳性率较高外,与肿瘤大小、门脉癌栓及病理分级,TNM分期无关,表明Bcl-2基因对HCC的发展及晚期肝癌的形成似不起决定作用。与多数在其他恶性肿瘤中的研究结果有较大差别。我们认为并不是所有的程序化死亡都可用Bcl-2来阻止,可能还有独立于Bcl-2的其它引起细胞凋亡的途径和因素[10]。这尚需进行更加深入的研究。
, 百拇医药
C-myc基因是较早发现并研究的癌基因之一,其定位于人染色体8q24,编码的核内转化蛋白P62对正常细胞生长和分化起重要调节作用。该基因除具有刺激细胞增生的功能外,还具有促进凋亡的作用,这种相互对立的作用依赖于关键性生长因子的存在与否[11]。在HCC研究中,C-myc基因异常表达可能与肿瘤的发生、发展有关,但许多研究者所得结论并不完全一致。本组实验表明在HCC癌组织及癌周组织中,C-myc阳性表达水平有显著性升高(P<0.05),显示该基因活化发生在肝癌早期,支持C-myc癌基因的激活可能参与肝细胞癌变的机理。Tiniako等研究认为肝癌组织中C-myc蛋白表达增加与肝病背景密切相关[15]。本实验支持此观点,在伴有肝硬化组中C-myc蛋白表达水平显著增高,肝硬化组织由于肝细胞反复再生,使突变机会上升,癌基因变异水平增加,致癌变发生发展。HBV是肝癌的主要病因之一,在人肝癌和癌旁组织中均发现有HBV DNA整合[16],在土拨鼠肝炎病毒(WHV)诱发土拨鼠肝癌常常可见病毒基因片段整合在myc基因的调控区。本实验选取患者外周血HBsAg,与肝组织检测有一定差别,表明外周血HBsAg阳性、阴性患者其肝癌组织C-myc表达量无显著性差异。在HCC中,C-myc在具有门脉癌栓、无肿瘤包膜、较低分化及高TNM分期者具有较高的C-myc表达水平,与大多数研究相同,同时也表明C-myc基因的异常活化在HCC发展过程中可能是决定因素之一。
, http://www.100md.com
Bcl-2与C-myc共同表达可使肿瘤获得永生化[17]。本实验Bcl-2、C-myc在正常肝组织、癌周组织及癌组织中相伴存在,表达平行增高,在多数组织中的分布有较强一致性,显示两者在致癌的启动和演变过程中可能具有协同作用。Bcl-2做为C-myc基因关键性调节因子之一,不但可阻断C-myc所诱导的凋亡而不影响其丝裂原活性,它自身所具有的抗凋亡机制在肿瘤发生中也发挥很大作用[18]。双重免疫组化染色显示Bcl-2及C-myc癌基因蛋白阳性染色大部分定位于不同细胞,整体上交叉分布,部分聚集。也可见同一细胞内二者同时表达。从其分布可推想癌基因在致癌因子的作用下,大部分分别在不同的细胞中发生变异,经不同途径发挥作用并通过某种中介达到协同致癌目的。同一细胞两癌基因同时发生变异,其致癌机理可能有所不同。
单因素分析可看到Bcl-2和/或C-myc高表达与HCC预后不良有关,两者共同高表达与共同低表达之间预后差异更加显著(P<0.001)。由图3可见远期生存曲线间有部分交叉现象,可能与长期随访病例较少有关。多因素分析则显示C-myc可作为一个独立的预后因子,其高表达者具有高死亡率,对预后作用的强度仅次于“有无门脉癌栓”。而Bcl-2尚不能作为一个独立的指标来准确判断预后,需与其它多项指标综合分析才更加准确可靠,两基因联合检测可提高其预后判断价值。
, 百拇医药
癌周组织中Bcl-2、C-myc基因表达均较正常肝组织有显著增高,这些近似“正常细胞”虽然在细胞形态上尚未出现改变,实际已处于致癌因子作用下,基因水平已非完全正常,并具备较高的潜在致癌状态。本实验所选距肿瘤1cm处的癌周组织显然已不能满足根治要求。
作者简介:李华(1969-),男,陕西西安人,博士,主治医师,从事肝胆外科,肿瘤外科专业。
参考文献
1,Hsu HC,Shen JC,Lee CS,et al.Prognostic histologic parameters in resected small hepatocellular carcinoma:a comparison with resected large hepatocellular carcinoma.Cancer,1985;56:672
2,李华,潘承恩 多基因变异与肝细胞癌.实用肿瘤学杂志,1998;12:76
, http://www.100md.com
3,Tgujimoto Y,Gorham J,Cossman J,et al.The t (14;18) chromosome translocations involoved in B cell neoplasms result from mistake in VDJ joining.Science,1985;229:1390
4,Higashiyama M,Doi O,Kodama K,et al.High prevalence of Bcl-2 oncoprotein expression in small cell lung cancer.Anticancer Res,1995;15:503
5,Lauwers GY,Scott GV,Karpeh MS.Immunohistochemical evaluation of Bcl-2 protein expression in gastric adenocarcinomas.Cancer,1995;75:2209
, 百拇医药
6,Charpin C,Garcia S,Bouvier C,et al.Automated and quantitative immunocytochemical assays of Bcl-2 protein in breast carcinomas,Br J Cancer,1997;76:340
7,闫庆国,王文亮,黄高升.原发性肝癌细胞凋亡的研究进展.国外医学外科学分册,1997;24:268
8,Zhao M,Zhang NX,Economou M,et al.Immunohistochemical detection of Bcl-2 in liver lesions:Bcl-2 protein is expressed in hepatocellular carcinoma,but not in liver cell dysplasia.Histopath,1994;25:237
, 百拇医药
9,Charlotte F, L′Hermin A, Martin N, et al. Immunohistochemical detection of Bcl-2 protein in normal and pathological human liver.Am J Pathol,1994;144:460
10,夏红,章静波.程序化细胞死亡与肿瘤.肿瘤防治研究,1995;22:54
11,Willims GT,Smith CA.Molecular regulation of apoptosis:genetic control on cell death.Cell,1993;74:777
12,Beer DG, Schwarz M, Swawada N, et al. Expression of H-ras and C-myc proto-oncogenes in isolated r-glutamyl transpeptidase-positive rat.Hepatocytes and hepatocellular carcinomas induced by diethyinitrasamine.Cancer Res,1986;46:2435
, http://www.100md.com
13,Yaswen P,Goyetta M,Shank P,et al.Expression of C-ki-ras,C-Ha-ras and C-myc in specific cell types during hepatocarcinogenesis.Mol Cell Biol,1985;5:780
14,陈子华,吕新生,文继航,等.原癌基因Jun/C-myc在原发性肝细胞癌中的表达及意义.中华实验外科杂志,1997;14:277
15,Tiniakos D,Spandidos DA,Yiagnisis M,et al.Expression of ras and C-myc onco-protein and hepatitis B surface antigen in human liver disease.Hepatogastroenterol.1993;40:56
16,Tabor. Strongly supported features of the association between hepatitis B virus and hepatocellular carcinoma.Etiology,pathology and treatment of hepatocellular carcinoma in North America.TX Portfolio:The Woodlands,1991;107
17,Martin SJ, Green DR, Cotter TG. Dicing with death:dissecting the components of the apopotosis machinery.TIBS,1994;19:26
18,Bissonnette RP,Echeverri F,Mahboubi A,et al.Apoptotic cell death induced by C-myc is inhibited by Bcl-2.Nature,1992;359:552
收稿日期:1999-4-20, 百拇医药