红花黄素对豚鼠单个心室肌细胞动作电位和钙电流的影响*
作者:单宏丽 徐长庆 刘凤芝 李玉荣 杨宝峰 许宏远 娄延平
单位:单宏丽 徐长庆 刘凤芝 娄延平 哈尔滨医科大学病理生理学教研室 李玉荣 生理学教研室;杨宝峰 药理学教研室,哈尔滨 150086;许宏远 黑龙江省电力医院内科,哈尔滨 150030
关键词:红花黄素;心室肌细胞;豚鼠;膜片钳;动作电位时程;L-型钙电流
摘要 目的 观察红花黄素对豚鼠单个心室肌细胞动作电位和钙电流的影响
摘要 目的 观察红花黄素对豚鼠单个心室肌细胞动作电位和钙电流的影响。方法 采用膜片钳全细胞式记录技术。结果 红花黄素(3.3μg.L-1)能延长单个心室肌细胞动作电位时程,由(359.33±27.18) ms延长至(413.33±61.88) ms(P<0.05,n=6)。同时增加内向L-型钙电流的峰值,由(-1021±74) pA至(-1436±212) pA(P<0.05,n=7)。结论 由于红花黄素具有上述电生理作用,可用于心力衰竭和快速性心律失常的治疗。
, 百拇医药
中国图书分类号 R 284.1; R 331.38; R972.1; R 972.2
文献标识码 A 文章编号 1001-1978(1999)04-0351-03
Effects of safflower yellow pigment on action potential duration and calcium current in single guinea-pig ventricular myocytes
SHAN Hong-Li,XU Chang-Qing,LIU Feng-Zhi,LI Yu-Rong.YANG Bao-Feng,XU Hong-Yuan,LOU Yan-Ping
(Dept of Pathophysiology,Harbin Medical University,Harbin 150086)
, 百拇医药
ABSTRACT AIM To observe the effects of safflower yellow pigment (SYP) on action potential and calcium current in single guinea-pig ventricular myocyte. METHODS The patch-clamp whole cell recording technique was used. RESULT SYP (3.3 μg.L-1)prolonged the APD from (359.33±27.18) ms to (413.33±61.88) ms(P<0.05,n=6),while it increased the peak current of L-type calcium current from (-1021±74) pA to (-1 436±212) pA(P<0.05, n=7). CONCLUSION SYP can be used for the treatment of heart failure and rapid arrhythmias due to its electrophysiological action.
, 百拇医药
KEY WORDS safflower yellow pigment(SYP); ventricular myocytes ; guinea pig; patch-clamp technique; action potential duration(APD); L-type calcium current
红花是传统中草药,为性温味辛的菊科植物,有活血通经、祛瘀止痛功效。研究表明,红花具有扩血管、降血压、降血脂、抗凝、抗炎和提高耐缺氧能力等作用,临床用于治疗缺血性心脏病,脑中风等,获得良好疗效[1,2]。红花黄素(safflower yellow pigment, SYP)为由红花提取出的水溶性查尔酮类化合物,红花的有效成分大多在其水浸出液中[3],对SYP的研究日益受到人们重视[4]。但其电生理机制,尤其在分子水平上的研究,鲜见报道。本文采用全细胞膜片钳技术,观察SYP对豚鼠单个心室肌细胞APD和ICa的影响。
, http://www.100md.com
1 材料与方法
1.1 单个心肌细胞的分离 实验动物用豚鼠,由哈尔滨医科大学实验动物中心提供,体重300~400g,性别不限。分离方法和条件与以前报道基本相同[5]。猛击豚鼠枕部致昏,迅速开胸取心脏,采用Langendorff离体心脏灌流模型,主动脉逆行插管进行离体心脏灌流。首先用正常台氏液(mmol.L-1):NaCl 120,KCl 5.4,NaHCO3 20 ,NaH2PO4 0.9 ,MgCl2 1.0,CaCl2 1.8,Glucose 10,用HCl调pH至7.40±0.05,灌注5 min左右,以冲出心腔内残血,使心脏恢复正常节律,然后用无钙液(台氏液中去除钙离子)灌流4~5min,使心脏停跳于舒张期,最后用含胶原酶(Ⅰ型,Sigma公司)15 mg(50 ml)的无钙液进行循环消化,观察心脏颜色,体积的改变,消化10 min后自右心室分段剪取心肌组织,置于盛有高钾保存液KB液(mmol.L-1):glutamic acid(谷氨酸)70 ,taurin(牛磺酸)15 ,KCl 30,KH2PO4 10,HEPES 10, MgCl2 0.5,EDTA 0.5,Glucose 10,用5mol.L-1 KOH调pH至7.3~7.4。用吸管轻轻吹打使细胞分散。实验过程中所有的灌流液体均用0.95 O2+0.05 CO2气体饱和,实验温度在(37±0.5)℃,分离好的细胞置4℃冰箱中保存,静止1~2 h后应用。
, 百拇医药
1.2 膜电位和膜电流的记录 根据Hamil等人的改进的膜片钳记录技术进行[6]。向Olympus IMT-2型倒置显微镜上方的浴槽内滴入1滴细胞悬液,放置10min左右,待细胞贴壁后用改进的台氏液(mmol.L-1):NaCl 136, KCl 5.4, NaH2PO4 1.2, CaCl2 1.8,HEPES 5,MgSO4 1.2,Glucose 15 ,用NaOH 调pH至7.3~7.4,持续灌流,冲洗细胞,灌流速度为0.8ml.min-1。选择贴壁良好,杆状,横纹清晰,胞膜完整,折光率好的细胞进行封接实验。使用膜片钳放大器(AXOPATCH 200A),数模转换系统(DigiData 1200),pCLAMP 6.02微机程序,全细胞膜片钳记录,用电流钳记录单细胞膜电位,同时用电压钳记录内向钙电流。所有实验均在室温下(27℃±1℃)进行。动态采集的数据储存在DELL微机中,并用pCLAMP6中Clampfit分析软件进行数据分析和处理。
, http://www.100md.com
实验用玻璃微电极由两步拉制仪(日本Narishaga PP-83型)制备,充灌电极液后尖端阻抗为2~6MΩ。电极液所含组分为(mmol.L-1):KCl 20,K-Aspartate(天门冬氨酸钾)110 ,HEPES 5.0,MgCl2 1.0,EDTA 10, ATPNa2 5.0,用KOH调pH至7.2,冷冻保存备用。
1.3 溶液与试剂 红花黄素由我室自制;胶原酶,天门冬氨酸钾,ATPNa2,HEPES为Sigma公司产品;其余试剂为分析纯试剂。
1.4 实验分组 实验分正常对照组和实验处理组,观察指标在同一细胞上,系处理前后对照。
1.5 资料分析 数据用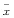 ±s表示,用配对t检验进行差异显著性测定。
±s表示,用配对t检验进行差异显著性测定。
, http://www.100md.com
2 结果
2.1 SYP对膜电位的影响 应用全细胞膜片钳技术的电流钳,记录单个细胞的跨膜电位,细胞封接阻抗为10 GΩ以上,保持电压为-80 mV。结果发现,红花黄素使动作电位时程(APD)延长,由(359.33±27.17) ms增加至(431.33±61.88)ms,对其余参数均无明显影响。图1为其中1次的实验记录。
Fig 1 Effect of SYP on APD of isolated
ventricular myocytes in guinea-pig
, http://www.100md.com 2.2 SYP对L型内向钙电流的影响 通过钳制电压记录L型Ca2+电流,该电流呈电压依赖性。本实验采用保持电压-40 mV,从-30 mV开始以10mV阶梯跃到+70mV的电压刺激,不同电压下的钙通道的开放程度不同,据此绘制电流-电压关系曲线。结果表明:红花黄素能增加内向钙电流(见图2,图3)。
2.3 SYP对L型Ca2+电流的动力学特性的影响 通过反映钙电流动力学特性的激活曲线(如图4)可知:应用SYP并不影响L型钙电流的动力学特性,即不改变通道的开放概率,而是通过增加电流幅度发挥作用。

, 百拇医药
Fig 2 Effect of SYP on calcium current of ventricular myocytes
Fig 3 Effect of SYP on I-V curve of calcium current of
ventricular myocytes in guinea-pig
, http://www.100md.com
Fig 4 Effect of SYP on the active curve of calcium current
3 讨论
本研究发现:SYP能延长APD并相应增加L型内向Ca2+电流。目前公认的钙通道有L型,T型和N型3种,心肌细胞只存在T型和L型钙通道。T型钙通道在较低膜电压下迅速激活,并快速失活,对APD的贡献较小。L-型钙通道的特点是:一般在-40 mV以上电压激活、持续时间较长,在0~+10 mV膜电位下出现最大峰电流,其反转电位约60~70 mV,且这一内向电流可被特异性阻断剂(如维拉帕米)所取消或特异性激动剂(如Bay K8644)所增强,它是维持动作电位平台期的主要内向电流[5,7]。本实验采用的保持电压为-40 mV,内向Na+电流和T型Ca2+电流被完全抑制,所记录到的内向电流可被维拉帕米所取消,加之其最大峰电流电位和反转电位均符合L型钙电流的特点,因此,本实验所采用的刺激程序记录到的电流显然是L型Ca2+电流。
, http://www.100md.com
内向整流钾电流(IK1)主要负责维持心肌细胞的静息电位(RP)和动作电位(AP)3期快速复极化过程,延迟整流钾电流(IK)则参与整个复极过程,和ICa一起共同维持AP的平台期[8~10]。本实验发现,红花黄素对RP和AP晚期快速复极无何影响,可见其对IK1无明显作用。
我们提出的APD50~10相当于复极2期(平台期,缓慢复极期), APD90~50相当于复极3期(快速复极晚期)的观点,已在膜片钳技术测得的药物抑制L型钙电流和缩短动作电位时程效应的相关性分析中得到进一步证实[5]。由于平台期占APD的比例很大,故平台期在决定APD中常常起决定性作用。而平台期的长短,则主要取决于Ca2+内流和K+外流,当然和Na+内流亦有一定关系。L型钙通道的激活或IK钾通道的抑制,均可引起APD的延长。本实验观察到的红花黄素可使APD明显延长,肯定与其增强L-型钙电流有关。我们在常规电生理的研究中,发现缺氧和复氧造成豚鼠乳头肌APD缩短,红花黄素可使缩短的APD明显延长[11],这与本实验观察到的情况十分相似。至于红花黄素对控制APD长短的主要钾通道离子电流——IK的影响,有待于进一步研究。
, http://www.100md.com
众所周知,Ca2+是心肌兴奋收缩偶联因子,心衰时心肌收缩力降低的一个主要原因是Ca2+的转运失常。SYP通过激活L型钙通道,促进Ca2+内流,进而可增加心肌收缩力,提示红花黄素可用于心力衰竭的治疗。红花黄素能延长APD ,必然使有效不应期也相应延长,这为临床应用红花黄素防治快速性心律失常提供理论依据。我们亦观察到,SYP能明显减轻H2O2所致的豚鼠心室肌细胞的跨膜电位和离子电流的改变(具体资料另文发表),这也是SYP心肌保护的可能机制之一。
*国家自然科学基金资助课题, No 39570305
作者简介:单宏丽,女,26 岁,硕士研究生;
徐长庆,男,54岁,教授,博士生导师,教研室主任
, 百拇医药 参考文献
1 傅秀兰. 复方红花治疗冠心病300例疗效观察. 实用中西医结合杂志, 1991;4(3):157~9
2 王贵淼,李一立. 红花的临床应用. 浙江中医杂志, 1985;1:42~3
3 陈希元,马 军,阿初克木. 红花黄素对大鼠动脉血浆中6-keto-PGF1α和TXB2含量的影响. 中国药理学通报,1996;12(6):483
4 Agarwal K,Mukherjee A,Chakrabarti J. In vivo cytogenetic studies on mice exposed to natral food colorings. Food Chemical Toxicology, 1994;32(9):837~8
, http://www.100md.com
5 徐长庆,娄延平,杨宝峰,李玉荣. 丹参酮Ⅱ-A抑制豚鼠单个心肌细胞L型钙电流和缩短动作电位时程效应的相关性分析. 中国药理学通报, 1998;14(5):428~31
6 Hamil OP ,Marty A,Neher E et al. Improved patchclamp techniques for high resolution current recording from cells and cell-free membrane patches. Pflugers Arch, 1981;,391:85~100
7 郑熙隆. 钙离子通道分子药理学进展. 国外医学*生理、病理科学与临床分册, 1993;(1):26~7
8 Nobel D. Ionic mechanisms controlling the action potential duration and the timing of repolarization. Jpn Heart J, 1986;27(suppl 1):3~19
, http://www.100md.com
9 Carmeliet E. K+ channels and control of ventricular&127;repolarization in the heart. Fundam Clin Pharmacol,1993;7(1):19~28
10 Surawicz B. Role of potassium channels in cycle length dependent regulation of action potential duration in mammalian cardiac Purkinje and ventricular muscle fibres. Cardiovasc Res, 1992;26(11):1021~9
11 李 芳,娄延平,王孝铭et al.红花黄素对豚鼠心室乳头肌缺氧和复氧损伤的保护作用. 哈尔滨医科大学学报,1999;33(1):6~8
1998-12-30收稿,1999-05-06修回, 百拇医药
单位:单宏丽 徐长庆 刘凤芝 娄延平 哈尔滨医科大学病理生理学教研室 李玉荣 生理学教研室;杨宝峰 药理学教研室,哈尔滨 150086;许宏远 黑龙江省电力医院内科,哈尔滨 150030
关键词:红花黄素;心室肌细胞;豚鼠;膜片钳;动作电位时程;L-型钙电流
摘要 目的 观察红花黄素对豚鼠单个心室肌细胞动作电位和钙电流的影响
摘要 目的 观察红花黄素对豚鼠单个心室肌细胞动作电位和钙电流的影响。方法 采用膜片钳全细胞式记录技术。结果 红花黄素(3.3μg.L-1)能延长单个心室肌细胞动作电位时程,由(359.33±27.18) ms延长至(413.33±61.88) ms(P<0.05,n=6)。同时增加内向L-型钙电流的峰值,由(-1021±74) pA至(-1436±212) pA(P<0.05,n=7)。结论 由于红花黄素具有上述电生理作用,可用于心力衰竭和快速性心律失常的治疗。
, 百拇医药
中国图书分类号 R 284.1; R 331.38; R972.1; R 972.2
文献标识码 A 文章编号 1001-1978(1999)04-0351-03
Effects of safflower yellow pigment on action potential duration and calcium current in single guinea-pig ventricular myocytes
SHAN Hong-Li,XU Chang-Qing,LIU Feng-Zhi,LI Yu-Rong.YANG Bao-Feng,XU Hong-Yuan,LOU Yan-Ping
(Dept of Pathophysiology,Harbin Medical University,Harbin 150086)
, 百拇医药
ABSTRACT AIM To observe the effects of safflower yellow pigment (SYP) on action potential and calcium current in single guinea-pig ventricular myocyte. METHODS The patch-clamp whole cell recording technique was used. RESULT SYP (3.3 μg.L-1)prolonged the APD from (359.33±27.18) ms to (413.33±61.88) ms(P<0.05,n=6),while it increased the peak current of L-type calcium current from (-1021±74) pA to (-1 436±212) pA(P<0.05, n=7). CONCLUSION SYP can be used for the treatment of heart failure and rapid arrhythmias due to its electrophysiological action.
, 百拇医药
KEY WORDS safflower yellow pigment(SYP); ventricular myocytes ; guinea pig; patch-clamp technique; action potential duration(APD); L-type calcium current
红花是传统中草药,为性温味辛的菊科植物,有活血通经、祛瘀止痛功效。研究表明,红花具有扩血管、降血压、降血脂、抗凝、抗炎和提高耐缺氧能力等作用,临床用于治疗缺血性心脏病,脑中风等,获得良好疗效[1,2]。红花黄素(safflower yellow pigment, SYP)为由红花提取出的水溶性查尔酮类化合物,红花的有效成分大多在其水浸出液中[3],对SYP的研究日益受到人们重视[4]。但其电生理机制,尤其在分子水平上的研究,鲜见报道。本文采用全细胞膜片钳技术,观察SYP对豚鼠单个心室肌细胞APD和ICa的影响。
, http://www.100md.com
1 材料与方法
1.1 单个心肌细胞的分离 实验动物用豚鼠,由哈尔滨医科大学实验动物中心提供,体重300~400g,性别不限。分离方法和条件与以前报道基本相同[5]。猛击豚鼠枕部致昏,迅速开胸取心脏,采用Langendorff离体心脏灌流模型,主动脉逆行插管进行离体心脏灌流。首先用正常台氏液(mmol.L-1):NaCl 120,KCl 5.4,NaHCO3 20 ,NaH2PO4 0.9 ,MgCl2 1.0,CaCl2 1.8,Glucose 10,用HCl调pH至7.40±0.05,灌注5 min左右,以冲出心腔内残血,使心脏恢复正常节律,然后用无钙液(台氏液中去除钙离子)灌流4~5min,使心脏停跳于舒张期,最后用含胶原酶(Ⅰ型,Sigma公司)15 mg(50 ml)的无钙液进行循环消化,观察心脏颜色,体积的改变,消化10 min后自右心室分段剪取心肌组织,置于盛有高钾保存液KB液(mmol.L-1):glutamic acid(谷氨酸)70 ,taurin(牛磺酸)15 ,KCl 30,KH2PO4 10,HEPES 10, MgCl2 0.5,EDTA 0.5,Glucose 10,用5mol.L-1 KOH调pH至7.3~7.4。用吸管轻轻吹打使细胞分散。实验过程中所有的灌流液体均用0.95 O2+0.05 CO2气体饱和,实验温度在(37±0.5)℃,分离好的细胞置4℃冰箱中保存,静止1~2 h后应用。
, 百拇医药
1.2 膜电位和膜电流的记录 根据Hamil等人的改进的膜片钳记录技术进行[6]。向Olympus IMT-2型倒置显微镜上方的浴槽内滴入1滴细胞悬液,放置10min左右,待细胞贴壁后用改进的台氏液(mmol.L-1):NaCl 136, KCl 5.4, NaH2PO4 1.2, CaCl2 1.8,HEPES 5,MgSO4 1.2,Glucose 15 ,用NaOH 调pH至7.3~7.4,持续灌流,冲洗细胞,灌流速度为0.8ml.min-1。选择贴壁良好,杆状,横纹清晰,胞膜完整,折光率好的细胞进行封接实验。使用膜片钳放大器(AXOPATCH 200A),数模转换系统(DigiData 1200),pCLAMP 6.02微机程序,全细胞膜片钳记录,用电流钳记录单细胞膜电位,同时用电压钳记录内向钙电流。所有实验均在室温下(27℃±1℃)进行。动态采集的数据储存在DELL微机中,并用pCLAMP6中Clampfit分析软件进行数据分析和处理。
, http://www.100md.com
实验用玻璃微电极由两步拉制仪(日本Narishaga PP-83型)制备,充灌电极液后尖端阻抗为2~6MΩ。电极液所含组分为(mmol.L-1):KCl 20,K-Aspartate(天门冬氨酸钾)110 ,HEPES 5.0,MgCl2 1.0,EDTA 10, ATPNa2 5.0,用KOH调pH至7.2,冷冻保存备用。
1.3 溶液与试剂 红花黄素由我室自制;胶原酶,天门冬氨酸钾,ATPNa2,HEPES为Sigma公司产品;其余试剂为分析纯试剂。
1.4 实验分组 实验分正常对照组和实验处理组,观察指标在同一细胞上,系处理前后对照。
1.5 资料分析 数据用
, http://www.100md.com
2 结果
2.1 SYP对膜电位的影响 应用全细胞膜片钳技术的电流钳,记录单个细胞的跨膜电位,细胞封接阻抗为10 GΩ以上,保持电压为-80 mV。结果发现,红花黄素使动作电位时程(APD)延长,由(359.33±27.17) ms增加至(431.33±61.88)ms,对其余参数均无明显影响。图1为其中1次的实验记录。

Fig 1 Effect of SYP on APD of isolated
ventricular myocytes in guinea-pig
, http://www.100md.com 2.2 SYP对L型内向钙电流的影响 通过钳制电压记录L型Ca2+电流,该电流呈电压依赖性。本实验采用保持电压-40 mV,从-30 mV开始以10mV阶梯跃到+70mV的电压刺激,不同电压下的钙通道的开放程度不同,据此绘制电流-电压关系曲线。结果表明:红花黄素能增加内向钙电流(见图2,图3)。
2.3 SYP对L型Ca2+电流的动力学特性的影响 通过反映钙电流动力学特性的激活曲线(如图4)可知:应用SYP并不影响L型钙电流的动力学特性,即不改变通道的开放概率,而是通过增加电流幅度发挥作用。


, 百拇医药
Fig 2 Effect of SYP on calcium current of ventricular myocytes

Fig 3 Effect of SYP on I-V curve of calcium current of
ventricular myocytes in guinea-pig

, http://www.100md.com
Fig 4 Effect of SYP on the active curve of calcium current
3 讨论
本研究发现:SYP能延长APD并相应增加L型内向Ca2+电流。目前公认的钙通道有L型,T型和N型3种,心肌细胞只存在T型和L型钙通道。T型钙通道在较低膜电压下迅速激活,并快速失活,对APD的贡献较小。L-型钙通道的特点是:一般在-40 mV以上电压激活、持续时间较长,在0~+10 mV膜电位下出现最大峰电流,其反转电位约60~70 mV,且这一内向电流可被特异性阻断剂(如维拉帕米)所取消或特异性激动剂(如Bay K8644)所增强,它是维持动作电位平台期的主要内向电流[5,7]。本实验采用的保持电压为-40 mV,内向Na+电流和T型Ca2+电流被完全抑制,所记录到的内向电流可被维拉帕米所取消,加之其最大峰电流电位和反转电位均符合L型钙电流的特点,因此,本实验所采用的刺激程序记录到的电流显然是L型Ca2+电流。
, http://www.100md.com
内向整流钾电流(IK1)主要负责维持心肌细胞的静息电位(RP)和动作电位(AP)3期快速复极化过程,延迟整流钾电流(IK)则参与整个复极过程,和ICa一起共同维持AP的平台期[8~10]。本实验发现,红花黄素对RP和AP晚期快速复极无何影响,可见其对IK1无明显作用。
我们提出的APD50~10相当于复极2期(平台期,缓慢复极期), APD90~50相当于复极3期(快速复极晚期)的观点,已在膜片钳技术测得的药物抑制L型钙电流和缩短动作电位时程效应的相关性分析中得到进一步证实[5]。由于平台期占APD的比例很大,故平台期在决定APD中常常起决定性作用。而平台期的长短,则主要取决于Ca2+内流和K+外流,当然和Na+内流亦有一定关系。L型钙通道的激活或IK钾通道的抑制,均可引起APD的延长。本实验观察到的红花黄素可使APD明显延长,肯定与其增强L-型钙电流有关。我们在常规电生理的研究中,发现缺氧和复氧造成豚鼠乳头肌APD缩短,红花黄素可使缩短的APD明显延长[11],这与本实验观察到的情况十分相似。至于红花黄素对控制APD长短的主要钾通道离子电流——IK的影响,有待于进一步研究。
, http://www.100md.com
众所周知,Ca2+是心肌兴奋收缩偶联因子,心衰时心肌收缩力降低的一个主要原因是Ca2+的转运失常。SYP通过激活L型钙通道,促进Ca2+内流,进而可增加心肌收缩力,提示红花黄素可用于心力衰竭的治疗。红花黄素能延长APD ,必然使有效不应期也相应延长,这为临床应用红花黄素防治快速性心律失常提供理论依据。我们亦观察到,SYP能明显减轻H2O2所致的豚鼠心室肌细胞的跨膜电位和离子电流的改变(具体资料另文发表),这也是SYP心肌保护的可能机制之一。
*国家自然科学基金资助课题, No 39570305
作者简介:单宏丽,女,26 岁,硕士研究生;
徐长庆,男,54岁,教授,博士生导师,教研室主任
, 百拇医药 参考文献
1 傅秀兰. 复方红花治疗冠心病300例疗效观察. 实用中西医结合杂志, 1991;4(3):157~9
2 王贵淼,李一立. 红花的临床应用. 浙江中医杂志, 1985;1:42~3
3 陈希元,马 军,阿初克木. 红花黄素对大鼠动脉血浆中6-keto-PGF1α和TXB2含量的影响. 中国药理学通报,1996;12(6):483
4 Agarwal K,Mukherjee A,Chakrabarti J. In vivo cytogenetic studies on mice exposed to natral food colorings. Food Chemical Toxicology, 1994;32(9):837~8
, http://www.100md.com
5 徐长庆,娄延平,杨宝峰,李玉荣. 丹参酮Ⅱ-A抑制豚鼠单个心肌细胞L型钙电流和缩短动作电位时程效应的相关性分析. 中国药理学通报, 1998;14(5):428~31
6 Hamil OP ,Marty A,Neher E et al. Improved patchclamp techniques for high resolution current recording from cells and cell-free membrane patches. Pflugers Arch, 1981;,391:85~100
7 郑熙隆. 钙离子通道分子药理学进展. 国外医学*生理、病理科学与临床分册, 1993;(1):26~7
8 Nobel D. Ionic mechanisms controlling the action potential duration and the timing of repolarization. Jpn Heart J, 1986;27(suppl 1):3~19
, http://www.100md.com
9 Carmeliet E. K+ channels and control of ventricular&127;repolarization in the heart. Fundam Clin Pharmacol,1993;7(1):19~28
10 Surawicz B. Role of potassium channels in cycle length dependent regulation of action potential duration in mammalian cardiac Purkinje and ventricular muscle fibres. Cardiovasc Res, 1992;26(11):1021~9
11 李 芳,娄延平,王孝铭et al.红花黄素对豚鼠心室乳头肌缺氧和复氧损伤的保护作用. 哈尔滨医科大学学报,1999;33(1):6~8
1998-12-30收稿,1999-05-06修回, 百拇医药