绞股蓝总皂苷对内毒素、氧自由基介导血管内皮细胞表达c-sis基因和调节平滑肌细胞增殖的影响*
作者:黄红林 陈临溪 朱炳阳 余 麟 廖端芳
单位:(衡阳医学院心肺药理学研究室,衡阳 421001)
关键词:绞股蓝总皂苷;内毒素;氧自由基;c-sis;一氧化氮;内皮细胞;平滑肌细胞
中国药理学通报990412
摘要 目的 研究绞股蓝总皂苷(Gyp)对血管平滑肌细胞增殖的调节与内皮细胞c-sis基因表达和一氧化氮(NO)合成/释放的关系。方法 采用原位杂交法检测内皮细胞 c-sis mRNA表达,用Griess法测定内皮细胞NO释放量,用MTT快速比色法检测平滑肌细胞(SMC)增殖。结果 内毒素(LPS)16mg.L-1促进牛主动脉内皮细胞 c-sis基因表达,明显降低内皮细胞培养液中一氧化氮含量,刺激SMC增殖;黄嘌呤-黄嘌呤氧化酶(X-XO)系统产生的氧自由基(OFR)具有与LPS相似的作用。绞股蓝总皂苷对LPS诱导的内皮细胞 c-sis基因表达具有明显抑制作用,并能对抗OFR诱导的EC损伤,保护内皮细胞释放NO的能力,抑制LPS和OFR通过EC介导的S MC增殖。Gyp的效应可被NO合成酶抑制剂硝基-左旋精氨酸部分取消。结论 绞股蓝总皂苷通过抑制内皮细胞c-sis基因表达,促进内皮细胞合成(释放)NO抑制平滑肌细胞增殖。
, 百拇医药
中国图书分类号 R 284.1; R 322.74; R 394.2; R543.5
文献标识码 A 文章编号 1001-1978(1999)04-0325 -04
Effects of gypenosides on c-sis expression of bovine aortic
endothelial cells and proliferation of vascular smooth muscle cells
induced by lipopolysaccharide and active oxygen species
HUANG Hong-Lin, CHEN Lin-Xi, ZHU Bin-Yang, YU Lin, LIAO Duan-Fang
, 百拇医药
(Division of Cardiopulmonary Pharmacology,Hengyang Medical College,Hengyang 421001)
ABSTRACT AIM To investigate the effects of gypenosides(Gyp) onc-sis expression of endothelial cells (EC) and proliferation of vascular smooth muscle cells (VSMC)induced by lipopolysaccharide (LPS) and oxygen free radical(OFR).METHODS Cultured bovine aortic endothelial cells were incubated with Gyp (10~20 mg.L-1)and LPS (16 mg.L-1) or xanthine(100μmol.L-1) plus xanthine oxidase (100U.L-1). C-sis expression was determined by in situ hybridigation. Nitrite, the matabolic product of NO, was measured according to a modified Griess method,and the proliferation of endothelial cells and VSMC was estimated by MTT assay. RESULTS We observed that LPS promotedc-sis gene expression, and inhibited NO release, and that X-XO inhibited EC proliferation and NO release. Both LPS and X-XO stimulated SMC proliferation by inducing growth factors release from EC.Gyp significantly de-creased c-sis gene expression,increased NO synthesis and proliferation of EC.Furthermore,Gyp indirectly inhibited SMC proliferation by blocking the effects of LPS and X-XO.The effeccts of Gyp wer abolished by NO synthase inhibitor NG-L-Arg.CONCLUSION Gyp inhibited X-XO and LPS induced proliferation of VSMC by attenuating c-sis gene expression and pro-moting NO sythesis/release of EC.
, http://www.100md.com
KEY WORDS gypenosides;lipopolysaccharide;oxygen free radical;c-sis gene;nitric oxide;endothe-lial cell;smooth muscle cell
动脉粥样硬化(Atherosclerosis,As)是一个复杂的病理过程,除了内皮损伤、脂质沉积、单核细胞泡沫化外,还表现出明显的血管平滑肌细胞(smooth muscle cells,SMC)增殖,后者在影响As的预后及经皮穿刺冠脉成形术后再狭窄方面起重要作用[1]。内皮细胞在受到细菌内毒素(lipopolysaccharide,LPS)、ox-LDL和氧自由基(oxygen free rad icals,OFR)[2,3]刺激时,可释放多种细胞因子和生长因子,内皮细胞c-sis基因编码的PDGF-BB就是其中最重要的一种,它可通过旁分泌刺激平滑肌细胞增殖,参与动脉粥样硬化形成[4]。
, 百拇医药
绞股蓝总皂苷(gypenosides,Gyp)为葫芦科植物绞股蓝的主要有效成分,我们前面的实验研究发现Gyp具有抗氧化损伤[5,6],并能有效对抗高脂所致血清NO、SOD、LPO、TC和T G的改变[7],能延缓食饵性兔动脉粥样硬化斑块的形成[8],还有明显的抗内毒素休克、预防继发性DIC等作用[9]。为进一步探讨Gyp抗动脉粥样硬化的作用机制,我们观察了Gyp对LPS诱导的牛主动脉内皮细胞表达c-sis基因的影响和Gyp对LPS 及X-XO诱导EC、SMC增殖的作用,并探讨这些作用与内皮细胞释放/合成NO的关系。
1 材料和方法
1.1 试剂 内毒素(lipopolysaccharide,LPS),黄嘌呤(xanthine ,X),黄嘌呤氧化酶(xanthine oxidase,XO),NG-硝基-L-精氨酸(NG-nitro-L-arginine,NG-L-Arg),M 119培养基,二甲基噻唑-二苯基溴化四唑[3(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT]均为Sigma公司产品;地高辛标记与检测试剂盒,华美公司产品;c-sis基因探针,北京医科大学汤健实验室赠;Gyp系湖南省医药工业研究所药理室赠送;其它试剂均为市售分析纯。
, 百拇医药
1.2 牛主动脉内皮细胞和平滑肌细胞培养 血管内皮细胞(endothelial cells,EC)参照Booyse等[10]描述的方法进行:胎牛经颈动脉放血致死,无菌取出整段胸主动脉,剥去外膜结缔组织,用D-Hanks液冲洗3~4次,纵向剪开血管,内膜朝下置于培养皿内,以2.5g.L-1胰蛋白酶消化(37℃,15min),加等量含20%(体积分数)牛血清的M 199培养液终止消化。用小勺轻刮内膜,收集液体离心(1 000×g,10min),弃上清液,加培养液制成细胞悬液,种植于培养瓶内,37℃,CO2培养箱培养,待5~6d融合后用2.5g.L-1胰蛋白酶消化进行传代培养。实验用长势良好的第4代融合的细胞。
SMC采用常规贴块法培养:取胎牛胸主动脉置Hanks液中,剥去外膜结缔组织,沿纵轴剪开血管壁,剥离内膜,反复清洗,将内膜剪成1mm×1mm组织块,种植于培养瓶,加入含20%(体积分数)胎牛血清的M 199培养液,37℃、CO2培养箱培养,实验用第4至第5代融合的细胞置96孔培养板用MTT法测细胞增殖。
, http://www.100md.com
1.3 内皮细胞c-sis基因检测的原位杂交方法 预先在6孔培养板内放置盖玻片,将EC接种于玻片上,待细胞融合后作如下分组:①正常对照组;②LPS处理组,加LPS 16mg.L-1;③~④ Gyp处理组:分别加入10mg.L-1、20mg.L-1 Gyp,再每孔加入 LPS 16mg.L-1;⑤NG-L-Arg抑制组:先加入20mg.L-1 Gyp,再加入NG-L-Arg 100μmol.L-1,最后加入 LPS 16mg.L-1。细胞继续培养24 h后分别收集培养液测NO和作为LPS刺激后的内皮细胞条件培养液(EC-CM)-20℃保存待作SMC增殖实验。按试剂盒操作说明书标记c-sis探针,并在EC培养玻片上进行cDNA-mRNA原位杂交,杂交时用预杂交液代替杂交液。杂交后进行免疫原检测→显色,终止反应。参照陈季[11]的方法,每张玻片随机数细胞20个,统计所有细胞浆中蓝色颗粒数。
, http://www.100md.com
1.4 内皮细胞培养液中NO测定 取内皮细胞种植于24孔板,再做如下处理:①正常处理组;②X-XO处理组:每孔含黄嘌呤(X)100μmol.L-1和黄嘌呤氧化酶(XO) 100U.L-1;③Gyp处理组:在加 X-XO前10min分别加入Gyp 10mg.L-1、20mg.L-1;④NG-L-Arg抑制组:在加 X-XO前,同时加入Gyp 20mg.L-1和NG-L-Arg(100μmol.L-1)。待 X-XO 作用30 min后,分别收集培养液测NO。
培养液NO微量测定参照文献[12,13]进行,取上清液40ml,加入0.943mol.L-1 NH4Cl 50ml,1.25mol.L-1 NaOH 10ml,室温放置10min,加 Griess 试剂100μl,60 ℃水浴、0℃冰浴各10 min,4 mol.L-1 HCl 50μl,用酶联免疫仪 540 nm 测吸光度(A值),同时以亚硝酸钠作标准曲线,结果以NO转变为亚硝酸盐的量(g.L-1)表示。
, http://www.100md.com
1.5 LPS和X-XO刺激EC增殖试验 将第5代融合的EC按2×108.L-1移植到两块96孔培养板中,培养24h后,再换以含0.5%(体积分数)牛血清M 199培养24 h,让细胞进入静止期后,按如下分组处理。
1.5.1 LPS刺激组(剂量同前述) ①正常对照组;②LPS刺激组;③ Gyp保护组;④NG-L-Arg对抗组。各组在加入LPS后继续培养72 h,弃去培养液,加入MTT(50mg.L-1)继续培养12h,再弃培养液,加入DMSO,振荡使兰紫色结晶充分溶解,用酶联免疫仪 570nm测得A值,以A值反映细胞的增殖情况。
1.5.2 X-XO刺激组(剂量分组同前述) ①正常对照组;②X-XO刺激组;③Gyp保护组;④NG-L-Arg对抗组。在X-XO作用30 min后,弃去培养液,换入正常培养液继续培养72h后弃去培养液,加入MTT,其余操作同上。
, http://www.100md.com
1.6 LPS和X-XO介导EC调节SMC增殖试验 取第5代融合的SMC移植到两块96孔培养板中,培养24 h,再换以含0.5%(体积分数)牛血清M199培养24 h,使细胞进入静止期后,其中一板换入LPS处理后的内皮细胞条件培养液(EC-CM),以正常的培养液作对照(CON),按MTT法测EC-CM对SMC增殖的影响。以A值表示细胞增殖情况。另一96孔板SMC用作探讨X-XO刺激后的EC条件培养液对SMC增殖的影响。
1.7 实验数据处理 实验结果以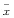 ±s表示,数据经方差齐性检验后行方差分析,两均数之间的比较用q检验。
±s表示,数据经方差齐性检验后行方差分析,两均数之间的比较用q检验。
2 结果
2.1 Gyp对LPS诱导内皮细胞c-sis基因表达的影响 原位杂交检测显示:体外培养的牛主动脉内皮细胞有c -sis mRNA表达,c-sis mRNA转录的阳性信号为蓝紫色颗粒。内皮细胞经LPS处理24 h后,其c-sis基因表达明显增强,约为对照组的2.5倍(188.3±30.7 vs 74.5±11.6,P<0.01)。Gyp(10, 20mg.L-1)均能对抗LPS的作用(48.5±8.6 vs 188.3±30.7,29.3±6.8 vs 188.3±30.7,P<0.01)。此外,Gyp也抑制X-XO诱导内皮细胞c-sis表达(结果未显示)。Gyp的作用可被NG-L-Arg部分取消(54.5±10.8 vs 29.3±6.8,P<0.01,图1)。
, 百拇医药
Fig 1 Effects of Gyp on c-sis expression of
endothelial cells induced by LPS(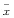 ±s,n=20)
±s,n=20)
*P<0.05,**P<0.01, vs CON; ##P<0.01, vs LPS; △△P<0.01, vs Gyp 20+LPS
2.2 LPS、X-XO和Gyp对内皮细胞合成释放一氧化氮的影响 培养的牛主动脉内皮细胞分别与LPS和X-XO作用24h和30min后,其培养液中的NO代谢产物含物量降低,Gyp能有效地保护内皮细胞含成释放NO的能力。NG-L-Arg可部分减弱Gyp的作用(表1)
, http://www.100md.com
Table1 Effects of LPS、X-XO and Gyp on NO release of endothelial cells and on proliferation of smooth muscle cells(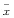 ±s,n=8) Groups
±s,n=8) Groups
EC Nitrite/g.L-1
SMC MTT assay/A
LPS
Control
1.73±0.25
0.47±0.03
, 百拇医药
LPS
0.97±0.09aa
0.52±0.04a
Gyp20+LPSD
1.35±0.24
0.48±0.03
Gyp20+LPS
1.57±0.28bb
0.45±0.02b
Gyp20+NG-L-Arg+LPS
, 百拇医药
1.20±0.05c
0.51±0.05c
X-XO
Control
1.81±0.14
0.21±0.04
X-XO
0.94±0.31
0.42±0.05**
Gyp10+X-XO
1.41±0.16##
, 百拇医药
0.26±0.02##
Gyp20+X-XO
1.53±0.22##
0.25±0.02##
Gyp20+NG-L-Arg+X-XO
1.31±0.14+
0.54±0.05++
NG-L-Arg
1.12±0.14**
, http://www.100md.com
aP<0.05,aaP<0.01, vs Control; bP<0.05, bbP<0.01, vs LPS; cP<0.05 vs Gyp 20+LPS;**P<0.01 vs Control;##P<0.01 vs X-XO;+P<0.05,++P<0.01, vs Gyp 20+X-XO.
2.3 Gyp对LPS和X-XO刺激内皮细胞增殖的影响 LPS(16mg.L-1)对内皮细胞增殖无明显影响(1.09+0.07 vs 1.12±0.05,P>0.05),而X-XO可明显抑制内皮细胞的增殖(0.29±0.11 vs 1.12±0.05,P<0.01),Gyp(20mg.L-1)可对抗X-XO的增殖抑制作用,且可轻度促进内皮细胞增殖(1.10±0.29 vs 0.29±0.11,P<0.01)。NG-L-Arg亦可阻断Gyp的作用(图2)。
, 百拇医药
Fig 2 Effects of Gyp on proliferation of endothelial
cells stimulated by X-XO(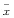 ±s,n=8)
±s,n=8)
**P<0.01 vs CON; △P<0.05, △△P<0.01 v s X-XO; ##P<0.01 vs Gyp 20+X-XO
2.4 LPS和Gyp的内皮细胞条件培养液及X-XO直接刺激对平滑肌细胞增殖的影响 未经任何刺激处理的EC-CM本身无明显促平滑肌细胞增殖作用,Gyp本身对SMC增殖亦无影响。EC在受LPS刺激后产生的条件培养液可使SMC明显增殖( 0.52±0.04 vs 0.47±0.03, P<0.05),而用Gyp与LPS同时处理的内皮细胞条件培养液刺激SMC增殖的作用明显减弱。NG-L-Arg 可抑制Gyp间接调节平滑肌细胞增殖作用。X-XO亦可直接刺激SMC增殖(0.42±0.05 vs 0.21±0.04, P<0.01),Gyp可取消X-XO促SMC增殖作用,且这一作用可被NG-L-Arg阻断(表1)。
, 百拇医药
3 讨论
目前认为c-sis编码的主要产物为PDGF-BB[2],PDGF-BB为血小板聚集和SMC增殖的强烈诱导剂。正常情况下,内皮细胞c-sis基因表达较少,但在受到LPS、OFR、O-LDL刺激时,EC表达c-sis增加[4],合成释放PDGF增多。PDGF通过旁分泌机制既可促进EC增生修复,也可促进动脉中膜平滑肌细胞向内膜下迁移和增殖,因而在动脉粥样硬化的发生发展中起主要作用。本实验观察到LPS作用后内皮细胞c-sis基因表达明显增多,同时LPS作用后的内皮细胞培养液能明显刺激平滑肌细胞增殖,X-XO产生的OFR刺激SMC增殖的作用与LPS相似,说明LPS和X-XO可能通过诱导EC增加c-sis基因表达和PDGF-BB产生而刺激SMC增殖。
动脉粥样硬化是一种复杂的病理过程,包括内皮损伤、血栓形成、脂质沉积、单核细胞泡沫化和平滑肌细胞迁移增殖等,后者在动脉粥样硬化发生发展与转归中起重要作用。很多因素(如FGF,TGF,NO等)能抑制SMC增生,其中NO是血管壁内在调节SMC增生的重要因素。我室近年研究表明,Gyp具有抗膜脂质过氧化和保护血管内皮释放NO的作用[5,6],并能抑制兔食饵性主动脉粥样硬化斑块形成[8]。本实验进一步发现Gyp能抑制LPS诱导内皮细胞c-sis基因表达和间接抑制SMC增生,并保护内皮细胞NO的合成(释放),Gyp的作用可被NOS抑制剂NG-L-Arg减弱。说明Gyp一方面通过抑制内皮细胞c-sis基因表达,另一方面通过促进内皮细胞合成(释放)NO而间接抑制平滑肌细胞增殖。
, 百拇医药
(致谢:本院分子生物中心杨和平博士精心指导原位杂交技术。)
*国家自然科学基金资助课题,No 39200151;湖南省教委资助课题,No 1191206
作者简介:黄红林,女,35岁,副教授,研究方向:心血管药理学;
廖端芳,男,39岁,硕士,教授,研究方向:心血管药理学
参考文献
1 Ross R. The pathogenesis of atherosclerosis:a perspec tive for the 1990s.Nature,1993;362(29):801~8
2 杨和平,欧和生,刘革修 et al.内毒素对猪主动脉内皮细胞瑞斯托霉素辅助因子(vwf)分泌和c-sis mRNA表达的影响.基础医学与临床 ,1994;14(3):62~3
, http://www.100md.com
3 Suzuki H, Shabano K, Okane M et al. Int erferon-r modulates messenger RNA levels of c-sis(PDGF-B Chain),PDGF-A cha in,and IL-1B genes in human vascular endothelial cells. Am J Pathol , 1989;134(1):35~3
4 汤 健,周爱儒.原癌基因与心血管疾病.北京:北京医科大学.中国协和医科大学联合出版社, 1991:161~7
5 肖观莲,廖端芳,陈剑雄 et al.绞股蓝总皂苷对自由基损伤兔主动脉舒张功能的保护作用. 中国药理学通报, 19 94;10(2):136~8
6 邱立波,胡 弼,廖端芳. 绞股蓝总皂苷对豚鼠心肌自由基损伤的保护作用.中国药理学通报, 1993;9(4):287~90
, 百拇医药
7 廖端芳,尹卫东,陈剑雄et al.绞股蓝皂苷对实验性家兔血清一氧化氮及过氧化脂质的影响.中国动脉硬化杂志, 19 94;2(4):149~52
8 黄红林,尹卫东,廖端芳 et al.绞股蓝总皂苷对兔实验性动脉粥样硬化斑块形成的影响.中国动脉硬化杂志, 1998; 6(4):287~91
9 雷建华,胡 弼,唐朝克et al.绞股蓝总皂苷对内毒素休克继发DIC的预防作用. 衡阳医学院学报, 1994;22(2):131~3
10 Booyse FM, Sedlak BJ, Jr Rafelson ME. Culture of arterial endothelial cells:Characterizaation and grouth of bovine aortic cell.Thromb Diath Haemorrh,1975;34:825~39
, 百拇医药
11 陈 季.应用原位细胞杂交技术检测原癌基因在人胃癌细胞株及原发性胃癌中的表达.中华消化杂志, 1989;9(5):253~6
12 Termin A,Hoffmann M,Bing RJ.A simplified method for the determination of nitric oxide in biological solution.Life Sciences,1992;51:1621~9
13 Green LC, Wagner DA,Glogowski J et al.Analysis of ntrate, ntrite,and [15N] nitrate in biological fluids.A nal Biochem, 1982,126:131~8
1998-12-09收稿,1999-06-30修回, 百拇医药
单位:(衡阳医学院心肺药理学研究室,衡阳 421001)
关键词:绞股蓝总皂苷;内毒素;氧自由基;c-sis;一氧化氮;内皮细胞;平滑肌细胞
中国药理学通报990412
摘要 目的 研究绞股蓝总皂苷(Gyp)对血管平滑肌细胞增殖的调节与内皮细胞c-sis基因表达和一氧化氮(NO)合成/释放的关系。方法 采用原位杂交法检测内皮细胞 c-sis mRNA表达,用Griess法测定内皮细胞NO释放量,用MTT快速比色法检测平滑肌细胞(SMC)增殖。结果 内毒素(LPS)16mg.L-1促进牛主动脉内皮细胞 c-sis基因表达,明显降低内皮细胞培养液中一氧化氮含量,刺激SMC增殖;黄嘌呤-黄嘌呤氧化酶(X-XO)系统产生的氧自由基(OFR)具有与LPS相似的作用。绞股蓝总皂苷对LPS诱导的内皮细胞 c-sis基因表达具有明显抑制作用,并能对抗OFR诱导的EC损伤,保护内皮细胞释放NO的能力,抑制LPS和OFR通过EC介导的S MC增殖。Gyp的效应可被NO合成酶抑制剂硝基-左旋精氨酸部分取消。结论 绞股蓝总皂苷通过抑制内皮细胞c-sis基因表达,促进内皮细胞合成(释放)NO抑制平滑肌细胞增殖。
, 百拇医药
中国图书分类号 R 284.1; R 322.74; R 394.2; R543.5
文献标识码 A 文章编号 1001-1978(1999)04-0325 -04
Effects of gypenosides on c-sis expression of bovine aortic
endothelial cells and proliferation of vascular smooth muscle cells
induced by lipopolysaccharide and active oxygen species
HUANG Hong-Lin, CHEN Lin-Xi, ZHU Bin-Yang, YU Lin, LIAO Duan-Fang
, 百拇医药
(Division of Cardiopulmonary Pharmacology,Hengyang Medical College,Hengyang 421001)
ABSTRACT AIM To investigate the effects of gypenosides(Gyp) onc-sis expression of endothelial cells (EC) and proliferation of vascular smooth muscle cells (VSMC)induced by lipopolysaccharide (LPS) and oxygen free radical(OFR).METHODS Cultured bovine aortic endothelial cells were incubated with Gyp (10~20 mg.L-1)and LPS (16 mg.L-1) or xanthine(100μmol.L-1) plus xanthine oxidase (100U.L-1). C-sis expression was determined by in situ hybridigation. Nitrite, the matabolic product of NO, was measured according to a modified Griess method,and the proliferation of endothelial cells and VSMC was estimated by MTT assay. RESULTS We observed that LPS promotedc-sis gene expression, and inhibited NO release, and that X-XO inhibited EC proliferation and NO release. Both LPS and X-XO stimulated SMC proliferation by inducing growth factors release from EC.Gyp significantly de-creased c-sis gene expression,increased NO synthesis and proliferation of EC.Furthermore,Gyp indirectly inhibited SMC proliferation by blocking the effects of LPS and X-XO.The effeccts of Gyp wer abolished by NO synthase inhibitor NG-L-Arg.CONCLUSION Gyp inhibited X-XO and LPS induced proliferation of VSMC by attenuating c-sis gene expression and pro-moting NO sythesis/release of EC.
, http://www.100md.com
KEY WORDS gypenosides;lipopolysaccharide;oxygen free radical;c-sis gene;nitric oxide;endothe-lial cell;smooth muscle cell
动脉粥样硬化(Atherosclerosis,As)是一个复杂的病理过程,除了内皮损伤、脂质沉积、单核细胞泡沫化外,还表现出明显的血管平滑肌细胞(smooth muscle cells,SMC)增殖,后者在影响As的预后及经皮穿刺冠脉成形术后再狭窄方面起重要作用[1]。内皮细胞在受到细菌内毒素(lipopolysaccharide,LPS)、ox-LDL和氧自由基(oxygen free rad icals,OFR)[2,3]刺激时,可释放多种细胞因子和生长因子,内皮细胞c-sis基因编码的PDGF-BB就是其中最重要的一种,它可通过旁分泌刺激平滑肌细胞增殖,参与动脉粥样硬化形成[4]。
, 百拇医药
绞股蓝总皂苷(gypenosides,Gyp)为葫芦科植物绞股蓝的主要有效成分,我们前面的实验研究发现Gyp具有抗氧化损伤[5,6],并能有效对抗高脂所致血清NO、SOD、LPO、TC和T G的改变[7],能延缓食饵性兔动脉粥样硬化斑块的形成[8],还有明显的抗内毒素休克、预防继发性DIC等作用[9]。为进一步探讨Gyp抗动脉粥样硬化的作用机制,我们观察了Gyp对LPS诱导的牛主动脉内皮细胞表达c-sis基因的影响和Gyp对LPS 及X-XO诱导EC、SMC增殖的作用,并探讨这些作用与内皮细胞释放/合成NO的关系。
1 材料和方法
1.1 试剂 内毒素(lipopolysaccharide,LPS),黄嘌呤(xanthine ,X),黄嘌呤氧化酶(xanthine oxidase,XO),NG-硝基-L-精氨酸(NG-nitro-L-arginine,NG-L-Arg),M 119培养基,二甲基噻唑-二苯基溴化四唑[3(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT]均为Sigma公司产品;地高辛标记与检测试剂盒,华美公司产品;c-sis基因探针,北京医科大学汤健实验室赠;Gyp系湖南省医药工业研究所药理室赠送;其它试剂均为市售分析纯。
, 百拇医药
1.2 牛主动脉内皮细胞和平滑肌细胞培养 血管内皮细胞(endothelial cells,EC)参照Booyse等[10]描述的方法进行:胎牛经颈动脉放血致死,无菌取出整段胸主动脉,剥去外膜结缔组织,用D-Hanks液冲洗3~4次,纵向剪开血管,内膜朝下置于培养皿内,以2.5g.L-1胰蛋白酶消化(37℃,15min),加等量含20%(体积分数)牛血清的M 199培养液终止消化。用小勺轻刮内膜,收集液体离心(1 000×g,10min),弃上清液,加培养液制成细胞悬液,种植于培养瓶内,37℃,CO2培养箱培养,待5~6d融合后用2.5g.L-1胰蛋白酶消化进行传代培养。实验用长势良好的第4代融合的细胞。
SMC采用常规贴块法培养:取胎牛胸主动脉置Hanks液中,剥去外膜结缔组织,沿纵轴剪开血管壁,剥离内膜,反复清洗,将内膜剪成1mm×1mm组织块,种植于培养瓶,加入含20%(体积分数)胎牛血清的M 199培养液,37℃、CO2培养箱培养,实验用第4至第5代融合的细胞置96孔培养板用MTT法测细胞增殖。
, http://www.100md.com
1.3 内皮细胞c-sis基因检测的原位杂交方法 预先在6孔培养板内放置盖玻片,将EC接种于玻片上,待细胞融合后作如下分组:①正常对照组;②LPS处理组,加LPS 16mg.L-1;③~④ Gyp处理组:分别加入10mg.L-1、20mg.L-1 Gyp,再每孔加入 LPS 16mg.L-1;⑤NG-L-Arg抑制组:先加入20mg.L-1 Gyp,再加入NG-L-Arg 100μmol.L-1,最后加入 LPS 16mg.L-1。细胞继续培养24 h后分别收集培养液测NO和作为LPS刺激后的内皮细胞条件培养液(EC-CM)-20℃保存待作SMC增殖实验。按试剂盒操作说明书标记c-sis探针,并在EC培养玻片上进行cDNA-mRNA原位杂交,杂交时用预杂交液代替杂交液。杂交后进行免疫原检测→显色,终止反应。参照陈季[11]的方法,每张玻片随机数细胞20个,统计所有细胞浆中蓝色颗粒数。
, http://www.100md.com
1.4 内皮细胞培养液中NO测定 取内皮细胞种植于24孔板,再做如下处理:①正常处理组;②X-XO处理组:每孔含黄嘌呤(X)100μmol.L-1和黄嘌呤氧化酶(XO) 100U.L-1;③Gyp处理组:在加 X-XO前10min分别加入Gyp 10mg.L-1、20mg.L-1;④NG-L-Arg抑制组:在加 X-XO前,同时加入Gyp 20mg.L-1和NG-L-Arg(100μmol.L-1)。待 X-XO 作用30 min后,分别收集培养液测NO。
培养液NO微量测定参照文献[12,13]进行,取上清液40ml,加入0.943mol.L-1 NH4Cl 50ml,1.25mol.L-1 NaOH 10ml,室温放置10min,加 Griess 试剂100μl,60 ℃水浴、0℃冰浴各10 min,4 mol.L-1 HCl 50μl,用酶联免疫仪 540 nm 测吸光度(A值),同时以亚硝酸钠作标准曲线,结果以NO转变为亚硝酸盐的量(g.L-1)表示。
, http://www.100md.com
1.5 LPS和X-XO刺激EC增殖试验 将第5代融合的EC按2×108.L-1移植到两块96孔培养板中,培养24h后,再换以含0.5%(体积分数)牛血清M 199培养24 h,让细胞进入静止期后,按如下分组处理。
1.5.1 LPS刺激组(剂量同前述) ①正常对照组;②LPS刺激组;③ Gyp保护组;④NG-L-Arg对抗组。各组在加入LPS后继续培养72 h,弃去培养液,加入MTT(50mg.L-1)继续培养12h,再弃培养液,加入DMSO,振荡使兰紫色结晶充分溶解,用酶联免疫仪 570nm测得A值,以A值反映细胞的增殖情况。
1.5.2 X-XO刺激组(剂量分组同前述) ①正常对照组;②X-XO刺激组;③Gyp保护组;④NG-L-Arg对抗组。在X-XO作用30 min后,弃去培养液,换入正常培养液继续培养72h后弃去培养液,加入MTT,其余操作同上。
, http://www.100md.com
1.6 LPS和X-XO介导EC调节SMC增殖试验 取第5代融合的SMC移植到两块96孔培养板中,培养24 h,再换以含0.5%(体积分数)牛血清M199培养24 h,使细胞进入静止期后,其中一板换入LPS处理后的内皮细胞条件培养液(EC-CM),以正常的培养液作对照(CON),按MTT法测EC-CM对SMC增殖的影响。以A值表示细胞增殖情况。另一96孔板SMC用作探讨X-XO刺激后的EC条件培养液对SMC增殖的影响。
1.7 实验数据处理 实验结果以
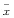 ±s表示,数据经方差齐性检验后行方差分析,两均数之间的比较用q检验。
±s表示,数据经方差齐性检验后行方差分析,两均数之间的比较用q检验。2 结果
2.1 Gyp对LPS诱导内皮细胞c-sis基因表达的影响 原位杂交检测显示:体外培养的牛主动脉内皮细胞有c -sis mRNA表达,c-sis mRNA转录的阳性信号为蓝紫色颗粒。内皮细胞经LPS处理24 h后,其c-sis基因表达明显增强,约为对照组的2.5倍(188.3±30.7 vs 74.5±11.6,P<0.01)。Gyp(10, 20mg.L-1)均能对抗LPS的作用(48.5±8.6 vs 188.3±30.7,29.3±6.8 vs 188.3±30.7,P<0.01)。此外,Gyp也抑制X-XO诱导内皮细胞c-sis表达(结果未显示)。Gyp的作用可被NG-L-Arg部分取消(54.5±10.8 vs 29.3±6.8,P<0.01,图1)。

, 百拇医药
Fig 1 Effects of Gyp on c-sis expression of
endothelial cells induced by LPS(
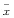 ±s,n=20)
±s,n=20)*P<0.05,**P<0.01, vs CON; ##P<0.01, vs LPS; △△P<0.01, vs Gyp 20+LPS
2.2 LPS、X-XO和Gyp对内皮细胞合成释放一氧化氮的影响 培养的牛主动脉内皮细胞分别与LPS和X-XO作用24h和30min后,其培养液中的NO代谢产物含物量降低,Gyp能有效地保护内皮细胞含成释放NO的能力。NG-L-Arg可部分减弱Gyp的作用(表1)
, http://www.100md.com
Table1 Effects of LPS、X-XO and Gyp on NO release of endothelial cells and on proliferation of smooth muscle cells(
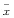 ±s,n=8) Groups
±s,n=8) GroupsEC Nitrite/g.L-1
SMC MTT assay/A
LPS
Control
1.73±0.25
0.47±0.03
, 百拇医药
LPS
0.97±0.09aa
0.52±0.04a
Gyp20+LPSD
1.35±0.24
0.48±0.03
Gyp20+LPS
1.57±0.28bb
0.45±0.02b
Gyp20+NG-L-Arg+LPS
, 百拇医药
1.20±0.05c
0.51±0.05c
X-XO
Control
1.81±0.14
0.21±0.04
X-XO
0.94±0.31
0.42±0.05**
Gyp10+X-XO
1.41±0.16##
, 百拇医药
0.26±0.02##
Gyp20+X-XO
1.53±0.22##
0.25±0.02##
Gyp20+NG-L-Arg+X-XO
1.31±0.14+
0.54±0.05++
NG-L-Arg
1.12±0.14**
, http://www.100md.com
aP<0.05,aaP<0.01, vs Control; bP<0.05, bbP<0.01, vs LPS; cP<0.05 vs Gyp 20+LPS;**P<0.01 vs Control;##P<0.01 vs X-XO;+P<0.05,++P<0.01, vs Gyp 20+X-XO.
2.3 Gyp对LPS和X-XO刺激内皮细胞增殖的影响 LPS(16mg.L-1)对内皮细胞增殖无明显影响(1.09+0.07 vs 1.12±0.05,P>0.05),而X-XO可明显抑制内皮细胞的增殖(0.29±0.11 vs 1.12±0.05,P<0.01),Gyp(20mg.L-1)可对抗X-XO的增殖抑制作用,且可轻度促进内皮细胞增殖(1.10±0.29 vs 0.29±0.11,P<0.01)。NG-L-Arg亦可阻断Gyp的作用(图2)。

, 百拇医药
Fig 2 Effects of Gyp on proliferation of endothelial
cells stimulated by X-XO(
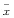 ±s,n=8)
±s,n=8)**P<0.01 vs CON; △P<0.05, △△P<0.01 v s X-XO; ##P<0.01 vs Gyp 20+X-XO
2.4 LPS和Gyp的内皮细胞条件培养液及X-XO直接刺激对平滑肌细胞增殖的影响 未经任何刺激处理的EC-CM本身无明显促平滑肌细胞增殖作用,Gyp本身对SMC增殖亦无影响。EC在受LPS刺激后产生的条件培养液可使SMC明显增殖( 0.52±0.04 vs 0.47±0.03, P<0.05),而用Gyp与LPS同时处理的内皮细胞条件培养液刺激SMC增殖的作用明显减弱。NG-L-Arg 可抑制Gyp间接调节平滑肌细胞增殖作用。X-XO亦可直接刺激SMC增殖(0.42±0.05 vs 0.21±0.04, P<0.01),Gyp可取消X-XO促SMC增殖作用,且这一作用可被NG-L-Arg阻断(表1)。
, 百拇医药
3 讨论
目前认为c-sis编码的主要产物为PDGF-BB[2],PDGF-BB为血小板聚集和SMC增殖的强烈诱导剂。正常情况下,内皮细胞c-sis基因表达较少,但在受到LPS、OFR、O-LDL刺激时,EC表达c-sis增加[4],合成释放PDGF增多。PDGF通过旁分泌机制既可促进EC增生修复,也可促进动脉中膜平滑肌细胞向内膜下迁移和增殖,因而在动脉粥样硬化的发生发展中起主要作用。本实验观察到LPS作用后内皮细胞c-sis基因表达明显增多,同时LPS作用后的内皮细胞培养液能明显刺激平滑肌细胞增殖,X-XO产生的OFR刺激SMC增殖的作用与LPS相似,说明LPS和X-XO可能通过诱导EC增加c-sis基因表达和PDGF-BB产生而刺激SMC增殖。
动脉粥样硬化是一种复杂的病理过程,包括内皮损伤、血栓形成、脂质沉积、单核细胞泡沫化和平滑肌细胞迁移增殖等,后者在动脉粥样硬化发生发展与转归中起重要作用。很多因素(如FGF,TGF,NO等)能抑制SMC增生,其中NO是血管壁内在调节SMC增生的重要因素。我室近年研究表明,Gyp具有抗膜脂质过氧化和保护血管内皮释放NO的作用[5,6],并能抑制兔食饵性主动脉粥样硬化斑块形成[8]。本实验进一步发现Gyp能抑制LPS诱导内皮细胞c-sis基因表达和间接抑制SMC增生,并保护内皮细胞NO的合成(释放),Gyp的作用可被NOS抑制剂NG-L-Arg减弱。说明Gyp一方面通过抑制内皮细胞c-sis基因表达,另一方面通过促进内皮细胞合成(释放)NO而间接抑制平滑肌细胞增殖。
, 百拇医药
(致谢:本院分子生物中心杨和平博士精心指导原位杂交技术。)
*国家自然科学基金资助课题,No 39200151;湖南省教委资助课题,No 1191206
作者简介:黄红林,女,35岁,副教授,研究方向:心血管药理学;
廖端芳,男,39岁,硕士,教授,研究方向:心血管药理学
参考文献
1 Ross R. The pathogenesis of atherosclerosis:a perspec tive for the 1990s.Nature,1993;362(29):801~8
2 杨和平,欧和生,刘革修 et al.内毒素对猪主动脉内皮细胞瑞斯托霉素辅助因子(vwf)分泌和c-sis mRNA表达的影响.基础医学与临床 ,1994;14(3):62~3
, http://www.100md.com
3 Suzuki H, Shabano K, Okane M et al. Int erferon-r modulates messenger RNA levels of c-sis(PDGF-B Chain),PDGF-A cha in,and IL-1B genes in human vascular endothelial cells. Am J Pathol , 1989;134(1):35~3
4 汤 健,周爱儒.原癌基因与心血管疾病.北京:北京医科大学.中国协和医科大学联合出版社, 1991:161~7
5 肖观莲,廖端芳,陈剑雄 et al.绞股蓝总皂苷对自由基损伤兔主动脉舒张功能的保护作用. 中国药理学通报, 19 94;10(2):136~8
6 邱立波,胡 弼,廖端芳. 绞股蓝总皂苷对豚鼠心肌自由基损伤的保护作用.中国药理学通报, 1993;9(4):287~90
, 百拇医药
7 廖端芳,尹卫东,陈剑雄et al.绞股蓝皂苷对实验性家兔血清一氧化氮及过氧化脂质的影响.中国动脉硬化杂志, 19 94;2(4):149~52
8 黄红林,尹卫东,廖端芳 et al.绞股蓝总皂苷对兔实验性动脉粥样硬化斑块形成的影响.中国动脉硬化杂志, 1998; 6(4):287~91
9 雷建华,胡 弼,唐朝克et al.绞股蓝总皂苷对内毒素休克继发DIC的预防作用. 衡阳医学院学报, 1994;22(2):131~3
10 Booyse FM, Sedlak BJ, Jr Rafelson ME. Culture of arterial endothelial cells:Characterizaation and grouth of bovine aortic cell.Thromb Diath Haemorrh,1975;34:825~39
, 百拇医药
11 陈 季.应用原位细胞杂交技术检测原癌基因在人胃癌细胞株及原发性胃癌中的表达.中华消化杂志, 1989;9(5):253~6
12 Termin A,Hoffmann M,Bing RJ.A simplified method for the determination of nitric oxide in biological solution.Life Sciences,1992;51:1621~9
13 Green LC, Wagner DA,Glogowski J et al.Analysis of ntrate, ntrite,and [15N] nitrate in biological fluids.A nal Biochem, 1982,126:131~8
1998-12-09收稿,1999-06-30修回, 百拇医药