酶法制备谷胱甘肽工艺的研究
作者:陶 锐 吴梧桐 许激扬
单位:中国药科大学生物化学教研室,南京210009
关键词:酶法;谷胱甘肽;直接高效液相法;优化
摘 要 以含有r
摘 要 以含有r-谷氨酰半胱氨酸合成酶(GSH-I)和谷胱甘肽合成酶(GSH-Ⅱ)的S.cerevisiae emulsefier.E 472c酵母菌株为酶源,以谷氨酸、半胱氨酸、甘氨酸为底物,酶法制备谷胱甘肽(GSH)工艺的研究。采用了直接高效液相色谱法检测酶促反应中GSH的含量,建立了酶促反应的最佳反应条件。在优化反应条件下,对底物半胱氨酸的转化率为80%,经过分离纯化回收率为83%,总产率为66.4%。结果表明,该法制备GSH成本低,工艺过程简单,能够适用于GSH的工业化生产。
Study on Enzymatic Synthesis of Glutathione
, 百拇医药
Tao Rui, Wu Wutong, Xu Jiyang
(Department of Biochemistry, China Pharmaceutical University, Nanjing 210009)
Abstract A simple and economical method of enzymatic synthesis of Glutathione was developed. Glutathione was produced by means of the biotransformation of L-Glutamic acid .L-Cysteine and Glycine in the presence of yeast cell of S.cerevisiae emuls efier E 472 c. The analytical method of determine GSH and GSSG with HPLC was founded and as eries reaction conditions were optimized. Under this condition, the transformation rate can approach 80% with a mole yield of 82%.
, 百拇医药
Key Words Enzymatic synthesis, Glutathione, Direct HP LC, Optimization
谷胱甘肽是由谷氨酸,半胱氨酸和甘氨酸形成的三肽化合物,分为还原型(GSH)和氧化型(GSSG),广泛存在于生物体内,是主要的抗氧化剂,对细胞具有多种生化作用。临床用于中毒性肝炎和感染性肝炎的治疗[1-2],抑制白内障以及角膜与视网膜疾病的改善[3],有机物及重金属的解毒,癌症辐射和化疗的保护[4-6],对肺纤维化、肝癌、卵巢癌、艾滋病也是有益的联合用药[7-9],亦广泛用于食品加工业,化妆品工业等。
谷胱甘肽的生产方法很多,如化学合成法,提取法,基因工程法,酶法[10]等。由于酶促反应具有催化专一性强,反应条件温和,转化效率高等优点,因此国际上多采用此法生产。其反应过程如下: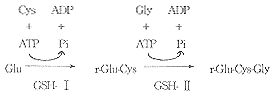
, 百拇医药
本实验室已通过菌种筛选得到一种含有r-谷氨酰半胱氨酸合成酶(GSH-I)和谷胱甘肽合成酶(GSH-Ⅱ)的S.cerevisiaeemulsefier.E472c菌株,故采用酵母细胞酶促反应制备GSH,着重建立了快速准确的高效液相含量检测法及确定了影响酶活各因素的最优化条件,为实现生物转化GSH的产业化提供了基础。
1 材 料
1.1 菌种 S.cerevisiae emulsefier.E 472c.酵母菌株(本实验室筛选)
1.2 仪器及实验材料 高效液相色谱仪HP1050;进样器HP1050自动进样器;1050四元梯度梯泵;检测器1040MDNA紫外检测器(惠普公司);低温高速离心机(Bec kman);标准谷胱甘肽(GSH以及GSSG)(SIGMA);甘氨酸,谷氨酸,半胱氨酸(上海康达氨基酸厂).其它试剂为国产分析纯。
, 百拇医药
2 方 法
2.1 菌种培养
将斜面活化的菌种接种至100mL含0.5%葡萄糖,0.5%NaCl,1.0%蛋白胨,0.5%酵母浸出汁,1.0%牛肉浸膏的培养液中,28℃,振荡过夜,离心收集成熟酵母细胞,称重待用。
2.2 酶转化反应
酶转化反应的反应液用0.1mol/L磷酸缓冲液(pH7.0)配制,含有0.03mol/L甘氨酸、0.03mol/L谷氨酸、0.03mol/L半胱氨酸、0.01mol/LMgCl2、0.5mol/L葡萄糖。反应液中按一定比例(100mg/mL)加入湿菌体,28℃剧烈振荡反应数小时,反应完毕后,破碎细胞,离心除菌体,收集上清液。
2.3 高效液相法测定GSH含量[11]
, http://www.100md.com
上清液稀释后吸入高效液相仪加样管中,其分析条件为:
电脑软件:HPCL30化学工作站(惠普公司)
色谱柱:ALLTIMAC18150×4.6mm+保护柱
流动相:缓冲液A:0.1%TFA,H2O;缓冲液B:0.1%TFA,CH3CN;缓冲液C:A∶B=95∶5(体积比)样品溶于A相中。
柱温:29.8℃ 柱压:100kg/cm
流速:0.8ml/min检测波长:214nm
洗脱后可由峰面积确定GSH以及GSSG含量。
2.4 底物浓度、葡萄糖浓度、pH等对转化反应的影响及其反应条件的最优化
, 百拇医药
在不同的底物浓度、葡萄糖浓度、pH等条件下测定GSH含量,并由之确定最佳酶促反应条件。
2.5 S.cerevisiaeemulisifierE.472c的酶转化反应
在已确定的反应条件下进行批式转化反应,底物组成同2.2。反应液中以100mg/mL的比例加入菌体,28℃剧烈振荡,每隔一定时间取样并测定其产率。
2.6 GSH的分离纯化
反应上清液调pH至3.0,抽滤得黄色澄清溶液,减压浓缩,上732阳离子交换柱,用0.5mol/LNH4OH洗脱,洗脱液调pH至4.5,上707阴离子交换柱,用0.5mol/LH2SO4洗脱,收集洗脱液,浓缩,乙醇沉淀,真空干燥,收集白色GSH晶体状粉末。
, 百拇医药
3 结 果
3.1 GSH含量测定
GSH的高效液相图谱见图1。GSH及GSSG的保留时间分别为4.6min和5.6min可由其峰面积进行定量,并计算出GSH的产率。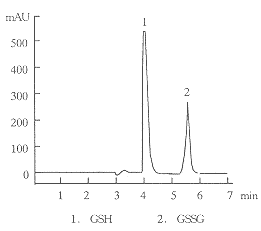
Fig1 The direct HPLC elution profile of GSH and GSSG
3.2 葡萄糖浓度与MgCl2浓度对酶促反应的影响
结果见图2。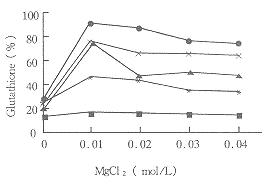
, 百拇医药
Fig 2 Effect of glucose and MgCl2 concentration on glutathione production.
Glucose concentrations were:0mol/L (■); 0.25mol/L (*): 0.5mol/L (◆);
0.75mol/L (×); 1.0mol/L (▲)
在GSH生成体系中,葡萄糖用于产生ATP。因此,酶转化反应中酶活受到葡萄糖浓度的影响。表明该菌在缺乏葡萄糖条件下,GSH产量极低,在葡萄糖浓度为0.5mol/L时,GSH产量达到最大值。
在MgCl2浓度为0.01mol/L时,GSH生成的产量达到最大值。
3.3 磷酸盐缓冲液浓度与pH值对酶促反应的影响
, http://www.100md.com
结果见图3。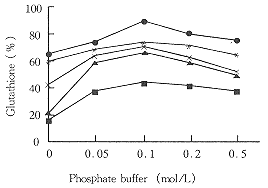
Fig3 Effect of phosphate concentration and pH on
glutathione pro ductio n. The pH of reaction were:
5.0(●);6.0(*);7.0(■);8.0(▲);9.0( ×)
磷酸盐缓冲液浓度为0.1mol/L时,GSH生成达到最大值。GSH生成适于在低浓度磷酸盐缓冲液,但是当缺乏磷酸盐缓冲液时,产量极少。
由图3可见,反应的最佳起始pH为7.0左右。反应过程中,反应液的pH值随葡萄糖消耗量的大小而降低,当0.5mol/L葡萄糖完全反应后,反应液的pH值为5.5~6.0.
, 百拇医药
3.4 氨基酸浓度对酶促反应的影响[12]
结果见表1和图4。
Tab1 Amino acid requirement for glutathione production
Amino acid
omitted W
Glutathione-producing yield
(mmol/g(ww.cells))
None
0.19
, 百拇医药 L-glutamate
0.14
L-cysteine
0
Glycine
0.12
L-glutamate and
Glycine
0.09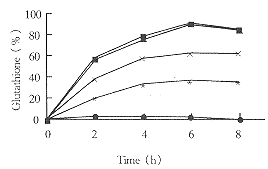
Fig 4 Effect of Cysteine concentration on
, 百拇医药
glutathione production. C yst eine concentrations used
were:0mol/L(●); 0.01mol/L(*);0.02mol/L(×); :0.03mo l/L(■);0.04mol/L(▲)
在缺乏L-Glu和Gly时,GSH产量下降,可能是酵母转化体系中,有L-Glu和Gly内源性物质生成,故仍有少量GSH生成。但在缺乏L-半胱氨酸时,无GSH生成。故采用不同的半胱氨酸浓度来测定底物氨基酸对GSH生成的影响。根据图4得三种氨基酸的最适底物浓度为0.03mol/L。
3.5最佳条件下的酶转化反应[13]
综合考虑以上诸多的因素,最终确定反应pH为7.0,葡萄糖浓度为0.5mol/L,底物氨基酸浓度为0.03mol/L,磷酸钾缓冲液浓度0.1mol/L,MgCl2浓度0.01mol/L为最佳反应条件。在以上确定的条件下进行反应,分别在10min,3h,6h,9h,12h,18h,24h取样并测定GSH含量.反应在进行到6h的时候达到平衡,对底物半胱氨酸,其转化率可达80%.转化曲线如图5所示。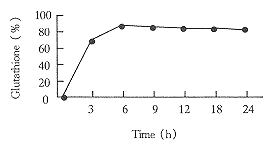
, 百拇医药
Fig5 The conversion reaction of glutathione production.
3.6 GSH的分离纯化
酵母抽提液50ml(0.1mol/L),经732阳离子交换柱,707阴离子交换柱,乙醇沉淀,真空干燥,得GSH白色结晶状粉末1.24g(82.7%)。mp185℃(分解),[α]D:-16.5(H2O),红外吸收光谱与标准品一致,直接高效液相色谱法检测GSH>90%。(见图6)
Fig 6 The Direct HPLC elution profile of GSH.(GSH≥98%)
, 百拇医药
4 讨 论
(1)本文运用直接高效液相法进行测定GSH含量,此方法能同时检测GSH及GSSG含量。快速,准确,简单,避免了传统纸层析法与紫外分光光度法中样品长时间处在光照、空气中引起氧化,而影响测定结果。
(2)γ-谷氨酰半胱氨酸合成酶(GSH-Ⅰ)是个调节酶,受终产物GSH的反馈抑制[10]。当GSH在细胞中累积达一定量时,GSH与酶分子中的调节部位结合使活性中心变构失活,从而抑制GSH继续合成。故采用酵母细胞固定化酶法制备GSH,使转化产物GSH能自行从胞内分泌至胞外,而减少产物对GSH-Ⅰ的反馈抑制,提高酶活。此讨论正在进行试验论证。
(3)我们通过对影响酶活各因素的研究,确定了各因素的最佳水平,进而又进行了酶转化的放大批量反应(20L发酵罐),结果显示在反应平衡后,转化率可达80%,经过分离纯化,回收率为83%,总产率为66.4%。结果表明,该酶具有很理想的催化活力,用此法制备GSH具有成本低、工艺过程简单,有生物转化合成GSH产业化的前景。
, http://www.100md.com
参考文献
1 彭星亮,蔡伊梅,蔡伟,等.谷胱甘肽辅助治疗重型病毒性肝炎和肝炎肝硬化.中国新药与临床杂志,1998,17(4):227
2 何念海,顾长海,马巧玉,等.还原型谷胱甘肽治疗病毒性肝炎的临床观察.临床内科杂志,1996,13(6):27
3 Sharma YR, VajpayeeRB, Bhatmagar R. Topical glutathione therapy in senile ca taracts, cataract-Ⅲ. Indian J Ophthalmol, 1989, 37(3): 12 1
4 胡俊斌,刘新月,陈燕,等.谷胱甘肽对化疗药物性肝损坏的防治作用.中国新药 与临床杂志,1998,17(4):231
5 马胜林,姜初明.谷胱甘肽治疗肿瘤病人肝、肾损害和药物性肝、肾损害.中国新 药与临床杂志,1998,17(4):233
, http://www.100md.com
6 杨秀明,勾琼,喻兰,等.谷胱甘肽与纳洛酮合用治疗笨二氮卓类药物中毒68例. 中国新药与临床杂志,1998,17(4):235
7 George J, Allan D, Richard C. Effect of glutathion e a erosol on oxidant-antioxidant imbalance in idiopathic pulmonary fibrosis. Lancet, 1991, 338: 215
8 Dalhoff K,Ranek L,Mantoni M. Glutathione treatment of hepatocellular carcino ma. Liver , 1992, 12(5): 343
9 Dmyth JF, Bowman A, Renen T. Glutathione reduces the toxicity and improves q uality of life of women diagnosed with ovarian cancer treated with cisplatin: re sult of a double-blind, randomized trial. Ann Oncol, 1997, 8(6):569
, http://www.100md.com
10 Kousaku Murata, Keiko Tani, Jyojikato. Glutathone production by imm obilized Saccharomyces cerevisiae cells containing an ATP regeneration system. Europe an J Appl Microbiol Biotechnol, 1981, 11:72
11 Raggi M A, Mandriol R, Bugamelli F. Comparison of analytical m ethods for qu ality control of pharmaceutical formulations containing glutathione. Chromat ographic ,1997,46(1):17
12 Catalina A,Keigo M, Hiroshi S. Cysteine additi on strategy for maximum glutathione production in fed-batch culture of Saccharomyces cerev isiae. Appl Microbiol Biotechnol, 1992, 37:141
13 Kuniaki S, Hisao T. Advanced control of glutathione fermentatio n process. Biotechnology and Bioengineering. 1992, 40:904
收稿日期:1999-03-15, 百拇医药
单位:中国药科大学生物化学教研室,南京210009
关键词:酶法;谷胱甘肽;直接高效液相法;优化
摘 要 以含有r
摘 要 以含有r-谷氨酰半胱氨酸合成酶(GSH-I)和谷胱甘肽合成酶(GSH-Ⅱ)的S.cerevisiae emulsefier.E 472c酵母菌株为酶源,以谷氨酸、半胱氨酸、甘氨酸为底物,酶法制备谷胱甘肽(GSH)工艺的研究。采用了直接高效液相色谱法检测酶促反应中GSH的含量,建立了酶促反应的最佳反应条件。在优化反应条件下,对底物半胱氨酸的转化率为80%,经过分离纯化回收率为83%,总产率为66.4%。结果表明,该法制备GSH成本低,工艺过程简单,能够适用于GSH的工业化生产。
Study on Enzymatic Synthesis of Glutathione
, 百拇医药
Tao Rui, Wu Wutong, Xu Jiyang
(Department of Biochemistry, China Pharmaceutical University, Nanjing 210009)
Abstract A simple and economical method of enzymatic synthesis of Glutathione was developed. Glutathione was produced by means of the biotransformation of L-Glutamic acid .L-Cysteine and Glycine in the presence of yeast cell of S.cerevisiae emuls efier E 472 c. The analytical method of determine GSH and GSSG with HPLC was founded and as eries reaction conditions were optimized. Under this condition, the transformation rate can approach 80% with a mole yield of 82%.
, 百拇医药
Key Words Enzymatic synthesis, Glutathione, Direct HP LC, Optimization
谷胱甘肽是由谷氨酸,半胱氨酸和甘氨酸形成的三肽化合物,分为还原型(GSH)和氧化型(GSSG),广泛存在于生物体内,是主要的抗氧化剂,对细胞具有多种生化作用。临床用于中毒性肝炎和感染性肝炎的治疗[1-2],抑制白内障以及角膜与视网膜疾病的改善[3],有机物及重金属的解毒,癌症辐射和化疗的保护[4-6],对肺纤维化、肝癌、卵巢癌、艾滋病也是有益的联合用药[7-9],亦广泛用于食品加工业,化妆品工业等。
谷胱甘肽的生产方法很多,如化学合成法,提取法,基因工程法,酶法[10]等。由于酶促反应具有催化专一性强,反应条件温和,转化效率高等优点,因此国际上多采用此法生产。其反应过程如下:
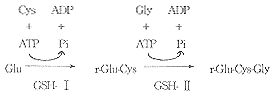
, 百拇医药
本实验室已通过菌种筛选得到一种含有r-谷氨酰半胱氨酸合成酶(GSH-I)和谷胱甘肽合成酶(GSH-Ⅱ)的S.cerevisiaeemulsefier.E472c菌株,故采用酵母细胞酶促反应制备GSH,着重建立了快速准确的高效液相含量检测法及确定了影响酶活各因素的最优化条件,为实现生物转化GSH的产业化提供了基础。
1 材 料
1.1 菌种 S.cerevisiae emulsefier.E 472c.酵母菌株(本实验室筛选)
1.2 仪器及实验材料 高效液相色谱仪HP1050;进样器HP1050自动进样器;1050四元梯度梯泵;检测器1040MDNA紫外检测器(惠普公司);低温高速离心机(Bec kman);标准谷胱甘肽(GSH以及GSSG)(SIGMA);甘氨酸,谷氨酸,半胱氨酸(上海康达氨基酸厂).其它试剂为国产分析纯。
, 百拇医药
2 方 法
2.1 菌种培养
将斜面活化的菌种接种至100mL含0.5%葡萄糖,0.5%NaCl,1.0%蛋白胨,0.5%酵母浸出汁,1.0%牛肉浸膏的培养液中,28℃,振荡过夜,离心收集成熟酵母细胞,称重待用。
2.2 酶转化反应
酶转化反应的反应液用0.1mol/L磷酸缓冲液(pH7.0)配制,含有0.03mol/L甘氨酸、0.03mol/L谷氨酸、0.03mol/L半胱氨酸、0.01mol/LMgCl2、0.5mol/L葡萄糖。反应液中按一定比例(100mg/mL)加入湿菌体,28℃剧烈振荡反应数小时,反应完毕后,破碎细胞,离心除菌体,收集上清液。
2.3 高效液相法测定GSH含量[11]
, http://www.100md.com
上清液稀释后吸入高效液相仪加样管中,其分析条件为:
电脑软件:HPCL30化学工作站(惠普公司)
色谱柱:ALLTIMAC18150×4.6mm+保护柱
流动相:缓冲液A:0.1%TFA,H2O;缓冲液B:0.1%TFA,CH3CN;缓冲液C:A∶B=95∶5(体积比)样品溶于A相中。
柱温:29.8℃ 柱压:100kg/cm
流速:0.8ml/min检测波长:214nm
洗脱后可由峰面积确定GSH以及GSSG含量。
2.4 底物浓度、葡萄糖浓度、pH等对转化反应的影响及其反应条件的最优化
, 百拇医药
在不同的底物浓度、葡萄糖浓度、pH等条件下测定GSH含量,并由之确定最佳酶促反应条件。
2.5 S.cerevisiaeemulisifierE.472c的酶转化反应
在已确定的反应条件下进行批式转化反应,底物组成同2.2。反应液中以100mg/mL的比例加入菌体,28℃剧烈振荡,每隔一定时间取样并测定其产率。
2.6 GSH的分离纯化
反应上清液调pH至3.0,抽滤得黄色澄清溶液,减压浓缩,上732阳离子交换柱,用0.5mol/LNH4OH洗脱,洗脱液调pH至4.5,上707阴离子交换柱,用0.5mol/LH2SO4洗脱,收集洗脱液,浓缩,乙醇沉淀,真空干燥,收集白色GSH晶体状粉末。
, 百拇医药
3 结 果
3.1 GSH含量测定
GSH的高效液相图谱见图1。GSH及GSSG的保留时间分别为4.6min和5.6min可由其峰面积进行定量,并计算出GSH的产率。

Fig1 The direct HPLC elution profile of GSH and GSSG
3.2 葡萄糖浓度与MgCl2浓度对酶促反应的影响
结果见图2。

, 百拇医药
Fig 2 Effect of glucose and MgCl2 concentration on glutathione production.
Glucose concentrations were:0mol/L (■); 0.25mol/L (*): 0.5mol/L (◆);
0.75mol/L (×); 1.0mol/L (▲)
在GSH生成体系中,葡萄糖用于产生ATP。因此,酶转化反应中酶活受到葡萄糖浓度的影响。表明该菌在缺乏葡萄糖条件下,GSH产量极低,在葡萄糖浓度为0.5mol/L时,GSH产量达到最大值。
在MgCl2浓度为0.01mol/L时,GSH生成的产量达到最大值。
3.3 磷酸盐缓冲液浓度与pH值对酶促反应的影响
, http://www.100md.com
结果见图3。

Fig3 Effect of phosphate concentration and pH on
glutathione pro ductio n. The pH of reaction were:
5.0(●);6.0(*);7.0(■);8.0(▲);9.0( ×)
磷酸盐缓冲液浓度为0.1mol/L时,GSH生成达到最大值。GSH生成适于在低浓度磷酸盐缓冲液,但是当缺乏磷酸盐缓冲液时,产量极少。
由图3可见,反应的最佳起始pH为7.0左右。反应过程中,反应液的pH值随葡萄糖消耗量的大小而降低,当0.5mol/L葡萄糖完全反应后,反应液的pH值为5.5~6.0.
, 百拇医药
3.4 氨基酸浓度对酶促反应的影响[12]
结果见表1和图4。
Tab1 Amino acid requirement for glutathione production
Amino acid
omitted W
Glutathione-producing yield
(mmol/g(ww.cells))
None
0.19
, 百拇医药 L-glutamate
0.14
L-cysteine
0
Glycine
0.12
L-glutamate and
Glycine
0.09

Fig 4 Effect of Cysteine concentration on
, 百拇医药
glutathione production. C yst eine concentrations used
were:0mol/L(●); 0.01mol/L(*);0.02mol/L(×); :0.03mo l/L(■);0.04mol/L(▲)
在缺乏L-Glu和Gly时,GSH产量下降,可能是酵母转化体系中,有L-Glu和Gly内源性物质生成,故仍有少量GSH生成。但在缺乏L-半胱氨酸时,无GSH生成。故采用不同的半胱氨酸浓度来测定底物氨基酸对GSH生成的影响。根据图4得三种氨基酸的最适底物浓度为0.03mol/L。
3.5最佳条件下的酶转化反应[13]
综合考虑以上诸多的因素,最终确定反应pH为7.0,葡萄糖浓度为0.5mol/L,底物氨基酸浓度为0.03mol/L,磷酸钾缓冲液浓度0.1mol/L,MgCl2浓度0.01mol/L为最佳反应条件。在以上确定的条件下进行反应,分别在10min,3h,6h,9h,12h,18h,24h取样并测定GSH含量.反应在进行到6h的时候达到平衡,对底物半胱氨酸,其转化率可达80%.转化曲线如图5所示。

, 百拇医药
Fig5 The conversion reaction of glutathione production.
3.6 GSH的分离纯化
酵母抽提液50ml(0.1mol/L),经732阳离子交换柱,707阴离子交换柱,乙醇沉淀,真空干燥,得GSH白色结晶状粉末1.24g(82.7%)。mp185℃(分解),[α]D:-16.5(H2O),红外吸收光谱与标准品一致,直接高效液相色谱法检测GSH>90%。(见图6)

Fig 6 The Direct HPLC elution profile of GSH.(GSH≥98%)
, 百拇医药
4 讨 论
(1)本文运用直接高效液相法进行测定GSH含量,此方法能同时检测GSH及GSSG含量。快速,准确,简单,避免了传统纸层析法与紫外分光光度法中样品长时间处在光照、空气中引起氧化,而影响测定结果。
(2)γ-谷氨酰半胱氨酸合成酶(GSH-Ⅰ)是个调节酶,受终产物GSH的反馈抑制[10]。当GSH在细胞中累积达一定量时,GSH与酶分子中的调节部位结合使活性中心变构失活,从而抑制GSH继续合成。故采用酵母细胞固定化酶法制备GSH,使转化产物GSH能自行从胞内分泌至胞外,而减少产物对GSH-Ⅰ的反馈抑制,提高酶活。此讨论正在进行试验论证。
(3)我们通过对影响酶活各因素的研究,确定了各因素的最佳水平,进而又进行了酶转化的放大批量反应(20L发酵罐),结果显示在反应平衡后,转化率可达80%,经过分离纯化,回收率为83%,总产率为66.4%。结果表明,该酶具有很理想的催化活力,用此法制备GSH具有成本低、工艺过程简单,有生物转化合成GSH产业化的前景。
, http://www.100md.com
参考文献
1 彭星亮,蔡伊梅,蔡伟,等.谷胱甘肽辅助治疗重型病毒性肝炎和肝炎肝硬化.中国新药与临床杂志,1998,17(4):227
2 何念海,顾长海,马巧玉,等.还原型谷胱甘肽治疗病毒性肝炎的临床观察.临床内科杂志,1996,13(6):27
3 Sharma YR, VajpayeeRB, Bhatmagar R. Topical glutathione therapy in senile ca taracts, cataract-Ⅲ. Indian J Ophthalmol, 1989, 37(3): 12 1
4 胡俊斌,刘新月,陈燕,等.谷胱甘肽对化疗药物性肝损坏的防治作用.中国新药 与临床杂志,1998,17(4):231
5 马胜林,姜初明.谷胱甘肽治疗肿瘤病人肝、肾损害和药物性肝、肾损害.中国新 药与临床杂志,1998,17(4):233
, http://www.100md.com
6 杨秀明,勾琼,喻兰,等.谷胱甘肽与纳洛酮合用治疗笨二氮卓类药物中毒68例. 中国新药与临床杂志,1998,17(4):235
7 George J, Allan D, Richard C. Effect of glutathion e a erosol on oxidant-antioxidant imbalance in idiopathic pulmonary fibrosis. Lancet, 1991, 338: 215
8 Dalhoff K,Ranek L,Mantoni M. Glutathione treatment of hepatocellular carcino ma. Liver , 1992, 12(5): 343
9 Dmyth JF, Bowman A, Renen T. Glutathione reduces the toxicity and improves q uality of life of women diagnosed with ovarian cancer treated with cisplatin: re sult of a double-blind, randomized trial. Ann Oncol, 1997, 8(6):569
, http://www.100md.com
10 Kousaku Murata, Keiko Tani, Jyojikato. Glutathone production by imm obilized Saccharomyces cerevisiae cells containing an ATP regeneration system. Europe an J Appl Microbiol Biotechnol, 1981, 11:72
11 Raggi M A, Mandriol R, Bugamelli F. Comparison of analytical m ethods for qu ality control of pharmaceutical formulations containing glutathione. Chromat ographic ,1997,46(1):17
12 Catalina A,Keigo M, Hiroshi S. Cysteine additi on strategy for maximum glutathione production in fed-batch culture of Saccharomyces cerev isiae. Appl Microbiol Biotechnol, 1992, 37:141
13 Kuniaki S, Hisao T. Advanced control of glutathione fermentatio n process. Biotechnology and Bioengineering. 1992, 40:904
收稿日期:1999-03-15, 百拇医药