Cecropin B抗菌肽基因的定向诱变与表达
作者:胡云龙 胡泰山 林世康 苏剑 施国民 李伟 赵学忠 屈贤铭
单位:胡云龙 林世康 苏 剑 施国民 赵学忠(南京军区军事医学研究所,南京210002);胡泰山 李伟 屈贤铭(中国科学院上海生物工程研究中心,上海200023)
关键词:抗菌肽;定向诱变;基因表达;杀伤作用
摘 要 采用寡核苷酸介导的定向点突变法
摘 要 采用寡核苷酸介导的定向点突变法,对天蚕抗菌肽Cecropin B基因13位甲硫氨酸(Met)诱变为亮氨酸(Leu)或缬氨酸(Val),保留1位上的Met,诱变后的Cecropin B DNA序列分析证明产生了预期的点突变。将Cecropin B突变体基因与pGEX-4T-2融合表达载体中的谷胱甘肽转移酶(GST)基因融合,在E.coli中表达,当IPTG诱导30min后,工程菌的数量开始减少,然后逐渐恢复正常。说明Cecropin B突变体与GST基因融合表达后仍然具有很强杀伤原核细胞的作用。
, 百拇医药
The Site-directed Mutagenesis and
Expressing of Cecropin B Gene
Hu Yunlong Hu Taishan1 Lin Shikang Su Jian Shi Guomin Li Wei1 Zhao Xuezhong Qu Xianming1
(Institute of Millitary Medicine Nanjing Command, Nanjing 2100021;1Sha nghai Research certre of biotechnology Sillica, Shanghai 2002332)
Abstract Using the method of oligonucleotide-mediated si te directed mutagen esis, We have mutated the Met13 of Cecropin B gene for Leu13 or Val13. The DNA sequencing analysis of CecropinB mutant displayed a expecting site-directed Mutag e nesis.The fusion expression vetor pGEX-4T-2 contains GST gene, which encodes Gl utathione S-Transferese fused to modified Cecropin B gene and expressed in E. coli TG1.After 30min of IPTG induction, a large number of engineering bacteria were dead. The results demonstrated the fusion protein of GST-CecropinB mutant have still killed the protocaryon cell.
, http://www.100md.com
Key Words Cecropin B, Site-directed mutagenesis, Gene expressing,Kill
高等生物都有一套防御机制来保护它们免受细菌的侵害。昆虫也一样,当体内被注入活的非病原菌或受到其他外部刺激时,许多昆虫会产生一些有很强活力的无细胞免疫物质。Hultmark等人通过对滞育的美国天蚕Hyalophora Cecropia幼虫注入活的E.coli以诱导,从其血淋巴中分离出两种低分子量和碱性极强的具有很强抗菌活性的蛋白质分子[1]。Steiner等人发表了它们的一级结构并给这类肽正式命名为Cecropin B[2]。长度一般在33-39个氨基酸残基,相对分子质量约为4000u,它不仅对一些革兰氏阳性菌及阴性菌有很高的抗菌活力,而且对真菌[3]、原虫[4]、某些病毒[5]和一些肿瘤细胞[6]也有明显的杀伤作用。值得一提的是抗菌肽对真核细胞几乎没有破坏作用,这可能与细胞膜和骨架上的组成有关[7,8]。本文通过定向诱变抗菌肽基因并与GST基因融合表达,为采用CNBr切割融合蛋白的Met位点及大量制备抗菌肽打下基础。
, http://www.100md.com
1 材 料
Cecropin B基因:根据美国天蚕Hyalophora Cecropia蛹的抗菌肽基因序列人工合成;菌株E.coli DH5aF'和TG1为本实验室保存;CJ236、M13BM20、M13BM21和U-DNA Mutagenesis Kit购自B.M公司;T4DNA Ligase、T4 DNA polymerase和IPTG购自Promega公司;Sequence Version 2.0购自USB公司;突变引物由中科院上海细胞生物学研究所合成;pGEX-4T-2融合表达载体购自Phamarcia公司。
2 方 法
2.1 定向诱变方法
, 百拇医药
按B.M公司U-DNA Mutagenesis Kit说明书进行操作。
2.2 DNA测序方法
按USB公司Sequence Version 2.0Kit说明书进行操作。
2.3 抗菌肽活性测定方法
将灭菌处理的LEG培养基7.5ml,在50℃左右与50μL对数生长期E.coli K12 D31(A600nm=0.5)悬浮液混匀铺平板,冷却凝固后等距打孔,滴入待测样品5μL,37℃培养10h,测量抑菌圈的直径,以表示抗菌肽抗菌活力的大小。
2.4 重组表达质粒pGEXCL和pGEXCV的构建
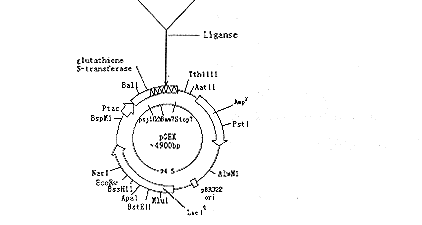
将Cecropin B Leu13/Cecropin B Val13基因与用EcoR1和BamH1酶切的pGEX-4T-2表达载体连接,并与其中的谷胱甘肽转移酶基因融合,构建成重组表达质粒并命名为pGEXCL和pGEXCV(见图1)。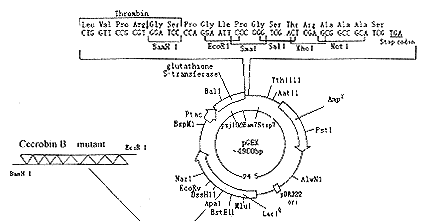
, http://www.100md.com
Fig 1 Construction of recombinant plasmid of pGEXCL and pGEXCV
3 结 果
3.1 诱变引物的设计
根据Leu和Val在大肠杆菌中的偏爱密码子,设计Cecropin B基因中Met13密码子ATG诱变为CTG(Leu)或GTG(Val),两者只相差一个碱基,因此,只需人工合成一个21mer的寡聚核苷酸(5'TTACGACCCAG/CCTTCTCGATT3'),就能同时定点诱变Met13的密码子ATG为CTG或GTG(见图2)。
, 百拇医药
Fig 2 Nucleotide sequence of Cecropin B gene
3.2 定向突变株的筛选和鉴定
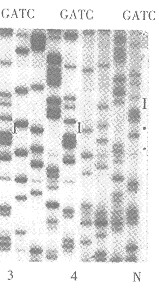
含尿嘧啶DNA单链模板与已经磷酸化的诱变寡核苷酸进行退火后,加入T4DNA Ligase和T4 DNA polymerase,以尿嘧啶单链为模板,从突变引物的3'端起合成了双链M13的负链,合成的负链中不含尿嘧啶碱基。经琼脂糖电泳可以看出已合成了双链M13BM21-Cecropin B DNA。双链DNA转化大肠杆菌TG1,挑取4个噬菌斑在TG1中扩增培养,提取单链M13BM21-Cecropin B DNA作序列分列,结果显示1、3、4号噬菌斑DNA样品中Cecropin B基因第13位Met的ATG诱变为CTG,2号样品的ATG诱变为GTG,DNA序列分析证明产生了预期的点突变(见图3)。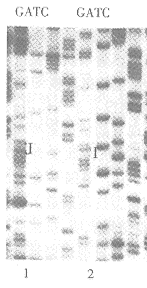
, 百拇医药
N:Cecropin B wild type 2: Cecropin B leu 1.3.4: Cecropin B Val
Fig 3 Sequencing analysis of the Cecropin B mutant gene
3.3 重组表达质粒的鉴定
提取突变克隆的RF DNA,经BamHI和EcoRI酶切,经0.7%琼脂糖凝胶电泳分离回收Cecropin B Leu13或Cecropin B Val13DNA,连接到pGEX-4T-2表达载体的BamHI和EcoRI位点上,转化大肠杆菌TG1中扩增,提取质粒DNA经酶切后得到一个约132bp大小的片段,证实pGEX-4T-2/Cecropin B mutant表达质粒的构建(见图4)。

, 百拇医药
1.2.3:Cecropin B Leu13 4.5:Cecropin B Val13
Fig 4 Restruction analysis of recombinant plasmid pGEX-4T-2/Cecropin B mutant
3.4 Cecropin B突变体在E.coli中表达及抗菌活性
分别取pGEXCL/pGEXCV和pGEX-4T-2 DNA转化的大肠杆菌TG1和未转化的TG1接种LB培养基,37℃振摇培养80min后,加IPTG诱导。结果发现诱导30min后,工程菌生长数量明显减少,培养基变清。提示表达产物对工程菌有较强的杀伤效应,当诱导240min时,随着IPTG的消耗,培养基中的工程菌的数量又开始增加,逐渐恢复至正常水平。而用pGEX-4T-2表达载体转化的宿主菌不受IPTG诱导表达的影响,与未转化的大肠杆菌TG1生长曲线基本一致(见图5)。取表达质粒转化的大肠杆菌培养上清和对照的培养上清,用平板法测定其抗菌活性,结果对照的培养上清无抗菌活性,而转化的培养上清抗菌活性的抑菌圈为8.5cm。因此,认为CecropinB突变体与GST基因融合后,在大肠杆菌中的表达产物仍然具有很强杀伤原核细胞的作用。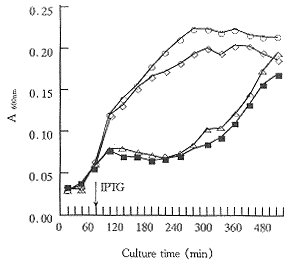
, http://www.100md.com
Fig 5 The growth curve of engineering bacteria
of CecropinB mutant after IPTG induction
4 讨 论
寡核苷酸引导的定向诱变不仅广泛研究DNA和其编码的蛋白质的结构和功能,也是DNA重组技术中不可缺少的重要手段。本文采用Kunkel方法,实验中所用的CJ236菌株为dUTP水解酶和尿嘧啶N-糖基化酶缺陷株型,在菌体产生的M13单链中,尿嘧啶(U)替代了胸腺嘧啶(T),以含U的单链为模板,由合成的寡核苷酸引物引导生成的新链为不含U的正常链,在转化到E.coli TG1菌株中时,后者产生的dUTP水解酶和尿嘧啶N-糖基化酶,破坏了含U的单链,因此突变效率高。
根据抗菌肽作用模型,其杀菌作用是通过N端11个氨基酸形成一种强正电荷的两性螺旋,插入细胞膜,破坏膜的有序结构和稳定性,导致细胞膜最终破裂,N端的1-11个氨基酸去除后,整个抗菌肽的活性也就丧失[11-13]。在实验中将CecropinB基因和GST基因融合后表达,为了避免杀伤E.Coli细胞,实验结果表明表达的融合蛋白仍然具有很强杀伤原核细胞的作用。为了获取大量表达的抗菌肽,我们下一步考虑在真核细胞表达,因为抗菌肽对真核细胞没有杀伤作用。
, http://www.100md.com
当今细菌菌株已对现有的抗生素类药物产生抗药性之际,人们赞誉抗菌肽象青霉素那样,具有巨大的应用潜力。美国马盖宁制药公司已经开发出两种新型抗菌肽进入临床Ⅲ期试验,另外临床实验结果表明:抗菌肽对皮肤黑色素瘤有治疗效果。目前主要是进行新型抗菌肽的设计和筛选及抗菌肽转基因动物和抗菌肽基因导入植物中的研究,试图培育出新的抗病品种,目前已经取得重大进展。因此,对昆虫抗菌肽的研究不仅对昆虫的防御体系和机制有了新的认识,而且在医学和农业上有广阔的应用前景。
国家863高技术基金项目(101-01-02-03)
参考文献
1 Hultmark D, Steiner H, Rasmuson T, et al. Insect immunity: Purificati on and properties of three inducible bactercidal proteins from Hemolymph of immunized pupae of hyalophora cectopia. Eur J Biochem,1980,106:7
, 百拇医药
2 Steiner H, Hultmark D, Engstrom A, et al. Sepuence and specificity of two antibacterial proteins involved in insect immunity. Nature,1981,292:246
3 Ganz T, rayner J R, Valore E V, et al. The structure of the rabbit macroph age defensin genes and their organ-specific expression. J Imunal, 1989,143:1358
4 Jaynes J M, Burton C A,Barr S B,et al. In vitro cytocidal effect of novel lytic peptides on pladmodium falciparum and trypanosoma cruzi. FASEB J,1989,2:2878
, 百拇医药
5 Daher K A, Selsted E M, Lehrer R I,et al. Direct inactiviation of viruses by human granulocyte defensins. J Virol, 1986,60:1068
6 Jaynes J M.Lytic peptides: A magic bullet? Biotechnology News,1990,10:8
7 Boman H G, Hultmark D. Cell-free immunity in insects.Annu Rev, 1987,41:103
8 屈贤铭, 唐海伦,Steiner H,等. 柞蚕抗菌肽B、D对脂质体的作用. 生物化学 与生物物理学报, 1989,21(1):35
9 Fink J, Boman A, Boman H G,et al. Design, synthesis and antibaterial activity of cecropin-lide model peptides.Int J Peptide Protein Res,1989,33:807
收稿日期:1999-03-22, 百拇医药
单位:胡云龙 林世康 苏 剑 施国民 赵学忠(南京军区军事医学研究所,南京210002);胡泰山 李伟 屈贤铭(中国科学院上海生物工程研究中心,上海200023)
关键词:抗菌肽;定向诱变;基因表达;杀伤作用
摘 要 采用寡核苷酸介导的定向点突变法
摘 要 采用寡核苷酸介导的定向点突变法,对天蚕抗菌肽Cecropin B基因13位甲硫氨酸(Met)诱变为亮氨酸(Leu)或缬氨酸(Val),保留1位上的Met,诱变后的Cecropin B DNA序列分析证明产生了预期的点突变。将Cecropin B突变体基因与pGEX-4T-2融合表达载体中的谷胱甘肽转移酶(GST)基因融合,在E.coli中表达,当IPTG诱导30min后,工程菌的数量开始减少,然后逐渐恢复正常。说明Cecropin B突变体与GST基因融合表达后仍然具有很强杀伤原核细胞的作用。
, 百拇医药
The Site-directed Mutagenesis and
Expressing of Cecropin B Gene
Hu Yunlong Hu Taishan1 Lin Shikang Su Jian Shi Guomin Li Wei1 Zhao Xuezhong Qu Xianming1
(Institute of Millitary Medicine Nanjing Command, Nanjing 2100021;1Sha nghai Research certre of biotechnology Sillica, Shanghai 2002332)
Abstract Using the method of oligonucleotide-mediated si te directed mutagen esis, We have mutated the Met13 of Cecropin B gene for Leu13 or Val13. The DNA sequencing analysis of CecropinB mutant displayed a expecting site-directed Mutag e nesis.The fusion expression vetor pGEX-4T-2 contains GST gene, which encodes Gl utathione S-Transferese fused to modified Cecropin B gene and expressed in E. coli TG1.After 30min of IPTG induction, a large number of engineering bacteria were dead. The results demonstrated the fusion protein of GST-CecropinB mutant have still killed the protocaryon cell.
, http://www.100md.com
Key Words Cecropin B, Site-directed mutagenesis, Gene expressing,Kill
高等生物都有一套防御机制来保护它们免受细菌的侵害。昆虫也一样,当体内被注入活的非病原菌或受到其他外部刺激时,许多昆虫会产生一些有很强活力的无细胞免疫物质。Hultmark等人通过对滞育的美国天蚕Hyalophora Cecropia幼虫注入活的E.coli以诱导,从其血淋巴中分离出两种低分子量和碱性极强的具有很强抗菌活性的蛋白质分子[1]。Steiner等人发表了它们的一级结构并给这类肽正式命名为Cecropin B[2]。长度一般在33-39个氨基酸残基,相对分子质量约为4000u,它不仅对一些革兰氏阳性菌及阴性菌有很高的抗菌活力,而且对真菌[3]、原虫[4]、某些病毒[5]和一些肿瘤细胞[6]也有明显的杀伤作用。值得一提的是抗菌肽对真核细胞几乎没有破坏作用,这可能与细胞膜和骨架上的组成有关[7,8]。本文通过定向诱变抗菌肽基因并与GST基因融合表达,为采用CNBr切割融合蛋白的Met位点及大量制备抗菌肽打下基础。
, http://www.100md.com
1 材 料
Cecropin B基因:根据美国天蚕Hyalophora Cecropia蛹的抗菌肽基因序列人工合成;菌株E.coli DH5aF'和TG1为本实验室保存;CJ236、M13BM20、M13BM21和U-DNA Mutagenesis Kit购自B.M公司;T4DNA Ligase、T4 DNA polymerase和IPTG购自Promega公司;Sequence Version 2.0购自USB公司;突变引物由中科院上海细胞生物学研究所合成;pGEX-4T-2融合表达载体购自Phamarcia公司。
2 方 法
2.1 定向诱变方法
, 百拇医药
按B.M公司U-DNA Mutagenesis Kit说明书进行操作。
2.2 DNA测序方法
按USB公司Sequence Version 2.0Kit说明书进行操作。
2.3 抗菌肽活性测定方法
将灭菌处理的LEG培养基7.5ml,在50℃左右与50μL对数生长期E.coli K12 D31(A600nm=0.5)悬浮液混匀铺平板,冷却凝固后等距打孔,滴入待测样品5μL,37℃培养10h,测量抑菌圈的直径,以表示抗菌肽抗菌活力的大小。
2.4 重组表达质粒pGEXCL和pGEXCV的构建
将Cecropin B Leu13/Cecropin B Val13基因与用EcoR1和BamH1酶切的pGEX-4T-2表达载体连接,并与其中的谷胱甘肽转移酶基因融合,构建成重组表达质粒并命名为pGEXCL和pGEXCV(见图1)。


, http://www.100md.com
Fig 1 Construction of recombinant plasmid of pGEXCL and pGEXCV
3 结 果
3.1 诱变引物的设计
根据Leu和Val在大肠杆菌中的偏爱密码子,设计Cecropin B基因中Met13密码子ATG诱变为CTG(Leu)或GTG(Val),两者只相差一个碱基,因此,只需人工合成一个21mer的寡聚核苷酸(5'TTACGACCCAG/CCTTCTCGATT3'),就能同时定点诱变Met13的密码子ATG为CTG或GTG(见图2)。

, 百拇医药
Fig 2 Nucleotide sequence of Cecropin B gene
3.2 定向突变株的筛选和鉴定
含尿嘧啶DNA单链模板与已经磷酸化的诱变寡核苷酸进行退火后,加入T4DNA Ligase和T4 DNA polymerase,以尿嘧啶单链为模板,从突变引物的3'端起合成了双链M13的负链,合成的负链中不含尿嘧啶碱基。经琼脂糖电泳可以看出已合成了双链M13BM21-Cecropin B DNA。双链DNA转化大肠杆菌TG1,挑取4个噬菌斑在TG1中扩增培养,提取单链M13BM21-Cecropin B DNA作序列分列,结果显示1、3、4号噬菌斑DNA样品中Cecropin B基因第13位Met的ATG诱变为CTG,2号样品的ATG诱变为GTG,DNA序列分析证明产生了预期的点突变(见图3)。


, 百拇医药
N:Cecropin B wild type 2: Cecropin B leu 1.3.4: Cecropin B Val
Fig 3 Sequencing analysis of the Cecropin B mutant gene
3.3 重组表达质粒的鉴定
提取突变克隆的RF DNA,经BamHI和EcoRI酶切,经0.7%琼脂糖凝胶电泳分离回收Cecropin B Leu13或Cecropin B Val13DNA,连接到pGEX-4T-2表达载体的BamHI和EcoRI位点上,转化大肠杆菌TG1中扩增,提取质粒DNA经酶切后得到一个约132bp大小的片段,证实pGEX-4T-2/Cecropin B mutant表达质粒的构建(见图4)。


, 百拇医药
1.2.3:Cecropin B Leu13 4.5:Cecropin B Val13
Fig 4 Restruction analysis of recombinant plasmid pGEX-4T-2/Cecropin B mutant
3.4 Cecropin B突变体在E.coli中表达及抗菌活性
分别取pGEXCL/pGEXCV和pGEX-4T-2 DNA转化的大肠杆菌TG1和未转化的TG1接种LB培养基,37℃振摇培养80min后,加IPTG诱导。结果发现诱导30min后,工程菌生长数量明显减少,培养基变清。提示表达产物对工程菌有较强的杀伤效应,当诱导240min时,随着IPTG的消耗,培养基中的工程菌的数量又开始增加,逐渐恢复至正常水平。而用pGEX-4T-2表达载体转化的宿主菌不受IPTG诱导表达的影响,与未转化的大肠杆菌TG1生长曲线基本一致(见图5)。取表达质粒转化的大肠杆菌培养上清和对照的培养上清,用平板法测定其抗菌活性,结果对照的培养上清无抗菌活性,而转化的培养上清抗菌活性的抑菌圈为8.5cm。因此,认为CecropinB突变体与GST基因融合后,在大肠杆菌中的表达产物仍然具有很强杀伤原核细胞的作用。

, http://www.100md.com
Fig 5 The growth curve of engineering bacteria
of CecropinB mutant after IPTG induction
4 讨 论
寡核苷酸引导的定向诱变不仅广泛研究DNA和其编码的蛋白质的结构和功能,也是DNA重组技术中不可缺少的重要手段。本文采用Kunkel方法,实验中所用的CJ236菌株为dUTP水解酶和尿嘧啶N-糖基化酶缺陷株型,在菌体产生的M13单链中,尿嘧啶(U)替代了胸腺嘧啶(T),以含U的单链为模板,由合成的寡核苷酸引物引导生成的新链为不含U的正常链,在转化到E.coli TG1菌株中时,后者产生的dUTP水解酶和尿嘧啶N-糖基化酶,破坏了含U的单链,因此突变效率高。
根据抗菌肽作用模型,其杀菌作用是通过N端11个氨基酸形成一种强正电荷的两性螺旋,插入细胞膜,破坏膜的有序结构和稳定性,导致细胞膜最终破裂,N端的1-11个氨基酸去除后,整个抗菌肽的活性也就丧失[11-13]。在实验中将CecropinB基因和GST基因融合后表达,为了避免杀伤E.Coli细胞,实验结果表明表达的融合蛋白仍然具有很强杀伤原核细胞的作用。为了获取大量表达的抗菌肽,我们下一步考虑在真核细胞表达,因为抗菌肽对真核细胞没有杀伤作用。
, http://www.100md.com
当今细菌菌株已对现有的抗生素类药物产生抗药性之际,人们赞誉抗菌肽象青霉素那样,具有巨大的应用潜力。美国马盖宁制药公司已经开发出两种新型抗菌肽进入临床Ⅲ期试验,另外临床实验结果表明:抗菌肽对皮肤黑色素瘤有治疗效果。目前主要是进行新型抗菌肽的设计和筛选及抗菌肽转基因动物和抗菌肽基因导入植物中的研究,试图培育出新的抗病品种,目前已经取得重大进展。因此,对昆虫抗菌肽的研究不仅对昆虫的防御体系和机制有了新的认识,而且在医学和农业上有广阔的应用前景。
国家863高技术基金项目(101-01-02-03)
参考文献
1 Hultmark D, Steiner H, Rasmuson T, et al. Insect immunity: Purificati on and properties of three inducible bactercidal proteins from Hemolymph of immunized pupae of hyalophora cectopia. Eur J Biochem,1980,106:7
, 百拇医药
2 Steiner H, Hultmark D, Engstrom A, et al. Sepuence and specificity of two antibacterial proteins involved in insect immunity. Nature,1981,292:246
3 Ganz T, rayner J R, Valore E V, et al. The structure of the rabbit macroph age defensin genes and their organ-specific expression. J Imunal, 1989,143:1358
4 Jaynes J M, Burton C A,Barr S B,et al. In vitro cytocidal effect of novel lytic peptides on pladmodium falciparum and trypanosoma cruzi. FASEB J,1989,2:2878
, 百拇医药
5 Daher K A, Selsted E M, Lehrer R I,et al. Direct inactiviation of viruses by human granulocyte defensins. J Virol, 1986,60:1068
6 Jaynes J M.Lytic peptides: A magic bullet? Biotechnology News,1990,10:8
7 Boman H G, Hultmark D. Cell-free immunity in insects.Annu Rev, 1987,41:103
8 屈贤铭, 唐海伦,Steiner H,等. 柞蚕抗菌肽B、D对脂质体的作用. 生物化学 与生物物理学报, 1989,21(1):35
9 Fink J, Boman A, Boman H G,et al. Design, synthesis and antibaterial activity of cecropin-lide model peptides.Int J Peptide Protein Res,1989,33:807
收稿日期:1999-03-22, 百拇医药