热休克蛋白90α(HSP90α)在大肠杆菌中的表达
作者:乔绘红 赵玫 施一江 袁兴华 范云霞 周纯 徐枫 黄常志
单位:乔绘红(现在北京市东单三条5号医科院基础所病理室,北京 100005); 赵玫(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021); 施一江(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021); 袁兴华(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
关键词:热休克蛋白90α;基因表达;大肠杆菌
中国免疫学杂志000302 摘 要 目的:探讨热休克蛋白90α的生物学功能,获得高质量及充足的HSP90α蛋白。方法:采用PCR的方法扩增HSP90αcDNA5'端424 bp片段,在起始密码子位置制造一个NcoI酶切位点,将PCR产物克隆到中间载体,再通过合适的酶切位点将其余片段连接到此载体,形成一个带有NcoI突变位点的HSP90αcDNA全长克隆。最终将HSP90α全部编码cDNA插入到pET-16b表达载体中。结果:经诱导表达,SDS-PAGE凝胶电泳分离显示在分子量大约83 kD处有一诱导蛋白带。Western Blot证明表达产物与抗HSP90α抗血清有特异的免疫反应。结论:构建成了T7启动子控制下的HSP90α表达质粒。
, 百拇医药
中国图书分类号 Q784 R73-3
Expression of HSP90α in E. coli
QIAO Hui-Hong ZHAO Mei SHI Yi-Jiang et al
(Cancer Institute of CAMS & PUMC,Beijing 100021)
Abstract:Objective:To acquire high quality HSP90α protein.Methods:Hsp90α cDNA 5'-end 424 bp fragment was amplified by PCR.Three bases were mutated,so NcoI restriction enzyme site was produced.The PCR product was successively inserted into intermediate vector,by some restriction enzyme hsp90α 3'-end fragment was inserted into the vector.Thus,a clone was obtained which contains whole fragment of hsp90α cDNA with NcoI restriction enzyme site.After cleaved with NcoI and BamHI,the hsp90α cDNA was cloned into pET-16 blxpression vector.Results:tSDS-PAGE gel electrophoresis showed that a protein band with molecular weight of 83 kD appeared as the expected size after transformation and inductionin the host bacteria (DE3).Western-blot analysis showed that the expressed protein was hybridized with the antibody to HSP90α. Conclusion:HSP90α expressing plasmid was constructed.
, 百拇医药
Key words:HSP90α Gene expression E.coli
HSP90是热休克蛋白家族中一个重要的成员,在细胞内具有重要的生理功能[1]。近年来的研究表明HSP90在肿瘤免疫中具有重要作用,它作为抗原肽的载体参与了MHCI类抗原的提呈[2];大量表达在肿瘤细胞膜上的HSP90可能具有NK细胞识别的靶结构[3]。人类HSP90根据是否含有谷氨酰胺丰富的片段分为HSP90α与HSP90β两类[4]。其中HSP90α与肿瘤的关系密切,在许多肿瘤细胞中HSP90α表达升高,HSP90β基本无变化[5]。所以本研究用基因工程的方法构建HSP90α表达质粒,为探讨其在肿瘤组织中大量表达的意义,及其在肿瘤免疫治疗中的应用打下基础。
1 材料与方法
1.1 材料
, 百拇医药
1.1.1 质粒,菌种,引物 pBluescript-KS-HSP90α质粒由中国医学科学院基础医学研究所分子生物学国家重点实验室沈瞐瞓教授提供。pUC119,pET-16b载体与DH5χ,DE3宿主菌由加拿大Paul Liu教授惠赠。单链寡核苷酸引物,Startprimer(25mers):5'-CAC CAT GGC TGA GGA AAC CCA GAC C-3',C,C,G原序列为A,G,C。Haltprimer(25mers):5'-AGC AGA ATA AAA ACC AAC ACC GAA C-3'。
1.1.2 试剂 限制性内切酶,T4DNA连接酶,购自美国Promega公司,Taq DNA polymerase购自上海生工公司。α-32PdATP为福瑞公司产品,其它试剂皆为分析纯试剂。
1.2 方法
1.2.1 聚合酶链反应 常规反应体系,扩增条件为:质粒DNA沸水浴中变性5 min,然后依次94℃ 30 s,58℃ 45 s,72℃ 1 min,共30个循环,最后72℃保温10 min。
, 百拇医药
1.2.2 外源基因的表达 重组表达质粒转化大肠杆菌DE3,IPTG(异丙基硫代-β-D-半乳糖苷)终浓度1 mmol/L诱导表达2.5 h。取样测A600,离心收集菌体,按照每0.1 OD加10 μl去离子水及等体积2×SDS-PAGE上样缓冲液的比例悬溶样品,煮沸5 min,取20 μl上样,行SDS-PAGE分析以鉴定是否有诱导表达产物。
1.2.3 蛋白质凝胶电泳(SDS-PAGE)分析 8%的聚丙烯酰胺凝胶电泳按照Laemmli方法进行,用考马斯亮蓝R-250染色。
1.2.4 基因操作及Western Blot均按MoleculorCloning一书方法进行[6]。
2 结果
2.1 HSP90α原核表达质粒的构建及鉴定 位于pBluescript-KS载体中的HSP90α的编码cDNA全长2.9 kb,终止密码子(TAA)位于距ATG2.2 kb处,距ATG120 bp处有一Bgl II单酶切位点,距ATG 2 458 bp处有一Hinc II酶切位点,用PCR的方法扩增hsp90α cDNA5'端424 bp,并在ATG附近突变3个碱基,创造1个NcoI酶切位点,将产物克隆至TA载体,然后从EcoR I位点将PCR产物插入pUC119载体,再通过Bgl II和Hinc II位点将该cDNA3'端2 332 bp与pUC119中HSP90α cDNA5'端第120个碱基相连,形成一个带有NcoI酶切位点的HSP90α cDNA全长克隆。最后通过NcoI,BamH I位点将全部编码序列cDNA插入到pET-16b表达载体中,此连接产物转化DE3菌,挑取4个单菌落提取质粒DNA,以HSP90α5'端925 bp片段作探针进行杂交,第1第4个质粒杂交结果是强阳性(图1),对这两个质粒进行酶切鉴定(图2)和序列测定(图3),与预期结果相符,说明成功地构建了HSP90α表达质粒。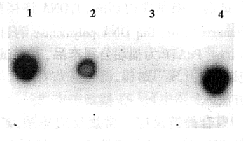
, http://www.100md.com
图1 重组质粒DNA的Dot Blot分析
Fig.1 Dot Blot analysis of recombinant plasmid DNA 1,2,3,4 different plasmid DNA
图2 pET-HSP90α的酶切鉴定
Fig.2 Restriction enzyme analysis Of pET-HSP90α
Note:1.λDNA/HisndIII marker;2.pET-HSP90α/BgIII,PstI;3.pET-HSP90α/NcoI;4 pET-HSP90α/EcoRI
, 百拇医药
图3 pET-HSP90α的部分序列分析结果
Fig.3 Partial sequencing analysis of pET-HSP90α
2.2 HSP90α蛋白的表达及鉴定 经IPTG诱导表达,SDS-PAGE电泳结果表明诱导表达蛋白的分子量为83 kD,与预期结果完全相符(图4)。经薄层扫描分析表达蛋白占细菌总蛋白的9%。分离纯化的蛋白行SDS-PAGE凝胶电泳,转移到硝酸纤维素膜上,用由本室制备的抗HSP90α血清(另文发表)进行Western Blot,结果表明,表达产物能与抗HSP90α有特异的免疫反应。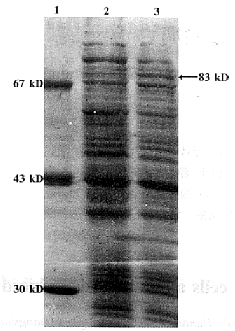
图4 pET-HSP90α表达产物的SDS-PAGE图谱
Fig.4 SDS-PAGE analysis of HSP90α Expressed in E.coli
, 百拇医药
Note:1.LMW marker;2.Un-induced product ;3.Induced product
图5 HSP90α的Western Blot鉴定
Fig.5 Western Blot analysis of HSP90α
Note:1.HSP90α;2.the antibody hybridized with HSP90α fusion protein;3.LMW marker
3 讨论
本研究构建了HSP90α表达质粒。鉴于扩增2.0 kb以上的片段比较困难,且片段越长发生错配的机率越高,所以本研究采取了先扩增5'端小片段,将其克隆至中间载体,再通过合适的酶切位点,将3'端cDNA连接到该中间载体,最后将全部编码cDNA插入到表达载体的方案,证明此方案简单易行。
, 百拇医药
在没有合适的酶切位点进行克隆时,人们往往采用PCR的方法,扩增所需片段,理论上PCR的产物为平末端,但是许多原核细胞和真核细胞的DNA聚合酶都具有非模板指导的在双股DNA分子的3’平末端的-OH加一个或几个脱氧核苷酸(主要是A)的活力[7],针对PCR产物的这个特点,一些公司设计了“TA载体”,即在一个平末端载体3’端加上一个T,这样任何PCR产物可以利用TA配对,直接克隆到T载体中去。利用TA载体克隆效率很高,尤其进行多个PCR产物克隆时是一种方便快捷的方法。
本研究用原核系统表达HSP90α,为获得纯品HSP90α,制备抗血清,探讨HSP90α在肿瘤组织中大量表达的意义及其在肿瘤免疫治疗中的应用打下基础。
基金项目:国家自然科学基金资助项目(批准号39770824)
作者简介:乔绘红,女,27岁,生物化学专业硕士生;
, http://www.100md.com
黄常志,男,42岁,副教授,硕士生导师,主要研究热休克蛋白与肿瘤免疫
作者单位;范云霞(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
周纯(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
徐枫(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
黄常志(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
参考文献:
[1]Jerome V,Vourc'H c,Baulien E E et al.Cell cycle regulation of the chicken HSP90 expression.Exp Cell Res,1993;205:44
, http://www.100md.com
[2]Srivastava P K,Heiichiro U,Nathalic E.Heat shock proteins transfer peptides during antigen processing and CTL priming.Immunogenetics,1994;39:93
[3]Yagihashi A, Sato N,Torigoe T et al.Identification of the transformation-associated cell surface antigen expressed on the rat fetus-derived fibroblast.Cancer Research,1988;48:2798
[4]Hickey E,Brandon S E, Smale G.Sequence and regulation of ageneencoding a human89--kilodalton heat shock protein.Molecular and cellular biology,1989;26:15
, 百拇医药
[5]Gress,Thomas M.Differentiale xpression of heat shock proteins in pancreatic carcinoma.Cancer Res,1994;54(2):547
[6]金东雁,孟黎明译. 分子克隆. 第2版. 北京:科学技术出版社. 1992:30-35
[7]Clark J M.Novelnon-templated nucotide addition reactions catalyzed by procaryotic and eucaryotic DNA polymerases.Nucl Acids Res,1988;16:9677
收稿日期:1998-06-16
修改日期:1999-02-08, 百拇医药
单位:乔绘红(现在北京市东单三条5号医科院基础所病理室,北京 100005); 赵玫(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021); 施一江(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021); 袁兴华(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
关键词:热休克蛋白90α;基因表达;大肠杆菌
中国免疫学杂志000302 摘 要 目的:探讨热休克蛋白90α的生物学功能,获得高质量及充足的HSP90α蛋白。方法:采用PCR的方法扩增HSP90αcDNA5'端424 bp片段,在起始密码子位置制造一个NcoI酶切位点,将PCR产物克隆到中间载体,再通过合适的酶切位点将其余片段连接到此载体,形成一个带有NcoI突变位点的HSP90αcDNA全长克隆。最终将HSP90α全部编码cDNA插入到pET-16b表达载体中。结果:经诱导表达,SDS-PAGE凝胶电泳分离显示在分子量大约83 kD处有一诱导蛋白带。Western Blot证明表达产物与抗HSP90α抗血清有特异的免疫反应。结论:构建成了T7启动子控制下的HSP90α表达质粒。
, 百拇医药
中国图书分类号 Q784 R73-3
Expression of HSP90α in E. coli
QIAO Hui-Hong ZHAO Mei SHI Yi-Jiang et al
(Cancer Institute of CAMS & PUMC,Beijing 100021)
Abstract:Objective:To acquire high quality HSP90α protein.Methods:Hsp90α cDNA 5'-end 424 bp fragment was amplified by PCR.Three bases were mutated,so NcoI restriction enzyme site was produced.The PCR product was successively inserted into intermediate vector,by some restriction enzyme hsp90α 3'-end fragment was inserted into the vector.Thus,a clone was obtained which contains whole fragment of hsp90α cDNA with NcoI restriction enzyme site.After cleaved with NcoI and BamHI,the hsp90α cDNA was cloned into pET-16 blxpression vector.Results:tSDS-PAGE gel electrophoresis showed that a protein band with molecular weight of 83 kD appeared as the expected size after transformation and inductionin the host bacteria (DE3).Western-blot analysis showed that the expressed protein was hybridized with the antibody to HSP90α. Conclusion:HSP90α expressing plasmid was constructed.
, 百拇医药
Key words:HSP90α Gene expression E.coli
HSP90是热休克蛋白家族中一个重要的成员,在细胞内具有重要的生理功能[1]。近年来的研究表明HSP90在肿瘤免疫中具有重要作用,它作为抗原肽的载体参与了MHCI类抗原的提呈[2];大量表达在肿瘤细胞膜上的HSP90可能具有NK细胞识别的靶结构[3]。人类HSP90根据是否含有谷氨酰胺丰富的片段分为HSP90α与HSP90β两类[4]。其中HSP90α与肿瘤的关系密切,在许多肿瘤细胞中HSP90α表达升高,HSP90β基本无变化[5]。所以本研究用基因工程的方法构建HSP90α表达质粒,为探讨其在肿瘤组织中大量表达的意义,及其在肿瘤免疫治疗中的应用打下基础。
1 材料与方法
1.1 材料
, 百拇医药
1.1.1 质粒,菌种,引物 pBluescript-KS-HSP90α质粒由中国医学科学院基础医学研究所分子生物学国家重点实验室沈瞐瞓教授提供。pUC119,pET-16b载体与DH5χ,DE3宿主菌由加拿大Paul Liu教授惠赠。单链寡核苷酸引物,Startprimer(25mers):5'-CAC CAT GGC TGA GGA AAC CCA GAC C-3',C,C,G原序列为A,G,C。Haltprimer(25mers):5'-AGC AGA ATA AAA ACC AAC ACC GAA C-3'。
1.1.2 试剂 限制性内切酶,T4DNA连接酶,购自美国Promega公司,Taq DNA polymerase购自上海生工公司。α-32PdATP为福瑞公司产品,其它试剂皆为分析纯试剂。
1.2 方法
1.2.1 聚合酶链反应 常规反应体系,扩增条件为:质粒DNA沸水浴中变性5 min,然后依次94℃ 30 s,58℃ 45 s,72℃ 1 min,共30个循环,最后72℃保温10 min。
, 百拇医药
1.2.2 外源基因的表达 重组表达质粒转化大肠杆菌DE3,IPTG(异丙基硫代-β-D-半乳糖苷)终浓度1 mmol/L诱导表达2.5 h。取样测A600,离心收集菌体,按照每0.1 OD加10 μl去离子水及等体积2×SDS-PAGE上样缓冲液的比例悬溶样品,煮沸5 min,取20 μl上样,行SDS-PAGE分析以鉴定是否有诱导表达产物。
1.2.3 蛋白质凝胶电泳(SDS-PAGE)分析 8%的聚丙烯酰胺凝胶电泳按照Laemmli方法进行,用考马斯亮蓝R-250染色。
1.2.4 基因操作及Western Blot均按MoleculorCloning一书方法进行[6]。
2 结果
2.1 HSP90α原核表达质粒的构建及鉴定 位于pBluescript-KS载体中的HSP90α的编码cDNA全长2.9 kb,终止密码子(TAA)位于距ATG2.2 kb处,距ATG120 bp处有一Bgl II单酶切位点,距ATG 2 458 bp处有一Hinc II酶切位点,用PCR的方法扩增hsp90α cDNA5'端424 bp,并在ATG附近突变3个碱基,创造1个NcoI酶切位点,将产物克隆至TA载体,然后从EcoR I位点将PCR产物插入pUC119载体,再通过Bgl II和Hinc II位点将该cDNA3'端2 332 bp与pUC119中HSP90α cDNA5'端第120个碱基相连,形成一个带有NcoI酶切位点的HSP90α cDNA全长克隆。最后通过NcoI,BamH I位点将全部编码序列cDNA插入到pET-16b表达载体中,此连接产物转化DE3菌,挑取4个单菌落提取质粒DNA,以HSP90α5'端925 bp片段作探针进行杂交,第1第4个质粒杂交结果是强阳性(图1),对这两个质粒进行酶切鉴定(图2)和序列测定(图3),与预期结果相符,说明成功地构建了HSP90α表达质粒。

, http://www.100md.com
图1 重组质粒DNA的Dot Blot分析
Fig.1 Dot Blot analysis of recombinant plasmid DNA 1,2,3,4 different plasmid DNA

图2 pET-HSP90α的酶切鉴定
Fig.2 Restriction enzyme analysis Of pET-HSP90α
Note:1.λDNA/HisndIII marker;2.pET-HSP90α/BgIII,PstI;3.pET-HSP90α/NcoI;4 pET-HSP90α/EcoRI

, 百拇医药
图3 pET-HSP90α的部分序列分析结果
Fig.3 Partial sequencing analysis of pET-HSP90α
2.2 HSP90α蛋白的表达及鉴定 经IPTG诱导表达,SDS-PAGE电泳结果表明诱导表达蛋白的分子量为83 kD,与预期结果完全相符(图4)。经薄层扫描分析表达蛋白占细菌总蛋白的9%。分离纯化的蛋白行SDS-PAGE凝胶电泳,转移到硝酸纤维素膜上,用由本室制备的抗HSP90α血清(另文发表)进行Western Blot,结果表明,表达产物能与抗HSP90α有特异的免疫反应。

图4 pET-HSP90α表达产物的SDS-PAGE图谱
Fig.4 SDS-PAGE analysis of HSP90α Expressed in E.coli
, 百拇医药
Note:1.LMW marker;2.Un-induced product ;3.Induced product

图5 HSP90α的Western Blot鉴定
Fig.5 Western Blot analysis of HSP90α
Note:1.HSP90α;2.the antibody hybridized with HSP90α fusion protein;3.LMW marker
3 讨论
本研究构建了HSP90α表达质粒。鉴于扩增2.0 kb以上的片段比较困难,且片段越长发生错配的机率越高,所以本研究采取了先扩增5'端小片段,将其克隆至中间载体,再通过合适的酶切位点,将3'端cDNA连接到该中间载体,最后将全部编码cDNA插入到表达载体的方案,证明此方案简单易行。
, 百拇医药
在没有合适的酶切位点进行克隆时,人们往往采用PCR的方法,扩增所需片段,理论上PCR的产物为平末端,但是许多原核细胞和真核细胞的DNA聚合酶都具有非模板指导的在双股DNA分子的3’平末端的-OH加一个或几个脱氧核苷酸(主要是A)的活力[7],针对PCR产物的这个特点,一些公司设计了“TA载体”,即在一个平末端载体3’端加上一个T,这样任何PCR产物可以利用TA配对,直接克隆到T载体中去。利用TA载体克隆效率很高,尤其进行多个PCR产物克隆时是一种方便快捷的方法。
本研究用原核系统表达HSP90α,为获得纯品HSP90α,制备抗血清,探讨HSP90α在肿瘤组织中大量表达的意义及其在肿瘤免疫治疗中的应用打下基础。
基金项目:国家自然科学基金资助项目(批准号39770824)
作者简介:乔绘红,女,27岁,生物化学专业硕士生;
, http://www.100md.com
黄常志,男,42岁,副教授,硕士生导师,主要研究热休克蛋白与肿瘤免疫
作者单位;范云霞(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
周纯(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
徐枫(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
黄常志(中国医学科学院中国协和医科大学肿瘤研究所,北京 100021)
参考文献:
[1]Jerome V,Vourc'H c,Baulien E E et al.Cell cycle regulation of the chicken HSP90 expression.Exp Cell Res,1993;205:44
, http://www.100md.com
[2]Srivastava P K,Heiichiro U,Nathalic E.Heat shock proteins transfer peptides during antigen processing and CTL priming.Immunogenetics,1994;39:93
[3]Yagihashi A, Sato N,Torigoe T et al.Identification of the transformation-associated cell surface antigen expressed on the rat fetus-derived fibroblast.Cancer Research,1988;48:2798
[4]Hickey E,Brandon S E, Smale G.Sequence and regulation of ageneencoding a human89--kilodalton heat shock protein.Molecular and cellular biology,1989;26:15
, 百拇医药
[5]Gress,Thomas M.Differentiale xpression of heat shock proteins in pancreatic carcinoma.Cancer Res,1994;54(2):547
[6]金东雁,孟黎明译. 分子克隆. 第2版. 北京:科学技术出版社. 1992:30-35
[7]Clark J M.Novelnon-templated nucotide addition reactions catalyzed by procaryotic and eucaryotic DNA polymerases.Nucl Acids Res,1988;16:9677
收稿日期:1998-06-16
修改日期:1999-02-08, 百拇医药