阿仑膦酸盐促进体外培养鼠破骨细胞凋亡
作者:王晓敏 于世风 庞淑珍
单位:北京医科大学口腔医学院病理研究室,北京 100081
关键词:破骨细胞;药物作用;脱噬作用;药物作用;阿仑膦酸盐☆;细胞;培养的
北京医科大学学报990520 摘 要 目的:研究阿仑膦酸盐通过凋亡抑制破骨细胞性骨吸收的作用。方法:通过光镜、透射电子显微镜和原位末端标记显示形态学特征的方法确证阿仑膦酸盐可诱导体外培养破骨细胞凋亡。结果:破骨细胞和其前体细胞在阿仑膦酸盐处理后呈现凋亡的形态学特征。结论:阿仑膦酸盐导致破骨细胞量的减少可能和细胞凋亡有关。
中国图书资料分类法分类号 R364.26
The study on osteoclastic apoptosis induced by alendronate in vitro
, 百拇医药
WANG Xiao-Min, YU Shi-Feng, PANG Shu-Zhen
(Department of Pathology, School of Stomatology, Beijing Medical University, Beijing 100081)
MeSH Osteoclasts/drug eff Apoptosis/drug eff Alendronate☆ Cells, cultured
ABSTRACT Objective: To study the inhibiting effect of alendronate on the apoptosis of osteoclasts. Methods: Osteoclasts were cultured from rat bone marrow induced by 1,25(OH)2D3 in vitro. The apoptosis of cultured osteoclast induced by alendronate was confirmed by morphological features in light microscopic, transmission electron microscopic and in situ DNA end-labeling examinations. Results: Osteoclast and their progenitor cells underwent apoptosis after exposure to alendronate in vitro. Conclusion: The reduction of osteoclast amount induced by alendronate may be due to cell apoptosis.
, 百拇医药
(J Beijing Med Univ, 1999,31:454-457)
双膦酸盐是抑制骨吸收的有效因子,最初用于治疗Paget′s病、恶性高血钙症,最近用于治疗骨质疏松症。双膦酸盐是焦磷酸盐的同型物,焦磷酸盐的主要结构为P-O-P,存在于血浆、尿、唾液等体液中,不仅可抑制磷酸钙结晶的形成、聚集和溶解,还可以抑制软组织异位钙化。但是焦磷酸盐在体内很快水解,而无法对骨吸收产生影响。双膦酸盐的主要结构部分为P-C-P,与焦磷酸盐相似,但它的理化性质十分稳定,至今未发现其能被酶水解,且能够在体内、体外减少破骨细胞的数目与活性,但其作用机制尚不清楚[1]。破骨细胞数目减少可能与破骨细胞的形成减少或与药物对成熟破骨细胞的毒性作用有关。已有报道体外分离培养的破骨细胞在缺乏生长因子的情况下能够引发凋亡[2]。所以双膦酸盐的毒性作用可能和促进破骨细胞凋亡有关。为此建立了SD大鼠骨髓体外培养破骨细胞体系,观察了第3代双膦酸盐阿仑膦酸盐对破骨细胞及其前体细胞的作用。
, http://www.100md.com
1 材料与方法
1.1 材料
动物:5周大小SD雄性大鼠,购自国家计划生育委员会动物室。
药品及试剂:1,25(OH)2D3(1,25 dihydroxy-vitamin D3)(北京协和医院内分泌科馈赠),alendronate(河北制药总集团馈赠),α-MEM培养基,蛋白酶K和DAPI(4,6-diamidino-2-phenylindole, Sigma,Chemical,Co),dNTP(dATP, dCTP,dGTP dTTP,购自原平生物制品公司),biotin- dUTP(Clontech Laboratories Inc USA),Klenow聚合酶(购自Boehringer Mannheim)。
1.2 方法
, 百拇医药
1.2.1 破骨细胞的培养 将SD大鼠在乙醚麻醉下断颈处死,无菌条件下取四肢长骨,在平衡盐液内去净附着在骨表面的软组织与软骨骺,用剪刀剪断长骨两端以暴露骨髓腔,用5 ml注射器吸取α-MEM全培养液(体积分数为15%的新生牛血清,青霉素100 U.ml-1链霉素100 mg.L-1,25 mmol.L-1 Hepes) 1 ml冲洗髓腔3次,收集冲洗液,用筛网过滤,细胞悬液注入培养皿内1 h后,收集含未附着细胞的培养液,去除附着细胞,细胞悬液注入培养瓶(每瓶5×106个细胞)和24孔培养板内(8个孔内放无菌的骨片,16个孔内放无菌的盖玻片,每孔5×105个细胞),同时加入1,25(OH)2D3(终浓度为10-8 mol.L-1)。在体积分数为5%的CO2、37 ℃、潮湿条件下进行培养。每3 d换液1次,每次换液去掉4/5体积的旧培养液,换以同体积的含1,25(OH)2D3的新培养液。
, 百拇医药
1.2.2 阿仑膦酸盐的添加 于培养第6天骨片上出现骨吸收陷窝时,去掉含玻片孔和培养瓶的旧培养液,换上新培养液(含10-8 mol.L-1 1,25(OH)2 D3)。于培养瓶及8个玻片孔内加入阿仑膦酸盐至终浓度为100 μmol.L-1,另8个玻片孔内加入等体积的PBS液,继续培养48 h。
1.2.3 观察方法 (1)倒置相差显微镜:观察培养细胞的形态、运动情况及骨吸收陷窝的形成;(2)HE、Giemsa、TRAP染色:用药后48 h,取用药组和非用药组玻片10%(体积分数)中性福尔马林固定,甲醇固定,分别用于HE、TRAP (抗酒石酸酸性磷酸酶)染色和姬姆萨染色,光镜观察;(3)荧光显微镜:用细胞刮子轻刮培养瓶内附着细胞和未附着细胞汇集,PBS洗涤,室温下40 g.L-1多聚甲醛固定10 min,将细胞涂于载玻片上,DAPI(一种可激发荧光的核染色物质,2.85×10-6 mol.L-1)染色10 min,荧光显微镜下观察;(4)透射电镜:用细胞刮子轻刮培养瓶培养面,离心收集5×106细胞, PBS洗涤两遍,PBS重悬细胞,滴入有琼脂空槽的离心管中,离心,800~1 000 r.min-1,10 min。取出离心管中的琼脂,切下含细胞团的部分,戊二醛固定2 h,常规制备,透射电镜观察;(5)原位末端标记:取用药组与非用药组玻片,40 g.L-1多聚甲醛固定,PBS洗涤后,置2×SSC液中,80 ℃、20 min,蒸馏水洗涤,置1 mg.L-1蛋白酶K溶液中37 ℃、15 min、流水冲洗终止反应。再用缓冲液液(50 mmol.L-1 Tris-HCI, 5 mmol.L-1 MgCl2 ,10 mmol.L-1 β-巯基乙醇,体积分数为0.005%的牛血清白蛋白)漂洗5 min,滤纸拭干玻片周边液体,放温盒内。每张玻片滴加标记液[0.01 mmol.L-1 dNTP(dATP、dCTP、dGTP), 0.01 mmol.L-1 bio-tin-dUTP 40 U.ml-1 klenow聚合酶]约50 μl,覆盖玻片,25 ℃,1 h。PBS漂洗后置1 g.L-1 H2O2内15 min,PBS洗涤,温盒内用辣根酶标记生物素(HRP-avidin)点片,室温30 min,PBS洗涤,二氨基联苯胺(DAB- H2O2,HRP的底物)显色,流水冲洗后,常规脱水,透明,封片。
, http://www.100md.com
2 结果
2.1 倒置相差显微镜观察
培养1~4 d只见单核细胞贴壁延展,细胞数量逐渐增多。第5天偶见多核巨细胞,胞核或集聚在细胞中央,或散在细胞周边,但骨片上未出现骨吸收陷窝。培养第6天,骨片上可见散在的骨吸收陷窝。培养第7天,骨吸收陷窝数明显增加,未用药组玻片上多核巨细胞显著增多,用药组玻片上多核巨细胞及圆形单核细胞胞浆皱缩。
2.2 光镜观察
培养1~3 d TRAP染色阴性,培养第7天多数多核巨细胞及圆形单核细胞TRAP染色呈阳性(光镜下胞浆呈紫红色)。Giemsa 染色示形成的破骨细胞胞核或集聚在细胞中央或散在细胞周边。HE染色可见,未用药组的圆形单核细胞及破骨细胞(多核巨细胞)胞浆丰满,内含许多空泡结构,核大呈椭圆形,核仁清晰。用药组的破骨细胞胞浆浓缩,核固缩深染,有的细胞出现核碎裂。破骨细胞前体细胞(TRAP 染色阳性的圆形单核细胞)也呈现凋亡特征(图1、2)。原位末端标记的结果显示,许多胞浆皱缩的破骨细胞及其前体细胞胞核呈棕褐色,胞浆淡染(图3、4)。未用药组破骨细胞及其前体细胞染色阴性(图5)。
, 百拇医药
图1 未凋亡破骨细胞,核大,核仁清晰,胞浆丰满。 HE ×252
Figure 1 Nonapoptotic osteoclast, big nuclei, clear nucleolus, affluent cytoplasm. HE ×252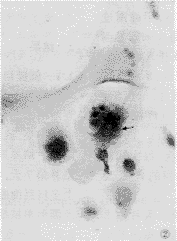
图2 凋亡破骨细胞胞浆收缩,核固缩核碎裂。 HE ×252
Figure 2 Two osteoclasts showing the morphological features of apoptosis (cytoplasmic contraction, chromatin condensation, and nuclear fragmentation). HE ×252
, 百拇医药
图3 凋亡破骨细胞胞核呈黄色胞浆淡染原位末端标记。 ×75
Figure 3 The TUNEL showing apoptotic osteoclasts staining positive. ×75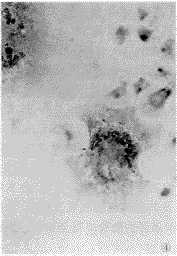
图4 凋亡破骨细胞胞核呈阳性表达原位末端标记。 ×252
Figure 4 The TUNEL showing apoptotic osteoclasts staining positive. ×252
图5 未凋亡细胞胞核呈阴性表达原位末端标记。 ×150
, http://www.100md.com Figure 5 The TUNEL showing Nonapopototic osteoclast staining negtive. ×150
2.3 荧光显微镜观察
凋亡细胞核核周呈一亮环 ,而未凋亡细胞核染色均一(图6)。
图6 凋亡破骨细胞胞核周缘呈环状亮色,而未凋亡细胞核荧光染色均一。DAPI染色×1 500
Figure 6 Bright fluorescence of condensed nuclear chromatin appeared around circumnuclear edge of apoptotic osteoclast,nonapoptotic nuclear fluorescence showed coherent distributed. DAPI staining×1 500
, 百拇医药
2.4 电镜观察
凋亡破骨细胞胞核的凋亡程度不一。染色质固缩并凝聚成块,集聚在核膜周边,呈环状小体,细胞浆浓缩,内质网变疏松,形成一个个空泡,线粒体结构无改变(图7)。
图7 凋亡破骨细胞胞核染色质凝聚成块,集聚在核膜周缘呈环状,内质网疏松,线粒体集聚。 ×6 000
Figure 7 Nuclear chromatin of apoptotic osteoclasts condensed at nuclear membrane in circular form, loosened endoplasmic reticulum and mitochondria gathering with intact structure. ×6 000
, http://www.100md.com
3 讨论
本研究利用SD大鼠骨髓体外培养破骨细胞体系,主要从形态学角度确证了阿仑膦酸盐对破骨细胞及其前体细胞具有毒性作用,表现在诱导细胞凋亡而不是使细胞坏死。将阿仑膦酸盐加入培养体系中48 h后,光镜与电镜下破骨细胞及其前体细胞表现为凋亡的形态学特征:胞浆和核浓缩,染色质固缩,常集聚于核膜周围,呈境界分明的颗粒状块状。继而胞核和细胞外形发生皱褶,核裂解成质膜包绕的碎片,细胞膜突出形成质膜小泡,脱落后形成凋亡小体,其中可保留完整的细胞器和致密的染色质。
坏死的细胞则表现为染色质减少、呈细颗粒状,细胞器肿胀破裂。本实验采用1,25(OH)2D3诱导SD大鼠骨髓细胞形成多核巨细胞,并在骨片上形成骨吸收陷窝,且TRAP染色阳性,说明诱导形成的多核巨细胞是破骨细胞[3]。阿仑膦酸盐诱导的多核巨细胞及圆形单核细胞的凋亡, 也就是破骨细胞及其前体细胞的凋亡。原位末端标记的结果显示凋亡细胞的细胞核呈棕褐色着染,胞浆也可因核DNA碎片的溢出而呈阳性着染,未用药细胞染色阴性[4]。
, 百拇医药
本实验证实了阿仑膦酸盐能够诱导破骨细胞及其前体细胞凋亡,但其确切机制尚不清楚。有人提出将成骨细胞暴露于双膦酸盐后可产生抑制破骨细胞活性的物质。大鼠骨髓培养形成的破骨细胞和具有成骨细胞特征的基质细胞群有关。这些细胞可能通过产生一氧化氮(NO)、细胞外ATP、TGF-β或凋亡基因表达产物(Fas配体)介导破骨细胞及其前体细胞凋亡的发生[5]。而这些产物已被证明可诱导其它类型细胞凋亡。而且凋亡一旦在形态学上得到认证,其过程就不可逆转。因此,一旦破骨细胞走向凋亡,在功能上就不可能再进行骨吸收。所以阿仑膦酸盐诱导破骨细胞凋亡是抑制骨吸收及其有意义的机制之一,从而认为,利用破骨细胞体外培养体系,进一步改善实验技术和手段,从生化和遗传学角度研究致使破骨细胞及其前体细胞凋亡的机制,寻找新的抗破骨细胞性骨吸收制剂,是目前防治骨吸收破坏的发展趋势之一。
注:☆ 自由词。
参考文献
, 百拇医药 1 Hughes DE, Mian M, Guilland CDF, et al. The cellular mechenism of action of bisphosphonates. Drugs Exp Clin Res, 1991,17:109-114
2 Fuller K, Owens JM, Jagger CJ, et al. Macrophage colony-stimulating factor stimulate survival and chemotactic behavior in isolated osteoclasts. J Exp Med, 1993 , 178:1 733-1 744
3 Naoyuki T, Hiromi Y, Shusak Y, et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrin, 1988, 122:1 373-1 382
4 姜 泊,张亚历,周殿元.分子生物学常用实验方法.北京:人民军医出版社, 1996. 182-183
5 Hughes D, Wright KR, Harnyl UY. Bisphosphonates promote apoptosis in murine osteoclasts in vitro and in vivo. J Bone Min Res, 1995,10:1 478-1 487
(1998-09-02收稿), 百拇医药
单位:北京医科大学口腔医学院病理研究室,北京 100081
关键词:破骨细胞;药物作用;脱噬作用;药物作用;阿仑膦酸盐☆;细胞;培养的
北京医科大学学报990520 摘 要 目的:研究阿仑膦酸盐通过凋亡抑制破骨细胞性骨吸收的作用。方法:通过光镜、透射电子显微镜和原位末端标记显示形态学特征的方法确证阿仑膦酸盐可诱导体外培养破骨细胞凋亡。结果:破骨细胞和其前体细胞在阿仑膦酸盐处理后呈现凋亡的形态学特征。结论:阿仑膦酸盐导致破骨细胞量的减少可能和细胞凋亡有关。
中国图书资料分类法分类号 R364.26
The study on osteoclastic apoptosis induced by alendronate in vitro
, 百拇医药
WANG Xiao-Min, YU Shi-Feng, PANG Shu-Zhen
(Department of Pathology, School of Stomatology, Beijing Medical University, Beijing 100081)
MeSH Osteoclasts/drug eff Apoptosis/drug eff Alendronate☆ Cells, cultured
ABSTRACT Objective: To study the inhibiting effect of alendronate on the apoptosis of osteoclasts. Methods: Osteoclasts were cultured from rat bone marrow induced by 1,25(OH)2D3 in vitro. The apoptosis of cultured osteoclast induced by alendronate was confirmed by morphological features in light microscopic, transmission electron microscopic and in situ DNA end-labeling examinations. Results: Osteoclast and their progenitor cells underwent apoptosis after exposure to alendronate in vitro. Conclusion: The reduction of osteoclast amount induced by alendronate may be due to cell apoptosis.
, 百拇医药
(J Beijing Med Univ, 1999,31:454-457)
双膦酸盐是抑制骨吸收的有效因子,最初用于治疗Paget′s病、恶性高血钙症,最近用于治疗骨质疏松症。双膦酸盐是焦磷酸盐的同型物,焦磷酸盐的主要结构为P-O-P,存在于血浆、尿、唾液等体液中,不仅可抑制磷酸钙结晶的形成、聚集和溶解,还可以抑制软组织异位钙化。但是焦磷酸盐在体内很快水解,而无法对骨吸收产生影响。双膦酸盐的主要结构部分为P-C-P,与焦磷酸盐相似,但它的理化性质十分稳定,至今未发现其能被酶水解,且能够在体内、体外减少破骨细胞的数目与活性,但其作用机制尚不清楚[1]。破骨细胞数目减少可能与破骨细胞的形成减少或与药物对成熟破骨细胞的毒性作用有关。已有报道体外分离培养的破骨细胞在缺乏生长因子的情况下能够引发凋亡[2]。所以双膦酸盐的毒性作用可能和促进破骨细胞凋亡有关。为此建立了SD大鼠骨髓体外培养破骨细胞体系,观察了第3代双膦酸盐阿仑膦酸盐对破骨细胞及其前体细胞的作用。
, http://www.100md.com
1 材料与方法
1.1 材料
动物:5周大小SD雄性大鼠,购自国家计划生育委员会动物室。
药品及试剂:1,25(OH)2D3(1,25 dihydroxy-vitamin D3)(北京协和医院内分泌科馈赠),alendronate(河北制药总集团馈赠),α-MEM培养基,蛋白酶K和DAPI(4,6-diamidino-2-phenylindole, Sigma,Chemical,Co),dNTP(dATP, dCTP,dGTP dTTP,购自原平生物制品公司),biotin- dUTP(Clontech Laboratories Inc USA),Klenow聚合酶(购自Boehringer Mannheim)。
1.2 方法
, 百拇医药
1.2.1 破骨细胞的培养 将SD大鼠在乙醚麻醉下断颈处死,无菌条件下取四肢长骨,在平衡盐液内去净附着在骨表面的软组织与软骨骺,用剪刀剪断长骨两端以暴露骨髓腔,用5 ml注射器吸取α-MEM全培养液(体积分数为15%的新生牛血清,青霉素100 U.ml-1链霉素100 mg.L-1,25 mmol.L-1 Hepes) 1 ml冲洗髓腔3次,收集冲洗液,用筛网过滤,细胞悬液注入培养皿内1 h后,收集含未附着细胞的培养液,去除附着细胞,细胞悬液注入培养瓶(每瓶5×106个细胞)和24孔培养板内(8个孔内放无菌的骨片,16个孔内放无菌的盖玻片,每孔5×105个细胞),同时加入1,25(OH)2D3(终浓度为10-8 mol.L-1)。在体积分数为5%的CO2、37 ℃、潮湿条件下进行培养。每3 d换液1次,每次换液去掉4/5体积的旧培养液,换以同体积的含1,25(OH)2D3的新培养液。
, 百拇医药
1.2.2 阿仑膦酸盐的添加 于培养第6天骨片上出现骨吸收陷窝时,去掉含玻片孔和培养瓶的旧培养液,换上新培养液(含10-8 mol.L-1 1,25(OH)2 D3)。于培养瓶及8个玻片孔内加入阿仑膦酸盐至终浓度为100 μmol.L-1,另8个玻片孔内加入等体积的PBS液,继续培养48 h。
1.2.3 观察方法 (1)倒置相差显微镜:观察培养细胞的形态、运动情况及骨吸收陷窝的形成;(2)HE、Giemsa、TRAP染色:用药后48 h,取用药组和非用药组玻片10%(体积分数)中性福尔马林固定,甲醇固定,分别用于HE、TRAP (抗酒石酸酸性磷酸酶)染色和姬姆萨染色,光镜观察;(3)荧光显微镜:用细胞刮子轻刮培养瓶内附着细胞和未附着细胞汇集,PBS洗涤,室温下40 g.L-1多聚甲醛固定10 min,将细胞涂于载玻片上,DAPI(一种可激发荧光的核染色物质,2.85×10-6 mol.L-1)染色10 min,荧光显微镜下观察;(4)透射电镜:用细胞刮子轻刮培养瓶培养面,离心收集5×106细胞, PBS洗涤两遍,PBS重悬细胞,滴入有琼脂空槽的离心管中,离心,800~1 000 r.min-1,10 min。取出离心管中的琼脂,切下含细胞团的部分,戊二醛固定2 h,常规制备,透射电镜观察;(5)原位末端标记:取用药组与非用药组玻片,40 g.L-1多聚甲醛固定,PBS洗涤后,置2×SSC液中,80 ℃、20 min,蒸馏水洗涤,置1 mg.L-1蛋白酶K溶液中37 ℃、15 min、流水冲洗终止反应。再用缓冲液液(50 mmol.L-1 Tris-HCI, 5 mmol.L-1 MgCl2 ,10 mmol.L-1 β-巯基乙醇,体积分数为0.005%的牛血清白蛋白)漂洗5 min,滤纸拭干玻片周边液体,放温盒内。每张玻片滴加标记液[0.01 mmol.L-1 dNTP(dATP、dCTP、dGTP), 0.01 mmol.L-1 bio-tin-dUTP 40 U.ml-1 klenow聚合酶]约50 μl,覆盖玻片,25 ℃,1 h。PBS漂洗后置1 g.L-1 H2O2内15 min,PBS洗涤,温盒内用辣根酶标记生物素(HRP-avidin)点片,室温30 min,PBS洗涤,二氨基联苯胺(DAB- H2O2,HRP的底物)显色,流水冲洗后,常规脱水,透明,封片。
, http://www.100md.com
2 结果
2.1 倒置相差显微镜观察
培养1~4 d只见单核细胞贴壁延展,细胞数量逐渐增多。第5天偶见多核巨细胞,胞核或集聚在细胞中央,或散在细胞周边,但骨片上未出现骨吸收陷窝。培养第6天,骨片上可见散在的骨吸收陷窝。培养第7天,骨吸收陷窝数明显增加,未用药组玻片上多核巨细胞显著增多,用药组玻片上多核巨细胞及圆形单核细胞胞浆皱缩。
2.2 光镜观察
培养1~3 d TRAP染色阴性,培养第7天多数多核巨细胞及圆形单核细胞TRAP染色呈阳性(光镜下胞浆呈紫红色)。Giemsa 染色示形成的破骨细胞胞核或集聚在细胞中央或散在细胞周边。HE染色可见,未用药组的圆形单核细胞及破骨细胞(多核巨细胞)胞浆丰满,内含许多空泡结构,核大呈椭圆形,核仁清晰。用药组的破骨细胞胞浆浓缩,核固缩深染,有的细胞出现核碎裂。破骨细胞前体细胞(TRAP 染色阳性的圆形单核细胞)也呈现凋亡特征(图1、2)。原位末端标记的结果显示,许多胞浆皱缩的破骨细胞及其前体细胞胞核呈棕褐色,胞浆淡染(图3、4)。未用药组破骨细胞及其前体细胞染色阴性(图5)。

, 百拇医药
图1 未凋亡破骨细胞,核大,核仁清晰,胞浆丰满。 HE ×252
Figure 1 Nonapoptotic osteoclast, big nuclei, clear nucleolus, affluent cytoplasm. HE ×252

图2 凋亡破骨细胞胞浆收缩,核固缩核碎裂。 HE ×252
Figure 2 Two osteoclasts showing the morphological features of apoptosis (cytoplasmic contraction, chromatin condensation, and nuclear fragmentation). HE ×252

, 百拇医药
图3 凋亡破骨细胞胞核呈黄色胞浆淡染原位末端标记。 ×75
Figure 3 The TUNEL showing apoptotic osteoclasts staining positive. ×75

图4 凋亡破骨细胞胞核呈阳性表达原位末端标记。 ×252
Figure 4 The TUNEL showing apoptotic osteoclasts staining positive. ×252

图5 未凋亡细胞胞核呈阴性表达原位末端标记。 ×150
, http://www.100md.com Figure 5 The TUNEL showing Nonapopototic osteoclast staining negtive. ×150
2.3 荧光显微镜观察
凋亡细胞核核周呈一亮环 ,而未凋亡细胞核染色均一(图6)。

图6 凋亡破骨细胞胞核周缘呈环状亮色,而未凋亡细胞核荧光染色均一。DAPI染色×1 500
Figure 6 Bright fluorescence of condensed nuclear chromatin appeared around circumnuclear edge of apoptotic osteoclast,nonapoptotic nuclear fluorescence showed coherent distributed. DAPI staining×1 500
, 百拇医药
2.4 电镜观察
凋亡破骨细胞胞核的凋亡程度不一。染色质固缩并凝聚成块,集聚在核膜周边,呈环状小体,细胞浆浓缩,内质网变疏松,形成一个个空泡,线粒体结构无改变(图7)。

图7 凋亡破骨细胞胞核染色质凝聚成块,集聚在核膜周缘呈环状,内质网疏松,线粒体集聚。 ×6 000
Figure 7 Nuclear chromatin of apoptotic osteoclasts condensed at nuclear membrane in circular form, loosened endoplasmic reticulum and mitochondria gathering with intact structure. ×6 000
, http://www.100md.com
3 讨论
本研究利用SD大鼠骨髓体外培养破骨细胞体系,主要从形态学角度确证了阿仑膦酸盐对破骨细胞及其前体细胞具有毒性作用,表现在诱导细胞凋亡而不是使细胞坏死。将阿仑膦酸盐加入培养体系中48 h后,光镜与电镜下破骨细胞及其前体细胞表现为凋亡的形态学特征:胞浆和核浓缩,染色质固缩,常集聚于核膜周围,呈境界分明的颗粒状块状。继而胞核和细胞外形发生皱褶,核裂解成质膜包绕的碎片,细胞膜突出形成质膜小泡,脱落后形成凋亡小体,其中可保留完整的细胞器和致密的染色质。
坏死的细胞则表现为染色质减少、呈细颗粒状,细胞器肿胀破裂。本实验采用1,25(OH)2D3诱导SD大鼠骨髓细胞形成多核巨细胞,并在骨片上形成骨吸收陷窝,且TRAP染色阳性,说明诱导形成的多核巨细胞是破骨细胞[3]。阿仑膦酸盐诱导的多核巨细胞及圆形单核细胞的凋亡, 也就是破骨细胞及其前体细胞的凋亡。原位末端标记的结果显示凋亡细胞的细胞核呈棕褐色着染,胞浆也可因核DNA碎片的溢出而呈阳性着染,未用药细胞染色阴性[4]。
, 百拇医药
本实验证实了阿仑膦酸盐能够诱导破骨细胞及其前体细胞凋亡,但其确切机制尚不清楚。有人提出将成骨细胞暴露于双膦酸盐后可产生抑制破骨细胞活性的物质。大鼠骨髓培养形成的破骨细胞和具有成骨细胞特征的基质细胞群有关。这些细胞可能通过产生一氧化氮(NO)、细胞外ATP、TGF-β或凋亡基因表达产物(Fas配体)介导破骨细胞及其前体细胞凋亡的发生[5]。而这些产物已被证明可诱导其它类型细胞凋亡。而且凋亡一旦在形态学上得到认证,其过程就不可逆转。因此,一旦破骨细胞走向凋亡,在功能上就不可能再进行骨吸收。所以阿仑膦酸盐诱导破骨细胞凋亡是抑制骨吸收及其有意义的机制之一,从而认为,利用破骨细胞体外培养体系,进一步改善实验技术和手段,从生化和遗传学角度研究致使破骨细胞及其前体细胞凋亡的机制,寻找新的抗破骨细胞性骨吸收制剂,是目前防治骨吸收破坏的发展趋势之一。
注:☆ 自由词。
参考文献
, 百拇医药 1 Hughes DE, Mian M, Guilland CDF, et al. The cellular mechenism of action of bisphosphonates. Drugs Exp Clin Res, 1991,17:109-114
2 Fuller K, Owens JM, Jagger CJ, et al. Macrophage colony-stimulating factor stimulate survival and chemotactic behavior in isolated osteoclasts. J Exp Med, 1993 , 178:1 733-1 744
3 Naoyuki T, Hiromi Y, Shusak Y, et al. Osteoclast-like cell formation and its regulation by osteotropic hormones in mouse bone marrow cultures. Endocrin, 1988, 122:1 373-1 382
4 姜 泊,张亚历,周殿元.分子生物学常用实验方法.北京:人民军医出版社, 1996. 182-183
5 Hughes D, Wright KR, Harnyl UY. Bisphosphonates promote apoptosis in murine osteoclasts in vitro and in vivo. J Bone Min Res, 1995,10:1 478-1 487
(1998-09-02收稿), 百拇医药