盐酸多柔比星隐形脂质体给药后在小鼠组织中质量分数的测定
作者:吕万良 齐宪荣 孙华东 张强 魏树礼
单位:北京医科大学药学院药剂研究室,北京 100083
关键词:
北京医科大学学报990525 多柔比星(doxorubicin,adriamycin)为蒽环类抗生素,结构类似柔红霉素,属抗肿瘤药。文献[1~4]报道了许多高效液相色谱法,这些方法主要用于测定盐酸多柔比星的含量和主要代谢物。在试图重现这些方法时,我们遇到了一些困难,主要表现在(1)难以重现或重现不稳定;(2)方法复杂、繁琐;(3)组织提取物中有大量不溶物;(4)回收率差;(5)盐酸多柔比星保留时间太短,与内源性物质分不开。为此,本文旨在建立简便可行的方法,用于定量动物体内组织中多柔比星的质量分数。
1 材料与方法
1.1 材料与试剂
, 百拇医药
仪器:高效液相色谱仪(TSP, 美国),Spectra100可变波长紫外检测器(TSP, 美国),YWG-C18不锈钢色谱柱(250 mm×4.6 mm, 5 μm, 大连依利特),WDL-95色谱工作站(中科院大连化学物理研究所);组织匀浆器,离心机(北京医疗仪器厂);工业用气态氮(北京),手术器械若干。
试剂与药品:乙腈(色谱级,天津);磷酸、氯仿、甲醇等(均为市售分析纯试剂)。盐酸多柔比星隐形脂质体、普通脂质体(均为本室研制),盐酸多柔比星注射剂(自制)。
动物:昆明种小鼠,雌雄兼用,体重(20±2) g。
1.2 样品采集和预处理
空白样品采集:将小鼠数只分别断头处死,收集空白血液,取出心、肝、脾、肺、肾用生理盐水漂洗去血液,滤纸吸干,精密称重后置1.5 ml尖底具塞试管于-20℃冰箱保存。
, 百拇医药
样品采集:将盐酸多柔比星注射液、盐酸多柔比星普通脂质体注射液、盐酸多柔比星隐形脂质体注射液分别用生理盐水注射液稀释至0.5 g.L-1,尾静脉注射,给药剂量为5 mg.kg-1。每30只小鼠随机分为5组,每组6只,分别于给药后1、3、5、24、48 h将小鼠断头取血,随后取出心、肝、脾、肺、肾脏,用生理盐水漂后用滤纸吸干,精密称重后置1.5 ml尖底具塞试管中,于-20 ℃冰箱保存。
预处理:取各时间点样品置匀浆器中,加入0.8 ml枸橼酸缓冲液(pH 6.8),匀浆1 min (3 000 r.min-1),转移至离心管中,加入氯仿-甲醇(体积比为4∶1),旋涡振摇1 min,离心,精密吸取氯仿层3.0 ml,60 ℃下N2吹干,用封口膜封口待测。加入甲醇200 μl溶解残渣,精密吸取50 μl注入HPLC六通阀。
, 百拇医药
1.3 色谱条件
流动相为乙腈-水(体积比为32∶68, 用8.67 mol.L-1磷酸调pH至3.0), 流速为1.5 ml.min-1,检测波长为254 nm,灵敏度为0.01~0.005。
工作曲线:精密称取减压干燥的盐酸多柔比星适量,定量溶解成100.0 mg.L-1标准贮备液,置4 ℃冰箱备用。取标准贮备液稀释成系列标准液,分别取系列标准液加入至心、肝、脾、肺、肾及血液组织空白匀浆中,制备成系列浓度的含药组织样品匀浆,转移至离心管中,以下照预处理内容进行。
回收率及精密度:取贮备液分别稀释成高、中、低3种浓度的标准液,参照工作曲线项下方法进行回收率及日内差和日间差测定。
, 百拇医药 2 结果
盐酸多柔比星在小鼠体内各组织中的平均标准曲线、回收率、精密度及质量分数分别见表1~3。
表1 盐酸多柔比星在小鼠体内各组织中的平均标准曲线
Table 1 Mean calibration curve of doxorubicin hydrochloride
(DOX) in the mouse tissues Tissue
Calibrtion curve of DOX
r
Heart
A=1.723+5.657C
, http://www.100md.com
0.9975
Liver
A=-0.816+1.570C
0.9997
Spleen
A=-3.556+11.321C
0.9966
Lung
A=-2.017+11.278C
0.9989
Kidney
A=-1.118+17.783C
, http://www.100md.com
0.9966
Blood
A=-0.332+1.469C
0.9995
n=3.表2 盐酸多柔比星在小鼠体内各组织中的平均回收率及精密度(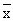 ±s)
±s)
Table 2 Mean recovery and precision of DOX in mouse tissues(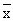 ±s) 10-6ωDOX
±s) 10-6ωDOX
Within-day-run/%
, http://www.100md.com
Between-day-run/%
Recovery
RSD
Recovery
RSD
Heart
0.5
89.1±3.7
4.15
91.7±8.0
8.75
5.0
, 百拇医药
94.9±2.5
2.59
98.0±3.5
3.61
10.0
101.2±2.2
2.16
100.7±4.1
4.04
Liver
1.7
93.4±5.5
, 百拇医药 5.93
92.9±7.5
8.09
4.25
94.4±1.3
1.41
94.8±5.5
5.78
8.5
96.6±2.1
2.18
97.9±5.9
6.02
, http://www.100md.com
Spleen
1.0
90.7±0.7
0.78
91.1±2.2
2.41
5.0
96.2±3.5
3.61
95.1±5.0
5.20
15.0
97.2±3.8
, http://www.100md.com
3.95
96.7±5.8
5.96
Lung
1.0
95.0±3.9
4.15
94.8±6.2
6.53
2.5
95.5±4.1
4.28
97.9±5.9
, 百拇医药
5.99
10.0
99.5±1.2
1.25
96.0±4.3
4.45
Kidney
1.2
98.7±4.5
4.53
97.7±5.5
5.65
6.0
, 百拇医药
97.8±3.7
3.82
98.0±5.9
6.03
12.0
96.3±3.7
3.79
94.9±6.2
6.48
Blood
2.0
96.5±4.8
, 百拇医药 4.95
94.1±5.5
5.89
10.0
101.5±1.9
1.91
98.8±4.2
4.24
20.0
96.4±2.1
2.20
96.2±1.2
1.22
, 百拇医药
n=3; RSD, relative standard deviation.表3 盐酸多柔比星隐形脂质体和对照制剂经尾静泳注射后在小鼠体内各组织中的平均质量分数
Table 3 Mean mass fraction in the mouse tissues following tail intravenous injection of DOX, DOX stealth liposomes, regular liposomes
(10-6ωDOX)
1.0 h
3.0 h
5.0 h
24.0 h
, http://www.100md.com
48.0 h
Heart
Stealth1
3.21
3.65
2.91
2.45
1.77
Regular2
4.59
3.82
3.83
, http://www.100md.com
2.98
1.97
Dox3
11.92
14.16
8.25
3.95
2.11
Liver
Stealth
5.65
5.63
6.57
, 百拇医药
2.13
2.82
Regular
6.00
8.58
6.70
3.97
1.82
Dox
4.47
2.05
4.63
2.96
, 百拇医药
1.49
Spleen
stealth
4.81
7.73
8.56
7.86
8.73
Regular
12.80
10.71
10.43
8.80
, 百拇医药
9.43
Dox
2.32
1.41
1.81
3.52
3.06
Lung
Stealth
4.45
3.23
2.94
2.46
, http://www.100md.com
1.83
Regular
4.08
4.32
3.88
3.18
2.19
Dox
8.40
7.74
6.42
3.38
1.14
, http://www.100md.com
Kidney
Stealth
2.65
4.29
2.68
2.51
1.71
Regular
1.97
2.28
1.87
1.29
1.17
, http://www.100md.com
Dox
4.92
4.36
3.88
1.62
1.60
Blood
Stealth
24.41
21.33
7.44
4.76
2.47
, http://www.100md.com
Regular
15.77
11.99
6.18
0.67
0.54
Dox
5.51
3.34
1.63
0.50
0.44
n=6; 1, injection of doxorubicin hydrochloride stealth liposomes; 2, injection of doxorubicin hydrochloride regular liposomes; 3, injection of doxorubicin hydrochloride.
, http://www.100md.com
3 讨论
色谱条件选择:多柔比星碱基本身属两亲性物质,在形成盐酸盐后极性较大,易形成离子型,在应用YWG-C18(非极性键合相)色谱柱进行分离时很快流出,用单纯改变二元流动相组分不能改进保留时间(tR较短),将乙腈-水二元流动相调节pH至3.0左右后,同时将流动相极性增加,盐酸多柔比星在分析柱上保留时间延长。在反相高效液相色谱中,组织提取物的内源性杂质多为极性大化合物,柱上停留时间短,先于药物流出色谱柱,因此减少了对药物峰的干扰,有利于及时再进样。前述的文献法在重现时即是出现保留时间太短的问题。
样品处理:组织中药物的提取,采用一步提取法有较大的优势,表现在回收率稳定,重现性好,减少了多步骤反复提取带来的更多的偶然因素,其次是在大批量体内样品分析时,节省大量的时间。实验结果表明,组织样品中盐酸多柔比星与内源性杂质在柱上分离完全,干扰小。盐酸多柔比星在各组织样品中各浓度水平的平均RSD<10%,平均回收率>90%,精密度合乎生物样品体内分析的质控要求。
, http://www.100md.com
测定结果:以盐酸多柔比星普通脂质体和盐酸多柔比星注射液为对照制剂,盐酸多柔比星隐形脂质体在小鼠体内各组织中的质量分数测定结果为新型靶向制剂盐酸多柔比星隐形脂质体的靶向性趋向分析提供了实验基础。结果初步表明:隐形脂质体的血液循环时间延长,表现出具有逃避网状内皮系统捕获的能力,同普通脂质体相比被动靶向性减弱,主动靶向性增强;另外脂质体制剂同多柔比星注射剂相比,心脏浓度降低,从而可望降低多柔比星的心脏毒性和提高药物疗效。
参考文献
1 Shinozawa S, Mimaki Y, Araki Y. Determination of the Mass ratio of adriamycin and its metabolites in the serum and tissues of Ehrlich carcinoma-bearing mice by high-performance liquid chromatography. J Chromatogr B Biomed Appl, 1980, 196: 463-469
, http://www.100md.com
2 Rose LM, Tillery KF, Dareer S, et al. High-performance liquid chromatographic determination of doxorubicin and its metabolites in plasma and tissue. J Chromatogr B Biomed Appl, 1988, 425: 419-423
3 Leca FR, Marchiset-Leca D, Antonetti M. A highly sensitive method for the determination of adriamycin and adriamycinol in human plasma using HPLC with fluorimetric detection. Chromatographia, 1989, 28(7, 8): 325-328
4 Frezard F. Fluorometric determination in biological fluids of the release kinetics of liposome-entrapped doxorubicin. J Liposome Res, 1994; 4(2): 1063-1073
(1998-10-27收稿), http://www.100md.com
单位:北京医科大学药学院药剂研究室,北京 100083
关键词:
北京医科大学学报990525 多柔比星(doxorubicin,adriamycin)为蒽环类抗生素,结构类似柔红霉素,属抗肿瘤药。文献[1~4]报道了许多高效液相色谱法,这些方法主要用于测定盐酸多柔比星的含量和主要代谢物。在试图重现这些方法时,我们遇到了一些困难,主要表现在(1)难以重现或重现不稳定;(2)方法复杂、繁琐;(3)组织提取物中有大量不溶物;(4)回收率差;(5)盐酸多柔比星保留时间太短,与内源性物质分不开。为此,本文旨在建立简便可行的方法,用于定量动物体内组织中多柔比星的质量分数。
1 材料与方法
1.1 材料与试剂
, 百拇医药
仪器:高效液相色谱仪(TSP, 美国),Spectra100可变波长紫外检测器(TSP, 美国),YWG-C18不锈钢色谱柱(250 mm×4.6 mm, 5 μm, 大连依利特),WDL-95色谱工作站(中科院大连化学物理研究所);组织匀浆器,离心机(北京医疗仪器厂);工业用气态氮(北京),手术器械若干。
试剂与药品:乙腈(色谱级,天津);磷酸、氯仿、甲醇等(均为市售分析纯试剂)。盐酸多柔比星隐形脂质体、普通脂质体(均为本室研制),盐酸多柔比星注射剂(自制)。
动物:昆明种小鼠,雌雄兼用,体重(20±2) g。
1.2 样品采集和预处理
空白样品采集:将小鼠数只分别断头处死,收集空白血液,取出心、肝、脾、肺、肾用生理盐水漂洗去血液,滤纸吸干,精密称重后置1.5 ml尖底具塞试管于-20℃冰箱保存。
, 百拇医药
样品采集:将盐酸多柔比星注射液、盐酸多柔比星普通脂质体注射液、盐酸多柔比星隐形脂质体注射液分别用生理盐水注射液稀释至0.5 g.L-1,尾静脉注射,给药剂量为5 mg.kg-1。每30只小鼠随机分为5组,每组6只,分别于给药后1、3、5、24、48 h将小鼠断头取血,随后取出心、肝、脾、肺、肾脏,用生理盐水漂后用滤纸吸干,精密称重后置1.5 ml尖底具塞试管中,于-20 ℃冰箱保存。
预处理:取各时间点样品置匀浆器中,加入0.8 ml枸橼酸缓冲液(pH 6.8),匀浆1 min (3 000 r.min-1),转移至离心管中,加入氯仿-甲醇(体积比为4∶1),旋涡振摇1 min,离心,精密吸取氯仿层3.0 ml,60 ℃下N2吹干,用封口膜封口待测。加入甲醇200 μl溶解残渣,精密吸取50 μl注入HPLC六通阀。
, 百拇医药
1.3 色谱条件
流动相为乙腈-水(体积比为32∶68, 用8.67 mol.L-1磷酸调pH至3.0), 流速为1.5 ml.min-1,检测波长为254 nm,灵敏度为0.01~0.005。
工作曲线:精密称取减压干燥的盐酸多柔比星适量,定量溶解成100.0 mg.L-1标准贮备液,置4 ℃冰箱备用。取标准贮备液稀释成系列标准液,分别取系列标准液加入至心、肝、脾、肺、肾及血液组织空白匀浆中,制备成系列浓度的含药组织样品匀浆,转移至离心管中,以下照预处理内容进行。
回收率及精密度:取贮备液分别稀释成高、中、低3种浓度的标准液,参照工作曲线项下方法进行回收率及日内差和日间差测定。
, 百拇医药 2 结果
盐酸多柔比星在小鼠体内各组织中的平均标准曲线、回收率、精密度及质量分数分别见表1~3。
表1 盐酸多柔比星在小鼠体内各组织中的平均标准曲线
Table 1 Mean calibration curve of doxorubicin hydrochloride
(DOX) in the mouse tissues Tissue
Calibrtion curve of DOX
r
Heart
A=1.723+5.657C
, http://www.100md.com
0.9975
Liver
A=-0.816+1.570C
0.9997
Spleen
A=-3.556+11.321C
0.9966
Lung
A=-2.017+11.278C
0.9989
Kidney
A=-1.118+17.783C
, http://www.100md.com
0.9966
Blood
A=-0.332+1.469C
0.9995
n=3.表2 盐酸多柔比星在小鼠体内各组织中的平均回收率及精密度(
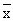 ±s)
±s)Table 2 Mean recovery and precision of DOX in mouse tissues(
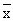 ±s) 10-6ωDOX
±s) 10-6ωDOXWithin-day-run/%
, http://www.100md.com
Between-day-run/%
Recovery
RSD
Recovery
RSD
Heart
0.5
89.1±3.7
4.15
91.7±8.0
8.75
5.0
, 百拇医药
94.9±2.5
2.59
98.0±3.5
3.61
10.0
101.2±2.2
2.16
100.7±4.1
4.04
Liver
1.7
93.4±5.5
, 百拇医药 5.93
92.9±7.5
8.09
4.25
94.4±1.3
1.41
94.8±5.5
5.78
8.5
96.6±2.1
2.18
97.9±5.9
6.02
, http://www.100md.com
Spleen
1.0
90.7±0.7
0.78
91.1±2.2
2.41
5.0
96.2±3.5
3.61
95.1±5.0
5.20
15.0
97.2±3.8
, http://www.100md.com
3.95
96.7±5.8
5.96
Lung
1.0
95.0±3.9
4.15
94.8±6.2
6.53
2.5
95.5±4.1
4.28
97.9±5.9
, 百拇医药
5.99
10.0
99.5±1.2
1.25
96.0±4.3
4.45
Kidney
1.2
98.7±4.5
4.53
97.7±5.5
5.65
6.0
, 百拇医药
97.8±3.7
3.82
98.0±5.9
6.03
12.0
96.3±3.7
3.79
94.9±6.2
6.48
Blood
2.0
96.5±4.8
, 百拇医药 4.95
94.1±5.5
5.89
10.0
101.5±1.9
1.91
98.8±4.2
4.24
20.0
96.4±2.1
2.20
96.2±1.2
1.22
, 百拇医药
n=3; RSD, relative standard deviation.表3 盐酸多柔比星隐形脂质体和对照制剂经尾静泳注射后在小鼠体内各组织中的平均质量分数
Table 3 Mean mass fraction in the mouse tissues following tail intravenous injection of DOX, DOX stealth liposomes, regular liposomes
(10-6ωDOX)
1.0 h
3.0 h
5.0 h
24.0 h
, http://www.100md.com
48.0 h
Heart
Stealth1
3.21
3.65
2.91
2.45
1.77
Regular2
4.59
3.82
3.83
, http://www.100md.com
2.98
1.97
Dox3
11.92
14.16
8.25
3.95
2.11
Liver
Stealth
5.65
5.63
6.57
, 百拇医药
2.13
2.82
Regular
6.00
8.58
6.70
3.97
1.82
Dox
4.47
2.05
4.63
2.96
, 百拇医药
1.49
Spleen
stealth
4.81
7.73
8.56
7.86
8.73
Regular
12.80
10.71
10.43
8.80
, 百拇医药
9.43
Dox
2.32
1.41
1.81
3.52
3.06
Lung
Stealth
4.45
3.23
2.94
2.46
, http://www.100md.com
1.83
Regular
4.08
4.32
3.88
3.18
2.19
Dox
8.40
7.74
6.42
3.38
1.14
, http://www.100md.com
Kidney
Stealth
2.65
4.29
2.68
2.51
1.71
Regular
1.97
2.28
1.87
1.29
1.17
, http://www.100md.com
Dox
4.92
4.36
3.88
1.62
1.60
Blood
Stealth
24.41
21.33
7.44
4.76
2.47
, http://www.100md.com
Regular
15.77
11.99
6.18
0.67
0.54
Dox
5.51
3.34
1.63
0.50
0.44
n=6; 1, injection of doxorubicin hydrochloride stealth liposomes; 2, injection of doxorubicin hydrochloride regular liposomes; 3, injection of doxorubicin hydrochloride.
, http://www.100md.com
3 讨论
色谱条件选择:多柔比星碱基本身属两亲性物质,在形成盐酸盐后极性较大,易形成离子型,在应用YWG-C18(非极性键合相)色谱柱进行分离时很快流出,用单纯改变二元流动相组分不能改进保留时间(tR较短),将乙腈-水二元流动相调节pH至3.0左右后,同时将流动相极性增加,盐酸多柔比星在分析柱上保留时间延长。在反相高效液相色谱中,组织提取物的内源性杂质多为极性大化合物,柱上停留时间短,先于药物流出色谱柱,因此减少了对药物峰的干扰,有利于及时再进样。前述的文献法在重现时即是出现保留时间太短的问题。
样品处理:组织中药物的提取,采用一步提取法有较大的优势,表现在回收率稳定,重现性好,减少了多步骤反复提取带来的更多的偶然因素,其次是在大批量体内样品分析时,节省大量的时间。实验结果表明,组织样品中盐酸多柔比星与内源性杂质在柱上分离完全,干扰小。盐酸多柔比星在各组织样品中各浓度水平的平均RSD<10%,平均回收率>90%,精密度合乎生物样品体内分析的质控要求。
, http://www.100md.com
测定结果:以盐酸多柔比星普通脂质体和盐酸多柔比星注射液为对照制剂,盐酸多柔比星隐形脂质体在小鼠体内各组织中的质量分数测定结果为新型靶向制剂盐酸多柔比星隐形脂质体的靶向性趋向分析提供了实验基础。结果初步表明:隐形脂质体的血液循环时间延长,表现出具有逃避网状内皮系统捕获的能力,同普通脂质体相比被动靶向性减弱,主动靶向性增强;另外脂质体制剂同多柔比星注射剂相比,心脏浓度降低,从而可望降低多柔比星的心脏毒性和提高药物疗效。
参考文献
1 Shinozawa S, Mimaki Y, Araki Y. Determination of the Mass ratio of adriamycin and its metabolites in the serum and tissues of Ehrlich carcinoma-bearing mice by high-performance liquid chromatography. J Chromatogr B Biomed Appl, 1980, 196: 463-469
, http://www.100md.com
2 Rose LM, Tillery KF, Dareer S, et al. High-performance liquid chromatographic determination of doxorubicin and its metabolites in plasma and tissue. J Chromatogr B Biomed Appl, 1988, 425: 419-423
3 Leca FR, Marchiset-Leca D, Antonetti M. A highly sensitive method for the determination of adriamycin and adriamycinol in human plasma using HPLC with fluorimetric detection. Chromatographia, 1989, 28(7, 8): 325-328
4 Frezard F. Fluorometric determination in biological fluids of the release kinetics of liposome-entrapped doxorubicin. J Liposome Res, 1994; 4(2): 1063-1073
(1998-10-27收稿), http://www.100md.com