人鼻粘膜腺体细胞胶原蛋白凝胶内培养模型的建立
作者:郭永清 杨占泉 卜国铉
单位:130031长春 白求恩医科大学第三临床学院耳鼻咽喉-喉头外科
关键词:细胞;培养的;鼻粘膜;胶原;细胞分化
中华耳鼻咽喉科杂志980303 【摘要】 目的 建立人鼻粘膜腺体细胞的胶原蛋白凝胶内培养模型。方法 采用胶原蛋白凝胶内培养。结果 包埋于胶原蛋白凝胶内的腺体细胞呈三维生长,一周后可见管腔结构形成,透射电镜下可见管腔侧细胞表面布满微绒毛,细胞膜之间形成明显的紧密连接,细胞内充满分泌颗粒,具有典型的腺上皮特征。经爱先蓝PAS染色,证明有粘液糖蛋白分泌,而经抗溶菌酶多克隆抗体免疫组化染色,90%以上细胞呈阳性反应。结论 胶原蛋白凝胶内培养的鼻粘膜腺体细胞改变了原来的分化表型,同一细胞具有粘液腺和浆液腺两种分化特征。
Model of human nasal gland cells cultured in collagen gels Guo Yongqing,Yang Zhanquan,Bu Guoxuan. Third Clinical College of Bethune University of Medical Sciences, Changchun 130031
, http://www.100md.com
【Abstract】 Objective To establish a culture model of human nasal gland (HNG) cells in collagen gels. Method The HNG cells were cultured in collagen gels. Results The HNG cells cultured in collagen gels showed 3-D outgrowth. After one week culture, the HNG cells developed ductal projections, the sections of collagen gel culture examined by light microscopy showed cross sectional area of tubules with a lumen containing secretory products. The cells contained numerous secretory granules. Electron microscopy showed 3-D cultured HNG cells forming a well defined lumen inside the tubular formation. These cells were polarized and interconnected by junctional complexes and possessed extensive microvilli along all their luminal border. Secretory products in the lumen and the cells located close to the luminary surface were intensely stained blue by AB-PAS staining. Immunohistochemical staining of cells labeled with a rabbit antiserum against human lysozyme showed 90% positivity. Conclusion These data indicated that HNG cells altered their phenotypes when cultured in vitro and changed from differentiated serous and mucous cells toward intermediate seromucous cells.
, http://www.100md.com
【Key words】 Cells, cultured Nasal mucosa Collagen Cell differentiation
近年来细胞培养技术发展很快,发现细胞外基质可以促进体外培养细胞的分化。在胶原蛋白凝胶上培养的呼吸道上皮细胞出现了纤毛的分化,腺体细胞具有了分泌粘液的表型[1,2]。最近的研究表明,胶原内包埋培养不仅可以促进细胞的分化,在某种程度上可以构建细胞的组织结构[3]。本研究试图建立人鼻粘膜腺体(human nasal gland)细胞的胶原蛋白凝胶内培养模型。
材料与方法
一、人鼻粘膜腺体细胞的分离
鼻内窥镜手术中取出的鼻息肉经PBS冲洗去除粘液,放入含有0.05%蛋白酶XIV的PBS中,4℃过夜。溶液中含有以下抗生素:100 U/ml青霉素;100 μg/ml链霉素;50 μg/ml庆大霉素;2.5 μg/ml二性霉素B。12小时后加入小牛血清(终浓度2.5%)以中和蛋白酶活性,经震荡使上皮完全脱落。去掉上皮的鼻息肉组织用PBS洗三次,用眼科剪刀剪碎(2~3 mm3)。然后将剪碎的组织放入Hank平衡盐溶液中,其中含有20 mmol/L HEPES, 500 U/ml IV型胶原酶,6 U/ml弹性蛋白酶,200 U/ml透明质酸酶,10 U/ml DNA酶,震荡消化6小时后离心去上清。
, http://www.100md.com
二、腺体细胞的原代单层培养
将离心后获得的细胞,加入40% Ham F12、 40%DMEM培养液,20%小牛血清(FCS),将细胞悬液加入到T25细胞培养瓶中,37℃,5%CO2+95%空气条件下放置1小时以去除纤维母细胞,然后将细胞悬液更换到I型胶原蛋白涂抹的T25细胞培养瓶中进行培养。12小时后更换成无血清培养液,成分为50%Ham F12, 50%DMEM培养液,并加入以下激素及生长因子:10 μg/ml胰岛素、5 μg/ml转铁蛋白、20 ng/ml三碘甲状腺氨酸、0.36 μg/ml皮质醇、7.5 μg/ml内皮细胞生长因子、25 ng/ml表皮生长因子,0.1 μmol/ml维生素A酸,20 ng/ml霍乱毒素。每3天换液1次。
三、胶原蛋白凝胶(Collagen gels) 内培养
胶原蛋白凝胶的制备依据曰本Nitta Gelatin公司提供的配方。8 ml I型胶原蛋白加入1 ml 10倍Ham F12培养液,1 ml缓冲液(0.2 mol/L HEPES, 0.08 mol/L NaOH),在0℃下充分混合,将混合液加入到12孔培养板中,每孔加1 ml, 37℃下放置30分钟,使其凝固。经5~7天的原代单层培养,用胰蛋白酶钠(Trypsin)-EDTA消化后,经台盼蓝染色,细胞活性大于95%时,在胶原蛋白凝胶上加入上述无血清培养液,其中含有1×105个腺体细胞(每孔加0.5 ml)。12小时细胞贴壁后,完全去除培养液,在其上面每孔再加入1 ml胶原溶液。待胶原蛋白凝固后,每孔加入2 ml无血清培养液,48小时后将贴附于孔壁的胶原蛋白凝胶完整分离,使其悬浮于培养液中,每3天换培养液1次。
, http://www.100md.com
四、爱先蓝(pH 2.5)-PAS 染色
胶原蛋白凝胶上培养1、2周的细胞经甲醛固定,石蜡包埋。切片后经脱蜡、水洗后进行染色。具体步骤如下,3%醋酸作用20秒,1%爱先蓝(pH 2.5)染色30分钟,蒸馏水冲洗后,1%过碘酸10分钟,蒸馏水5分钟,0.5%亚硫酸钠6分钟,席夫试剂10分钟,苏木精染核,脱水,封片。酸性粘多糖染成蓝色,糖元及中性粘多糖染成紫红色。为了鉴别阳性是否为糖元,在染色前先经淀粉酶(0.05 mol/L PBS, pH 6.0) 37℃作用30分钟,如果为糖元,经此过程后,染色转为阴性。
五、免疫组织化学染色
单层培养一周完全融合的细胞经胰蛋白酶钠(Trypsin)-EDTA消化后,作成单细胞悬液,经过Sytospin,粘附于玻璃片上的细胞自然干燥后,丙酮固定。用鼠抗人角蛋白单克隆抗体(AE1/AE3)染色,以证明培养的细胞为上皮系细胞。胶原内培养1、2周后的细胞经多聚甲醛固定,石蜡包埋。用免抗人溶菌酶多克隆抗体进行免疫组织化学染色,以鉴定浆液性腺体细胞的分化情况。采用VectastainABC-AP试剂盒,具体染色过程如下:一抗作用60分钟,PBS洗10分钟,生物素标记的二抗作用60分钟,PBS洗10分钟,ABC-AP作用于30分钟,PBS洗10分钟,加入碱性磷酸酶底物作用30分钟,PBS冲洗,苏木素染核,脱水,透明,封片。
, 百拇医药
六、透射电子显微镜观察
胶原蛋白凝胶内培养1、2周的细胞经2.5%戊二醛,1%锇酸固定后,系列酒精脱水,透明(丙酮∶Epon为1∶1),采用Epon 812包埋,超薄切片,电子染色,观察。
结果
一、人鼻粘膜腺体细胞的原代单层培养
分离的单细胞悬液在一般培养瓶中37℃放置1小时,混入的大部分纤维母细胞首先贴壁,取出未贴壁人鼻粘膜腺体细胞悬液重新注入到I型胶原蛋白涂抹的培养瓶中,6~12小时后贴壁,1周后细胞完全融合,融合后的细胞用胰酶蛋白钠-EDTA消化,混入生长的少量纤维母细胞首先被消化,吸引出之后,继续消化,回收的细胞经抗角蛋白单克隆抗体染色,所有细胞均呈阳性反应,证明为上皮系细胞(图1)。
二、胶原蛋白凝胶内培养
, http://www.100md.com
在胶原上培养12小时,大部分细胞贴壁,其上经胶原蛋白凝胶覆盖后,细胞呈三维生长,形成立体的组织块,在倒置显微镜下观察,2天后可见管腔样结构形成,1周后形成明显的管腔(图2)。培养2周的石蜡包埋切片爱先蓝-PAS染色可见大部分细胞,特别是靠近管腔侧的细胞被染成深蓝色,证明存在粘液糖蛋白的分泌(图3)。抗溶菌酶多克隆抗体免疫组化染色如图4所示,几乎所有细胞均呈阳性反应,说明这些细胞具有浆液细胞的分化表型。通过透射电镜检查,从超微结构上证实了管腔样结构形成,管腔侧细胞表面出现了微绒毛,细胞膜之间形成明显的紧密连接。细胞内,特别是靠近管腔细胞膜侧可见大量的分泌颗粒,含高电子密度及低电子密度二种,可认为是粘液样分泌颗粒及浆液样分泌颗粒。而且细胞质内含有很多糖元颗粒(图5)。
讨论
机体内不同器官的正常细胞具有高度分化的独特功能结构,而利用传统的单层细胞培养法,这些细胞在体外很快失去其原来具有的分化功能,即所谓脱分化(dedifferentiation)现象。多年来,人们不断探索如何在体外模拟体内细胞的生理环境促进其分化。近年来发现,细胞外基质(extracellular matrix)可以促进培养细胞的分化。I型胶原是构成细胞外基质主要成分的纤维性蛋白,广泛存在于动物皮肤、骨骼、肌键等部位,这些组织经弱酸处理后,胶原纤维之间的结合受到破坏,胶原蛋白分子可以溶解出来,将这种酸性溶液的pH值中和,加入NaCl,在25~37℃加温后,分子之间可以结合,形成纤维状的凝胶。在胶原凝胶上培养的细胞克服了脱分化现象,具有部分体内细胞的分化特点,呼吸道上皮胶原上培养出现纤毛再生,腺体细胞培养可见到粘液分泌[1,2]。
, http://www.100md.com
尽管胶原上培养可以促进细胞分化,但是无法构建细胞组织结构。胶原蛋白凝胶内包埋培养为这一研究开辟了新的道路,乳腺、甲状腺细胞的包埋培养不仅促进了细胞的分泌现象[3,4],而且出现了腺腔样结构,成为细胞培养道路上的里程碑。本研究显示鼻息肉腺体细胞在胶原蛋白凝胶内呈三维生长,形成了立体组织块,并出现了明显的管腔样结构;在电镜下得到明确证实,管腔侧细胞膜表面可见微绒毛,细胞膜之间形成明显的紧密连接,与正常体内的管腔组织极相似。且培养的腺体细胞呈现分泌特点,爱先蓝(pH 2.5)-PAS染色呈阳性反应,证明有粘液糖蛋白的分泌。从组织学上来看,鼻粘膜腺体是包括粘液和浆液的混合腺体,为了证明是否存在浆液腺细胞的分化,我们采用了作为浆液腺细胞标志之一的抗溶菌酶抗体进行免疫组织化学染色,结果90%以上的细胞呈阳性反应,从这一点可以看出,培养的腺体细胞不是分化成单一的粘液腺或浆液腺细胞,而是同一细胞具有二种分化表型,同一细胞内在电镜下可见到这两种分泌颗粒。不论细胞组织化学染色还是电镜观察均证实有大量糖原合成,这可能是细胞分化的一个过程。动物实验表明,人工机械损伤的气管上皮再生过程中,早期上皮的分化细胞可见很多糖元合成[5]。不同时期的猴胚胎的气管腺发生学研究表明,在胚胎发生的早期,有大量的糖元合成,随着胚胎的成熟,糖元合成减少[6]。从以上来看,培养的腺体细胞虽然出现了某些分化,但同体内的终分化细胞相比,仍相距很远。当然到目前为止,任何一种培养系统均存在这一现象,这也是今后有待进一步解决的课题。
, 百拇医药
参考文献
1 Clark AB, Randell SH, Nettesheim PN, et al. Regulation of ciliated cell differentiation in cultures of rat tracheal epithelial cells. Am J Respir Cell Mol Biol, 1995,12:329-338.
2Fulrukawa M, Yamaya M,Ikeda K, et al. Culture and characterization of human nasal gland cells. Am J Physiol, 1996,126:2027-2034.
3Toda S, Sugihara H. Reconstruction of thyroid follicles from isolated porcine follicle cells in three-dimensional collagen gel culture.Endorhinology, 1990, 126:2027-2034.
, 百拇医药
4Hamamoto S, Imagawa W, Yang J, et al. Morphogenesis of mouse mammary epithelial cells growing within collagen gels: ultrastructural and immunocytochemical characterization. Cell Differ, 1988,22:191-202.
5Shimizu T, Nettesheim P, Ramaekers FCS, et al. Expression of cell-type-specific markers during rat tracheal epithelial regeneration. Am J Respir Cell Mol Biol, 1992, 7: 30-41.
6Plopper CG, Weir AJ, Nishio SJ, et al. Tracheal submucosal gland development in the rhesus monkey, Macacamulatta: ultrastructure and histochemistry. Anat Embryol 1986, 174: 167-178.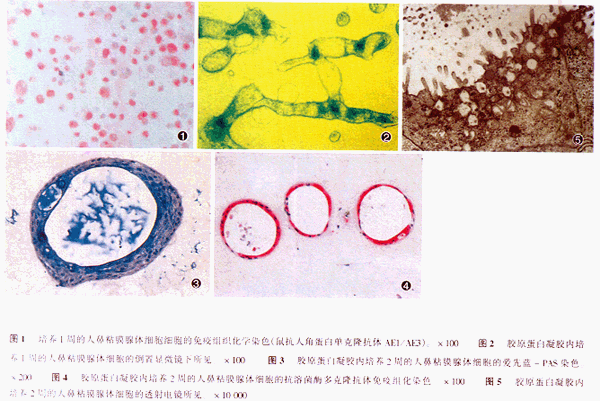
(收稿:1997-08-07 修回:1998-02-12), 百拇医药
单位:130031长春 白求恩医科大学第三临床学院耳鼻咽喉-喉头外科
关键词:细胞;培养的;鼻粘膜;胶原;细胞分化
中华耳鼻咽喉科杂志980303 【摘要】 目的 建立人鼻粘膜腺体细胞的胶原蛋白凝胶内培养模型。方法 采用胶原蛋白凝胶内培养。结果 包埋于胶原蛋白凝胶内的腺体细胞呈三维生长,一周后可见管腔结构形成,透射电镜下可见管腔侧细胞表面布满微绒毛,细胞膜之间形成明显的紧密连接,细胞内充满分泌颗粒,具有典型的腺上皮特征。经爱先蓝PAS染色,证明有粘液糖蛋白分泌,而经抗溶菌酶多克隆抗体免疫组化染色,90%以上细胞呈阳性反应。结论 胶原蛋白凝胶内培养的鼻粘膜腺体细胞改变了原来的分化表型,同一细胞具有粘液腺和浆液腺两种分化特征。
Model of human nasal gland cells cultured in collagen gels Guo Yongqing,Yang Zhanquan,Bu Guoxuan. Third Clinical College of Bethune University of Medical Sciences, Changchun 130031
, http://www.100md.com
【Abstract】 Objective To establish a culture model of human nasal gland (HNG) cells in collagen gels. Method The HNG cells were cultured in collagen gels. Results The HNG cells cultured in collagen gels showed 3-D outgrowth. After one week culture, the HNG cells developed ductal projections, the sections of collagen gel culture examined by light microscopy showed cross sectional area of tubules with a lumen containing secretory products. The cells contained numerous secretory granules. Electron microscopy showed 3-D cultured HNG cells forming a well defined lumen inside the tubular formation. These cells were polarized and interconnected by junctional complexes and possessed extensive microvilli along all their luminal border. Secretory products in the lumen and the cells located close to the luminary surface were intensely stained blue by AB-PAS staining. Immunohistochemical staining of cells labeled with a rabbit antiserum against human lysozyme showed 90% positivity. Conclusion These data indicated that HNG cells altered their phenotypes when cultured in vitro and changed from differentiated serous and mucous cells toward intermediate seromucous cells.
, http://www.100md.com
【Key words】 Cells, cultured Nasal mucosa Collagen Cell differentiation
近年来细胞培养技术发展很快,发现细胞外基质可以促进体外培养细胞的分化。在胶原蛋白凝胶上培养的呼吸道上皮细胞出现了纤毛的分化,腺体细胞具有了分泌粘液的表型[1,2]。最近的研究表明,胶原内包埋培养不仅可以促进细胞的分化,在某种程度上可以构建细胞的组织结构[3]。本研究试图建立人鼻粘膜腺体(human nasal gland)细胞的胶原蛋白凝胶内培养模型。
材料与方法
一、人鼻粘膜腺体细胞的分离
鼻内窥镜手术中取出的鼻息肉经PBS冲洗去除粘液,放入含有0.05%蛋白酶XIV的PBS中,4℃过夜。溶液中含有以下抗生素:100 U/ml青霉素;100 μg/ml链霉素;50 μg/ml庆大霉素;2.5 μg/ml二性霉素B。12小时后加入小牛血清(终浓度2.5%)以中和蛋白酶活性,经震荡使上皮完全脱落。去掉上皮的鼻息肉组织用PBS洗三次,用眼科剪刀剪碎(2~3 mm3)。然后将剪碎的组织放入Hank平衡盐溶液中,其中含有20 mmol/L HEPES, 500 U/ml IV型胶原酶,6 U/ml弹性蛋白酶,200 U/ml透明质酸酶,10 U/ml DNA酶,震荡消化6小时后离心去上清。
, http://www.100md.com
二、腺体细胞的原代单层培养
将离心后获得的细胞,加入40% Ham F12、 40%DMEM培养液,20%小牛血清(FCS),将细胞悬液加入到T25细胞培养瓶中,37℃,5%CO2+95%空气条件下放置1小时以去除纤维母细胞,然后将细胞悬液更换到I型胶原蛋白涂抹的T25细胞培养瓶中进行培养。12小时后更换成无血清培养液,成分为50%Ham F12, 50%DMEM培养液,并加入以下激素及生长因子:10 μg/ml胰岛素、5 μg/ml转铁蛋白、20 ng/ml三碘甲状腺氨酸、0.36 μg/ml皮质醇、7.5 μg/ml内皮细胞生长因子、25 ng/ml表皮生长因子,0.1 μmol/ml维生素A酸,20 ng/ml霍乱毒素。每3天换液1次。
三、胶原蛋白凝胶(Collagen gels) 内培养
胶原蛋白凝胶的制备依据曰本Nitta Gelatin公司提供的配方。8 ml I型胶原蛋白加入1 ml 10倍Ham F12培养液,1 ml缓冲液(0.2 mol/L HEPES, 0.08 mol/L NaOH),在0℃下充分混合,将混合液加入到12孔培养板中,每孔加1 ml, 37℃下放置30分钟,使其凝固。经5~7天的原代单层培养,用胰蛋白酶钠(Trypsin)-EDTA消化后,经台盼蓝染色,细胞活性大于95%时,在胶原蛋白凝胶上加入上述无血清培养液,其中含有1×105个腺体细胞(每孔加0.5 ml)。12小时细胞贴壁后,完全去除培养液,在其上面每孔再加入1 ml胶原溶液。待胶原蛋白凝固后,每孔加入2 ml无血清培养液,48小时后将贴附于孔壁的胶原蛋白凝胶完整分离,使其悬浮于培养液中,每3天换培养液1次。
, http://www.100md.com
四、爱先蓝(pH 2.5)-PAS 染色
胶原蛋白凝胶上培养1、2周的细胞经甲醛固定,石蜡包埋。切片后经脱蜡、水洗后进行染色。具体步骤如下,3%醋酸作用20秒,1%爱先蓝(pH 2.5)染色30分钟,蒸馏水冲洗后,1%过碘酸10分钟,蒸馏水5分钟,0.5%亚硫酸钠6分钟,席夫试剂10分钟,苏木精染核,脱水,封片。酸性粘多糖染成蓝色,糖元及中性粘多糖染成紫红色。为了鉴别阳性是否为糖元,在染色前先经淀粉酶(0.05 mol/L PBS, pH 6.0) 37℃作用30分钟,如果为糖元,经此过程后,染色转为阴性。
五、免疫组织化学染色
单层培养一周完全融合的细胞经胰蛋白酶钠(Trypsin)-EDTA消化后,作成单细胞悬液,经过Sytospin,粘附于玻璃片上的细胞自然干燥后,丙酮固定。用鼠抗人角蛋白单克隆抗体(AE1/AE3)染色,以证明培养的细胞为上皮系细胞。胶原内培养1、2周后的细胞经多聚甲醛固定,石蜡包埋。用免抗人溶菌酶多克隆抗体进行免疫组织化学染色,以鉴定浆液性腺体细胞的分化情况。采用VectastainABC-AP试剂盒,具体染色过程如下:一抗作用60分钟,PBS洗10分钟,生物素标记的二抗作用60分钟,PBS洗10分钟,ABC-AP作用于30分钟,PBS洗10分钟,加入碱性磷酸酶底物作用30分钟,PBS冲洗,苏木素染核,脱水,透明,封片。
, 百拇医药
六、透射电子显微镜观察
胶原蛋白凝胶内培养1、2周的细胞经2.5%戊二醛,1%锇酸固定后,系列酒精脱水,透明(丙酮∶Epon为1∶1),采用Epon 812包埋,超薄切片,电子染色,观察。
结果
一、人鼻粘膜腺体细胞的原代单层培养
分离的单细胞悬液在一般培养瓶中37℃放置1小时,混入的大部分纤维母细胞首先贴壁,取出未贴壁人鼻粘膜腺体细胞悬液重新注入到I型胶原蛋白涂抹的培养瓶中,6~12小时后贴壁,1周后细胞完全融合,融合后的细胞用胰酶蛋白钠-EDTA消化,混入生长的少量纤维母细胞首先被消化,吸引出之后,继续消化,回收的细胞经抗角蛋白单克隆抗体染色,所有细胞均呈阳性反应,证明为上皮系细胞(图1)。
二、胶原蛋白凝胶内培养
, http://www.100md.com
在胶原上培养12小时,大部分细胞贴壁,其上经胶原蛋白凝胶覆盖后,细胞呈三维生长,形成立体的组织块,在倒置显微镜下观察,2天后可见管腔样结构形成,1周后形成明显的管腔(图2)。培养2周的石蜡包埋切片爱先蓝-PAS染色可见大部分细胞,特别是靠近管腔侧的细胞被染成深蓝色,证明存在粘液糖蛋白的分泌(图3)。抗溶菌酶多克隆抗体免疫组化染色如图4所示,几乎所有细胞均呈阳性反应,说明这些细胞具有浆液细胞的分化表型。通过透射电镜检查,从超微结构上证实了管腔样结构形成,管腔侧细胞表面出现了微绒毛,细胞膜之间形成明显的紧密连接。细胞内,特别是靠近管腔细胞膜侧可见大量的分泌颗粒,含高电子密度及低电子密度二种,可认为是粘液样分泌颗粒及浆液样分泌颗粒。而且细胞质内含有很多糖元颗粒(图5)。
讨论
机体内不同器官的正常细胞具有高度分化的独特功能结构,而利用传统的单层细胞培养法,这些细胞在体外很快失去其原来具有的分化功能,即所谓脱分化(dedifferentiation)现象。多年来,人们不断探索如何在体外模拟体内细胞的生理环境促进其分化。近年来发现,细胞外基质(extracellular matrix)可以促进培养细胞的分化。I型胶原是构成细胞外基质主要成分的纤维性蛋白,广泛存在于动物皮肤、骨骼、肌键等部位,这些组织经弱酸处理后,胶原纤维之间的结合受到破坏,胶原蛋白分子可以溶解出来,将这种酸性溶液的pH值中和,加入NaCl,在25~37℃加温后,分子之间可以结合,形成纤维状的凝胶。在胶原凝胶上培养的细胞克服了脱分化现象,具有部分体内细胞的分化特点,呼吸道上皮胶原上培养出现纤毛再生,腺体细胞培养可见到粘液分泌[1,2]。
, http://www.100md.com
尽管胶原上培养可以促进细胞分化,但是无法构建细胞组织结构。胶原蛋白凝胶内包埋培养为这一研究开辟了新的道路,乳腺、甲状腺细胞的包埋培养不仅促进了细胞的分泌现象[3,4],而且出现了腺腔样结构,成为细胞培养道路上的里程碑。本研究显示鼻息肉腺体细胞在胶原蛋白凝胶内呈三维生长,形成了立体组织块,并出现了明显的管腔样结构;在电镜下得到明确证实,管腔侧细胞膜表面可见微绒毛,细胞膜之间形成明显的紧密连接,与正常体内的管腔组织极相似。且培养的腺体细胞呈现分泌特点,爱先蓝(pH 2.5)-PAS染色呈阳性反应,证明有粘液糖蛋白的分泌。从组织学上来看,鼻粘膜腺体是包括粘液和浆液的混合腺体,为了证明是否存在浆液腺细胞的分化,我们采用了作为浆液腺细胞标志之一的抗溶菌酶抗体进行免疫组织化学染色,结果90%以上的细胞呈阳性反应,从这一点可以看出,培养的腺体细胞不是分化成单一的粘液腺或浆液腺细胞,而是同一细胞具有二种分化表型,同一细胞内在电镜下可见到这两种分泌颗粒。不论细胞组织化学染色还是电镜观察均证实有大量糖原合成,这可能是细胞分化的一个过程。动物实验表明,人工机械损伤的气管上皮再生过程中,早期上皮的分化细胞可见很多糖元合成[5]。不同时期的猴胚胎的气管腺发生学研究表明,在胚胎发生的早期,有大量的糖元合成,随着胚胎的成熟,糖元合成减少[6]。从以上来看,培养的腺体细胞虽然出现了某些分化,但同体内的终分化细胞相比,仍相距很远。当然到目前为止,任何一种培养系统均存在这一现象,这也是今后有待进一步解决的课题。
, 百拇医药
参考文献
1 Clark AB, Randell SH, Nettesheim PN, et al. Regulation of ciliated cell differentiation in cultures of rat tracheal epithelial cells. Am J Respir Cell Mol Biol, 1995,12:329-338.
2Fulrukawa M, Yamaya M,Ikeda K, et al. Culture and characterization of human nasal gland cells. Am J Physiol, 1996,126:2027-2034.
3Toda S, Sugihara H. Reconstruction of thyroid follicles from isolated porcine follicle cells in three-dimensional collagen gel culture.Endorhinology, 1990, 126:2027-2034.
, 百拇医药
4Hamamoto S, Imagawa W, Yang J, et al. Morphogenesis of mouse mammary epithelial cells growing within collagen gels: ultrastructural and immunocytochemical characterization. Cell Differ, 1988,22:191-202.
5Shimizu T, Nettesheim P, Ramaekers FCS, et al. Expression of cell-type-specific markers during rat tracheal epithelial regeneration. Am J Respir Cell Mol Biol, 1992, 7: 30-41.
6Plopper CG, Weir AJ, Nishio SJ, et al. Tracheal submucosal gland development in the rhesus monkey, Macacamulatta: ultrastructure and histochemistry. Anat Embryol 1986, 174: 167-178.

(收稿:1997-08-07 修回:1998-02-12), 百拇医药