中国人肥胖抑素cDNA的克隆和在大肠杆菌中的初步表达
作者:齐可民 丁宗一 樊征鸿 周红 江载芳 唐建国
单位:100045 北京儿科研究所(齐可民、丁宗一、樊征鸿、周红、江载芳);北京大学生命科学学院(唐建国)
关键词:蛋白质类;;克隆;分子;;DNA;互补;;;大肠杆菌
论著 Cloning of human leptin cDNA and its expression in E. coli
Qi Kemin, Ding Zongyi, Fan Zhenghong, et al
【摘要】 目的 为获得大量人肥胖抑素(leptin)以便对其理化特性、生物学功能及其在肥胖发生中的作用进行深入的探讨。方法 作者从人脂肪细胞中提取总RNA,经逆转录聚合酶链反应(RT-PCR)获得了人leptin cDNA;通过体外DNA重组技术,以pBV220为表达载体构建重组表达质粒pBV220-leptin,经酶切及序列分析所证实。然后将重组表达质粒转化大肠杆菌DH5α(E. coli DH5α)进行表达。结果 经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,含有重组表达质粒的菌株表达出了特异性的16 ku蛋白质,其产量占总菌体蛋白的31%~47%,重组蛋白主要以包涵体形式存在。结论 人leptin重组表达系统的构建是成功的。
, http://www.100md.com
Cloning of human leptin cDNA and its expression in E. coli Qi Kemin*, Ding Zongyi, Fan
Zhenghong, et al. *Institute of Pediatric Research of Beijing, Beijing 100045
【Abstract】 Objective To obtain human leptin and to investigate its characteristics, biological function and its relation to obesity. Methods Human leptin cDNA fragment was obtained by reverse transcription-polymerase chain reaction (RT-PCR) with total RNA extracted from human adipocytes and the recombinant expressing plasmid pBV220-Leptin was constructed. The recombinant plasmid was confirmed by restriction endonuclease digestion and DNA sequencing. Results SDS-PAGE analysis showed that E. coli DH5α containing the recombinant plasmid could produce a kind of protein of 16ku which amounted to 31%~47% of total cellular proteins. Conclusion The results suggest that the construction of human leptin expressing plasmid is successful.
, 百拇医药
【Key words】 Proteins Cloning,molecular DNA, complementary Escherichia coli
肥胖基因(obese gene, ob)是两年前被成功克隆的一种肥胖相关性基因,普遍存在于脊椎动物体内,具有高度保守性。对肥胖鼠的研究表明,ob基因突变致肥胖抑素(leptin)不表达或无功能表达以及leptin受体异常均可引起肥胖表型,但是关于leptin在人类肥胖发生中的作用尚不清楚。目前外源性重组leptin的应用已取得显著效果,具体表现在它不仅使内源性leptin缺乏的突变系C57 BL/6J ob/ob小鼠体重下降,而且对后天饮食诱发的肥胖鼠亦有同样的减重效果[1~3],这使人们看到了应用leptin治疗肥胖症的可喜前景。基于这一现状,我们对中国人leptin cDNA进行了克隆,并将其在大肠杆菌中表达,为进一步探讨肥胖发生的机制和leptin的临床应用奠定基础。
, 百拇医药
材料及方法
一、材料
1.脂肪组织:取一例正常体重的急性阑尾炎患儿(男性、12岁、汉族)腹壁脂肪组织,总量800 mg。取出后置-70℃保存,在一周内使用。
2.质粒及菌株:表达质粒pBV220及大肠杆菌DH5α(E. coli DH5α)均由北京大学生命科学学院蛋白质工程国家重点实验室保存。
3.工具酶及试剂:限制性内切酶EcoRI、BamHI及Taq DNA聚合酶购自华美生物工程公司,T4 DNA连接酶及禽源反转录酶购自Promega公司,[α-35S]dATP(370 kBq/μl)购自美国NEN公司。总RNA提取试剂盒TRIzo1 Reagent为Life Tech公司产品,DNA序列分析所用试剂为Pharmacia公司的T7 SequencingTMKit。其余均为分析纯。
, 百拇医药
二、方法
1.寡核苷酸引物合成:根据已报道的人ob基因编码区序列[4,5],针对+178→+618区段设计了5′和3′端两个引物,并分别加上EcoRI和BamHI酶切位点,引物由上海Sangon生物工程公司合成。引物1(5′端引物):5′GC GAA TTC CGG ATG GTG CCT ATC CAA AAA 3′;引物2(3′端引物):5′GC GGA TCC TCA GCA CCC AGG GCT 3′。
2.脂肪组织总RNA的制备:取脂肪组织50~100 mg,加入1 ml TRIzol溶液,冰浴中匀浆数次后静置5分钟,加入200 μl氯仿,快速振荡15秒钟后冰浴放置3分钟,4℃ 12 000 r/min离心15分钟;吸取水相,加入0.5 ml异丙醇,冰浴10分钟沉淀RNA;同样条件离心10分钟,弃水相,沉淀用1 ml70%乙醇洗一次后真空抽干,溶于25 μl无RNA酶的水中,立即进行逆转录反应。同时琼脂糖凝胶电泳检查所提取RNA的质量。
, 百拇医药
3.逆转录-聚合酶链反应(RT-PCR):取5 μl所提取的脂肪细胞总RNA,以引物2为逆转录的起始引物,在30 U的禽源逆转录酶的作用下反应1.5小时,95℃灭活5分钟终止反应,然后进行逆转录产物的PCR扩增。PCR反应条件:94℃变性1分钟,55℃退火1分钟,72℃延伸1分钟,共进行35个循环,最后一轮反应结束,72℃继续延伸10分钟,以使反应进行彻底[5,6]。
4.DNA重组:质粒提取、酶切反应及连接反应均按常规方法进行[5,6];酶切DNA片段的回收采用北京联华生物工程公司生产的DNA快速纯化试剂盒PURIGENE KIT。
5.重组DNA的转化及重组子的筛选和鉴定:E.coli DH5α感受态细胞的制备采用氯化钙法。重组DNA转化按文献[6]方法进行。重组子筛选鉴定采用酶切和表达筛选,将重组质粒进行EcoRI和BamHI双酶切,筛选出能被切下463bp DNA片段的重组子,然后转化宿主菌E.coli DH5α诱导表达,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),根据能否表达出16 ku特异性蛋白条带再做重组子的最后鉴定。
, 百拇医药
6.DNA序列分析:采用双脱氧链终止法[6]:以重组pBV220为模板,从5′和3′端同时进行序列测定,引物使用本实验中合成的引物1和2。具体操作按试剂盒提供方法。
7.重组子的诱导表达:挑取转化的单菌落,300 μl 2-YT(Amp+)培养液30℃振荡培养过夜,加入3 ml同样培养液30℃振荡培养2~3小时,42℃诱导4~6小时。表达产物直接进行全蛋白15%SDS-PAGE检查。
8.紫外薄层扫描分析:SDS-PAGE凝胶经考马斯亮蓝R250染色后,利用紫外薄层扫描分析目的蛋白在总蛋白中的含量。
结 果
一、RT-PCR获取人leptin基因片段
, http://www.100md.com 对从脂肪细胞中所提取的总RNA进行琼脂糖凝胶电泳,结果可见28S和18S RNA条带,表明抽提的总RNA是完整的。以总RNA为模板逆转录后进行PCR反应,得到一大约463bp长的扩增产物(图1),与leptin cDNA大小一致。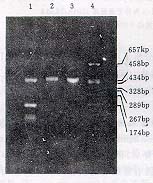
1,2,3为RT-PCR扩增DNA片段;4为分子量
标准pGEM-7Zf(+)/HaeⅢ
图1 RT-PCR产物1.5%琼脂糖凝胶电泳
二、人leptin表达载体的构建及鉴定
, http://www.100md.com
对pBV220及leptin cDNA片段同时进行EcoRI和BamHI双酶切反应,再用T4 DNA连接酶将目的基因片段与pBV220相连接,然后转化E.coli DH5α感受态细胞,即得到人leptin的表达质粒。重组子经EcoRI和BamHI双酶切,得到两个DNA片段,其中一个大小约463 bp,与leptin cDNA相符合(图2);诱导表达后菌体总蛋白的SDS-PAGE显示在16ku处有一特异性条带(图3);序列分析显示克隆到pBV220中的DNA片段包含了人leptin的完整编码区域。
三、人leptin基因序列分析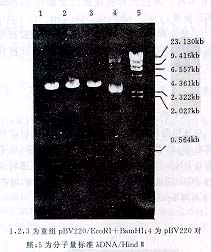 1,2,3为重组pBV220/EcoRI+BamHI;4为pBV220对
1,2,3为重组pBV220/EcoRI+BamHI;4为pBV220对
照;5为分子量标准λDNA/HindⅢ
, 百拇医药
图2 重组子的酶切筛选图谱 序列分析显示,克隆到pBV220中的cDNA片段长度为444bp(包含翻译起始与终止密码),包含了人leptin的全部编码区域。核苷酸序列与其他学者报道一致[1,5]。
四、重组人leptin在大肠杆菌中的表达
携有人leptin表达质粒的宿主菌E.coli DH5α经温度诱导后,菌体裂解物进行SDS-PAGE电泳,结果显示携有重组表达质粒的受体菌在约16 ku位置处有一特异条带。薄层扫描显示leptin表达量占菌体总蛋白的31%~47%,达到了高效表达(图3)。表达产物主要以包涵体形式存在。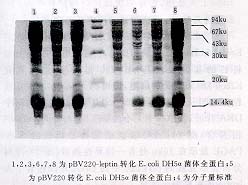
, http://www.100md.com
1,2,3,6,7,8为pBV220-leptin转化E.coli DH5α菌体全蛋白;5
为pBV220转化E.coli DH5α菌体全蛋白;4为分子量标准
图3 表达蛋白SDS-PAGE分析
讨论
多年来,肥胖症的病因及发生机制一直是人们致力研究的主要难题,ob基因的成功克隆使这一问题有了突破性进展。1994年底Friedman研究小组利用定位克隆(positional cloning)方法首先在C57BL/6J ob/ob小鼠第6号染色体近端的小眼基因和Waved-1基因丛中发现了ob基因突变,并将其克隆,同时在人类亦发现了其同源性序列。ob基因cDNA全长504bp,编码产生167个氨基酸组成的蛋白质分子。leptin是这种表达初产物在由脂肪细胞分泌入血循环的过程中被切割掉含21个氨基酸的N-端信号肽而生成的生物活性蛋白,分子量为16 ku,具有内分泌激素特性,主要通过作用于下丘脑部位特异性受体发挥其对食欲、能量代谢及性生殖功能等方面的调控。进一步研究发现,日本人以及30%的野生型C57BL/6J小鼠的ob基因编码区存在第49位谷氨酰胺(glutamine, Gln)密码子的缺失,导致表达蛋白中少一个氨基酸[1,4]。因此,在正常的脊椎动物中ob基因及其表达蛋白实际上存在两种形式,即Gln缺失型与Gln非缺失型。本组研究采用RT-PCR技术从人脂肪细胞中克隆到了leptin cDNA,序列分析显示编码第49位Gln的密码子CAG是存在的,属非缺失型,与其他学者的研究结果相同[1,5]。上述现象发生的原因及两种形式蛋白质的结构与功能是否存在差异,还有待进一步探讨。
, 百拇医药
自从70年代用基因工程技术在实验室获得了表达成功的肽类以来,基因工程产品越来越受到人们的重视。表达载体的选择直接影响到蛋白的表达水平。温度诱导型表达质粒pBV220已成功地表达了人γ-干扰素、人白细胞介素-2、人肿瘤坏死因子、超氧化物歧化酶以及人胰岛素原等外源性基因[7]。因此我们选择此质粒,构建人leptin的表达载体,经酶切鉴定及序列分析筛选出重组子,转化E. coli DH5α诱导特异性蛋白的表达。对人leptin的特性研究表明,内源性leptin的分子量为15.90 ku,重组leptin由于N-端多一个起始密码子编码的甲硫氨酸而稍有增加,为16.07 ku[8]。这与我们的重组子转化E.coli DH5α诱导表达的特异蛋白的分子量相一致,表明所构建的人leptin表达载体系统是成功的;同时特异蛋白的表达效率在31%~47%,实现了高效表达。进一步的研究工作是表达蛋白的后加工及分离纯化,得到有生物活性的leptin,以便探讨其在肥胖发生中的作用及leptin的临床应用。 参考文献
, 百拇医药
1Zhang YY, Poenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its
human homologue. Nature, 1994, 372:425-432.
2Considine RV, Caro JF. Leptin in humans: current progress and future directions. Clin Chem, 1996, 42:843-844.
3Bray GA, Leptin and leptinomania. Lancet, 1996, 348:140-141.
4Masuzaki H, Ogarva V, Isse N, et al. Human obese gene expression. Diabetes, 1995, 44:855-858.
, 百拇医药
5Considine RV, Considine EL, Williams CJ, et al. Evidence against either a premature stop
codon or the absence of obese gene mRNA in human obesity. J Clin Invest, 1995, 95:2986-2988.
6Sambrook J, Fritch EF, Maniatis T. Molecular cloning: a laborary mannual 2nd ed. New York: CSH,1989, 13-17.
7Jianguo Tang, Meihao HU. Production of human proinsulin in E. coli in a non-fusion form.
Biotechnology letters, 1993, 15:661-663.
8Cohen SL, Halaas JL, Friedman JM. Human leptin characterization. Nature, 1996, 382:589-591.
(收稿:1997-08-06 修回:1997-09-29), 百拇医药
单位:100045 北京儿科研究所(齐可民、丁宗一、樊征鸿、周红、江载芳);北京大学生命科学学院(唐建国)
关键词:蛋白质类;;克隆;分子;;DNA;互补;;;大肠杆菌
论著 Cloning of human leptin cDNA and its expression in E. coli
Qi Kemin, Ding Zongyi, Fan Zhenghong, et al
【摘要】 目的 为获得大量人肥胖抑素(leptin)以便对其理化特性、生物学功能及其在肥胖发生中的作用进行深入的探讨。方法 作者从人脂肪细胞中提取总RNA,经逆转录聚合酶链反应(RT-PCR)获得了人leptin cDNA;通过体外DNA重组技术,以pBV220为表达载体构建重组表达质粒pBV220-leptin,经酶切及序列分析所证实。然后将重组表达质粒转化大肠杆菌DH5α(E. coli DH5α)进行表达。结果 经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,含有重组表达质粒的菌株表达出了特异性的16 ku蛋白质,其产量占总菌体蛋白的31%~47%,重组蛋白主要以包涵体形式存在。结论 人leptin重组表达系统的构建是成功的。
, http://www.100md.com
Cloning of human leptin cDNA and its expression in E. coli Qi Kemin*, Ding Zongyi, Fan
Zhenghong, et al. *Institute of Pediatric Research of Beijing, Beijing 100045
【Abstract】 Objective To obtain human leptin and to investigate its characteristics, biological function and its relation to obesity. Methods Human leptin cDNA fragment was obtained by reverse transcription-polymerase chain reaction (RT-PCR) with total RNA extracted from human adipocytes and the recombinant expressing plasmid pBV220-Leptin was constructed. The recombinant plasmid was confirmed by restriction endonuclease digestion and DNA sequencing. Results SDS-PAGE analysis showed that E. coli DH5α containing the recombinant plasmid could produce a kind of protein of 16ku which amounted to 31%~47% of total cellular proteins. Conclusion The results suggest that the construction of human leptin expressing plasmid is successful.
, 百拇医药
【Key words】 Proteins Cloning,molecular DNA, complementary Escherichia coli
肥胖基因(obese gene, ob)是两年前被成功克隆的一种肥胖相关性基因,普遍存在于脊椎动物体内,具有高度保守性。对肥胖鼠的研究表明,ob基因突变致肥胖抑素(leptin)不表达或无功能表达以及leptin受体异常均可引起肥胖表型,但是关于leptin在人类肥胖发生中的作用尚不清楚。目前外源性重组leptin的应用已取得显著效果,具体表现在它不仅使内源性leptin缺乏的突变系C57 BL/6J ob/ob小鼠体重下降,而且对后天饮食诱发的肥胖鼠亦有同样的减重效果[1~3],这使人们看到了应用leptin治疗肥胖症的可喜前景。基于这一现状,我们对中国人leptin cDNA进行了克隆,并将其在大肠杆菌中表达,为进一步探讨肥胖发生的机制和leptin的临床应用奠定基础。
, 百拇医药
材料及方法
一、材料
1.脂肪组织:取一例正常体重的急性阑尾炎患儿(男性、12岁、汉族)腹壁脂肪组织,总量800 mg。取出后置-70℃保存,在一周内使用。
2.质粒及菌株:表达质粒pBV220及大肠杆菌DH5α(E. coli DH5α)均由北京大学生命科学学院蛋白质工程国家重点实验室保存。
3.工具酶及试剂:限制性内切酶EcoRI、BamHI及Taq DNA聚合酶购自华美生物工程公司,T4 DNA连接酶及禽源反转录酶购自Promega公司,[α-35S]dATP(370 kBq/μl)购自美国NEN公司。总RNA提取试剂盒TRIzo1 Reagent为Life Tech公司产品,DNA序列分析所用试剂为Pharmacia公司的T7 SequencingTMKit。其余均为分析纯。
, 百拇医药
二、方法
1.寡核苷酸引物合成:根据已报道的人ob基因编码区序列[4,5],针对+178→+618区段设计了5′和3′端两个引物,并分别加上EcoRI和BamHI酶切位点,引物由上海Sangon生物工程公司合成。引物1(5′端引物):5′GC GAA TTC CGG ATG GTG CCT ATC CAA AAA 3′;引物2(3′端引物):5′GC GGA TCC TCA GCA CCC AGG GCT 3′。
2.脂肪组织总RNA的制备:取脂肪组织50~100 mg,加入1 ml TRIzol溶液,冰浴中匀浆数次后静置5分钟,加入200 μl氯仿,快速振荡15秒钟后冰浴放置3分钟,4℃ 12 000 r/min离心15分钟;吸取水相,加入0.5 ml异丙醇,冰浴10分钟沉淀RNA;同样条件离心10分钟,弃水相,沉淀用1 ml70%乙醇洗一次后真空抽干,溶于25 μl无RNA酶的水中,立即进行逆转录反应。同时琼脂糖凝胶电泳检查所提取RNA的质量。
, 百拇医药
3.逆转录-聚合酶链反应(RT-PCR):取5 μl所提取的脂肪细胞总RNA,以引物2为逆转录的起始引物,在30 U的禽源逆转录酶的作用下反应1.5小时,95℃灭活5分钟终止反应,然后进行逆转录产物的PCR扩增。PCR反应条件:94℃变性1分钟,55℃退火1分钟,72℃延伸1分钟,共进行35个循环,最后一轮反应结束,72℃继续延伸10分钟,以使反应进行彻底[5,6]。
4.DNA重组:质粒提取、酶切反应及连接反应均按常规方法进行[5,6];酶切DNA片段的回收采用北京联华生物工程公司生产的DNA快速纯化试剂盒PURIGENE KIT。
5.重组DNA的转化及重组子的筛选和鉴定:E.coli DH5α感受态细胞的制备采用氯化钙法。重组DNA转化按文献[6]方法进行。重组子筛选鉴定采用酶切和表达筛选,将重组质粒进行EcoRI和BamHI双酶切,筛选出能被切下463bp DNA片段的重组子,然后转化宿主菌E.coli DH5α诱导表达,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),根据能否表达出16 ku特异性蛋白条带再做重组子的最后鉴定。
, 百拇医药
6.DNA序列分析:采用双脱氧链终止法[6]:以重组pBV220为模板,从5′和3′端同时进行序列测定,引物使用本实验中合成的引物1和2。具体操作按试剂盒提供方法。
7.重组子的诱导表达:挑取转化的单菌落,300 μl 2-YT(Amp+)培养液30℃振荡培养过夜,加入3 ml同样培养液30℃振荡培养2~3小时,42℃诱导4~6小时。表达产物直接进行全蛋白15%SDS-PAGE检查。
8.紫外薄层扫描分析:SDS-PAGE凝胶经考马斯亮蓝R250染色后,利用紫外薄层扫描分析目的蛋白在总蛋白中的含量。
结 果
一、RT-PCR获取人leptin基因片段
, http://www.100md.com 对从脂肪细胞中所提取的总RNA进行琼脂糖凝胶电泳,结果可见28S和18S RNA条带,表明抽提的总RNA是完整的。以总RNA为模板逆转录后进行PCR反应,得到一大约463bp长的扩增产物(图1),与leptin cDNA大小一致。

1,2,3为RT-PCR扩增DNA片段;4为分子量
标准pGEM-7Zf(+)/HaeⅢ
图1 RT-PCR产物1.5%琼脂糖凝胶电泳
二、人leptin表达载体的构建及鉴定
, http://www.100md.com
对pBV220及leptin cDNA片段同时进行EcoRI和BamHI双酶切反应,再用T4 DNA连接酶将目的基因片段与pBV220相连接,然后转化E.coli DH5α感受态细胞,即得到人leptin的表达质粒。重组子经EcoRI和BamHI双酶切,得到两个DNA片段,其中一个大小约463 bp,与leptin cDNA相符合(图2);诱导表达后菌体总蛋白的SDS-PAGE显示在16ku处有一特异性条带(图3);序列分析显示克隆到pBV220中的DNA片段包含了人leptin的完整编码区域。
三、人leptin基因序列分析
 1,2,3为重组pBV220/EcoRI+BamHI;4为pBV220对
1,2,3为重组pBV220/EcoRI+BamHI;4为pBV220对照;5为分子量标准λDNA/HindⅢ
, 百拇医药
图2 重组子的酶切筛选图谱 序列分析显示,克隆到pBV220中的cDNA片段长度为444bp(包含翻译起始与终止密码),包含了人leptin的全部编码区域。核苷酸序列与其他学者报道一致[1,5]。
四、重组人leptin在大肠杆菌中的表达
携有人leptin表达质粒的宿主菌E.coli DH5α经温度诱导后,菌体裂解物进行SDS-PAGE电泳,结果显示携有重组表达质粒的受体菌在约16 ku位置处有一特异条带。薄层扫描显示leptin表达量占菌体总蛋白的31%~47%,达到了高效表达(图3)。表达产物主要以包涵体形式存在。

, http://www.100md.com
1,2,3,6,7,8为pBV220-leptin转化E.coli DH5α菌体全蛋白;5
为pBV220转化E.coli DH5α菌体全蛋白;4为分子量标准
图3 表达蛋白SDS-PAGE分析
讨论
多年来,肥胖症的病因及发生机制一直是人们致力研究的主要难题,ob基因的成功克隆使这一问题有了突破性进展。1994年底Friedman研究小组利用定位克隆(positional cloning)方法首先在C57BL/6J ob/ob小鼠第6号染色体近端的小眼基因和Waved-1基因丛中发现了ob基因突变,并将其克隆,同时在人类亦发现了其同源性序列。ob基因cDNA全长504bp,编码产生167个氨基酸组成的蛋白质分子。leptin是这种表达初产物在由脂肪细胞分泌入血循环的过程中被切割掉含21个氨基酸的N-端信号肽而生成的生物活性蛋白,分子量为16 ku,具有内分泌激素特性,主要通过作用于下丘脑部位特异性受体发挥其对食欲、能量代谢及性生殖功能等方面的调控。进一步研究发现,日本人以及30%的野生型C57BL/6J小鼠的ob基因编码区存在第49位谷氨酰胺(glutamine, Gln)密码子的缺失,导致表达蛋白中少一个氨基酸[1,4]。因此,在正常的脊椎动物中ob基因及其表达蛋白实际上存在两种形式,即Gln缺失型与Gln非缺失型。本组研究采用RT-PCR技术从人脂肪细胞中克隆到了leptin cDNA,序列分析显示编码第49位Gln的密码子CAG是存在的,属非缺失型,与其他学者的研究结果相同[1,5]。上述现象发生的原因及两种形式蛋白质的结构与功能是否存在差异,还有待进一步探讨。
, 百拇医药
自从70年代用基因工程技术在实验室获得了表达成功的肽类以来,基因工程产品越来越受到人们的重视。表达载体的选择直接影响到蛋白的表达水平。温度诱导型表达质粒pBV220已成功地表达了人γ-干扰素、人白细胞介素-2、人肿瘤坏死因子、超氧化物歧化酶以及人胰岛素原等外源性基因[7]。因此我们选择此质粒,构建人leptin的表达载体,经酶切鉴定及序列分析筛选出重组子,转化E. coli DH5α诱导特异性蛋白的表达。对人leptin的特性研究表明,内源性leptin的分子量为15.90 ku,重组leptin由于N-端多一个起始密码子编码的甲硫氨酸而稍有增加,为16.07 ku[8]。这与我们的重组子转化E.coli DH5α诱导表达的特异蛋白的分子量相一致,表明所构建的人leptin表达载体系统是成功的;同时特异蛋白的表达效率在31%~47%,实现了高效表达。进一步的研究工作是表达蛋白的后加工及分离纯化,得到有生物活性的leptin,以便探讨其在肥胖发生中的作用及leptin的临床应用。 参考文献
, 百拇医药
1Zhang YY, Poenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its
human homologue. Nature, 1994, 372:425-432.
2Considine RV, Caro JF. Leptin in humans: current progress and future directions. Clin Chem, 1996, 42:843-844.
3Bray GA, Leptin and leptinomania. Lancet, 1996, 348:140-141.
4Masuzaki H, Ogarva V, Isse N, et al. Human obese gene expression. Diabetes, 1995, 44:855-858.
, 百拇医药
5Considine RV, Considine EL, Williams CJ, et al. Evidence against either a premature stop
codon or the absence of obese gene mRNA in human obesity. J Clin Invest, 1995, 95:2986-2988.
6Sambrook J, Fritch EF, Maniatis T. Molecular cloning: a laborary mannual 2nd ed. New York: CSH,1989, 13-17.
7Jianguo Tang, Meihao HU. Production of human proinsulin in E. coli in a non-fusion form.
Biotechnology letters, 1993, 15:661-663.
8Cohen SL, Halaas JL, Friedman JM. Human leptin characterization. Nature, 1996, 382:589-591.
(收稿:1997-08-06 修回:1997-09-29), 百拇医药