小鼠脑内兴奋性氨基酸的体外微透析法测定*
作者:侯燕芝 吕国蔚
单位:首都医科大学神经生物学系(北京100054)
关键词:
小鼠脑内兴奋性氨基酸的体外微透析法测定 在动物缺血缺氧性脑损伤的研究中,有关脑内兴奋性氨基酸毒性的研究近年来取得了很大进展。许多证据表明,缺血缺氧可导致动物脑内兴奋性氨基酸持续升高,细胞膜上离子通道病理性开放,细胞内Ca2+超载,最后造成急性期神经元水肿和退变[1,2]。因此,对脑内兴奋性氨基酸含量的测定已成为目前研究缺血缺氧性脑损伤及内源性保护机制的重要手段之一。为了深入研究缺血缺氧性脑损伤的机制,以及内源性的缺血缺氧耐受机制,我们建立了小鼠脑内兴奋性氨基酸的体外微透析-高效液相色谱(high performance liquid chromatograph, HPLC)快速测定方法,并应用于急性重复缺氧小鼠研究中。
, 百拇医药
材料与方法
(一)仪器:1050 A型液相色谱仪,美国惠普公司(Hewllet-Packard)产品。WZS-50型微量注射机(灵敏度:±5 μL/h)浙江医科大学医疗器械厂产品。
(二)试剂:氨基酸标准品、邻苯二甲醛(o-phthaldialdehyde, OPA)、硼酸为美国Sigma公司产品,巯基乙醇、甲醇、无水乙酸钠等均为国产分析纯试剂。
(三)样品制备:1.急性重复缺氧动物样品的制备:将昆明小鼠(体重16.00~22.00 g)置于含有新鲜空气,经过标定的125 mL广口瓶中,以橡皮塞密闭,一出现喘呼吸立即取出,并随即转移到另一相似体积的、含有新鲜空气的广口瓶中,密闭。如此重复1次或4次后立即断头,将鼠头迅速置于液氮罐中,隔夜取出。冰浴条件下取脑组织约400 mg,加入冰冷的超纯水1.5 mL,匀浆。匀浆液立即置于4℃保存,4 h内透析。2.空白对照样品的制备:空白对照组动物除不经缺氧处理外其它处理同缺氧组。
, 百拇医药
(四)微透析实验:1.微透析探头:选用瑞典Camegie Medicine公司生产的CMA/10型同心圆微透析探头,透析膜长4 mm,外直径0.5 mm。2.透析探头体外回收率的测定:将透析探头分别置于不同浓度的氨基酸标准混合液中,用微注射机以1.0 μL/min速度向探头内灌流生理盐水,在0~4℃条件下收集透析液,用HPLC法测定透析液中谷氨酸(glutamate, Glu)与天门冬氨酸(aspartate, Asp)含量,观察探头外氨基酸浓度对探头回收率的影响。3.样品的微量透析:制备好的小鼠脑匀浆液样品置于冰盒内,透析探头置于样品中,以1.0 μL/min速度连续灌流生理盐水,在0~4℃条件下收集到的透析液立即置于4℃保存。
(五)样品的HPLC法测定:1.氨基酸标准液和衍生化试剂的配制:用0.5 mol/L盐酸溶液配制含22种氨基酸的标准溶液,4℃保存。衍生化试剂:10 mg OPA溶于0.25 mL甲醇中,再加入20 μL β-巯基乙醇和2 mL 0.2 mol/L硼酸缓冲液(pH 9.5)混匀,4℃保存,24 h后使用。每隔1 d补加10 μL β-巯基乙醇,1星期内使用。2.色谱条件及衍生化反应:柱:Nova Pak C18色谱柱(Waters),150 mm×3.9 mm i.d.,粒径4 μm,柱温:40℃,流速:0.8 mL/min,流动相组成:A液为0.1 mol/L,乙酸钠缓冲液(pH 6.95)内含8%甲醇;B液为甲醇。样品采用自动进样器自动进样,进样程序及衍生化反应为:(1)洗针,(2)吸取OPA 20 μL, (3)吸取样品20 μL,(4)混和20次(时间60 s),(5)进样40 μL。样品采用下述梯度洗脱程序快速洗脱:0~7 min,100% A液;7~9 min,100% B液;9~10 min,100% A液。荧光检测器激发波长360 nm,发射波长455 nm处检测样品中Glu与Asp的含量并以外标法定量。
, 百拇医药
结 果
(一)微透析探头的体外回收率:以1.0 μL/min速度灌流微透析探头,随着氨基酸标准混合液浓度的增高,探头回收率逐渐降低,在0.01~10.00 mmol/L的溶液中,回收率可达30.0%(Glu)和33.4%(Asp)。
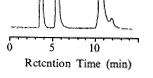
(二)HPLC色谱图:用本研究的HPLC法测定标准氨基酸混和液中Glu与Asp的含量,得到的色谱图如图1所示。
(三)线性范围与最小检测浓度:用HPLC法测定氨基酸标准混合液,以测得的Glu与Asp峰面积为纵坐标,含量为横坐标绘制工作曲线,两种物质的线性范围在0.01~10.00 mmol/L之间,相关系数分别为Glu∶r=0.996,Asp∶r=0.995,最小检测浓度达0.001 mmol/L。
, http://www.100md.com
Fig 1 Chromatograms of an amino acid standard mixture
图1 氨基酸标准混合液色谱图
(四)精密度与重复性:动物重复缺氧脑匀浆透析样品,平行管测定其中Glu与Asp的日内与日间变异系数(coefficient of variation, CV)及样品中两种氨基酸含量,并按峰面积统计,结果见表1。
(五)回收率试验:本底(blank):1 mL重复缺氧动物脑匀浆液+1 mL超纯水,混匀;标准(Std):以1 mL 1.00 mmol/L标准氨基酸混合液代替blank中脑匀浆液;标准加入(add):以1 mL 1.00 mmol/L标准氨基酸混合液代替blank中超纯水,以上3种混合液均经微透析处理,收集到的透析液分别进行HPLC分析,结果按下式计算:
, 百拇医药
详细结果见表1所示。
表1 精密度、重复性与回收率
Tab 1 Accuracy, repetition and recovery rate
Amino
acid
In the daytime
In the days
Recovery rate
x±s
CV(%)
x±s
, 百拇医药
CV(%)
(%)
Clu
167.87±3.92
2.34
172.23±4.48
2.51
95.2
Asp
99.97±2.68
2.68
104.22±3.10
, 百拇医药
2.98
104.1
x±s;: mean of peak area (n=10). 讨 论
国内外对缺血缺氧期间小鼠脑内Glu与Asp的测定多半采用脑匀浆液有机沉淀去蛋白、离心、过滤前处理后,再进行化学测定[3],其样品的化学前处理不仅复杂而且样品损失大。近几年来,国外报道应用一种新的生物化学样品收集技术研究动物脑缺血缺氧期间脑内兴奋性氨基酸的改变[4],我们也已建立了家兔脑内腺苷的微透析测定方法,并应用于脑缺血研究中[5],但目前这一技术多用于动物的在体实验中,而用于缺氧小鼠体外研究中尚未见报道。在本研究室开展的小鼠自身密闭重复缺氧耐受实验中,由于采用的动物模型个体太小,实验时动物剧烈翻滚,因此在体微透析技术无法直接应用于检测小鼠脑内兴奋性氨基酸含量的改变,本研究将脑内微透析技术加以扩展,应用于急性重复缺氧小鼠脑匀浆样品处理中,在对样品不进行任何化学前处理的情况下,直接对样品进行体外的微量透析,收集的透析液,直接用本文的HPLC法进行分析测定,结果表明,在本HPLC色谱条件下,样品中的Glu与Asp能很好地分离,峰形对称性好,保留时间恒定,检出时间仅需7 min,杂质峰可在检测峰后3~8 min内全部洗脱掉,其方法简单易行,并具较好的重现性与较高回收率,测得数据与我们用常规方法测定的结果基本一致。与其他HPLC方法相比,特别适合于Glu与Asp的快速检测分离。此外,本研究所获得的微透析探头对标准氨基酸的体外回收率显著高于国外类似实验结果[4]。综上所述,本方法较适合应用于不易直接采用在体微透析技术进行检测的实验及小型动物中,对不具备大型冷冻超速离心机的实验室,也提供了一个新的样品处理方法。
, 百拇医药
* 国家自然科学基金资助(No. 39670271)
参考文献
1 Rothman SM, Olney JW. Glutamate and the pathophysiology of hypoxic-ischemic brain damage. Ann Neurol, 1986,19(2):105.
2 肖卫兵.缺血性脑损伤和谷氨酸.生理科学进展,1994,25(4):323.
3 朱剑琴,李春宝,王新昌.脑内游离氨基酸的微量测定.生物化学学报,1981,5(1):61.
4 Globus MY, Busto R, Dietrich WD, et al. Effect of ischemia on the in vivo release of striatal dopamine, glutamate, and γ-aminobutyric acid studied by intracerebral microdialysis. J Neurochem, 1988,51(5):1455.
5 Hou YZ, Lu GW. Changes in extracellular adenosine in the rabbit striatum and cerebral cortex during incomplete cerebral ischemia. 中国病理生理杂志,1997,13(3):225.
(1998年6月1日收稿,1998年11月16日修回), 百拇医药
单位:首都医科大学神经生物学系(北京100054)
关键词:
小鼠脑内兴奋性氨基酸的体外微透析法测定 在动物缺血缺氧性脑损伤的研究中,有关脑内兴奋性氨基酸毒性的研究近年来取得了很大进展。许多证据表明,缺血缺氧可导致动物脑内兴奋性氨基酸持续升高,细胞膜上离子通道病理性开放,细胞内Ca2+超载,最后造成急性期神经元水肿和退变[1,2]。因此,对脑内兴奋性氨基酸含量的测定已成为目前研究缺血缺氧性脑损伤及内源性保护机制的重要手段之一。为了深入研究缺血缺氧性脑损伤的机制,以及内源性的缺血缺氧耐受机制,我们建立了小鼠脑内兴奋性氨基酸的体外微透析-高效液相色谱(high performance liquid chromatograph, HPLC)快速测定方法,并应用于急性重复缺氧小鼠研究中。
, 百拇医药
材料与方法
(一)仪器:1050 A型液相色谱仪,美国惠普公司(Hewllet-Packard)产品。WZS-50型微量注射机(灵敏度:±5 μL/h)浙江医科大学医疗器械厂产品。
(二)试剂:氨基酸标准品、邻苯二甲醛(o-phthaldialdehyde, OPA)、硼酸为美国Sigma公司产品,巯基乙醇、甲醇、无水乙酸钠等均为国产分析纯试剂。
(三)样品制备:1.急性重复缺氧动物样品的制备:将昆明小鼠(体重16.00~22.00 g)置于含有新鲜空气,经过标定的125 mL广口瓶中,以橡皮塞密闭,一出现喘呼吸立即取出,并随即转移到另一相似体积的、含有新鲜空气的广口瓶中,密闭。如此重复1次或4次后立即断头,将鼠头迅速置于液氮罐中,隔夜取出。冰浴条件下取脑组织约400 mg,加入冰冷的超纯水1.5 mL,匀浆。匀浆液立即置于4℃保存,4 h内透析。2.空白对照样品的制备:空白对照组动物除不经缺氧处理外其它处理同缺氧组。
, 百拇医药
(四)微透析实验:1.微透析探头:选用瑞典Camegie Medicine公司生产的CMA/10型同心圆微透析探头,透析膜长4 mm,外直径0.5 mm。2.透析探头体外回收率的测定:将透析探头分别置于不同浓度的氨基酸标准混合液中,用微注射机以1.0 μL/min速度向探头内灌流生理盐水,在0~4℃条件下收集透析液,用HPLC法测定透析液中谷氨酸(glutamate, Glu)与天门冬氨酸(aspartate, Asp)含量,观察探头外氨基酸浓度对探头回收率的影响。3.样品的微量透析:制备好的小鼠脑匀浆液样品置于冰盒内,透析探头置于样品中,以1.0 μL/min速度连续灌流生理盐水,在0~4℃条件下收集到的透析液立即置于4℃保存。
(五)样品的HPLC法测定:1.氨基酸标准液和衍生化试剂的配制:用0.5 mol/L盐酸溶液配制含22种氨基酸的标准溶液,4℃保存。衍生化试剂:10 mg OPA溶于0.25 mL甲醇中,再加入20 μL β-巯基乙醇和2 mL 0.2 mol/L硼酸缓冲液(pH 9.5)混匀,4℃保存,24 h后使用。每隔1 d补加10 μL β-巯基乙醇,1星期内使用。2.色谱条件及衍生化反应:柱:Nova Pak C18色谱柱(Waters),150 mm×3.9 mm i.d.,粒径4 μm,柱温:40℃,流速:0.8 mL/min,流动相组成:A液为0.1 mol/L,乙酸钠缓冲液(pH 6.95)内含8%甲醇;B液为甲醇。样品采用自动进样器自动进样,进样程序及衍生化反应为:(1)洗针,(2)吸取OPA 20 μL, (3)吸取样品20 μL,(4)混和20次(时间60 s),(5)进样40 μL。样品采用下述梯度洗脱程序快速洗脱:0~7 min,100% A液;7~9 min,100% B液;9~10 min,100% A液。荧光检测器激发波长360 nm,发射波长455 nm处检测样品中Glu与Asp的含量并以外标法定量。
, 百拇医药
结 果
(一)微透析探头的体外回收率:以1.0 μL/min速度灌流微透析探头,随着氨基酸标准混合液浓度的增高,探头回收率逐渐降低,在0.01~10.00 mmol/L的溶液中,回收率可达30.0%(Glu)和33.4%(Asp)。
(二)HPLC色谱图:用本研究的HPLC法测定标准氨基酸混和液中Glu与Asp的含量,得到的色谱图如图1所示。
(三)线性范围与最小检测浓度:用HPLC法测定氨基酸标准混合液,以测得的Glu与Asp峰面积为纵坐标,含量为横坐标绘制工作曲线,两种物质的线性范围在0.01~10.00 mmol/L之间,相关系数分别为Glu∶r=0.996,Asp∶r=0.995,最小检测浓度达0.001 mmol/L。



, http://www.100md.com
Fig 1 Chromatograms of an amino acid standard mixture
图1 氨基酸标准混合液色谱图
(四)精密度与重复性:动物重复缺氧脑匀浆透析样品,平行管测定其中Glu与Asp的日内与日间变异系数(coefficient of variation, CV)及样品中两种氨基酸含量,并按峰面积统计,结果见表1。
(五)回收率试验:本底(blank):1 mL重复缺氧动物脑匀浆液+1 mL超纯水,混匀;标准(Std):以1 mL 1.00 mmol/L标准氨基酸混合液代替blank中脑匀浆液;标准加入(add):以1 mL 1.00 mmol/L标准氨基酸混合液代替blank中超纯水,以上3种混合液均经微透析处理,收集到的透析液分别进行HPLC分析,结果按下式计算:
, 百拇医药
详细结果见表1所示。
表1 精密度、重复性与回收率
Tab 1 Accuracy, repetition and recovery rate
Amino
acid
In the daytime
In the days
Recovery rate
x±s
CV(%)
x±s
, 百拇医药
CV(%)
(%)
Clu
167.87±3.92
2.34
172.23±4.48
2.51
95.2
Asp
99.97±2.68
2.68
104.22±3.10
, 百拇医药
2.98
104.1
x±s;: mean of peak area (n=10). 讨 论
国内外对缺血缺氧期间小鼠脑内Glu与Asp的测定多半采用脑匀浆液有机沉淀去蛋白、离心、过滤前处理后,再进行化学测定[3],其样品的化学前处理不仅复杂而且样品损失大。近几年来,国外报道应用一种新的生物化学样品收集技术研究动物脑缺血缺氧期间脑内兴奋性氨基酸的改变[4],我们也已建立了家兔脑内腺苷的微透析测定方法,并应用于脑缺血研究中[5],但目前这一技术多用于动物的在体实验中,而用于缺氧小鼠体外研究中尚未见报道。在本研究室开展的小鼠自身密闭重复缺氧耐受实验中,由于采用的动物模型个体太小,实验时动物剧烈翻滚,因此在体微透析技术无法直接应用于检测小鼠脑内兴奋性氨基酸含量的改变,本研究将脑内微透析技术加以扩展,应用于急性重复缺氧小鼠脑匀浆样品处理中,在对样品不进行任何化学前处理的情况下,直接对样品进行体外的微量透析,收集的透析液,直接用本文的HPLC法进行分析测定,结果表明,在本HPLC色谱条件下,样品中的Glu与Asp能很好地分离,峰形对称性好,保留时间恒定,检出时间仅需7 min,杂质峰可在检测峰后3~8 min内全部洗脱掉,其方法简单易行,并具较好的重现性与较高回收率,测得数据与我们用常规方法测定的结果基本一致。与其他HPLC方法相比,特别适合于Glu与Asp的快速检测分离。此外,本研究所获得的微透析探头对标准氨基酸的体外回收率显著高于国外类似实验结果[4]。综上所述,本方法较适合应用于不易直接采用在体微透析技术进行检测的实验及小型动物中,对不具备大型冷冻超速离心机的实验室,也提供了一个新的样品处理方法。
, 百拇医药
* 国家自然科学基金资助(No. 39670271)
参考文献
1 Rothman SM, Olney JW. Glutamate and the pathophysiology of hypoxic-ischemic brain damage. Ann Neurol, 1986,19(2):105.
2 肖卫兵.缺血性脑损伤和谷氨酸.生理科学进展,1994,25(4):323.
3 朱剑琴,李春宝,王新昌.脑内游离氨基酸的微量测定.生物化学学报,1981,5(1):61.
4 Globus MY, Busto R, Dietrich WD, et al. Effect of ischemia on the in vivo release of striatal dopamine, glutamate, and γ-aminobutyric acid studied by intracerebral microdialysis. J Neurochem, 1988,51(5):1455.
5 Hou YZ, Lu GW. Changes in extracellular adenosine in the rabbit striatum and cerebral cortex during incomplete cerebral ischemia. 中国病理生理杂志,1997,13(3):225.
(1998年6月1日收稿,1998年11月16日修回), 百拇医药