同种MHC基因胸腺转移诱导小鼠心肌移植耐受
作者:李锦华 唐 皓 余学清 陈永雄 张仕光
单位:李锦华 余学清 陈永雄 张仕光:肾内科;中山医科大学附属第一医院;唐皓:急诊科 (广州510080);
关键词:基因;转移;主要组织相容性复合物;免疫耐受;心脏移植
同种MHC基因胸腺转移诱导小鼠心肌移植耐受
摘 要 目的:通过胸腺内注射表达外源性主要组织相容性抗原复合物(MHC)抗原质粒PXN(N2-B19-H-2Kb) , 诱导异基因小鼠心肌移植耐受。方法:给BALB/C小鼠胸腺内注射质粒PXN(N2-B19-H-2Kb),将外源性的编码C57BL/6小鼠MHC I 类抗原的H-2KbcDNA转移到BALB/C小鼠胸腺,2周后行C57BL/6小鼠心肌移植。用聚合酶链反应(PCR),反转录聚合酶链反应(RT-PCR),单克隆抗体免疫萤光染色流式细胞仪检测BALB/C小鼠胸腺细胞DNA,mRNA和MHC蛋白质表达。结果: BALB/C小鼠胸腺细胞表面有外源性MHC分子表达,转染效率为5.1%,胸腺内注射质粒PXN(N2-B19-H-2Kb)能明显延长移植小鼠心肌的存活时间,平均17 d,对照为8 d (P<0.01)。结论:同种MHC基因转移至受体鼠胸腺可以诱导特异性的免疫耐受。
, http://www.100md.com
Transfer of allogenic MHC gene into thymus by retroviral vector induces tolerance
LI Jin-Hua1, TANG Hao2, YU Xue-Qing1, CHEN Yong-Xiong1, ZHANG Shi-Guang1
1 Department of Nephorology,2 Emergency Department,the First Affiliated Hospital,Sun Yat-Sen University of Medical Sciences,Guangzhou (510080)
Abstract AIM: A mice myocardium allograft tolerence model was constructed by intrathymic injection of retroviral vector PXN(N2-B19-H-2Kb)to express allogenice major histocompatibility complex(MHC). MEHTODS: Retroviral vector PXN(N2-B19-H-2Kb)was injected into BALA/C thymus directly to express MHC of C57BL/6(H-2Kb);after 14 days,myocardium of C57BL/6(H-2Kb) mice was transplantated into BALA/C mice;and the polymerase chain reaction (PCR) , the reverse transcription polymerase chain reaction (RT-PCR) and flow cytometry assays detected DNA,mRNA and MHC protein expression in thymocytes.RESULTS: Allogenic MHC gene had been integrated into the chromosomal DNA of BALA/C thymus and expressed stably; It induced mouse heart allograft tolerance, 17days vs 8 days;P<0.01. CONCLUSION: Allogenic MHC gene transferring into recipient thymus directly could induce allogenice mice tolerance.
, http://www.100md.com
MeSH Genes; Transfection; Major histocompatibility complex; Immune tolerance; Heart transplantation
移植排斥反应一直是困扰器官移植的主要问题之一。通过T细胞在胸腺内接触异基因蛋白质抗原而诱导特异性的免疫耐受是目前的研究的热点之一[1]。据此,我们运用基因转移技术,通过胸腺内注射表达外源性主要组织相容性抗原复合物(major histocompatibility complex ,MHC)抗原质粒PXN(N2-B19-H-2Kb) ,以小鼠心肌移植为模型,诱导特异性的免疫耐受,为免疫耐受提供理论和实验依据。
材料和方法
(一)材料:受体鼠BALB/C(H-2d),供体鼠C57BL/6(H-2b),第三无关供体鼠CBA/J(H-2k),皆雄性,6~8周龄(本校实验动物部); DOTAP(Boehringer Marmnnheim);DMEM细胞培养基、抗小鼠CD3单克隆抗体(GIBCO-BRL);ConA、丝裂霉素(Sigma);氚标记胸腺嘧啶核苷([3H]-TdR)3.7×107Bq/mL,比度7.4×1011Bq/mmol(中国原子能科学研究院);生物素标记抗H-2Kb单克隆抗体(Pharmingen);荧光素标记亲和素avidinFITC(SABC);表达供体鼠(H-2b)MHC I类抗原的逆转录病毒载体PNX(N2-B19-H-2Kb)质粒(美国国立卫生研究院Sandra Doren博士惠赠)。
, 百拇医药
(二)方法:
1.外源性MHC基因胸腺转移:麻醉BALB/C(H-2d)小鼠,仰卧位固定四肢及头部,在胸骨上窝正中切开皮肤,钝性分离至气管并沿气管向前直至暴露胸腺上极,MHC基因转移组每只小鼠注射PNX(N2-B19-H-2Kb)1.2 μg加DOTAP 2 μg 和DMEM 2 μL,对照组单纯注射DOTAP 2 μg加 DMEM 2 μL,缝合皮肤。
2.外源性MHC基因表达的检测:逆转录病毒载体及引物A、B和C见图1。胸腺注射后28 d,(1)按文献[2]提取DNA。以一对引物(引物B: 5'- GCT CTT TCT TTC TGG CTG CT -3'. 引物C: 5'-GCC AGA GAT CAC CTG AAT AGT GTG -3'.检测目的基因在小鼠胸腺细胞的整合。PCR:denaturation 93℃ 1 min, annealing 50 ℃ 1 min,extension 72 ℃ 2 min ,35 cycles,final extension 72 ℃ 5 min,产物409bp;(2)按文献[2]提取总RNA,反转录后以一对引物作PCR,引物A: 5'- TAT ATA GCA CGG CAC TGC CG-3'.C同上,产物 431bp。以一对引物(sense: 5'- CCT GGT CTT T CTG GTG CTT G -3', anti-sense: 5'- GCA TCA TGA TGC TTG ATC AC -3')扩增小鼠β2微球蛋白基因的mRNA作为阳性内参照,反转录后PCR方法同上,产物360bp;(3)取胸腺注射PNX(N2-B19-H-2Kb)的小鼠胸腺细胞,以对照组的小鼠胸腺细胞为零点,用抗H-2Kb单克隆抗体直接免疫荧光法染色,流式细胞仪检测目的基因在转染小鼠胸腺细胞上的表达。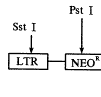
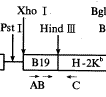
, http://www.100md.com
Fig 1 The PXN(N2-B19-H-2Kb )retroviral vector and locations of primer A,B and C
A: Location of the 5' B19 promoter primer for H-2Kb cDNA ,used for mRNA RT- PCR;B: Location of the 5' primer for H-2Kb cDNA ,used for DNA PCR;C: Location of the 3' primer for H-2Kb cDNA ,used for mRNA RT- PCR and DNA PCR 图1 逆转录病毒载体PXN(N2-B19-H-2Kb )结构图及引物A,B和C位置
(三)实验动物分组和小鼠心肌移植模型建立:供体鼠:将40只C57BL/6 小鼠随机分为4组:对照1组和对照2组胸腺注射DOTAP 2 μg加 DMEM 2 μL;第3组胸腺注射PNX(N2-B19-H-2Kb) 1.2 μg加DOTAP 2 μg 和DMEM 2 μL;第4组静脉注射PNX(N2-B19-H-2Kb)1.2 μg加DOTAP 2 μg 和DMEM 2 μL;第5组为第三供体组(CBA/6小鼠,10只)。受体鼠:皆BALB/C小鼠,50只随机分为5组。胸腺注射或静脉注射的当天及第3 d,除对照1组外,各组小鼠给予腹腔注射anti-CD3 monoclonal Ab 8.4 μg/mice,14 d后按文献[3]行小鼠心脏移植。术后第5 d用上海医用电子仪器厂68722型心电图机检测移植心肌心电活动,无心电者视为手术失败。以心电消失日为移植心肌存活的终止时间。
, 百拇医药
(四)小鼠脾细胞对丝裂原增殖反应的观察[4]:各组小鼠胸腺注射或静脉注射后第5周分离脾细胞,96孔板每孔加5×105细胞,设3个复孔,加入5.0 μg/mL(终浓度)ConA.用[3H]-TdR掺入法作脾细胞对丝裂原ConA的增值反应。常规收集细胞,测样本[3H]-TdR掺入率,以counts.min-1表示。
(五)小鼠混合淋巴细胞反应[5]:用[3H]-TdR掺入法分别作对供体和第三供体的单向混合淋巴细胞反应(mixed lymphocytes reaction,MLR):各组小鼠胸腺注射或静脉注射后第五周分离脾细胞,调细胞浓度为5×106/mL,作为MLR中的反应细胞,按5×105/孔加入96孔板, 设3复孔;另取丝裂霉素处理的C57BL/6或CBA/6小鼠脾细胞作为刺激细胞(5×105/孔).混合培养56 h后,加入用[3H]-TdR(1.85×107 Bq/孔).继续培养10 h,常规收集细胞,测样本[3?H]-TdR掺入率,以counts.min-1表示。
, 百拇医药
(六)统计处理: 实验数据以x±s表示。用多因素方差分析(ANOVA),继以最小显著差异法(LSD法)比较组间差异。
结果
(一)外源性MHC基因表达的检测:转染PNX(N2-B19-H-2Kb)载体的小鼠28 d后分别提取胸腺细胞DNA和RNA,作PCR和RT-PCR。扩增产物在1.5%琼脂糖电泳分别分析显示有特异性的H-2Kb cDNA 扩增片段(409bp,见图2)和H-2Kb mRNA反转录后cDNA扩增片段(431 bp, 见图3),而注射DOTAP+DMEM的胸腺细胞则没有。RT-PCR内参照片段为360bp。



, http://www.100md.com
Fig 2 PCR detection of allogenic MHC gene transferred into mice thymocytes
Lane 1:PCR marker 1 543bp,994bp,695bp,515bp,377bp,237bp;Lane 2: PCR product of mice thymocytes DNA(without intrathymic injection by retroviral vector PNX, N2-B19-H-2Kb);Lane 3: PCR product of mice thymocytes DNA (intrathymic injection by retroviral vector PNX)
图2 PCR检测小鼠胸腺细胞异MHC基因
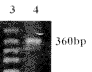


, http://www.100md.com
Fig 3 RT-PCR detection of allogenic MHC mRNA in mice thymocytes
Lane 1:RT-PCR product of mice thymocytes mRNA (not intrathymic injection by retroviral vector PNX ); Lane 2: RT-PCR product of mice thymocytes mRNA(intrathymic injection by retroviral vector PNX), 431bp; Lane 3: PCR marker :1 543bp,994bp,695bp, 515bp,377bp, 237bp; Lane 4: Internal control beta-microglobulin :360bp
图3 RT-PCR检测小鼠胸腺细胞异MHC mRNA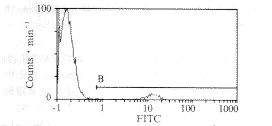
, http://www.100md.com
Fig 4 Flow cytometry analyses expression of H-2Kb on BALB/c mice thymocytes.The vertical axis indicates cell number and the horizontal axis represents fluorescense intensity 图4 流式细胞仪检测小鼠表达H-2Kb产物的胸腺细胞占总胸腺细胞的比例
(二)流式细胞仪检测显示:阴性对照管非特异荧光染色为1.3%,以此为零点胸腺注射PNX (N2-B19-H-2Kb) 14 d的小鼠表达H-2Kb产物的胸腺细胞占总胸腺细胞的5.1% (见图4)。
(三)MHC基因胸腺转移对异基因心肌移植存活时间的影响: C57BL/6小鼠或CBA/6小鼠的心肌移植给BALA/C。各组移植心肌存活的终止时间为:对照1组(8.6±1.7) d,对照2组(7.7±2.3) d,第3组(胸腺注射组) (17.2±5.1)d,第4组(静脉注射组)(9.1±2.4) d,第5组(8.3±2.6) d。
, 百拇医药
(四)各组小鼠脾脏T细胞对ConA的增殖反应以counts.min-1表示:对照1组26 567±1 778、对照2组25 433±1 873、第3组(胸腺注射组) 28 700±2 877、第4组(静脉注射组) 27 664±2 701、第5组26 790±1 889,差异均不显著(P>0.05)。
(五)各组小鼠混合淋巴细胞反应以counts.min-1表示:刺激细胞为C57BL/6时,对照1组为20 451±544对照2组为19 899±878,第3组(胸腺注射组)为1 099±110,第4组(静脉注射组)为18 737±766,第5组(第三供体组)为1 158±109;刺激细胞为CBA/6时,第3组(胸腺注射组)为18 758±1 988,第5组(第三供体组)为21 008±1 868。从以上数据可以看出,对照1,2组及静脉注射组对刺激细胞C57BL/6单向 MLR呈正常反应,而胸腺注射组和第三供体组呈特异性低反应或无反应, 胸腺注射组和第三供体组对刺激细胞CBA/6呈正常反应。
, http://www.100md.com
讨论
大量的研究[4~6]表明,胸腺内注射供体淋巴类细胞或实质细胞,可诱导特异性耐受。这是由于大量未成熟自身反应性T细胞在胸腺内因接触相应的受体抗原后,发生程序死亡而被清除,从而导致对供体的同种异体抗原无反应性。鼠的胸腺耐受模型要求胸腺与异体抗原接触的同时,用抗淋巴细胞血清[7]或射线照射方法[8]去除外周淋巴细胞并促进骨髓淋巴细胞进入胸腺,由此导致的免疫抑制持续两周[9]。我们在小鼠胸腺内注射质粒PXN(N2-B19-H-2Kb)的第3 d和第5 d给小鼠腹腔注射抗CD3mAb抗体,第3周行心肌移植。实验结果显示:外源性MHC基因已整合到靶细胞染色体DNA并有效地转录,胸腺细胞表面表达外源性MHC分子,转染效率为5.1%;胸腺内注射质粒PXN(N2-B19-H-2Kb)能明显延长异基因移植心肌存活时间,平均17 d,对照为8 d(P<0.01); 第5周受体鼠脾细胞对ConA的增殖反应在正常范围,其脾淋巴细胞对C57BL/6鼠脾脏刺激细胞无反应;单纯注射抗CD3mAb抗体的对照2组与对照1组心肌移植存活时间无差别(P>0.05),提示单纯短暂应用抗CD3mAb抗体对异基因心肌移植的存活无影响。我们的初步实验结果显示:将外源性MHC基因转移至小鼠胸腺有可能诱导特异性的免疫耐受。
, 百拇医药
Madsen等[10]在小鼠移植耐受实验中证实:H-2K位对诱导供体特异性耐受的作用最强,其次是IA座位和D座位;在对不相容的MHC抗原的免疫应答反应中针对一个主要的MHC座位诱导无反应性,即可建立有效的免疫耐受。我们通过直接胸腺注射表达外源性主要组织相容性抗原复合物(MHC)抗原质粒PXN(N2-B19-H-2Kb),使受体胸腺细胞只接触供体单一H-2Kb抗原不是供体所有MHC抗原,同样可以建立特异性免疫耐受。直接胸腺注射基因转移载体,可以避免体外细胞培养和基因转移等复杂操作,具有较强的潜在应用前景,为摆脱目前使用免疫抑制特异性不强、易引起感染等并发症的抗排斥药物提供了可能性。但目前使用的逆转录病毒载体对静止细胞的感染性不强,基因转移能力不高,存在重组成野生病毒的可能。因此,构建安全、基因转移能力强的载体是下一步的研究课题。
*国家自然科学基金资助 (No.39570343)
参考文献
, 百拇医药
1 Salaun J,Bandeira A,Khazaal I,et al. Thymic epithelium tolerizes for histocompatibility antigens. Science,1990,247(4949 pt 1):1471.
2 莎姆布鲁克J,费里奇EF,曼尼阿蒂斯T著. 分子克隆实验指南. 第2版. 北京:科学出版社,1992. 24~56,325~332.
3 陈丽君,张玉兰,刘京芳. 小鼠游离心肌耳廓移植模型用于药物筛选的探讨. 中国药理通讯,1984, 1(3-4):210.
4 Murphy KM,Heimberger AB,Loh DY. Induction by antigen of intrathymic aptosis CD4+CD8+ TCR thymocytes in vivo. Science,1990,250(4988):1720.
, http://www.100md.com
5 Posselt AM,Barker CF,Tomaszewski JE,et al. Induction of donor-specific unresponsiveness by intrathymic islet transplantation. Science,1990,249(4974):1293.
6 Sykes M,Sachs DH,Nienhuis AW, et al. Specific prolongation of skin graft survival following retroviral transduction of bone marrow with an allogenetic major histocompatibility complex gene. Transplantation,1993,55(1):197.
7 Ohzato H,Monaco AP. Induction of specific unresponsiveness (tolerance) to skin allografts by intrathymic donor-specific splenocyte injection in antilymphocytes serum-treated mice. Transplantation,1992,54(6):1090.
, 百拇医药
8 Staples PJ,Gery I,Waksman BH. Role of the thymus in tolerance.Ⅲ.Tolerance to bovine Gamma globulin after direct injection of antigen into the shielded thymus of irradiated rats. J Exp Med,1966,124(2):127.
9 Monoco AP,Wood ML,Gray JG,et al. Studies on heterologous antilymphocyte serum in mice:II.Effect on the immune response. J Immunol,1966,96(2):229.
10 Madsen JC,Superina RA,Wood KJ,et al. Immunological unresponsiveness induced by recipient cells transfected with donor MHC genes. Nature,1988,332(6160):161.
(1999年元月22日收稿,1999年6月14日修回), 百拇医药
单位:李锦华 余学清 陈永雄 张仕光:肾内科;中山医科大学附属第一医院;唐皓:急诊科 (广州510080);
关键词:基因;转移;主要组织相容性复合物;免疫耐受;心脏移植
同种MHC基因胸腺转移诱导小鼠心肌移植耐受
摘 要 目的:通过胸腺内注射表达外源性主要组织相容性抗原复合物(MHC)抗原质粒PXN(N2-B19-H-2Kb) , 诱导异基因小鼠心肌移植耐受。方法:给BALB/C小鼠胸腺内注射质粒PXN(N2-B19-H-2Kb),将外源性的编码C57BL/6小鼠MHC I 类抗原的H-2KbcDNA转移到BALB/C小鼠胸腺,2周后行C57BL/6小鼠心肌移植。用聚合酶链反应(PCR),反转录聚合酶链反应(RT-PCR),单克隆抗体免疫萤光染色流式细胞仪检测BALB/C小鼠胸腺细胞DNA,mRNA和MHC蛋白质表达。结果: BALB/C小鼠胸腺细胞表面有外源性MHC分子表达,转染效率为5.1%,胸腺内注射质粒PXN(N2-B19-H-2Kb)能明显延长移植小鼠心肌的存活时间,平均17 d,对照为8 d (P<0.01)。结论:同种MHC基因转移至受体鼠胸腺可以诱导特异性的免疫耐受。
, http://www.100md.com
Transfer of allogenic MHC gene into thymus by retroviral vector induces tolerance
LI Jin-Hua1, TANG Hao2, YU Xue-Qing1, CHEN Yong-Xiong1, ZHANG Shi-Guang1
1 Department of Nephorology,2 Emergency Department,the First Affiliated Hospital,Sun Yat-Sen University of Medical Sciences,Guangzhou (510080)
Abstract AIM: A mice myocardium allograft tolerence model was constructed by intrathymic injection of retroviral vector PXN(N2-B19-H-2Kb)to express allogenice major histocompatibility complex(MHC). MEHTODS: Retroviral vector PXN(N2-B19-H-2Kb)was injected into BALA/C thymus directly to express MHC of C57BL/6(H-2Kb);after 14 days,myocardium of C57BL/6(H-2Kb) mice was transplantated into BALA/C mice;and the polymerase chain reaction (PCR) , the reverse transcription polymerase chain reaction (RT-PCR) and flow cytometry assays detected DNA,mRNA and MHC protein expression in thymocytes.RESULTS: Allogenic MHC gene had been integrated into the chromosomal DNA of BALA/C thymus and expressed stably; It induced mouse heart allograft tolerance, 17days vs 8 days;P<0.01. CONCLUSION: Allogenic MHC gene transferring into recipient thymus directly could induce allogenice mice tolerance.
, http://www.100md.com
MeSH Genes; Transfection; Major histocompatibility complex; Immune tolerance; Heart transplantation
移植排斥反应一直是困扰器官移植的主要问题之一。通过T细胞在胸腺内接触异基因蛋白质抗原而诱导特异性的免疫耐受是目前的研究的热点之一[1]。据此,我们运用基因转移技术,通过胸腺内注射表达外源性主要组织相容性抗原复合物(major histocompatibility complex ,MHC)抗原质粒PXN(N2-B19-H-2Kb) ,以小鼠心肌移植为模型,诱导特异性的免疫耐受,为免疫耐受提供理论和实验依据。
材料和方法
(一)材料:受体鼠BALB/C(H-2d),供体鼠C57BL/6(H-2b),第三无关供体鼠CBA/J(H-2k),皆雄性,6~8周龄(本校实验动物部); DOTAP(Boehringer Marmnnheim);DMEM细胞培养基、抗小鼠CD3单克隆抗体(GIBCO-BRL);ConA、丝裂霉素(Sigma);氚标记胸腺嘧啶核苷([3H]-TdR)3.7×107Bq/mL,比度7.4×1011Bq/mmol(中国原子能科学研究院);生物素标记抗H-2Kb单克隆抗体(Pharmingen);荧光素标记亲和素avidinFITC(SABC);表达供体鼠(H-2b)MHC I类抗原的逆转录病毒载体PNX(N2-B19-H-2Kb)质粒(美国国立卫生研究院Sandra Doren博士惠赠)。
, 百拇医药
(二)方法:
1.外源性MHC基因胸腺转移:麻醉BALB/C(H-2d)小鼠,仰卧位固定四肢及头部,在胸骨上窝正中切开皮肤,钝性分离至气管并沿气管向前直至暴露胸腺上极,MHC基因转移组每只小鼠注射PNX(N2-B19-H-2Kb)1.2 μg加DOTAP 2 μg 和DMEM 2 μL,对照组单纯注射DOTAP 2 μg加 DMEM 2 μL,缝合皮肤。
2.外源性MHC基因表达的检测:逆转录病毒载体及引物A、B和C见图1。胸腺注射后28 d,(1)按文献[2]提取DNA。以一对引物(引物B: 5'- GCT CTT TCT TTC TGG CTG CT -3'. 引物C: 5'-GCC AGA GAT CAC CTG AAT AGT GTG -3'.检测目的基因在小鼠胸腺细胞的整合。PCR:denaturation 93℃ 1 min, annealing 50 ℃ 1 min,extension 72 ℃ 2 min ,35 cycles,final extension 72 ℃ 5 min,产物409bp;(2)按文献[2]提取总RNA,反转录后以一对引物作PCR,引物A: 5'- TAT ATA GCA CGG CAC TGC CG-3'.C同上,产物 431bp。以一对引物(sense: 5'- CCT GGT CTT T CTG GTG CTT G -3', anti-sense: 5'- GCA TCA TGA TGC TTG ATC AC -3')扩增小鼠β2微球蛋白基因的mRNA作为阳性内参照,反转录后PCR方法同上,产物360bp;(3)取胸腺注射PNX(N2-B19-H-2Kb)的小鼠胸腺细胞,以对照组的小鼠胸腺细胞为零点,用抗H-2Kb单克隆抗体直接免疫荧光法染色,流式细胞仪检测目的基因在转染小鼠胸腺细胞上的表达。



, http://www.100md.com
Fig 1 The PXN(N2-B19-H-2Kb )retroviral vector and locations of primer A,B and C
A: Location of the 5' B19 promoter primer for H-2Kb cDNA ,used for mRNA RT- PCR;B: Location of the 5' primer for H-2Kb cDNA ,used for DNA PCR;C: Location of the 3' primer for H-2Kb cDNA ,used for mRNA RT- PCR and DNA PCR 图1 逆转录病毒载体PXN(N2-B19-H-2Kb )结构图及引物A,B和C位置
(三)实验动物分组和小鼠心肌移植模型建立:供体鼠:将40只C57BL/6 小鼠随机分为4组:对照1组和对照2组胸腺注射DOTAP 2 μg加 DMEM 2 μL;第3组胸腺注射PNX(N2-B19-H-2Kb) 1.2 μg加DOTAP 2 μg 和DMEM 2 μL;第4组静脉注射PNX(N2-B19-H-2Kb)1.2 μg加DOTAP 2 μg 和DMEM 2 μL;第5组为第三供体组(CBA/6小鼠,10只)。受体鼠:皆BALB/C小鼠,50只随机分为5组。胸腺注射或静脉注射的当天及第3 d,除对照1组外,各组小鼠给予腹腔注射anti-CD3 monoclonal Ab 8.4 μg/mice,14 d后按文献[3]行小鼠心脏移植。术后第5 d用上海医用电子仪器厂68722型心电图机检测移植心肌心电活动,无心电者视为手术失败。以心电消失日为移植心肌存活的终止时间。
, 百拇医药
(四)小鼠脾细胞对丝裂原增殖反应的观察[4]:各组小鼠胸腺注射或静脉注射后第5周分离脾细胞,96孔板每孔加5×105细胞,设3个复孔,加入5.0 μg/mL(终浓度)ConA.用[3H]-TdR掺入法作脾细胞对丝裂原ConA的增值反应。常规收集细胞,测样本[3H]-TdR掺入率,以counts.min-1表示。
(五)小鼠混合淋巴细胞反应[5]:用[3H]-TdR掺入法分别作对供体和第三供体的单向混合淋巴细胞反应(mixed lymphocytes reaction,MLR):各组小鼠胸腺注射或静脉注射后第五周分离脾细胞,调细胞浓度为5×106/mL,作为MLR中的反应细胞,按5×105/孔加入96孔板, 设3复孔;另取丝裂霉素处理的C57BL/6或CBA/6小鼠脾细胞作为刺激细胞(5×105/孔).混合培养56 h后,加入用[3H]-TdR(1.85×107 Bq/孔).继续培养10 h,常规收集细胞,测样本[3?H]-TdR掺入率,以counts.min-1表示。
, 百拇医药
(六)统计处理: 实验数据以x±s表示。用多因素方差分析(ANOVA),继以最小显著差异法(LSD法)比较组间差异。
结果
(一)外源性MHC基因表达的检测:转染PNX(N2-B19-H-2Kb)载体的小鼠28 d后分别提取胸腺细胞DNA和RNA,作PCR和RT-PCR。扩增产物在1.5%琼脂糖电泳分别分析显示有特异性的H-2Kb cDNA 扩增片段(409bp,见图2)和H-2Kb mRNA反转录后cDNA扩增片段(431 bp, 见图3),而注射DOTAP+DMEM的胸腺细胞则没有。RT-PCR内参照片段为360bp。




, http://www.100md.com
Fig 2 PCR detection of allogenic MHC gene transferred into mice thymocytes
Lane 1:PCR marker 1 543bp,994bp,695bp,515bp,377bp,237bp;Lane 2: PCR product of mice thymocytes DNA(without intrathymic injection by retroviral vector PNX, N2-B19-H-2Kb);Lane 3: PCR product of mice thymocytes DNA (intrathymic injection by retroviral vector PNX)
图2 PCR检测小鼠胸腺细胞异MHC基因

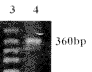


, http://www.100md.com
Fig 3 RT-PCR detection of allogenic MHC mRNA in mice thymocytes
Lane 1:RT-PCR product of mice thymocytes mRNA (not intrathymic injection by retroviral vector PNX ); Lane 2: RT-PCR product of mice thymocytes mRNA(intrathymic injection by retroviral vector PNX), 431bp; Lane 3: PCR marker :1 543bp,994bp,695bp, 515bp,377bp, 237bp; Lane 4: Internal control beta-microglobulin :360bp
图3 RT-PCR检测小鼠胸腺细胞异MHC mRNA

, http://www.100md.com
Fig 4 Flow cytometry analyses expression of H-2Kb on BALB/c mice thymocytes.The vertical axis indicates cell number and the horizontal axis represents fluorescense intensity 图4 流式细胞仪检测小鼠表达H-2Kb产物的胸腺细胞占总胸腺细胞的比例
(二)流式细胞仪检测显示:阴性对照管非特异荧光染色为1.3%,以此为零点胸腺注射PNX (N2-B19-H-2Kb) 14 d的小鼠表达H-2Kb产物的胸腺细胞占总胸腺细胞的5.1% (见图4)。
(三)MHC基因胸腺转移对异基因心肌移植存活时间的影响: C57BL/6小鼠或CBA/6小鼠的心肌移植给BALA/C。各组移植心肌存活的终止时间为:对照1组(8.6±1.7) d,对照2组(7.7±2.3) d,第3组(胸腺注射组) (17.2±5.1)d,第4组(静脉注射组)(9.1±2.4) d,第5组(8.3±2.6) d。
, 百拇医药
(四)各组小鼠脾脏T细胞对ConA的增殖反应以counts.min-1表示:对照1组26 567±1 778、对照2组25 433±1 873、第3组(胸腺注射组) 28 700±2 877、第4组(静脉注射组) 27 664±2 701、第5组26 790±1 889,差异均不显著(P>0.05)。
(五)各组小鼠混合淋巴细胞反应以counts.min-1表示:刺激细胞为C57BL/6时,对照1组为20 451±544对照2组为19 899±878,第3组(胸腺注射组)为1 099±110,第4组(静脉注射组)为18 737±766,第5组(第三供体组)为1 158±109;刺激细胞为CBA/6时,第3组(胸腺注射组)为18 758±1 988,第5组(第三供体组)为21 008±1 868。从以上数据可以看出,对照1,2组及静脉注射组对刺激细胞C57BL/6单向 MLR呈正常反应,而胸腺注射组和第三供体组呈特异性低反应或无反应, 胸腺注射组和第三供体组对刺激细胞CBA/6呈正常反应。
, http://www.100md.com
讨论
大量的研究[4~6]表明,胸腺内注射供体淋巴类细胞或实质细胞,可诱导特异性耐受。这是由于大量未成熟自身反应性T细胞在胸腺内因接触相应的受体抗原后,发生程序死亡而被清除,从而导致对供体的同种异体抗原无反应性。鼠的胸腺耐受模型要求胸腺与异体抗原接触的同时,用抗淋巴细胞血清[7]或射线照射方法[8]去除外周淋巴细胞并促进骨髓淋巴细胞进入胸腺,由此导致的免疫抑制持续两周[9]。我们在小鼠胸腺内注射质粒PXN(N2-B19-H-2Kb)的第3 d和第5 d给小鼠腹腔注射抗CD3mAb抗体,第3周行心肌移植。实验结果显示:外源性MHC基因已整合到靶细胞染色体DNA并有效地转录,胸腺细胞表面表达外源性MHC分子,转染效率为5.1%;胸腺内注射质粒PXN(N2-B19-H-2Kb)能明显延长异基因移植心肌存活时间,平均17 d,对照为8 d(P<0.01); 第5周受体鼠脾细胞对ConA的增殖反应在正常范围,其脾淋巴细胞对C57BL/6鼠脾脏刺激细胞无反应;单纯注射抗CD3mAb抗体的对照2组与对照1组心肌移植存活时间无差别(P>0.05),提示单纯短暂应用抗CD3mAb抗体对异基因心肌移植的存活无影响。我们的初步实验结果显示:将外源性MHC基因转移至小鼠胸腺有可能诱导特异性的免疫耐受。
, 百拇医药
Madsen等[10]在小鼠移植耐受实验中证实:H-2K位对诱导供体特异性耐受的作用最强,其次是IA座位和D座位;在对不相容的MHC抗原的免疫应答反应中针对一个主要的MHC座位诱导无反应性,即可建立有效的免疫耐受。我们通过直接胸腺注射表达外源性主要组织相容性抗原复合物(MHC)抗原质粒PXN(N2-B19-H-2Kb),使受体胸腺细胞只接触供体单一H-2Kb抗原不是供体所有MHC抗原,同样可以建立特异性免疫耐受。直接胸腺注射基因转移载体,可以避免体外细胞培养和基因转移等复杂操作,具有较强的潜在应用前景,为摆脱目前使用免疫抑制特异性不强、易引起感染等并发症的抗排斥药物提供了可能性。但目前使用的逆转录病毒载体对静止细胞的感染性不强,基因转移能力不高,存在重组成野生病毒的可能。因此,构建安全、基因转移能力强的载体是下一步的研究课题。
*国家自然科学基金资助 (No.39570343)
参考文献
, 百拇医药
1 Salaun J,Bandeira A,Khazaal I,et al. Thymic epithelium tolerizes for histocompatibility antigens. Science,1990,247(4949 pt 1):1471.
2 莎姆布鲁克J,费里奇EF,曼尼阿蒂斯T著. 分子克隆实验指南. 第2版. 北京:科学出版社,1992. 24~56,325~332.
3 陈丽君,张玉兰,刘京芳. 小鼠游离心肌耳廓移植模型用于药物筛选的探讨. 中国药理通讯,1984, 1(3-4):210.
4 Murphy KM,Heimberger AB,Loh DY. Induction by antigen of intrathymic aptosis CD4+CD8+ TCR thymocytes in vivo. Science,1990,250(4988):1720.
, http://www.100md.com
5 Posselt AM,Barker CF,Tomaszewski JE,et al. Induction of donor-specific unresponsiveness by intrathymic islet transplantation. Science,1990,249(4974):1293.
6 Sykes M,Sachs DH,Nienhuis AW, et al. Specific prolongation of skin graft survival following retroviral transduction of bone marrow with an allogenetic major histocompatibility complex gene. Transplantation,1993,55(1):197.
7 Ohzato H,Monaco AP. Induction of specific unresponsiveness (tolerance) to skin allografts by intrathymic donor-specific splenocyte injection in antilymphocytes serum-treated mice. Transplantation,1992,54(6):1090.
, 百拇医药
8 Staples PJ,Gery I,Waksman BH. Role of the thymus in tolerance.Ⅲ.Tolerance to bovine Gamma globulin after direct injection of antigen into the shielded thymus of irradiated rats. J Exp Med,1966,124(2):127.
9 Monoco AP,Wood ML,Gray JG,et al. Studies on heterologous antilymphocyte serum in mice:II.Effect on the immune response. J Immunol,1966,96(2):229.
10 Madsen JC,Superina RA,Wood KJ,et al. Immunological unresponsiveness induced by recipient cells transfected with donor MHC genes. Nature,1988,332(6160):161.
(1999年元月22日收稿,1999年6月14日修回), 百拇医药