大鼠运动状态下摄氧量测定方法的初步研究——小动物密闭跑台结合气相色谱分析法测定
作者:张 勇 文 立 时庆德 胡 慧 陈家琦
单位:张 勇 文 立 时庆德 胡 慧 陈家琦 (天津体育学院运动医学研究所(天津300381))
关键词:摄氧量;密闭跑台;气相层析;运动;大鼠
提要 实验采用了自行设计和制造的小动物密闭跑台 提要 实验采用了自行设计和制造的小动物密闭跑台,结合气相色谱分析法测定了Wistar大鼠运动状态下摄氧量。结果显示:随着运动负荷的增加,雄性和雌性大鼠摄氧量都随之增加,其递增趋势与Bedford等人结果一致。结果表明,小动物密闭跑台完全可满足气体收集的要求,结合气相色谱分析可完成小动物运动状态下呼吸代谢的测量。
A Primary Methodological Research on Measurement of Oxygen
, 百拇医药
Consumption of rats During Exercise
Zhang Yong,Wen Li,Shi Qingde,et al
Tianjin Research Institute of Sports Medicine,300381
It is important to measure maximum oxygen consumption accurately in exercise physiology.In this study,an airtight treadmill was constructed and gas samples contracted from the treadmill were separated and analyzed by gas chromatography.The experiment demonstrated that oxygen consumption of rats increased as the intensity of exercise increased.The results showed the same trend in the increase of oxygen consumption as Bedford's.The airtight treadmill we constructed could fulfill the needs of gas collection.The way that airtight treadmill combined with gas chromatography is suitable for measuring metabolic rate during exercise.
, 百拇医药
Key words:VO2,airtight treadmill,gas chromatography,exercise,rats
最大摄氧量是反映有氧运动能力的理想指标。人体和动物运动中,最大摄氧量百分率以其客观性和可比性被广泛用于运动强度评定。因此,准确测量最大摄氧量对于实验研究具有重要的现实意义。60年代,国外开始进行大鼠运动中摄氧量测定的研究[1]。至80年代,最大摄氧量的测量已逐渐规范化,但结果尚不统一[2,3,4,5]。然而,由于购置动物气体代谢设备费用十分昂贵,测试技术复杂,对大鼠最大摄氧量的直接测定在国内还未见报道,有关运动强度和运动中呼吸代谢的确定只能根据国外文献进行推导,使研究有很大局限性。本研究在参阅有关研究的基础上,结合气相色谱分析方法,成功地对大鼠运动状态下摄氧量进行了测试和分析。
1 实验动物和仪器
, http://www.100md.com
1.1 实验动物
纯种Wistar大鼠(天津医科大学实验动物中心提供),雌雄各9只,3月龄,雌性大鼠体重170~200克,雄性大鼠200~240克。分笼饲养,饲料为标准啮齿动物饲料,自由进食、进水,饲养温度25~31.5℃。测试前所有动物未进行过任何形式的运动训练。
1.2 仪器
1.2.1 跑台
参照美国Columbus公司产品,自行设计制造的有机玻璃密闭跑台。有机玻璃外罩体积为长545mm、宽160mm、高220mm,跑道长340mm、宽135mm。跑道完全密封在有机玻璃室内,主动轴与驱动电机相连,轴向由密封件密封。驱动电机为交流无级可调速电机。密封室纵向前端有混气室与出气口相连。出气口为三通接口,一端接混气室,一端接流量计、真空泵,取气样口由橡胶塞密封(图1)。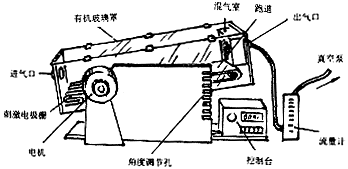
, http://www.100md.com
图1.小动物密闭跑台示意图
Fig.1Construction of the small animal airtight treadmill
1.2.2 气相色谱仪
日本产岛津GC-9A型,使用热导池检测,数据处理器为岛津C—R3A型。CO2分离柱选用2米长玻璃柱,固定相为高分子小球-102,60~80目。O2分离选用1米长玻璃柱,固定相为5A分子筛,40~60目。载气为H2。
1.2.3 其它仪器
北京测量仪器三厂产转子流量计两只,最大量程分别为1.6/h,1L/min各1个,经天津自动化仪表十四厂校准。天津医学仪器厂产真空泵。CO2取样、进样使用50ml医用注射器,六通阀进样。O2取样、进样使用澳大利亚产气相色谱专用100μl注射器,进样口进样。
, http://www.100md.com
2 实验程序
2.1 气相色谱仪检测
在柱温40℃、进样口温度90℃、检测器温度120℃、载气流速75ml/min条件下,使用高分子小球-102对CO2与N2+O2进行分离;N2+O2在这只分离柱中不分离。分子筛对CO2全部保留,300℃真空活化后可良好分离N2、O2。柱温100℃,进样口温度110℃,检测器温度120℃,载气流速75ml/min条件下,使用高分子小球-102分离水蒸汽。高分子小球-102对CO2与N2+O2的分辨率R>1.5。N2+O2不分离,保留时间为27s,CO2保留时间为54s。分子筛对CO2全部保留,300℃真空活化后可良好分离N2、O2,分辨率R>1.5。O2保留时间为20s,N2保留时间为49s。
, 百拇医药
采用浓度型热导池检测器检测仪器的测试精度。利用N2稀释的4.78%和0.478%的CO2以及用高纯O2和N2配置的20%的O2对气相色谱仪进行检验,测试精度符合本实验要求。
2.2 跑台性能测试与校正
为检验跑台的密闭性,封闭进气和出气口后进行了2atm的打压实验,观察1小时后气体泄漏情况。本实验混合标准气体依照Fedak[7]的一步N2稀释法进气。调整气流流速,使1分钟后测量气体成分与计算值比较其差异小于5%,并在关闭N21分钟后,室内气体与大气差异小于5%[2]。在实验条件下,5L/min的气流量可以保证接通N2后1min得到与计算值差异<4%的平稳结果,同样,关闭N2后1min可恢复到与大气差异<4%的结果。
, 百拇医药
2.3 大鼠运动方式
根据大鼠习服时的运动情况,对Bedford[2]等报道的等级稍加改动,分为5级负荷(见表1)。每级负荷在1min内均匀递增。
表1 实验动物运动负荷程序
Table 1 Loading Protocol of exercise for experimental animals
阶段
Stages
倾角(°)
Grade,degrees
速度(m/min)
, http://www.100md.com
Speed
持续时间(min)
duration
Ⅰ
0
8.0
3—4
Ⅱ
5
16.0
3—4
Ⅲ
10
, http://www.100md.com
20.8
3—4
Ⅳ
10
24.0
3—4
Ⅴ
10
27.2
3—4
2.4 测试指标
大鼠置于跑台后20~30分钟,从取样口用100μl针管取O2、N2分析,气样立即注入分子筛柱分离测定O2、N2;用50ml针管取CO2分析气样,用胶塞密封备测,待O2、N2分析后转用高分子小球分离测定CO2。每级负荷开始后2分钟分别取样,分析程序同上。
, 百拇医药
每次测试开始和结束时,测量环境大气成分、环境温度、气压。同批测试中分别测量大气和气室内不同阶段水蒸汽含量。
2.5 数据处理
摄氧量计算:摄氧量=(流入气体氧百分含量-流出气体氧百分含量)×气流量(ATPS)/公斤体重。实验数据计算平均值、标准差,并作雄性大鼠与雌性大鼠组间t检验。
3 结果和讨论
表2 不同运动阶段气体代谢测试结果
Table 2 The gas metabolism during various exercise stages
雌性female
雄性male
, http://www.100md.com
n
相对摄氧量
VO2
呼吸商
n
相对摄氧量
呼吸商
VO2(ml/kg.min)
R
VO2(ml/kg.min)
R
安静
, 百拇医药
5
36.7±10.00
1.51±0.62
9
42.0±13.7
1.50±0.36
阶段—Ⅰ
5
49.6±12.2
9
56.4±10.7
阶段—Ⅱ
5
, 百拇医药
61.8±20.8
9
72.6±18.5
阶段—Ⅲ
5
102.8±14.6
1.12±0.29
9
94.2±13.4
1.31±0.26
阶段—Ⅳ
5
115.5±14.7
, 百拇医药
1.15±0.19
7
105.1±12.9
1.23±0.19
阶段—Ⅴ
4
127.3±16.7
2
115.9
注:雌性和雄性大鼠体重分别为0.182±0.009和0.222±0.019kg。
目前,运动状态下小动物摄氧量的测量主要有两种方法,即Brooks、White发展的密封室方法[5]和Gleeson、Baldwin[4]发展的轻型面罩方法。Baldwin认为这两种技术测试所得的结果相似。Musch[6]则认为并不是每个阶段都相同,即使是轻型面罩对大鼠的运动也会有影响。密闭室方式和面罩方式原理相同,即在一流入气流量等于流出气流量的系统中,动物的摄氧量应等于流入的氧量减去流出的氧量,CO2的呼出量应等于流出其它的CO2量减去流入的CO2量。本实验在没有实验动物专门分析设备的条件下,选用了密闭跑台方式,气体分析采用气相层析方法。
, 百拇医药
本实验观察到,随着运动负荷的增加,雄性和雌性大鼠摄氧量都随之增加,其递增趋势与Bedford等人结果一致(见图2)。表明在没有专用气体分析装置的条件下,密闭跑台结合气相色谱分析测定动物运动状态下摄氧量的方法是可行的。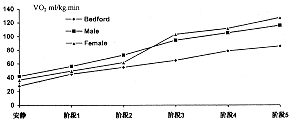
图2.雄性和雌性大鼠各运动阶段摄氧量与Bedford实验结果的比较
Fig2.Changes of VO2 in every stage compared with Bedford's result
从对比中我们发现,本实验的结果无论是安静状态还是运动中,各个阶段值均高于Bedford的指标。Gleeson[4]报道了用面罩的方法测得的Wistar大鼠摄氧量安静值为19ml/kg.min,最大值为83ml/kg.min。现有的最高值报道是Russell利用小动物功率计在Charles河鼠上获得的峰值摄氧量115.4ml/kg.min[8]。由于Bedford等未公布其计算方法,尚无法与之进行精确的比较。就本实验而言,未做进气量以及动物排出的水蒸汽量测量,只按平均值扣除,可能会引起某些误差。而精确测量进出气室的气量和同步测量水蒸汽量将有助于消除这种误差。Bedford等实验时的温度范围是18~24℃,而本实验时的温度范围为29~31.5℃。Dawson等[9]报道大鼠游泳的水温对摄氧量有影响,尤其是当体温随之变化时影响显著,直肠温度每升高1℃,摄氧量增加2.9ml/kg.min。这种增加可能与心率及心输出量的升高有关[10]。另有研究表明,水温的升高会使大鼠游泳时的心率增加[11]。因此,测试时的温度可能是造成差别的另一原因。
, http://www.100md.com
Taylor等[12]认为,随运动负荷增加而摄氧量增加不超过5%时,动物即达到最大摄氧量。本实验在完成第Ⅴ级负荷的大鼠中,我们所测得2只雌性大鼠和1只雄性大鼠的最大摄氧量分别为111.9、113.7和106ml/kg.min,符合以上评定标准。其它则较第Ⅳ级负荷增长8%~17%,测得的摄氧量并不能确定为最大摄氧量,应是150V电压刺激下得到的大鼠最大负荷时的稳态峰值摄氧量。本实验中,动物不能维持更大强度运动,可能与刺激强度有关。测定人体最大摄氧量时,呼吸商大于1及心率大于180次/分钟也是判定是否达到最大摄氧量的标准。本实验中,大鼠在测试前只进行过一次运动习服。测试时大部分大鼠放入密闭室内呼吸已大于1,这可能是由于不熟悉的环境对大鼠情绪的影响所致。此外,由于实验时环境温度较高,而大鼠无汗腺,只能通过呼吸进行体温调节,从而导致过度通气,使呼出CO2增多,呼吸商增加。所以,无法以呼吸商作为评定指标。以大鼠心率作为是否达到最大摄氧量的评定指标未见报道,对此研究可能会对大鼠最大摄氧量的确定有所裨益。综上,本研究方法中最大摄氧量的确定还有待于进一步实验。
, 百拇医药
本实验研究表明,雌性和雄性大鼠在安静及不同负荷阶段摄氧量无显著差异(表1),表明性别因素对大鼠摄氧量影响不大。尽管雌、雄性大鼠摄氧量随运动负荷增加趋势相似,但雌性在由第Ⅱ级到第Ⅲ级负荷时较雄性增加明显,可能表明雌、雄性大鼠心肺功能对运动负荷的反应略有差别。我们分别在实验中对9只雌性和9只雄性大鼠进行了测试,其中有4只雌性大鼠由于测试前后外界环境气体成分波动过大而剔除。9只雌鼠中的8只完成了第Ⅴ级负荷。而9只雄鼠中只有2只完成了第Ⅴ级负荷。本实验维持大鼠运动的手段是电刺激,最大电压为150V。在另一例测试中发现,如果用180V电压刺激雄性大鼠其不仅可以完成第5级负荷,甚至可完成跑速27.2m/min、坡度25°的负荷,并可持续3min以上。所以,本次实验表现出的雌性大鼠运动能力高于雄性大鼠的结果,还不能证明雌性大鼠对电刺激敏感性高,或者雌性大鼠的运动能力确实高于雄性大鼠。
4 小结
本研究自行设计并制造了密闭动物跑台,结合气相色谱分析,首次在国内完成了雄性和雌性大鼠运动状态下不同运动负荷时的摄氧量测定。实验结果表明,密闭动物跑台完全可满足气体收集的要求,结合气相色谱分析可以用来完成小动物安静和运动时摄氧量的测定。
, 百拇医药
参考文献
1.Mcardle DW.Metabolic stress of endurance swimming in the laboratory rat.J Appl Physiol.1967;22(1):50-54
2.Bedford TG,Tipton CM,Wilson NC,et al. Maximal oxygen consumption of rats and its changes with various experimental procedures. J Appl Physiol.1979;47(6);1278-1283.
3.Gleeson TT,Mullin WJ,and Baldwin KM.Cardiovascular responses to treadmill exercise in rats:effects of training.J Appl Physiol.1983;54(3);789-793.
, 百拇医药
4.Gleeson TT and Baldwin KM. Cardiovascular responses to treadmill exercise in untrained rats. J Appl Physiol. 1981;50(6);1206-1211.
5.Brooks GA and White TP.Determination of metabolic and heart rate responses of rats to treadmill exercise.J Appl Physiol.1978;45(6);1009-1015.
6.Musch TI,Bruno A,Bradford GE,et al.Measurements of metabolic rate in rats:a comparison of techniques.J Appl Physiol.1988;65(2);964-970
, http://www.100md.com
7.Fedak MA,Rome
L and Seeherman HJ.One-step N2-dilution technique for calibration open-circuit VO2 measuring systems. J Appl Physiol.1981;51(3);772-776
8.Russell JC,Campagna PD and Wenger
HA.Small -animal ergometer.J Appl Physiol.1980;48(2);394-398.
9.Dawson CA and Horvath SM.Swimming in small laboratory animals.Med Sci Sports Exerc.1970;2(5):51-78
, http://www.100md.com
10.杨锡让,乔居庠,李海萍等译.运动生理学.北京:人民体育出版社,1982:628
11.Baker MA and Horvath SA.Influence of water temperature on heart rate and rectal temperature of swimming rats.Am J Physiol.1964;207;1073-1076
12.Taylor CR,Schmidt-Nielsen K and Raab JL.Scaling of energetic cost of running to body size in mammals.Am J Physiol.1970;219;1104-1107
(1997.07.18收稿), 百拇医药
单位:张 勇 文 立 时庆德 胡 慧 陈家琦 (天津体育学院运动医学研究所(天津300381))
关键词:摄氧量;密闭跑台;气相层析;运动;大鼠
提要 实验采用了自行设计和制造的小动物密闭跑台 提要 实验采用了自行设计和制造的小动物密闭跑台,结合气相色谱分析法测定了Wistar大鼠运动状态下摄氧量。结果显示:随着运动负荷的增加,雄性和雌性大鼠摄氧量都随之增加,其递增趋势与Bedford等人结果一致。结果表明,小动物密闭跑台完全可满足气体收集的要求,结合气相色谱分析可完成小动物运动状态下呼吸代谢的测量。
A Primary Methodological Research on Measurement of Oxygen
, 百拇医药
Consumption of rats During Exercise
Zhang Yong,Wen Li,Shi Qingde,et al
Tianjin Research Institute of Sports Medicine,300381
It is important to measure maximum oxygen consumption accurately in exercise physiology.In this study,an airtight treadmill was constructed and gas samples contracted from the treadmill were separated and analyzed by gas chromatography.The experiment demonstrated that oxygen consumption of rats increased as the intensity of exercise increased.The results showed the same trend in the increase of oxygen consumption as Bedford's.The airtight treadmill we constructed could fulfill the needs of gas collection.The way that airtight treadmill combined with gas chromatography is suitable for measuring metabolic rate during exercise.
, 百拇医药
Key words:VO2,airtight treadmill,gas chromatography,exercise,rats
最大摄氧量是反映有氧运动能力的理想指标。人体和动物运动中,最大摄氧量百分率以其客观性和可比性被广泛用于运动强度评定。因此,准确测量最大摄氧量对于实验研究具有重要的现实意义。60年代,国外开始进行大鼠运动中摄氧量测定的研究[1]。至80年代,最大摄氧量的测量已逐渐规范化,但结果尚不统一[2,3,4,5]。然而,由于购置动物气体代谢设备费用十分昂贵,测试技术复杂,对大鼠最大摄氧量的直接测定在国内还未见报道,有关运动强度和运动中呼吸代谢的确定只能根据国外文献进行推导,使研究有很大局限性。本研究在参阅有关研究的基础上,结合气相色谱分析方法,成功地对大鼠运动状态下摄氧量进行了测试和分析。
1 实验动物和仪器
, http://www.100md.com
1.1 实验动物
纯种Wistar大鼠(天津医科大学实验动物中心提供),雌雄各9只,3月龄,雌性大鼠体重170~200克,雄性大鼠200~240克。分笼饲养,饲料为标准啮齿动物饲料,自由进食、进水,饲养温度25~31.5℃。测试前所有动物未进行过任何形式的运动训练。
1.2 仪器
1.2.1 跑台
参照美国Columbus公司产品,自行设计制造的有机玻璃密闭跑台。有机玻璃外罩体积为长545mm、宽160mm、高220mm,跑道长340mm、宽135mm。跑道完全密封在有机玻璃室内,主动轴与驱动电机相连,轴向由密封件密封。驱动电机为交流无级可调速电机。密封室纵向前端有混气室与出气口相连。出气口为三通接口,一端接混气室,一端接流量计、真空泵,取气样口由橡胶塞密封(图1)。

, http://www.100md.com
图1.小动物密闭跑台示意图
Fig.1Construction of the small animal airtight treadmill
1.2.2 气相色谱仪
日本产岛津GC-9A型,使用热导池检测,数据处理器为岛津C—R3A型。CO2分离柱选用2米长玻璃柱,固定相为高分子小球-102,60~80目。O2分离选用1米长玻璃柱,固定相为5A分子筛,40~60目。载气为H2。
1.2.3 其它仪器
北京测量仪器三厂产转子流量计两只,最大量程分别为1.6/h,1L/min各1个,经天津自动化仪表十四厂校准。天津医学仪器厂产真空泵。CO2取样、进样使用50ml医用注射器,六通阀进样。O2取样、进样使用澳大利亚产气相色谱专用100μl注射器,进样口进样。
, http://www.100md.com
2 实验程序
2.1 气相色谱仪检测
在柱温40℃、进样口温度90℃、检测器温度120℃、载气流速75ml/min条件下,使用高分子小球-102对CO2与N2+O2进行分离;N2+O2在这只分离柱中不分离。分子筛对CO2全部保留,300℃真空活化后可良好分离N2、O2。柱温100℃,进样口温度110℃,检测器温度120℃,载气流速75ml/min条件下,使用高分子小球-102分离水蒸汽。高分子小球-102对CO2与N2+O2的分辨率R>1.5。N2+O2不分离,保留时间为27s,CO2保留时间为54s。分子筛对CO2全部保留,300℃真空活化后可良好分离N2、O2,分辨率R>1.5。O2保留时间为20s,N2保留时间为49s。
, 百拇医药
采用浓度型热导池检测器检测仪器的测试精度。利用N2稀释的4.78%和0.478%的CO2以及用高纯O2和N2配置的20%的O2对气相色谱仪进行检验,测试精度符合本实验要求。
2.2 跑台性能测试与校正
为检验跑台的密闭性,封闭进气和出气口后进行了2atm的打压实验,观察1小时后气体泄漏情况。本实验混合标准气体依照Fedak[7]的一步N2稀释法进气。调整气流流速,使1分钟后测量气体成分与计算值比较其差异小于5%,并在关闭N21分钟后,室内气体与大气差异小于5%[2]。在实验条件下,5L/min的气流量可以保证接通N2后1min得到与计算值差异<4%的平稳结果,同样,关闭N2后1min可恢复到与大气差异<4%的结果。
, 百拇医药
2.3 大鼠运动方式
根据大鼠习服时的运动情况,对Bedford[2]等报道的等级稍加改动,分为5级负荷(见表1)。每级负荷在1min内均匀递增。
表1 实验动物运动负荷程序
Table 1 Loading Protocol of exercise for experimental animals
阶段
Stages
倾角(°)
Grade,degrees
速度(m/min)
, http://www.100md.com
Speed
持续时间(min)
duration
Ⅰ
0
8.0
3—4
Ⅱ
5
16.0
3—4
Ⅲ
10
, http://www.100md.com
20.8
3—4
Ⅳ
10
24.0
3—4
Ⅴ
10
27.2
3—4
2.4 测试指标
大鼠置于跑台后20~30分钟,从取样口用100μl针管取O2、N2分析,气样立即注入分子筛柱分离测定O2、N2;用50ml针管取CO2分析气样,用胶塞密封备测,待O2、N2分析后转用高分子小球分离测定CO2。每级负荷开始后2分钟分别取样,分析程序同上。
, 百拇医药
每次测试开始和结束时,测量环境大气成分、环境温度、气压。同批测试中分别测量大气和气室内不同阶段水蒸汽含量。
2.5 数据处理
摄氧量计算:摄氧量=(流入气体氧百分含量-流出气体氧百分含量)×气流量(ATPS)/公斤体重。实验数据计算平均值、标准差,并作雄性大鼠与雌性大鼠组间t检验。
3 结果和讨论
表2 不同运动阶段气体代谢测试结果
Table 2 The gas metabolism during various exercise stages
雌性female
雄性male
, http://www.100md.com
n
相对摄氧量
VO2
呼吸商
n
相对摄氧量
呼吸商
VO2(ml/kg.min)
R
VO2(ml/kg.min)
R
安静
, 百拇医药
5
36.7±10.00
1.51±0.62
9
42.0±13.7
1.50±0.36
阶段—Ⅰ
5
49.6±12.2
9
56.4±10.7
阶段—Ⅱ
5
, 百拇医药
61.8±20.8
9
72.6±18.5
阶段—Ⅲ
5
102.8±14.6
1.12±0.29
9
94.2±13.4
1.31±0.26
阶段—Ⅳ
5
115.5±14.7
, 百拇医药
1.15±0.19
7
105.1±12.9
1.23±0.19
阶段—Ⅴ
4
127.3±16.7
2
115.9
注:雌性和雄性大鼠体重分别为0.182±0.009和0.222±0.019kg。
目前,运动状态下小动物摄氧量的测量主要有两种方法,即Brooks、White发展的密封室方法[5]和Gleeson、Baldwin[4]发展的轻型面罩方法。Baldwin认为这两种技术测试所得的结果相似。Musch[6]则认为并不是每个阶段都相同,即使是轻型面罩对大鼠的运动也会有影响。密闭室方式和面罩方式原理相同,即在一流入气流量等于流出气流量的系统中,动物的摄氧量应等于流入的氧量减去流出的氧量,CO2的呼出量应等于流出其它的CO2量减去流入的CO2量。本实验在没有实验动物专门分析设备的条件下,选用了密闭跑台方式,气体分析采用气相层析方法。
, 百拇医药
本实验观察到,随着运动负荷的增加,雄性和雌性大鼠摄氧量都随之增加,其递增趋势与Bedford等人结果一致(见图2)。表明在没有专用气体分析装置的条件下,密闭跑台结合气相色谱分析测定动物运动状态下摄氧量的方法是可行的。

图2.雄性和雌性大鼠各运动阶段摄氧量与Bedford实验结果的比较
Fig2.Changes of VO2 in every stage compared with Bedford's result
从对比中我们发现,本实验的结果无论是安静状态还是运动中,各个阶段值均高于Bedford的指标。Gleeson[4]报道了用面罩的方法测得的Wistar大鼠摄氧量安静值为19ml/kg.min,最大值为83ml/kg.min。现有的最高值报道是Russell利用小动物功率计在Charles河鼠上获得的峰值摄氧量115.4ml/kg.min[8]。由于Bedford等未公布其计算方法,尚无法与之进行精确的比较。就本实验而言,未做进气量以及动物排出的水蒸汽量测量,只按平均值扣除,可能会引起某些误差。而精确测量进出气室的气量和同步测量水蒸汽量将有助于消除这种误差。Bedford等实验时的温度范围是18~24℃,而本实验时的温度范围为29~31.5℃。Dawson等[9]报道大鼠游泳的水温对摄氧量有影响,尤其是当体温随之变化时影响显著,直肠温度每升高1℃,摄氧量增加2.9ml/kg.min。这种增加可能与心率及心输出量的升高有关[10]。另有研究表明,水温的升高会使大鼠游泳时的心率增加[11]。因此,测试时的温度可能是造成差别的另一原因。
, http://www.100md.com
Taylor等[12]认为,随运动负荷增加而摄氧量增加不超过5%时,动物即达到最大摄氧量。本实验在完成第Ⅴ级负荷的大鼠中,我们所测得2只雌性大鼠和1只雄性大鼠的最大摄氧量分别为111.9、113.7和106ml/kg.min,符合以上评定标准。其它则较第Ⅳ级负荷增长8%~17%,测得的摄氧量并不能确定为最大摄氧量,应是150V电压刺激下得到的大鼠最大负荷时的稳态峰值摄氧量。本实验中,动物不能维持更大强度运动,可能与刺激强度有关。测定人体最大摄氧量时,呼吸商大于1及心率大于180次/分钟也是判定是否达到最大摄氧量的标准。本实验中,大鼠在测试前只进行过一次运动习服。测试时大部分大鼠放入密闭室内呼吸已大于1,这可能是由于不熟悉的环境对大鼠情绪的影响所致。此外,由于实验时环境温度较高,而大鼠无汗腺,只能通过呼吸进行体温调节,从而导致过度通气,使呼出CO2增多,呼吸商增加。所以,无法以呼吸商作为评定指标。以大鼠心率作为是否达到最大摄氧量的评定指标未见报道,对此研究可能会对大鼠最大摄氧量的确定有所裨益。综上,本研究方法中最大摄氧量的确定还有待于进一步实验。
, 百拇医药
本实验研究表明,雌性和雄性大鼠在安静及不同负荷阶段摄氧量无显著差异(表1),表明性别因素对大鼠摄氧量影响不大。尽管雌、雄性大鼠摄氧量随运动负荷增加趋势相似,但雌性在由第Ⅱ级到第Ⅲ级负荷时较雄性增加明显,可能表明雌、雄性大鼠心肺功能对运动负荷的反应略有差别。我们分别在实验中对9只雌性和9只雄性大鼠进行了测试,其中有4只雌性大鼠由于测试前后外界环境气体成分波动过大而剔除。9只雌鼠中的8只完成了第Ⅴ级负荷。而9只雄鼠中只有2只完成了第Ⅴ级负荷。本实验维持大鼠运动的手段是电刺激,最大电压为150V。在另一例测试中发现,如果用180V电压刺激雄性大鼠其不仅可以完成第5级负荷,甚至可完成跑速27.2m/min、坡度25°的负荷,并可持续3min以上。所以,本次实验表现出的雌性大鼠运动能力高于雄性大鼠的结果,还不能证明雌性大鼠对电刺激敏感性高,或者雌性大鼠的运动能力确实高于雄性大鼠。
4 小结
本研究自行设计并制造了密闭动物跑台,结合气相色谱分析,首次在国内完成了雄性和雌性大鼠运动状态下不同运动负荷时的摄氧量测定。实验结果表明,密闭动物跑台完全可满足气体收集的要求,结合气相色谱分析可以用来完成小动物安静和运动时摄氧量的测定。
, 百拇医药
参考文献
1.Mcardle DW.Metabolic stress of endurance swimming in the laboratory rat.J Appl Physiol.1967;22(1):50-54
2.Bedford TG,Tipton CM,Wilson NC,et al. Maximal oxygen consumption of rats and its changes with various experimental procedures. J Appl Physiol.1979;47(6);1278-1283.
3.Gleeson TT,Mullin WJ,and Baldwin KM.Cardiovascular responses to treadmill exercise in rats:effects of training.J Appl Physiol.1983;54(3);789-793.
, 百拇医药
4.Gleeson TT and Baldwin KM. Cardiovascular responses to treadmill exercise in untrained rats. J Appl Physiol. 1981;50(6);1206-1211.
5.Brooks GA and White TP.Determination of metabolic and heart rate responses of rats to treadmill exercise.J Appl Physiol.1978;45(6);1009-1015.
6.Musch TI,Bruno A,Bradford GE,et al.Measurements of metabolic rate in rats:a comparison of techniques.J Appl Physiol.1988;65(2);964-970
, http://www.100md.com
7.Fedak MA,Rome
L and Seeherman HJ.One-step N2-dilution technique for calibration open-circuit VO2 measuring systems. J Appl Physiol.1981;51(3);772-776
8.Russell JC,Campagna PD and Wenger
HA.Small -animal ergometer.J Appl Physiol.1980;48(2);394-398.
9.Dawson CA and Horvath SM.Swimming in small laboratory animals.Med Sci Sports Exerc.1970;2(5):51-78
, http://www.100md.com
10.杨锡让,乔居庠,李海萍等译.运动生理学.北京:人民体育出版社,1982:628
11.Baker MA and Horvath SA.Influence of water temperature on heart rate and rectal temperature of swimming rats.Am J Physiol.1964;207;1073-1076
12.Taylor CR,Schmidt-Nielsen K and Raab JL.Scaling of energetic cost of running to body size in mammals.Am J Physiol.1970;219;1104-1107
(1997.07.18收稿), 百拇医药