中药复方“体复康”对运动性疲劳大鼠脑组织神经肽Y动态变化影响的研究*
作者:陈家旭 杨维益 梁 嵘 刘晓兰 王天芳 李 峰 康纯洁 董 浩 刘 燕 高大安 吕丹云 冯连世 宗丕芳 周未艾 王启荣
单位:陈家旭 杨维益 梁 嵘 刘晓兰 王天芳 李 峰 康纯洁 董 浩 刘 燕 (北京中医药大学(北京100029));高大安 吕丹云 冯连世 宗丕芳 周未艾 王启荣 (国家体育总局体育科学研究所)
关键词:中药复方“体复康”;运动性疲劳;神经肽Y;免疫组织化学
中国运动医学杂志980409 提要 为了从脑组织神经肽Y水平探索运动性疲劳产生及药物调节的机理,采用ABC免疫组织化学法结合图象分析,观察中药复方“体复康”对运动性疲劳大鼠不同脑区神经肽Y的动态变化。结果显示:一定强度(速度由15m/min递增至35m/min,运动时间为20至25min/d)长期(共7周)运动的大鼠,安静状态下在丘脑室旁核(PV)、下丘脑背内侧核(DM)、下丘脑腹内侧核(VMH)等核团NPY无显著性变化;在此基础上的末次急性运动结束后3小时NPY变化尤为明显。中药复方“体复康”对于慢性运动应激过程中NPY的调节作用不明显,在急性运动应激中,中药复方对NPY的调节在运动结束后3小时尤为明显,且呈双向调节,即在PV、DM核团下调,而在VMH核团上调。结论:神经肽Y在运动性疲劳大鼠不同脑区呈现不同的动态变化趋势,中药复方“体复康”对NPY有双向调节作用。
, http://www.100md.com
Dynamic Effect of “Tifukang” Recipe on Neuropeptide Y of Brain in Rats
with Exercise-induced Fatigue
Chen Jiaxu, Yang Weiyi, Liang Rong, et al
Beijing University of Chinese Medicine and Pharmacology,Beijing 100029
The mechnism of exercise-induced fatigue(EIF) and the effect of “Tifukang” Recipe(TFK) on neuropeptide Y(NPY) of brain in rat with EIF were studied. Avidin-biotin-complex immunohistochemistry and image pattern analysis were used to observe the effect of TFK on the changes of NPY in different areas of brain. Results: After long term(7 weeks) and high intensity exercise (from 15m/min gradually increased to 35m/min, 20 to 25min/d), at rest, NPY was unchanged in paraventricularthalamic (PV),dorsomedial hypothalamic (DM) nucleus and ventromedial hypothalamic(VMH) nuclues, however, at 3 hours postexercise after final exercise it changed obviously. NPY was not remarkably affected in the chronic fatigue stress by TFK, but it was regulated bidirectionally by TFK, expecially at 3 hours post-exercise in the acute fatigue stress :down in PV and DM, while up in VMH.Conclusion:The dynamic changes of NPY in different areas of brain in rat with EIF were different, and TFK had bidirectionally regulating effect on NPY.
, 百拇医药
Key words: “Tifukang” Recipe, exercise-induced fatigue, neuropeptide Y, immunohistochemistry
运动性疲劳的机理和恢复问题是当今运动医学中的研究热点。运动作为一种应激源,血浆中NPY的变化已有报道,但关于NPY在运动性疲劳大鼠不同脑区及中药作用后的变化尚未见报道。我们在过去的研究中,以理气、扶正组方研制的中药复方“体复康”对运动性疲劳大鼠血浆内源性阿片肽有明显调节作用[1]。在此工作的基础上,运用ABC免疫组织化学法并结合图象分析,进一步定位定量研究NPY在运动性疲劳过程中的动态变化及该复方的调节作用。
1 材料与方法
1.1 材料
动物:二级Spargue-Dawley雄性大鼠,体重180~220g。由北京医科大学、解放军301医院等实验动物中心提供。
, http://www.100md.com
药物:本实验所用中药复方“体复康”以理气、扶正为组方原则,由枳壳、黄芪等组成,并由同仁堂制药集团公司加工成软胶囊。
1.2 方法
1.2.1 造模方法
适应训练:实验动物(200只)置于室温(20±2℃)实验室中,每5只1笼,自由进食饮水;适应实验环境1~2天后开始训练,采用递增强度的方式在国产电动鼠类跑台(购自杭州)上运动,坡度为0。从训练第1周起,每周递增速度,每周速度分别为15m/min、22m/min、27m/min、31m/min、35m/min。每天训练20min,每周5d,共训练5周。第5周后按以下方案进行训练。
一般训练:于第6、7周每只动物每日按35m/min的速度,在坡度为0的跑台上跑20min。
强化训练:于第6、7周每只动物每日按35m/min的速度,在坡度为0的跑台上跑25min。
, 百拇医药
造模期间于每周星期一、四测动物体重,造模周期共计7周,于第8周始取材,末次运动速度仍为35m/min,时间为30min。
1.2.2 实验分组
安静对照组(A组,n=13):自实验开始第1~7周直到第8周取材日不进行任何运动训练。
训练对照组(B组,n=12):接受5周的适应训练后,进一步进行2周的一般训练,于第8周取材日安静状态下取材。
强化训练组(C组,n=56):接受5周的适应训练后,再接受2周的强化训练。于第8周取材日将动物随机分为运动前安静态、运动后即刻、运动结束后30min与3h。
强化训练加中药治疗组(D组 n=53):接受5周的适应训练后,再接受2周的强化训练。于第8周取材日将动物随机分为运动前安静态、运动后即刻、运动结束后30min与3h。
, http://www.100md.com
1.2.3 给药方法
中药治疗组:在接受强化训练期间,每日于训练后1h灌胃中药3ml(将软胶囊按比例溶解,配制成相当于含生药1kg/L的药液,按10g/Kg的给药剂量,300g的大鼠应给药3ml)。其余各组则灌胃等体积的蒸馏水。
1.3 观察指标与方法
1.3.1 标本制备
大鼠经10%水合氯醛(400mg/kg体重)麻醉后,剖开胸腔,经左心室向升主动脉插管,先以预冷的0.9%生理盐水速灌冲洗,一般约需100-200ml,直至流出液体变清为止;继之灌入预冷的4%多聚甲醛溶液(0.1M PB配制,PH7.4)300ml,约30分钟;取脑置于4%多聚甲醛溶液中4℃后固定6-10小时。然后将脑组织移至20%蔗糖溶液(0.1M PB配制,PH7.4)中于4℃保存,待组织下沉后,液氮骤冷,于-20℃在LELCA-CM1900型恒冷箱切片机中制备10μm切片,裱贴在预先经2%APES(3-aminopropyltriethoxysilane,购自北京中山生物技术有限公司)胶处理的载玻片上,空气中干燥后置-70℃冰箱中备用。
, http://www.100md.com
石蜡标本制备:大鼠经10%水合氯醛麻醉后,立即断头处死,取脑置于10%中性缓冲福尔马林液(0.01M PB配制,PH7.0)中充分固定,常规酒精梯度脱水、二甲苯透明、石蜡(熔点56~58℃)包埋,制备4μm切片裱贴在预先经2%APES胶处理的载玻片上,备用。
1.3.2 ABC免疫组织化学染色程序
试剂:兔抗NPY血清(抗体稀释度为1∶1500,购自西安第四军医大学)、PK-4001兔ABC试剂盒(Vector公司产品,购自北京中山生物技术有限公司)、DAB购自Sigma公司。
冰冻切片经室温平衡,石蜡切片经二甲苯脱蜡、酒精梯度处理,水化后继之按以下步骤进行。0.5%Triton X-100,37℃,30min;1%甲醇-H2O2封闭内源性过氧化物酶,37℃,30min,避光;10%正常羊血清封闭,37℃,30min;加兔抗NPY第一抗体,37℃孵育1h后,4℃孵育24℃;生物素化羊抗兔第二抗体(稀释度为1∶200),37℃,1h;ABC复合物(稀释度为1∶100),37℃,1h;以上各步分别用PBS(PH7.4)5min×3次充分漂洗;0.1M NaAc-HAc缓冲液,10min;2%硫酸镍铵加0.05%DAB,室温,10min;0.01%H2O2,镜下控制显色时间;0.1M NaAc-HAc缓中液中止显色;自来水充分漂洗,酒精梯度脱水,二甲苯透明,中性树胶封片。
, 百拇医药
阴性对照组:分别以正常兔血清和PBS代替第一抗体孵育,其它步骤与上述完全相同;在对照组实验中未发现阳性物出现,即无特异性反应。
1.3.3 图象分析
采用Cambridge QTM 970型图象分析系统,对NPY免疫阳性物进行定量检测,其阳性物放大倍数为40×2×20(物镜放大倍数×透射放大倍数×电路放大倍数)。每组随机测试6张切片,每一部位随机测试1个视野;分别测量免疫阳性物面积(area,μm2)、平均光密度(mean optical density,MOD)、积分光密度(integral optical density, IOD)和阳性物面密度(area density)。用光密度表示各蛋白的相对含量,因IOD结合了阳性物面积和MOD两方面因素,故主要选取IOD表示蛋白水平的相对含量。
1.4 统计方法
, http://www.100md.com
实验结果均以平均值±标准差(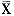 ±S)表示,两两比较采用Student' t检验,组间差异采用方差分析(ANOVA),继之以Duncan's检验;以P<0.05作为差异具有显著性的标准。
±S)表示,两两比较采用Student' t检验,组间差异采用方差分析(ANOVA),继之以Duncan's检验;以P<0.05作为差异具有显著性的标准。
2 结果
光镜下可见,NPY免疫阳性神经纤维呈蓝黑色的串珠状或线状样排列,背景着色较浅;阳性物主要分布于丘脑、下丘脑等脑区,分布丘脑室旁核(PV)、有许多阳性纤维沿第三脑室边缘行走,沿途分布所经过的核团,此外在下丘脑的弓状核(Arc)及正中隆起(ME)亦有分布。对PV及下丘脑背内侧核(DM)、下丘脑腹内侧核(VMH)的NPY免疫阳性纤维进行了图象分析,结果分别见表1-3。
从表1可以看出,各组NPY免疫阳性纤维在PV的IOD变化的情况是:在安静态下A、B、C、D各组之间IOD无显著性差异(P>0.05)。强化训练运动后即刻其IOD较运动前安静态显著增高(P<0.05),在运动结束后30分钟、3小时其IOD较运动前安静态仍继续升高(P<0.05,P<0.01)。强化训练加中药治疗运动后即刻其IOD虽均极显著高于D、E(P<0.01),但在运动结束后30分钟、3小时其IOD则逐渐显著性下降(P<0.05,P<0.01),呈现恢复的趋势;3小时其IOD较C组同时相点极显著性下降(P<0.01)。
, 百拇医药
从表2可以看出,各组NPY免疫阳性纤维在DM的IOD变化的情况是:在安静态下A、B、C、D各组之间IOD无显著性差异(P>0.05)。强化训练运动后即刻其IOD与运动前安静态无显著性差异(P>0.05);在运动结束后30分钟、3小时其IOD仍继续升高,其中运动后30min分别较运动前安静态、运动后即刻升高(P值<0.05);G分别较运动前安静态、运动后即刻、运动后30min升高(P<0.01,P<0.05,P<0.05)。强化训练加在药治疗运动后即刻其IOD较运动前安静态和C组运动后即刻无显著性差异(P>0.05),在运动结束后30分钟其IOD极显著高于运动后即刻(P<0.01),但运动结束后3小时其IOD得以恢复而较C组运动后3h,D组运动后30min极显著性下降(P<0.01)。
从表3可以看出,各组NPY免疫阳性纤维,在VMH的IOD变化情况是:在安静状态下A、B、C、D各组之间IOD无显著性差异(P>0.05)。强化训练运动后即刻、运动结束后30分钟其IOD较运动前安静态升高但均无显著性差异(P>0.05),至运动结束后3小时才分别显著高于运动前安静态、运动后即刻、运动后30min(P<0.05或P<0.01)。强化训练加中药治疗运动后即刻其IOD较运动前安静态显著长高(P<0.01);运动后30min继续升高,至运动结束后3小时其IOD分别显著高于运动前安静态、运动后即刻、30min和C组运动后3h(P<0.01或(P<0.05);运动后即刻、30min、3h其IOD均分别高于C组同时相点的IOD,其中运动后3h组IOD组显著升高(P<0.05)。
, http://www.100md.com
表1 各组大鼠丘脑室旁核NPY免疫阳性纤维图象分析结果(IOD;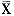 ±S)
±S)
Table 1 Results of image pattern analysis of NYP immune positive fibres in PV nuclues 组 别
Groups
安 静
at rest
即 刻
immediately after exercise
30分钟
, 百拇医药
30 minutes after exercise
3小时
3 hours after exersise
正常对照组
Control, A
593.591±202.796
—
—
—
训练对照组
Exercise control,B
, 百拇医药 1342.494±783.553
—
—
—
强化训练组
Heavy exercise, C
688.875±440.702
2010.92±542.034▲
3188.113±1517.885▲★
6738.316±2329.399
▲▲★★●●
, 百拇医药
中药治疗组
Treatment with TFK
1438.093±837.408
6755.584±1562.517▲▲
☆☆
3570.381±1429.138▲▲
★
3177.237±1452.584
▲★★☆☆
注:与运动前安静态比较 compared with baseline (at rest):▲P<0.05,▲▲P<0.01;
, 百拇医药
与运动后即刻点比较 compared with immediately after exercise:★P<0.05,★★P<0.01;
与30分钟恢复点比较 compared with 30 min after exercise:●●P<0.01;
与强化训练组各相应时相点比较 compared with heavy exercise at corresponding point:☆☆P<0.01
表2 各组大鼠下丘脑背内侧核NPY免疫阳性纤维图象分析结果(IOD;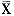 ±S)
±S)
Table 2 Results of image pattern analysis of NYP immune positive fibres in dorsomedial hypothalamic nucleus 组 别
, 百拇医药
Groups
安 静
at rest
即 刻
immediately after exercise
30分钟
30 minutes after exercise
3小时
3 hours after exersise
正常对照组
Control,A
, http://www.100md.com
1124.858±568.929
—
—
—
训练对照组
Exercise control,B
326.752±262.095
—
—
—
强化训练组
Heavy exercise,C
, 百拇医药
927.251±846.206
2236.369±1782.096
3125.774±1882.133▲★
4739.499±3047.719▲▲★●
中药治疗组
TReatment with TFK,D
1438.093±837.408
986.722±207.723
3928.605±1377.710▲▲★★
1299.815±625.420●●☆☆
, 百拇医药
注:与运动前安静态比较 compared with baseline (at rest):▲P<0.05,▲▲P<0.01;
与运动后即刻组比较 compared with immediately after exercise:★P<0.05,★★P<0.01;
与30分钟恢复点比较 compared with 30min after exercise:●P<0.05,●●P<0.01;
与强化训练组相应时相点比较 compared with heavy exercise at corresponding point:☆☆P<0.01;
表3 各组大鼠下丘脑腹内侧核NPY免疫阳性纤维图象分析结果(IOD;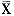 ±S)
±S)
, http://www.100md.com
Table 3 Results of image pattern analysis of NYP immune positive fibres of ventromedial hypothalamic nuclues 组 别
Groups
安 静
at rest
即 刻
immediately after exercise
30分钟
30 minutes after exercise
3小时
, 百拇医药
3 hours after exersise
正常对照组
Control,A
753.469±335.257
—
—
—
训练对照组
Exercise control,B
220.727±122.173
—
—
, 百拇医药
—
强化训练组
Heavy exercise,C
264.866±150.895
822.136±148.959
791.141±614.411
1779.561±1055.806▲▲★●
中药治疗组
Treatment with TFK,D
161.720±91.592
1299.08±284.050▲▲
, 百拇医药
1399.098±373.124▲▲
2541.506±927.684
▲▲★★●☆☆
注:与运动前安静态比较 compared with baseline (at rest):▲P<0.05,▲▲P<0.01;
与运动后即刻点比较 compared with immediately after exercise:★P<0.05,★★P<0.01;
与30分钟恢复点比较 compared with 30min after exercise:●P<0.05;
与强化训练组相应时相点比较 compared with heavy exercise at corresponding point:☆P<0.01。
, 百拇医药
3 讨论
NPY于1982年由Tatemoto等[2]首先从脑中分离并提纯出的一种具有生物活性的多肽,含36个氨基酸残基,分子中富含酪氨酸,因而命名为神经肽酪氨酸(neuropeptide tyrosine, NPY)。大鼠NPY的基因由7200bp组成。
NPY广泛分布于中枢神经系统和外周许多器官,如Allen等[3]用放免、组化技术研究在鼠脑内NPY免疫活性,表明NPY浓度从前脑至脑干逐渐减低,NPY免疫阳性细胞在大脑皮层(特别是深层细胞Ⅴ、Ⅵ层),尾状核、壳核及海马齿状回含量较高,其次为嗅前核、隔区、accumben核及杏仁复合体散在有NPY免疫阳性神经元胞体;在脑干,以大脑导水管周围、孤束核、三叉神经核浅层、终纹床核及丘脑室周围区域NPY含量较高。NPY免疫阳性神经纤维在很多种属脑血管中得到证实[4-9]。它还分布于心脏[10-12]、呼吸道[12]、胃肠道[12-14]、泌尿生殖道[15]、肾脏[16]、肾上腺[17]、交感神经节[18]等许多器官。
, 百拇医药
通过中枢系统的作用,NPY可以增加水和食盐的摄入[19]、抑制呼吸[20]、降低体温和血压[20]、减少黄体生成素的释放[21];在外周神经系统,它主要与去甲肾上腺素共存于交感神经系统中,并由交感神经末梢释放[22]。NPY对血管具有强烈收缩作用,表现在:①NPY直接收缩血管作用[23、24],②NPY能增强血管对其它血管收缩物质的反应[25],③NPY能抑制舒张血管物质的舒血管效应[26]。
血浆NPY在运动应激及其恢复过程中的变化已有报道,但未见有关脑组织NPY在运动应激中的变化。本实验结果经图象分析,NPY积分光密度于安静状态下在PV、DM、VMH等核团均无显著性差异,说明无论以何种训练强度以及是否经中药治疗,在安静状态下NPY在上述核团不被激活。强化训练运动后即刻NPY在PV、DM核团呈显著性增加,表明此强度的运动NPY被激活,并持续至运动结束后30分钟、3小时,尤以在VMH核团运动结束后3小时的变化最明显,这些变化可能与NPY前体的基因即mRNA转录增加或NPY的释放减少有关。经中药复方治疗后,运动结束后3小时NPY在PV、DM核团较未经中药复方“体复康”治疗的同时相点显著降低;而在VMH核团,经中药复方“体复康”治疗运动结束后3小时NPY显著增加,且显著高于未经中药复方治疗的同时相点组。
, 百拇医药
国内从中医药角度消除运动性疲劳方面,主要从补脾、补肾立法组方用药。我们认为在中医藏象学说中,肝脏的功能包括生理、心理两方面,与运动、疲劳均有联系;故在改善运动性疲劳和探讨疲劳机理上,除了脾、肾之外,对肝脏亦应加以关注[27]。因此,以理气、扶正为组方原则,方中枳壳,味苦、辛,性凉,能理气宽中;黄芪:味甘,性微温,归脾、肺经,能益气升阳,补中气不足。
上述结果表明:①一定强度(速度由15m/min递增到35m/min,运动时间为20至25min/d)长期(共7周)运动的大鼠,安静状态下在PV、DM、VMH等核团NPY无显著性变化;在此基础上的末次急性运动结束后3小时NPY变化尤为明显。②中药复方“体复康”对于慢性运动应激过程中NPY的调节作用不明显,在急性运动应激中,中药复方对NPY的调节在运动结束后3小时尤为明显,且呈双向的调节,即在PV、DM核团下调,而在VMH核团上调。
*国家自然科学基金重点项目(No.39430140)
, 百拇医药
参考文献
1.杨维益,陈家旭,梁 嵘,等.中药复方“体复康”对运动性疲劳大鼠血乳酸、β-内 啡肽、亮氨酸脑啡肽及强啡肽A1-13影响的实验研究.北京中医药大学学报 1997;20(4):37-40
2.Tatemoto K, Carlquist M, Mutt V. Neuropeptide Y-a novel brain peptide with structural similarities to peptide YY and pancreatic polypeptide. Nature 1982;296:659-60
3.Allen YS, Adrain TE, Allen JM, et al. Neuropeptide Y:Distribution in the rat brain. Science 1983;221:877-79
, 百拇医药
4.Allen JM, Schon F, Todd N, et al. Presence of neuropeptide Y in human circle of Willis and its possible role in cerebral vasospasm. Lancet 1984;8:550-552
5.Mejia JA, Pernow J, von Holst H, et al. Effect of neuropeptide Y, calcitonin gene-related substance P and capsiacin on cerebral arteries in man and animals. J Neurosurg 1988;69:913-918
6.Uemura Y, Sugimoto T, Okamoto S, et al. Changes of neuropeptide immunoreactivity in cerebral vascular nerve fibres after experimentally produced SAH. J Neurosurg 1987;66(5):741-47
, 百拇医药
7.Edvinsson L, Emson P, McCulloch J, et al. Neuropeptide Y:Cerebrovascular innervation and vasomoto effect in the cat. Neurosci Lett 1983;43(1):79-84
8.Everitt BJ, Hokfelt T, Terenius L, et al. Differential co-existance of neuropeptide Y-like immunoreactivity with catecholamine in the central nervous system of rat. Neurosci 1984;11(2):443-62
9.Hokfelt T, Lundberg JM, Tatemotok, et al. Neuropeptide Y (Npy)-and FMRFamide neuropeptide-like immuroreactivities in catecholamine neruons of the rat meulla oblongate. Acta Physiol Scand 1983;117(2):315-18
, 百拇医药
10.Gu J, Polak JM, Adrian TE, et al. Neuropeptide tyrosine (NPY)-A major cardiac neuropeptide. Lancet 1983;1(8332):1008-10
11.Gu J, Polak JM, Allen JM, et al. High concentrations of a novel peptide, neuropeptide Y, in the innervation of mouse and rat heart. J Histochem Cytochem 1984;32(5):367-72
12.Uddman R, Ekblad E, Edvinsson L, et al. Neuropeptide Y-like immunoreactivity in perivascular nerve fibres of the guinea pig. Regul Pept 1985;10(2-3):243-257
, 百拇医药
13.Ekblad E, Hakanson R, Sundler F. VIP and PHI co-exist with an NPY-like peptide in intramural neurons of the small intestine. Reaul Peot 1984:10(1):47-55
14.Koch TR, Roddy DR, Carney JA, et al. Distribution, quantitation, and origin of immunoreactive neuropeptide Y in the human gastro-intestinal tract. Regul Pept 1988;21(3-4);309-19
15.Feher E, Burnstock G. Ultra structural identification of vasoactive intestinal polypeptide and neuropeptide Y-containing nerve fibers in the vas deferens of the guinea-pig. J Auton Nerv Syst 1987;19(3):235-42
, 百拇医药
16.Ballesta J, Polak JM, Allen JM, et al. The nerves of the juxtaglomerular apparatus of man and other mammals contain the potent peptide NPY. Histochemistry 1984;80(5):483-85
17.Ma jane EA, Alho H, Kataoka Y, et al. Neuropeptide Y in bovine adrenal glands:Distribution and characterization. Endocrinology 1985;117(3):1162-68
18.Lundberg JM, Terenius L, Hokfelt T, et al. High levels of Neuropeptide Y in peripheral noradrenergic neurons in various mammals including man. Neurosci Lett 1983;42(2):167-72
, http://www.100md.com
19.Clark JT, Kalra PS, Crowley WR, et al. Neuropeptide Y and human pancreatic polypeptide stimulate feeding behavior in rats. Endocrinology 1984;115(1):427-29
20.Fuxe K, Agnati LF, Harfstrand A, et al. Central administration of neuropeptide Y induces hypotension, bradypnea and EEG synchronization in the rat. Acta Physiol Scand 1983;118(2):189-92
21.Kalra SP, Crowley WR. Norepinephrine-like effects of neuropeptide Y on LH release in the rat. Lift Sci 1984;35(11):1173-76
, http://www.100md.com
22.Franco-Cereceda A, Owall A, Settergren G, et al. Release of neuropeptide Y and noradrenaline from the human heart after aortic occlusion during coronary artery surgery. Cardiovasc Res 1990;24:242-46
23.Lundberg JM, Pernow J, Tatemoto K, et al. Pre-and postjunctional effects of NPY on sympathetic control of rat femoral artery. Acta Physiol Scand 1985;123(4):511-13
24.Dahlof C,dahlof P, Tatemoto K, et al. Neuropeptide Y(NPY) reduces field-stimulation evoked release of noradrenaline and enhances contractile force in the rat portal vein. Naunyn Schmiedebergs Arch Pharmacol 1985;328(3):327-30
, 百拇医药
25.Edvinesson L, Ekblad E, Hadanson R, et al. Neuropeptide Y potentiates the effect of various vasoconstrictor agents on rabbit blood vessels. Br J Pharmacol 1984;83(2):519-25
26.Abel PW, Han C. Effects of neuropeptide Y on contraction, relaxation and membrane potential of rabbit cerebral arteries. J Cardiovas Pharmacol 1989;13(1):52-63
27.杨维益,陈家旭,王天芳,等.运动性疲劳与中医肝脏的关系.北京中医药大学学报 1996;19(1):17-18
(1997.09.03收稿), 百拇医药
单位:陈家旭 杨维益 梁 嵘 刘晓兰 王天芳 李 峰 康纯洁 董 浩 刘 燕 (北京中医药大学(北京100029));高大安 吕丹云 冯连世 宗丕芳 周未艾 王启荣 (国家体育总局体育科学研究所)
关键词:中药复方“体复康”;运动性疲劳;神经肽Y;免疫组织化学
中国运动医学杂志980409 提要 为了从脑组织神经肽Y水平探索运动性疲劳产生及药物调节的机理,采用ABC免疫组织化学法结合图象分析,观察中药复方“体复康”对运动性疲劳大鼠不同脑区神经肽Y的动态变化。结果显示:一定强度(速度由15m/min递增至35m/min,运动时间为20至25min/d)长期(共7周)运动的大鼠,安静状态下在丘脑室旁核(PV)、下丘脑背内侧核(DM)、下丘脑腹内侧核(VMH)等核团NPY无显著性变化;在此基础上的末次急性运动结束后3小时NPY变化尤为明显。中药复方“体复康”对于慢性运动应激过程中NPY的调节作用不明显,在急性运动应激中,中药复方对NPY的调节在运动结束后3小时尤为明显,且呈双向调节,即在PV、DM核团下调,而在VMH核团上调。结论:神经肽Y在运动性疲劳大鼠不同脑区呈现不同的动态变化趋势,中药复方“体复康”对NPY有双向调节作用。
, http://www.100md.com
Dynamic Effect of “Tifukang” Recipe on Neuropeptide Y of Brain in Rats
with Exercise-induced Fatigue
Chen Jiaxu, Yang Weiyi, Liang Rong, et al
Beijing University of Chinese Medicine and Pharmacology,Beijing 100029
The mechnism of exercise-induced fatigue(EIF) and the effect of “Tifukang” Recipe(TFK) on neuropeptide Y(NPY) of brain in rat with EIF were studied. Avidin-biotin-complex immunohistochemistry and image pattern analysis were used to observe the effect of TFK on the changes of NPY in different areas of brain. Results: After long term(7 weeks) and high intensity exercise (from 15m/min gradually increased to 35m/min, 20 to 25min/d), at rest, NPY was unchanged in paraventricularthalamic (PV),dorsomedial hypothalamic (DM) nucleus and ventromedial hypothalamic(VMH) nuclues, however, at 3 hours postexercise after final exercise it changed obviously. NPY was not remarkably affected in the chronic fatigue stress by TFK, but it was regulated bidirectionally by TFK, expecially at 3 hours post-exercise in the acute fatigue stress :down in PV and DM, while up in VMH.Conclusion:The dynamic changes of NPY in different areas of brain in rat with EIF were different, and TFK had bidirectionally regulating effect on NPY.
, 百拇医药
Key words: “Tifukang” Recipe, exercise-induced fatigue, neuropeptide Y, immunohistochemistry
运动性疲劳的机理和恢复问题是当今运动医学中的研究热点。运动作为一种应激源,血浆中NPY的变化已有报道,但关于NPY在运动性疲劳大鼠不同脑区及中药作用后的变化尚未见报道。我们在过去的研究中,以理气、扶正组方研制的中药复方“体复康”对运动性疲劳大鼠血浆内源性阿片肽有明显调节作用[1]。在此工作的基础上,运用ABC免疫组织化学法并结合图象分析,进一步定位定量研究NPY在运动性疲劳过程中的动态变化及该复方的调节作用。
1 材料与方法
1.1 材料
动物:二级Spargue-Dawley雄性大鼠,体重180~220g。由北京医科大学、解放军301医院等实验动物中心提供。
, http://www.100md.com
药物:本实验所用中药复方“体复康”以理气、扶正为组方原则,由枳壳、黄芪等组成,并由同仁堂制药集团公司加工成软胶囊。
1.2 方法
1.2.1 造模方法
适应训练:实验动物(200只)置于室温(20±2℃)实验室中,每5只1笼,自由进食饮水;适应实验环境1~2天后开始训练,采用递增强度的方式在国产电动鼠类跑台(购自杭州)上运动,坡度为0。从训练第1周起,每周递增速度,每周速度分别为15m/min、22m/min、27m/min、31m/min、35m/min。每天训练20min,每周5d,共训练5周。第5周后按以下方案进行训练。
一般训练:于第6、7周每只动物每日按35m/min的速度,在坡度为0的跑台上跑20min。
强化训练:于第6、7周每只动物每日按35m/min的速度,在坡度为0的跑台上跑25min。
, 百拇医药
造模期间于每周星期一、四测动物体重,造模周期共计7周,于第8周始取材,末次运动速度仍为35m/min,时间为30min。
1.2.2 实验分组
安静对照组(A组,n=13):自实验开始第1~7周直到第8周取材日不进行任何运动训练。
训练对照组(B组,n=12):接受5周的适应训练后,进一步进行2周的一般训练,于第8周取材日安静状态下取材。
强化训练组(C组,n=56):接受5周的适应训练后,再接受2周的强化训练。于第8周取材日将动物随机分为运动前安静态、运动后即刻、运动结束后30min与3h。
强化训练加中药治疗组(D组 n=53):接受5周的适应训练后,再接受2周的强化训练。于第8周取材日将动物随机分为运动前安静态、运动后即刻、运动结束后30min与3h。
, http://www.100md.com
1.2.3 给药方法
中药治疗组:在接受强化训练期间,每日于训练后1h灌胃中药3ml(将软胶囊按比例溶解,配制成相当于含生药1kg/L的药液,按10g/Kg的给药剂量,300g的大鼠应给药3ml)。其余各组则灌胃等体积的蒸馏水。
1.3 观察指标与方法
1.3.1 标本制备
大鼠经10%水合氯醛(400mg/kg体重)麻醉后,剖开胸腔,经左心室向升主动脉插管,先以预冷的0.9%生理盐水速灌冲洗,一般约需100-200ml,直至流出液体变清为止;继之灌入预冷的4%多聚甲醛溶液(0.1M PB配制,PH7.4)300ml,约30分钟;取脑置于4%多聚甲醛溶液中4℃后固定6-10小时。然后将脑组织移至20%蔗糖溶液(0.1M PB配制,PH7.4)中于4℃保存,待组织下沉后,液氮骤冷,于-20℃在LELCA-CM1900型恒冷箱切片机中制备10μm切片,裱贴在预先经2%APES(3-aminopropyltriethoxysilane,购自北京中山生物技术有限公司)胶处理的载玻片上,空气中干燥后置-70℃冰箱中备用。
, http://www.100md.com
石蜡标本制备:大鼠经10%水合氯醛麻醉后,立即断头处死,取脑置于10%中性缓冲福尔马林液(0.01M PB配制,PH7.0)中充分固定,常规酒精梯度脱水、二甲苯透明、石蜡(熔点56~58℃)包埋,制备4μm切片裱贴在预先经2%APES胶处理的载玻片上,备用。
1.3.2 ABC免疫组织化学染色程序
试剂:兔抗NPY血清(抗体稀释度为1∶1500,购自西安第四军医大学)、PK-4001兔ABC试剂盒(Vector公司产品,购自北京中山生物技术有限公司)、DAB购自Sigma公司。
冰冻切片经室温平衡,石蜡切片经二甲苯脱蜡、酒精梯度处理,水化后继之按以下步骤进行。0.5%Triton X-100,37℃,30min;1%甲醇-H2O2封闭内源性过氧化物酶,37℃,30min,避光;10%正常羊血清封闭,37℃,30min;加兔抗NPY第一抗体,37℃孵育1h后,4℃孵育24℃;生物素化羊抗兔第二抗体(稀释度为1∶200),37℃,1h;ABC复合物(稀释度为1∶100),37℃,1h;以上各步分别用PBS(PH7.4)5min×3次充分漂洗;0.1M NaAc-HAc缓冲液,10min;2%硫酸镍铵加0.05%DAB,室温,10min;0.01%H2O2,镜下控制显色时间;0.1M NaAc-HAc缓中液中止显色;自来水充分漂洗,酒精梯度脱水,二甲苯透明,中性树胶封片。
, 百拇医药
阴性对照组:分别以正常兔血清和PBS代替第一抗体孵育,其它步骤与上述完全相同;在对照组实验中未发现阳性物出现,即无特异性反应。
1.3.3 图象分析
采用Cambridge QTM 970型图象分析系统,对NPY免疫阳性物进行定量检测,其阳性物放大倍数为40×2×20(物镜放大倍数×透射放大倍数×电路放大倍数)。每组随机测试6张切片,每一部位随机测试1个视野;分别测量免疫阳性物面积(area,μm2)、平均光密度(mean optical density,MOD)、积分光密度(integral optical density, IOD)和阳性物面密度(area density)。用光密度表示各蛋白的相对含量,因IOD结合了阳性物面积和MOD两方面因素,故主要选取IOD表示蛋白水平的相对含量。
1.4 统计方法
, http://www.100md.com
实验结果均以平均值±标准差(
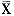 ±S)表示,两两比较采用Student' t检验,组间差异采用方差分析(ANOVA),继之以Duncan's检验;以P<0.05作为差异具有显著性的标准。
±S)表示,两两比较采用Student' t检验,组间差异采用方差分析(ANOVA),继之以Duncan's检验;以P<0.05作为差异具有显著性的标准。2 结果
光镜下可见,NPY免疫阳性神经纤维呈蓝黑色的串珠状或线状样排列,背景着色较浅;阳性物主要分布于丘脑、下丘脑等脑区,分布丘脑室旁核(PV)、有许多阳性纤维沿第三脑室边缘行走,沿途分布所经过的核团,此外在下丘脑的弓状核(Arc)及正中隆起(ME)亦有分布。对PV及下丘脑背内侧核(DM)、下丘脑腹内侧核(VMH)的NPY免疫阳性纤维进行了图象分析,结果分别见表1-3。
从表1可以看出,各组NPY免疫阳性纤维在PV的IOD变化的情况是:在安静态下A、B、C、D各组之间IOD无显著性差异(P>0.05)。强化训练运动后即刻其IOD较运动前安静态显著增高(P<0.05),在运动结束后30分钟、3小时其IOD较运动前安静态仍继续升高(P<0.05,P<0.01)。强化训练加中药治疗运动后即刻其IOD虽均极显著高于D、E(P<0.01),但在运动结束后30分钟、3小时其IOD则逐渐显著性下降(P<0.05,P<0.01),呈现恢复的趋势;3小时其IOD较C组同时相点极显著性下降(P<0.01)。
, 百拇医药
从表2可以看出,各组NPY免疫阳性纤维在DM的IOD变化的情况是:在安静态下A、B、C、D各组之间IOD无显著性差异(P>0.05)。强化训练运动后即刻其IOD与运动前安静态无显著性差异(P>0.05);在运动结束后30分钟、3小时其IOD仍继续升高,其中运动后30min分别较运动前安静态、运动后即刻升高(P值<0.05);G分别较运动前安静态、运动后即刻、运动后30min升高(P<0.01,P<0.05,P<0.05)。强化训练加在药治疗运动后即刻其IOD较运动前安静态和C组运动后即刻无显著性差异(P>0.05),在运动结束后30分钟其IOD极显著高于运动后即刻(P<0.01),但运动结束后3小时其IOD得以恢复而较C组运动后3h,D组运动后30min极显著性下降(P<0.01)。
从表3可以看出,各组NPY免疫阳性纤维,在VMH的IOD变化情况是:在安静状态下A、B、C、D各组之间IOD无显著性差异(P>0.05)。强化训练运动后即刻、运动结束后30分钟其IOD较运动前安静态升高但均无显著性差异(P>0.05),至运动结束后3小时才分别显著高于运动前安静态、运动后即刻、运动后30min(P<0.05或P<0.01)。强化训练加中药治疗运动后即刻其IOD较运动前安静态显著长高(P<0.01);运动后30min继续升高,至运动结束后3小时其IOD分别显著高于运动前安静态、运动后即刻、30min和C组运动后3h(P<0.01或(P<0.05);运动后即刻、30min、3h其IOD均分别高于C组同时相点的IOD,其中运动后3h组IOD组显著升高(P<0.05)。
, http://www.100md.com
表1 各组大鼠丘脑室旁核NPY免疫阳性纤维图象分析结果(IOD;
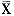 ±S)
±S)Table 1 Results of image pattern analysis of NYP immune positive fibres in PV nuclues 组 别
Groups
安 静
at rest
即 刻
immediately after exercise
30分钟
, 百拇医药
30 minutes after exercise
3小时
3 hours after exersise
正常对照组
Control, A
593.591±202.796
—
—
—
训练对照组
Exercise control,B
, 百拇医药 1342.494±783.553
—
—
—
强化训练组
Heavy exercise, C
688.875±440.702
2010.92±542.034▲
3188.113±1517.885▲★
6738.316±2329.399
▲▲★★●●
, 百拇医药
中药治疗组
Treatment with TFK
1438.093±837.408
6755.584±1562.517▲▲
☆☆
3570.381±1429.138▲▲
★
3177.237±1452.584
▲★★☆☆
注:与运动前安静态比较 compared with baseline (at rest):▲P<0.05,▲▲P<0.01;
, 百拇医药
与运动后即刻点比较 compared with immediately after exercise:★P<0.05,★★P<0.01;
与30分钟恢复点比较 compared with 30 min after exercise:●●P<0.01;
与强化训练组各相应时相点比较 compared with heavy exercise at corresponding point:☆☆P<0.01
表2 各组大鼠下丘脑背内侧核NPY免疫阳性纤维图象分析结果(IOD;
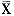 ±S)
±S)Table 2 Results of image pattern analysis of NYP immune positive fibres in dorsomedial hypothalamic nucleus 组 别
, 百拇医药
Groups
安 静
at rest
即 刻
immediately after exercise
30分钟
30 minutes after exercise
3小时
3 hours after exersise
正常对照组
Control,A
, http://www.100md.com
1124.858±568.929
—
—
—
训练对照组
Exercise control,B
326.752±262.095
—
—
—
强化训练组
Heavy exercise,C
, 百拇医药
927.251±846.206
2236.369±1782.096
3125.774±1882.133▲★
4739.499±3047.719▲▲★●
中药治疗组
TReatment with TFK,D
1438.093±837.408
986.722±207.723
3928.605±1377.710▲▲★★
1299.815±625.420●●☆☆
, 百拇医药
注:与运动前安静态比较 compared with baseline (at rest):▲P<0.05,▲▲P<0.01;
与运动后即刻组比较 compared with immediately after exercise:★P<0.05,★★P<0.01;
与30分钟恢复点比较 compared with 30min after exercise:●P<0.05,●●P<0.01;
与强化训练组相应时相点比较 compared with heavy exercise at corresponding point:☆☆P<0.01;
表3 各组大鼠下丘脑腹内侧核NPY免疫阳性纤维图象分析结果(IOD;
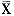 ±S)
±S), http://www.100md.com
Table 3 Results of image pattern analysis of NYP immune positive fibres of ventromedial hypothalamic nuclues 组 别
Groups
安 静
at rest
即 刻
immediately after exercise
30分钟
30 minutes after exercise
3小时
, 百拇医药
3 hours after exersise
正常对照组
Control,A
753.469±335.257
—
—
—
训练对照组
Exercise control,B
220.727±122.173
—
—
, 百拇医药
—
强化训练组
Heavy exercise,C
264.866±150.895
822.136±148.959
791.141±614.411
1779.561±1055.806▲▲★●
中药治疗组
Treatment with TFK,D
161.720±91.592
1299.08±284.050▲▲
, 百拇医药
1399.098±373.124▲▲
2541.506±927.684
▲▲★★●☆☆
注:与运动前安静态比较 compared with baseline (at rest):▲P<0.05,▲▲P<0.01;
与运动后即刻点比较 compared with immediately after exercise:★P<0.05,★★P<0.01;
与30分钟恢复点比较 compared with 30min after exercise:●P<0.05;
与强化训练组相应时相点比较 compared with heavy exercise at corresponding point:☆P<0.01。
, 百拇医药
3 讨论
NPY于1982年由Tatemoto等[2]首先从脑中分离并提纯出的一种具有生物活性的多肽,含36个氨基酸残基,分子中富含酪氨酸,因而命名为神经肽酪氨酸(neuropeptide tyrosine, NPY)。大鼠NPY的基因由7200bp组成。
NPY广泛分布于中枢神经系统和外周许多器官,如Allen等[3]用放免、组化技术研究在鼠脑内NPY免疫活性,表明NPY浓度从前脑至脑干逐渐减低,NPY免疫阳性细胞在大脑皮层(特别是深层细胞Ⅴ、Ⅵ层),尾状核、壳核及海马齿状回含量较高,其次为嗅前核、隔区、accumben核及杏仁复合体散在有NPY免疫阳性神经元胞体;在脑干,以大脑导水管周围、孤束核、三叉神经核浅层、终纹床核及丘脑室周围区域NPY含量较高。NPY免疫阳性神经纤维在很多种属脑血管中得到证实[4-9]。它还分布于心脏[10-12]、呼吸道[12]、胃肠道[12-14]、泌尿生殖道[15]、肾脏[16]、肾上腺[17]、交感神经节[18]等许多器官。
, 百拇医药
通过中枢系统的作用,NPY可以增加水和食盐的摄入[19]、抑制呼吸[20]、降低体温和血压[20]、减少黄体生成素的释放[21];在外周神经系统,它主要与去甲肾上腺素共存于交感神经系统中,并由交感神经末梢释放[22]。NPY对血管具有强烈收缩作用,表现在:①NPY直接收缩血管作用[23、24],②NPY能增强血管对其它血管收缩物质的反应[25],③NPY能抑制舒张血管物质的舒血管效应[26]。
血浆NPY在运动应激及其恢复过程中的变化已有报道,但未见有关脑组织NPY在运动应激中的变化。本实验结果经图象分析,NPY积分光密度于安静状态下在PV、DM、VMH等核团均无显著性差异,说明无论以何种训练强度以及是否经中药治疗,在安静状态下NPY在上述核团不被激活。强化训练运动后即刻NPY在PV、DM核团呈显著性增加,表明此强度的运动NPY被激活,并持续至运动结束后30分钟、3小时,尤以在VMH核团运动结束后3小时的变化最明显,这些变化可能与NPY前体的基因即mRNA转录增加或NPY的释放减少有关。经中药复方治疗后,运动结束后3小时NPY在PV、DM核团较未经中药复方“体复康”治疗的同时相点显著降低;而在VMH核团,经中药复方“体复康”治疗运动结束后3小时NPY显著增加,且显著高于未经中药复方治疗的同时相点组。
, 百拇医药
国内从中医药角度消除运动性疲劳方面,主要从补脾、补肾立法组方用药。我们认为在中医藏象学说中,肝脏的功能包括生理、心理两方面,与运动、疲劳均有联系;故在改善运动性疲劳和探讨疲劳机理上,除了脾、肾之外,对肝脏亦应加以关注[27]。因此,以理气、扶正为组方原则,方中枳壳,味苦、辛,性凉,能理气宽中;黄芪:味甘,性微温,归脾、肺经,能益气升阳,补中气不足。
上述结果表明:①一定强度(速度由15m/min递增到35m/min,运动时间为20至25min/d)长期(共7周)运动的大鼠,安静状态下在PV、DM、VMH等核团NPY无显著性变化;在此基础上的末次急性运动结束后3小时NPY变化尤为明显。②中药复方“体复康”对于慢性运动应激过程中NPY的调节作用不明显,在急性运动应激中,中药复方对NPY的调节在运动结束后3小时尤为明显,且呈双向的调节,即在PV、DM核团下调,而在VMH核团上调。
*国家自然科学基金重点项目(No.39430140)
, 百拇医药
参考文献
1.杨维益,陈家旭,梁 嵘,等.中药复方“体复康”对运动性疲劳大鼠血乳酸、β-内 啡肽、亮氨酸脑啡肽及强啡肽A1-13影响的实验研究.北京中医药大学学报 1997;20(4):37-40
2.Tatemoto K, Carlquist M, Mutt V. Neuropeptide Y-a novel brain peptide with structural similarities to peptide YY and pancreatic polypeptide. Nature 1982;296:659-60
3.Allen YS, Adrain TE, Allen JM, et al. Neuropeptide Y:Distribution in the rat brain. Science 1983;221:877-79
, 百拇医药
4.Allen JM, Schon F, Todd N, et al. Presence of neuropeptide Y in human circle of Willis and its possible role in cerebral vasospasm. Lancet 1984;8:550-552
5.Mejia JA, Pernow J, von Holst H, et al. Effect of neuropeptide Y, calcitonin gene-related substance P and capsiacin on cerebral arteries in man and animals. J Neurosurg 1988;69:913-918
6.Uemura Y, Sugimoto T, Okamoto S, et al. Changes of neuropeptide immunoreactivity in cerebral vascular nerve fibres after experimentally produced SAH. J Neurosurg 1987;66(5):741-47
, 百拇医药
7.Edvinsson L, Emson P, McCulloch J, et al. Neuropeptide Y:Cerebrovascular innervation and vasomoto effect in the cat. Neurosci Lett 1983;43(1):79-84
8.Everitt BJ, Hokfelt T, Terenius L, et al. Differential co-existance of neuropeptide Y-like immunoreactivity with catecholamine in the central nervous system of rat. Neurosci 1984;11(2):443-62
9.Hokfelt T, Lundberg JM, Tatemotok, et al. Neuropeptide Y (Npy)-and FMRFamide neuropeptide-like immuroreactivities in catecholamine neruons of the rat meulla oblongate. Acta Physiol Scand 1983;117(2):315-18
, 百拇医药
10.Gu J, Polak JM, Adrian TE, et al. Neuropeptide tyrosine (NPY)-A major cardiac neuropeptide. Lancet 1983;1(8332):1008-10
11.Gu J, Polak JM, Allen JM, et al. High concentrations of a novel peptide, neuropeptide Y, in the innervation of mouse and rat heart. J Histochem Cytochem 1984;32(5):367-72
12.Uddman R, Ekblad E, Edvinsson L, et al. Neuropeptide Y-like immunoreactivity in perivascular nerve fibres of the guinea pig. Regul Pept 1985;10(2-3):243-257
, 百拇医药
13.Ekblad E, Hakanson R, Sundler F. VIP and PHI co-exist with an NPY-like peptide in intramural neurons of the small intestine. Reaul Peot 1984:10(1):47-55
14.Koch TR, Roddy DR, Carney JA, et al. Distribution, quantitation, and origin of immunoreactive neuropeptide Y in the human gastro-intestinal tract. Regul Pept 1988;21(3-4);309-19
15.Feher E, Burnstock G. Ultra structural identification of vasoactive intestinal polypeptide and neuropeptide Y-containing nerve fibers in the vas deferens of the guinea-pig. J Auton Nerv Syst 1987;19(3):235-42
, 百拇医药
16.Ballesta J, Polak JM, Allen JM, et al. The nerves of the juxtaglomerular apparatus of man and other mammals contain the potent peptide NPY. Histochemistry 1984;80(5):483-85
17.Ma jane EA, Alho H, Kataoka Y, et al. Neuropeptide Y in bovine adrenal glands:Distribution and characterization. Endocrinology 1985;117(3):1162-68
18.Lundberg JM, Terenius L, Hokfelt T, et al. High levels of Neuropeptide Y in peripheral noradrenergic neurons in various mammals including man. Neurosci Lett 1983;42(2):167-72
, http://www.100md.com
19.Clark JT, Kalra PS, Crowley WR, et al. Neuropeptide Y and human pancreatic polypeptide stimulate feeding behavior in rats. Endocrinology 1984;115(1):427-29
20.Fuxe K, Agnati LF, Harfstrand A, et al. Central administration of neuropeptide Y induces hypotension, bradypnea and EEG synchronization in the rat. Acta Physiol Scand 1983;118(2):189-92
21.Kalra SP, Crowley WR. Norepinephrine-like effects of neuropeptide Y on LH release in the rat. Lift Sci 1984;35(11):1173-76
, http://www.100md.com
22.Franco-Cereceda A, Owall A, Settergren G, et al. Release of neuropeptide Y and noradrenaline from the human heart after aortic occlusion during coronary artery surgery. Cardiovasc Res 1990;24:242-46
23.Lundberg JM, Pernow J, Tatemoto K, et al. Pre-and postjunctional effects of NPY on sympathetic control of rat femoral artery. Acta Physiol Scand 1985;123(4):511-13
24.Dahlof C,dahlof P, Tatemoto K, et al. Neuropeptide Y(NPY) reduces field-stimulation evoked release of noradrenaline and enhances contractile force in the rat portal vein. Naunyn Schmiedebergs Arch Pharmacol 1985;328(3):327-30
, 百拇医药
25.Edvinesson L, Ekblad E, Hadanson R, et al. Neuropeptide Y potentiates the effect of various vasoconstrictor agents on rabbit blood vessels. Br J Pharmacol 1984;83(2):519-25
26.Abel PW, Han C. Effects of neuropeptide Y on contraction, relaxation and membrane potential of rabbit cerebral arteries. J Cardiovas Pharmacol 1989;13(1):52-63
27.杨维益,陈家旭,王天芳,等.运动性疲劳与中医肝脏的关系.北京中医药大学学报 1996;19(1):17-18
(1997.09.03收稿), 百拇医药