单纯肥胖症脂质代谢紊乱的运动防治——Ⅱ.有氧运动对饮食诱导肥胖大鼠肝脏低密度脂蛋白受体活性调节的影响*
作者:张 勇 颜宜** 杨锡让 蔡海江
单位:张 勇 (天津体育学院运动医学研究所(300381);颜宜 杨锡让 (北京体育大学人体运动科学系);蔡海江 (南京医科大学动脉粥样硬化研究中心)
关键词:高胆固醇血症;肥胖;肝脏;低密度脂蛋白受体;运动
单纯肥胖症脂质代谢紊乱的运动防治 提要 研究了实验性高胆固醇血症肥胖大鼠肝脏低密度脂蛋白受体(LDL-R)活性变化及有氧运动对LDL-R活性调节的影响。结果显示,12和20周饮食诱导高胆固醇血症肥胖大鼠血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)显著增高,伴随肝组织LDL-R活性显著降低。12周实验模型后,8周有氧运动结合饮食干预,肝脏LDL-R结合活性较同期高脂膳食组提高58.3%(P<0.05),单纯运动干预LDL-R结合活性也有增加趋势(增加21.9%),单纯饮食干预则无明显变化。研究提示:(1)高胆固醇负荷时细胞可通过下行调节影响LDL-R活性;(2)运动可能通过增加对细胞内胆固醇利用和降解,反馈作用于下行调节过程影响LDL-R的合成,增加对LDL-C摄取而改善血脂水平。
, 百拇医药
A Study on Prevention and Treatment of Lipid Metabolism Disorders in Simple
Obesity through Exercise. Part Ⅱ. Effect of Aerobic Exercise on Regulating Activity of
Hepatic LDL-R in Rats with Diet-induced Simple Obesity and Hypercholesterolemia
Zhang Yong, Yan Yicai, Yang Xirang, et al
Tianjin Research Institute of Sports Medicine, Tianjin 300381,China
, 百拇医药
The aim of the pressent study was to determine the effects of exercise on activities of hepatic low density lipoprotein receptor (LDL-R) in experimental obese and hypercholesterolemic rats. Using a specific assay for the binding of 125Ⅰ-LDL receptor to homogenate, the activities of hepatic LDL-R were measured. It was observed that the activity of LDL-R significantly decreased in diet-induced obese and hypercholesterolemic rats after high-cholesterol diet for 12 weeks. The aerobic exercise combined with diet and simple exercise therapy induced the increases in 58.3% and 21.9% of LDL-R activity, respectively, and LDL-R activity was unchanged in the rats with diet alone. These finding suggested:(1)LDL-R activity was regulated downward in cholesterol-loaded rats;(2) Exercise might have a feedback effect on the down-regulated synthesis of LDL-R through an enhanced degradation of intracellular cholesterol, which contributed to a lowering of plasma levels of LDL-C.
, 百拇医药
Key words: hypercholesteremia, obesity, liver, low density lipoprotein receptor, exercise
肥胖作为心血管疾病(CVD)的危险因素,与血脂质代谢紊乱密切相关。高脂肪,特别是饱和脂肪酸(SFA)的过量摄入是促使血清胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)增高,易患CVD的主要原因[1]。在本研究的另一部分实验中我们观察到,饮食诱导高胆固醇血症肥胖大鼠血清TC、LDL和载脂蛋白B-100(ApoB-100)水平墒高,脂质代谢紊乱。而长期有氧运动可明显改善其脂代谢水平,有效控制高胆固醇血症时的致动脉粥样硬化(AS)危险因素[2]。但是,对这些变化的机制还不完全清楚。尤其是与摄取和降解LDL密切相关的肝脏LDL-R途径在这一代谢过程变化中是否有重要的调节作用尚未见报道。肝脏是体内转化胆固醇并将胆固醇排出体外的唯一器官。血清LDL-C的摄取与降解主要由肝细胞表面的LDL受体(LDL-R)介导实现。离体及整体实验均证实,当细胞内胆固醇浓度增加或需要量减少时可下行调节(down-regulation)LDL-R的合成,使受体数目减少,血清胆固醇、LDL-C代谢障碍[3]。为此,我们应用肝组织匀浆125Ⅰ-LDL特异性结合膜滤过法,观察了长期有氧运动及饮食干预对实验性高胆固醇血症肥胖大鼠肝脏LDL-R活性调节的影响,并与所观察到的脂蛋白代谢比较,探讨有氧运动降低TC和LDL的可能机理。
, 百拇医药
1 材料与方法
1.1 饮食诱导高胆固醇血症肥胖大鼠实验动物模型及运动方式和程序
离乳雄性Sprague-Dawley大鼠55只,由国家计生委实验动物中心提供。随机分组,单笼饲养,自由饮水摄食。对照组动物饲以市售标准啮齿饲料(基础、低脂饲料),高脂组动物饲以按配方配制的高脂饲料,含基础饲料76.5%、胆固醇3%、胆酸钠0.5%、酪蛋白10%、猪油10%。实验动物分组如下:(1)高脂血症肥胖实验模型组:普通膳食12周和20周对照组(L12和L20)及高脂膳食12周和20周实验组(H20和H20)。观察肥胖及高血脂症,以确定模型建立。Lee Index(肥胖评定指数)[4]:在每一实验期结束处死动物前后分别准确称量体重和测量鼻肛身长,并按公式计算Lee Indes. Lee Indes=[3体重(g)/身长(cm)]×1000,经统计学处理比较组间Lee Index 均值差异的显著性。(2)运动及饮食干预组:高脂12周+高脂运动8周组(HHE)、高脂12周+低脂8周组(HL)和高脂12周+低脂运动8周组(HLE)。运动方式及程序:采用无负重游泳方式,游泳水温29±2℃。前2周每天运动1小时,每周5天。后6周每天运动增至1.5小时,每周5天。
, 百拇医药
1.2 实验样本处理
在每一实验期结束处死动物前禁食12小时,于安静状态下断头取血液样本,4℃下离心分离血清。取血后迅速取出肝脏,液氮冻存备用,实验前移至-70℃冰箱。
1.3 血清脂质、脂蛋白测定
测试药盒购自上海荣盛生物技术公司。(1)总胆固醇(TC):依POD酶法;(2)低密度脂蛋白(LDL):聚乙稀硫酸(PVC)沉淀法。
1.4 肝组织匀浆LDL-R活性测定
1.4.1 血浆脂蛋白分离及放射标记
新鲜健康人空腹血清用Beckman L8-80型超速离心机,Ti80转头,按序列超速离心法分离脂蛋白各组分[5]。LDL密度为1.019-1.062g/ml。经充分透析和滤菌后,按改良McFarlane氏单氯化碘(ICL)法[6],用无载体Na125I(购至中国科学院原子能研究所)进行标记。125I-LDL放射比活性为90~136cpm/ng。
, 百拇医药
1.4.2 肝组织匀浆制备
按Rudling等[7]方法进行。匀浆解冻后,称肝组织0.4~0.6克(湿重),分别置于含2.4ml Buffer A (50mmol/L Nacl, 1mmol CaCl2/L及20mmol/L Tris-HCl,pH7.5)的5ml塑料试管中,机械匀浆(中速15Sec,随后高速20Sce),用6号针头反复抽打组织匀浆10次,然后经尼龙网(250μm)过滤。以上操作步骤于4℃下进行。
组织匀浆蛋白定量依Lowry氏法。将已测定蛋白含量的组织匀浆置于-70℃贮存备用。
1.4.3 组织匀浆与125Ⅰ-LDL的结合
按Rudlkng等[7]方法进行。组织匀浆解冻后,用6号针头重新反复抽打10次。结合反应于1.5ml聚乙烯塑料管中进行。取组织匀浆蛋白50μl,加入Buffer B(100mmol/L NaCl,0.5mmol CaCl2,50mmol/L Tris-HCl及20mg/ml BSA,pH7.5)950μl,混匀。取已加Buffer B的组织匀浆蛋白两管,每管100μl,一管结合(125Ⅰ-LDL标记)前约20min先加入过量25倍未标记的冷LDL(约13μl),然后两管同时加入20μg/ml 125Ⅰ-LDL,分别为非特异结合和总结合。0℃孵育2小时,将反应混合液加到混合纤维素酯微孔滤膜上,真空抽滤,用25ml缓冲液洗涤滤膜,除去游离125Ⅰ-LDL,然后将滤膜移至聚乙烯塑料试管中,测定125Ⅰ的放射活性(cpm)。
, 百拇医药
滤膜使用前在Buffer C(100mmol/NaCl,0.5mmol CaCl2,50mmol/L Tris-HCl及0.1mg/mlBSA,pH7.5)中浸泡过夜,加预先用0.45μm滤膜滤过的1ml小牛血清于膜上,开始抽滤,随后用2ml Buffer C洗,再将结合反应液加至滤膜上,用25ml Buffer C洗涤滤膜,最后将滤膜小心移至聚乙烯塑料管中,在SN-684放免γ-计数器上测定125Ⅰ的放射活性(cpm)。
125Ⅰ-LDL受体特异结合(cpm)=总结合(cpm)-过量未标记LDL非特异结合(cpm)
125Ⅰ-LDL受体活性经换算以ng/mg pr.表示。
1.5 统计学处理
实验数据用SAS统计软件包处理。结果用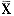 ±S表示,组间样本均数差异显著性用t检验法比较。
±S表示,组间样本均数差异显著性用t检验法比较。
, 百拇医药
2 结果与分析
2.1 大鼠体重和Lee指数、血脂变化
H12和H20组分别较L12和L20组体重增高6%和8%(p>0.05),而Lee Index分别较同期低脂对照组显著性增高(p<0.01)(见表1)。Lee指数是通常采用的实验动物肥胖评定标准,Lee指数与体内脂肪呈显著正相关[4]。H12和H20组血清TC和LDL均较同期对照组显著增高(见表2),即经12周和20周高脂饮食诱导,大鼠呈单纯肥胖并伴随脂质代谢紊乱,出现典型高胆固醇(高LDL)血症。
表1 12周和20周实验期实验动物形态学指标变化
Table 1 Changes of morphonetric data of experimental rats during the period of 12 and 20 weeks (X±SD)
, 百拇医药
Groups(n)
体重 Body Weight(g)
身长 Nasonanal Length (cm)
Lee 指数Lee Indes
L12(n=6)
H12(n=10)
L20(n=6)
H20(n=9)
HHE(n=8)
HL(n=8)
HLE(n=8)
, http://www.100md.com
355.00±79.6
375.45±21.1
395.00±42.3
425.56±66.0
398.75±53.3
365.00±63.9
365.25±45.3Δ
23.08±0.74
22.86±0.93
23.88±0.55
23.42±0.87
, 百拇医药
23.90±0.88
23.18±1.25
23.13±0.64
306.55±6.13
315.43±6.13*
306.77±5.90
320.52±12.9*
307.51±10.8#
307.45±7.33#
306.15±3.59#
, 百拇医药
Compared with L-:*p<0.05;Compared with H-:#p<0.05;Compared with H20:Δp<0.05
2.2 肝脏LDL-R结合活性变化
H12和H20组大鼠肝组织匀浆LDL-R结合活性分别较同期低脂对照L12、L20组大鼠降低37.2%和46.3%,呈显著性改变。表明饮食诱导高胆固醇血症肥胖大鼠肝脏LDL-R结合活性降低。干预实验观察到,HEE、HL、HLE组大鼠LDL-R结合活性均值分别较H20组增高21.9%(P=0.0723)、6.3%P>0.05)和53.8%(P<0.01)。表明持续高脂负荷结合运动干预较明显影响高脂负荷时肝LDL-R结合活性;单纯饮食干预并未显示LDL-R结合活性显著增高;运动结合饮食干预则显著增加LDL-R结合活性(见表2)。
表2 肝组织匀浆LDL-R结合活性变化
, 百拇医药
Table 2 Serum cholesterol and low density lipoproteins, specific binding of 125Ⅰ-LDL to liver homogenates (X±S)
Groups
TC
(mmol/L)
LDL-C(mmol/L)
LDL-R
(ng/mg pr.)
(%)
L12(n=6)
, 百拇医药 H12(n=10)
L20(n=6)
H20(n=9)
HHE(n=8)
HL(n=8)
HLE(n=8)
2.18±0.28
4.35±0.73***
2.25±0.33
4.12±1.25**
2.61±0.42##
, http://www.100md.com
2.93±0.63##
3.35±0.63##
0.29±0.04
2.39±0.81***
0.44±0.10
2.68±0.69***
0.99±0.43###
0.58±0.18###
0.42±0.08###
, 百拇医药 627.36±110.84
393.96±119.32***
648.72±78.86
348.48±123.33***
424.79±66.10
370.57±97.25
536.03±110.97##Δ
-37.2
-46.3
+21.9
, 百拇医药
+6.3
+53.8
Compared with L12 and L20:**P<0.01,***P<0.001;Compared with H20:#P<0.05,##P<0.01,###P<0.001;Compared with H20:P=0.0723;Compared with HL:ΔP<0.05;%“-”:Compared with L12 and L20;“+”:Compared with H20
3 讨论
血清LDL-C的摄取与降解主要由肝细胞表面的LDL-R介导实现[3],LDL通过其所含的ApoB-100上的精氨酸和赖氨酸残基携带的正电荷与LDL-R结合,LDL被摄取后,其中的ApoB-100被溶酶体中的蛋白酶水解为氨基酸,胆固醇酯被酯酶水解为游离胆固醇(FC)。LDL-R数目同时又受FC浓度的反馈调节。随LDL-C摄取与降解增多,细胞内FC浓度升高,通过两条途径控制细胞内胆固醇浓度,一为下行调节(down-regulation)减少受体合成数目,摄取LDL-C减少;其次在多个水平抑制3-羟-3甲基戊二酰辅酶A(HMG-CoA)还原酶活性,减少内源性胆固醇的合成。我们的实验观察到12和20高脂膳食诱导肥胖大鼠血清TC、LDL-C水平均较同期普通膳食组显著增高,同时,肝脏LDL-R结合活性明显下降(P<0.001)。这一结果与以往报道一致[8]。其原因是高脂负荷降低了LDL-R活性而阻碍了肝脏对血浆LDL的清除[9]。可能与以下因素有关:(1)LDL-R的饱和与不饱和状态,当血浆LDL水平增加时,受体趋于饱和,其机制是LDL-R通过细胞内FC的下行反馈调节[2];(2)LDL-R基因表达抑制,高脂负荷可通过降低LDL-R mRNA的表达而抑制肝脏LDL-R结合活性[8,10],高胆固醇负荷时细胞可通过转录水平下行调节LDL-R[8],而LDL-R基因转录又受固醇调节的反馈抑制[11]。
, http://www.100md.com
有关运动对血脂水平影响的人体研究表明,运动特别是中等强度的有氧运动可显著增加血清HDL-C,降低TC、LDL-C和ApoB水平。但对遗传性肥胖和高胆固醇血症Zucker大鼠脂代谢的研究显示[12],长期运动训练血清TC降低,而LDL-C水平并无改变。作者认为运动对血脂的影响可能与肝外组织的调节有关。本实验结果表明,有氧耐力运动显著地降低了高胆固醇血症肥胖大鼠TC、LDL-C水平。而血脂水平的改变与肝细胞调节,即运动通过某种途径调节肝细胞LDL-R活性,增加对血清LDL-C摄取有关。本实验结果显示,高胆固醇血症肥胖模型后,单纯有氧运动和有氧运动结合饮食干预均明显提高了肝组织LDL-R结合活性。这一结果尚未见报道。有氧运动提高肝细胞LDL-R活性,增加对血清LDL-C摄取的机制尚不清楚。研究表明,饮食干预治疗高脂血症时首先引起的是LDL-R活性的增高而抑制脏胆固醇合成[9]。但据本实验可以认为,运动对LDL-R的调节过程与单纯饮食治疗高脂血症时由于外源性胆固醇降低,通过下调作用的解除而增加LDL-R合成[9]不完全相同。我们推测,高脂膳食大鼠运动所致LDL-R活性增高可能与以下因素有关:(1)细胞内FC的调节。运动可能通过某种途径增加了肝细胞内胆固醇合成胆酸的排出而降低FC的浓度,通过“氧化固醇-细胞核酸结合蛋白-胆固醇反应性成分系统”的反馈调节[13],使LDL-R基因转录增加,LDL-R结合活性随之增加;(2)其他非细胞内FC因素的影响。如胰岛素可增加LDL-R mRNA的生成[12]和培养细胞的LDL-R活性[14]。耐力运动是否可通过提高肝细胞对胰岛素的敏感性,进而增进LDL-R mRNA的表达,使LDL-R数目增加?其调节的确切机制还不明了。
, 百拇医药
另外,我们还观察到高脂负荷后的不同干预形式对LDL-R的影响存在一定程度上的差异。单纯饮食干预并没有明显影响LDL-R活性,而运动结合饮食干预则具显著影响,二者间还存在显著差异。
*“健力宝”运动医学青年科学研究基金资助。
**北京职工医学院生理教研室。
参考文献
1. 张勇,等.单纯肥胖症脂质代谢紊乱的运动防治Ⅰ.有氧运动对饮食诱导单纯性肥胖大鼠脂蛋白代谢的影响.中国运动医学杂志1998;17(2):117-120
2.Zollner N, Tato F. Fatty acid composition of the diet: impact on serum lipids and atherosclerosis. Clin Invest.1992;10:968-1009
, 百拇医药
3. Browm MS, Goldstein J. A receptor-mediated pathway for cholesterol homoestasis. Science. 1986;232:34-47
4. Bermardis LL, Patterson DB. Correlation between“Lee Indes” and careass fat content in weanling and adult female rats with hypothalamic lesions. J Endocrinol. 1968;40:527-528
5. Schumaker VN.Sequetial fletation ultracentrifugation. Method in Enzyme. 1986:128:155
6. Mcfarlane AS. Efficient trace-labellingof proteins with iodine.Nature. 1958;182:53
, 百拇医药
7. Rudling MJ,Peterson CO.LDL receptors in bovine tissues assayed as the heparin-sensitive binding of 125Ⅰ-labelled in homogenations: relation between in the fetus and post term. Biochim Biophys Acta. 1985;836:96-104
8. 姜传仓,蔡海江,范乐明.高胆固醇血症大鼠 LDL受体与ApoA-ImRNA的水平变化及苯甲酸雌二醇对其的影响.中国病理生理杂志.1995;11(3):234-237
9. Connor WE, Connor SL. Diet, atherosclerosis, and fish oil. Adv Intern Med. 1990;35:139-171
, http://www.100md.com
10. Stone NJ. Diet, lipids and coronary heart disease. Endo Meta Clin Nor Am. 1990;19:321-329
11. Smith VR, Osborne TF, Goldstein JT. et al. Identification of sterol regulatory element in low density lipoprotein receptor gene.J Biol Chem. 1990;265:2306
12. Seelbach JD and Kris-Etheroton PM. Effect of vigorous treadmill exercise on plasma lipoproteins and hepatic lipoprotein production in Zucker rats.Atherosclerosis. 1985;57:53-64
13. 刘国庆.脂蛋白受体脂蛋白代谢酶的现代研究.见蔡海江主编.动脉粥样硬化——基础与临床,南京:江苏科技出版社,1996
14. Young IR, Stout RW. Effects of insulin and glucose on the cells of the arterial wall. Interaction of insulin with dibutyryl cyclic AMP and low density lipoprotein in arterial cells.Diabet Metab. 1987;13:301-306
(1997.06.15收稿), http://www.100md.com
单位:张 勇 (天津体育学院运动医学研究所(300381);颜宜 杨锡让 (北京体育大学人体运动科学系);蔡海江 (南京医科大学动脉粥样硬化研究中心)
关键词:高胆固醇血症;肥胖;肝脏;低密度脂蛋白受体;运动
单纯肥胖症脂质代谢紊乱的运动防治 提要 研究了实验性高胆固醇血症肥胖大鼠肝脏低密度脂蛋白受体(LDL-R)活性变化及有氧运动对LDL-R活性调节的影响。结果显示,12和20周饮食诱导高胆固醇血症肥胖大鼠血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)显著增高,伴随肝组织LDL-R活性显著降低。12周实验模型后,8周有氧运动结合饮食干预,肝脏LDL-R结合活性较同期高脂膳食组提高58.3%(P<0.05),单纯运动干预LDL-R结合活性也有增加趋势(增加21.9%),单纯饮食干预则无明显变化。研究提示:(1)高胆固醇负荷时细胞可通过下行调节影响LDL-R活性;(2)运动可能通过增加对细胞内胆固醇利用和降解,反馈作用于下行调节过程影响LDL-R的合成,增加对LDL-C摄取而改善血脂水平。
, 百拇医药
A Study on Prevention and Treatment of Lipid Metabolism Disorders in Simple
Obesity through Exercise. Part Ⅱ. Effect of Aerobic Exercise on Regulating Activity of
Hepatic LDL-R in Rats with Diet-induced Simple Obesity and Hypercholesterolemia
Zhang Yong, Yan Yicai, Yang Xirang, et al
Tianjin Research Institute of Sports Medicine, Tianjin 300381,China
, 百拇医药
The aim of the pressent study was to determine the effects of exercise on activities of hepatic low density lipoprotein receptor (LDL-R) in experimental obese and hypercholesterolemic rats. Using a specific assay for the binding of 125Ⅰ-LDL receptor to homogenate, the activities of hepatic LDL-R were measured. It was observed that the activity of LDL-R significantly decreased in diet-induced obese and hypercholesterolemic rats after high-cholesterol diet for 12 weeks. The aerobic exercise combined with diet and simple exercise therapy induced the increases in 58.3% and 21.9% of LDL-R activity, respectively, and LDL-R activity was unchanged in the rats with diet alone. These finding suggested:(1)LDL-R activity was regulated downward in cholesterol-loaded rats;(2) Exercise might have a feedback effect on the down-regulated synthesis of LDL-R through an enhanced degradation of intracellular cholesterol, which contributed to a lowering of plasma levels of LDL-C.
, 百拇医药
Key words: hypercholesteremia, obesity, liver, low density lipoprotein receptor, exercise
肥胖作为心血管疾病(CVD)的危险因素,与血脂质代谢紊乱密切相关。高脂肪,特别是饱和脂肪酸(SFA)的过量摄入是促使血清胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)增高,易患CVD的主要原因[1]。在本研究的另一部分实验中我们观察到,饮食诱导高胆固醇血症肥胖大鼠血清TC、LDL和载脂蛋白B-100(ApoB-100)水平墒高,脂质代谢紊乱。而长期有氧运动可明显改善其脂代谢水平,有效控制高胆固醇血症时的致动脉粥样硬化(AS)危险因素[2]。但是,对这些变化的机制还不完全清楚。尤其是与摄取和降解LDL密切相关的肝脏LDL-R途径在这一代谢过程变化中是否有重要的调节作用尚未见报道。肝脏是体内转化胆固醇并将胆固醇排出体外的唯一器官。血清LDL-C的摄取与降解主要由肝细胞表面的LDL受体(LDL-R)介导实现。离体及整体实验均证实,当细胞内胆固醇浓度增加或需要量减少时可下行调节(down-regulation)LDL-R的合成,使受体数目减少,血清胆固醇、LDL-C代谢障碍[3]。为此,我们应用肝组织匀浆125Ⅰ-LDL特异性结合膜滤过法,观察了长期有氧运动及饮食干预对实验性高胆固醇血症肥胖大鼠肝脏LDL-R活性调节的影响,并与所观察到的脂蛋白代谢比较,探讨有氧运动降低TC和LDL的可能机理。
, 百拇医药
1 材料与方法
1.1 饮食诱导高胆固醇血症肥胖大鼠实验动物模型及运动方式和程序
离乳雄性Sprague-Dawley大鼠55只,由国家计生委实验动物中心提供。随机分组,单笼饲养,自由饮水摄食。对照组动物饲以市售标准啮齿饲料(基础、低脂饲料),高脂组动物饲以按配方配制的高脂饲料,含基础饲料76.5%、胆固醇3%、胆酸钠0.5%、酪蛋白10%、猪油10%。实验动物分组如下:(1)高脂血症肥胖实验模型组:普通膳食12周和20周对照组(L12和L20)及高脂膳食12周和20周实验组(H20和H20)。观察肥胖及高血脂症,以确定模型建立。Lee Index(肥胖评定指数)[4]:在每一实验期结束处死动物前后分别准确称量体重和测量鼻肛身长,并按公式计算Lee Indes. Lee Indes=[3体重(g)/身长(cm)]×1000,经统计学处理比较组间Lee Index 均值差异的显著性。(2)运动及饮食干预组:高脂12周+高脂运动8周组(HHE)、高脂12周+低脂8周组(HL)和高脂12周+低脂运动8周组(HLE)。运动方式及程序:采用无负重游泳方式,游泳水温29±2℃。前2周每天运动1小时,每周5天。后6周每天运动增至1.5小时,每周5天。
, 百拇医药
1.2 实验样本处理
在每一实验期结束处死动物前禁食12小时,于安静状态下断头取血液样本,4℃下离心分离血清。取血后迅速取出肝脏,液氮冻存备用,实验前移至-70℃冰箱。
1.3 血清脂质、脂蛋白测定
测试药盒购自上海荣盛生物技术公司。(1)总胆固醇(TC):依POD酶法;(2)低密度脂蛋白(LDL):聚乙稀硫酸(PVC)沉淀法。
1.4 肝组织匀浆LDL-R活性测定
1.4.1 血浆脂蛋白分离及放射标记
新鲜健康人空腹血清用Beckman L8-80型超速离心机,Ti80转头,按序列超速离心法分离脂蛋白各组分[5]。LDL密度为1.019-1.062g/ml。经充分透析和滤菌后,按改良McFarlane氏单氯化碘(ICL)法[6],用无载体Na125I(购至中国科学院原子能研究所)进行标记。125I-LDL放射比活性为90~136cpm/ng。
, 百拇医药
1.4.2 肝组织匀浆制备
按Rudling等[7]方法进行。匀浆解冻后,称肝组织0.4~0.6克(湿重),分别置于含2.4ml Buffer A (50mmol/L Nacl, 1mmol CaCl2/L及20mmol/L Tris-HCl,pH7.5)的5ml塑料试管中,机械匀浆(中速15Sec,随后高速20Sce),用6号针头反复抽打组织匀浆10次,然后经尼龙网(250μm)过滤。以上操作步骤于4℃下进行。
组织匀浆蛋白定量依Lowry氏法。将已测定蛋白含量的组织匀浆置于-70℃贮存备用。
1.4.3 组织匀浆与125Ⅰ-LDL的结合
按Rudlkng等[7]方法进行。组织匀浆解冻后,用6号针头重新反复抽打10次。结合反应于1.5ml聚乙烯塑料管中进行。取组织匀浆蛋白50μl,加入Buffer B(100mmol/L NaCl,0.5mmol CaCl2,50mmol/L Tris-HCl及20mg/ml BSA,pH7.5)950μl,混匀。取已加Buffer B的组织匀浆蛋白两管,每管100μl,一管结合(125Ⅰ-LDL标记)前约20min先加入过量25倍未标记的冷LDL(约13μl),然后两管同时加入20μg/ml 125Ⅰ-LDL,分别为非特异结合和总结合。0℃孵育2小时,将反应混合液加到混合纤维素酯微孔滤膜上,真空抽滤,用25ml缓冲液洗涤滤膜,除去游离125Ⅰ-LDL,然后将滤膜移至聚乙烯塑料试管中,测定125Ⅰ的放射活性(cpm)。
, 百拇医药
滤膜使用前在Buffer C(100mmol/NaCl,0.5mmol CaCl2,50mmol/L Tris-HCl及0.1mg/mlBSA,pH7.5)中浸泡过夜,加预先用0.45μm滤膜滤过的1ml小牛血清于膜上,开始抽滤,随后用2ml Buffer C洗,再将结合反应液加至滤膜上,用25ml Buffer C洗涤滤膜,最后将滤膜小心移至聚乙烯塑料管中,在SN-684放免γ-计数器上测定125Ⅰ的放射活性(cpm)。
125Ⅰ-LDL受体特异结合(cpm)=总结合(cpm)-过量未标记LDL非特异结合(cpm)
125Ⅰ-LDL受体活性经换算以ng/mg pr.表示。
1.5 统计学处理
实验数据用SAS统计软件包处理。结果用
, 百拇医药
2 结果与分析
2.1 大鼠体重和Lee指数、血脂变化
H12和H20组分别较L12和L20组体重增高6%和8%(p>0.05),而Lee Index分别较同期低脂对照组显著性增高(p<0.01)(见表1)。Lee指数是通常采用的实验动物肥胖评定标准,Lee指数与体内脂肪呈显著正相关[4]。H12和H20组血清TC和LDL均较同期对照组显著增高(见表2),即经12周和20周高脂饮食诱导,大鼠呈单纯肥胖并伴随脂质代谢紊乱,出现典型高胆固醇(高LDL)血症。
表1 12周和20周实验期实验动物形态学指标变化
Table 1 Changes of morphonetric data of experimental rats during the period of 12 and 20 weeks (X±SD)
, 百拇医药
Groups(n)
体重 Body Weight(g)
身长 Nasonanal Length (cm)
Lee 指数Lee Indes
L12(n=6)
H12(n=10)
L20(n=6)
H20(n=9)
HHE(n=8)
HL(n=8)
HLE(n=8)
, http://www.100md.com
355.00±79.6
375.45±21.1
395.00±42.3
425.56±66.0
398.75±53.3
365.00±63.9
365.25±45.3Δ
23.08±0.74
22.86±0.93
23.88±0.55
23.42±0.87
, 百拇医药
23.90±0.88
23.18±1.25
23.13±0.64
306.55±6.13
315.43±6.13*
306.77±5.90
320.52±12.9*
307.51±10.8#
307.45±7.33#
306.15±3.59#
, 百拇医药
Compared with L-:*p<0.05;Compared with H-:#p<0.05;Compared with H20:Δp<0.05
2.2 肝脏LDL-R结合活性变化
H12和H20组大鼠肝组织匀浆LDL-R结合活性分别较同期低脂对照L12、L20组大鼠降低37.2%和46.3%,呈显著性改变。表明饮食诱导高胆固醇血症肥胖大鼠肝脏LDL-R结合活性降低。干预实验观察到,HEE、HL、HLE组大鼠LDL-R结合活性均值分别较H20组增高21.9%(P=0.0723)、6.3%P>0.05)和53.8%(P<0.01)。表明持续高脂负荷结合运动干预较明显影响高脂负荷时肝LDL-R结合活性;单纯饮食干预并未显示LDL-R结合活性显著增高;运动结合饮食干预则显著增加LDL-R结合活性(见表2)。
表2 肝组织匀浆LDL-R结合活性变化
, 百拇医药
Table 2 Serum cholesterol and low density lipoproteins, specific binding of 125Ⅰ-LDL to liver homogenates (X±S)
Groups
TC
(mmol/L)
LDL-C(mmol/L)
LDL-R
(ng/mg pr.)
(%)
L12(n=6)
, 百拇医药 H12(n=10)
L20(n=6)
H20(n=9)
HHE(n=8)
HL(n=8)
HLE(n=8)
2.18±0.28
4.35±0.73***
2.25±0.33
4.12±1.25**
2.61±0.42##
, http://www.100md.com
2.93±0.63##
3.35±0.63##
0.29±0.04
2.39±0.81***
0.44±0.10
2.68±0.69***
0.99±0.43###
0.58±0.18###
0.42±0.08###
, 百拇医药 627.36±110.84
393.96±119.32***
648.72±78.86
348.48±123.33***
424.79±66.10
370.57±97.25
536.03±110.97##Δ
-37.2
-46.3
+21.9
, 百拇医药
+6.3
+53.8
Compared with L12 and L20:**P<0.01,***P<0.001;Compared with H20:#P<0.05,##P<0.01,###P<0.001;Compared with H20:P=0.0723;Compared with HL:ΔP<0.05;%“-”:Compared with L12 and L20;“+”:Compared with H20
3 讨论
血清LDL-C的摄取与降解主要由肝细胞表面的LDL-R介导实现[3],LDL通过其所含的ApoB-100上的精氨酸和赖氨酸残基携带的正电荷与LDL-R结合,LDL被摄取后,其中的ApoB-100被溶酶体中的蛋白酶水解为氨基酸,胆固醇酯被酯酶水解为游离胆固醇(FC)。LDL-R数目同时又受FC浓度的反馈调节。随LDL-C摄取与降解增多,细胞内FC浓度升高,通过两条途径控制细胞内胆固醇浓度,一为下行调节(down-regulation)减少受体合成数目,摄取LDL-C减少;其次在多个水平抑制3-羟-3甲基戊二酰辅酶A(HMG-CoA)还原酶活性,减少内源性胆固醇的合成。我们的实验观察到12和20高脂膳食诱导肥胖大鼠血清TC、LDL-C水平均较同期普通膳食组显著增高,同时,肝脏LDL-R结合活性明显下降(P<0.001)。这一结果与以往报道一致[8]。其原因是高脂负荷降低了LDL-R活性而阻碍了肝脏对血浆LDL的清除[9]。可能与以下因素有关:(1)LDL-R的饱和与不饱和状态,当血浆LDL水平增加时,受体趋于饱和,其机制是LDL-R通过细胞内FC的下行反馈调节[2];(2)LDL-R基因表达抑制,高脂负荷可通过降低LDL-R mRNA的表达而抑制肝脏LDL-R结合活性[8,10],高胆固醇负荷时细胞可通过转录水平下行调节LDL-R[8],而LDL-R基因转录又受固醇调节的反馈抑制[11]。
, http://www.100md.com
有关运动对血脂水平影响的人体研究表明,运动特别是中等强度的有氧运动可显著增加血清HDL-C,降低TC、LDL-C和ApoB水平。但对遗传性肥胖和高胆固醇血症Zucker大鼠脂代谢的研究显示[12],长期运动训练血清TC降低,而LDL-C水平并无改变。作者认为运动对血脂的影响可能与肝外组织的调节有关。本实验结果表明,有氧耐力运动显著地降低了高胆固醇血症肥胖大鼠TC、LDL-C水平。而血脂水平的改变与肝细胞调节,即运动通过某种途径调节肝细胞LDL-R活性,增加对血清LDL-C摄取有关。本实验结果显示,高胆固醇血症肥胖模型后,单纯有氧运动和有氧运动结合饮食干预均明显提高了肝组织LDL-R结合活性。这一结果尚未见报道。有氧运动提高肝细胞LDL-R活性,增加对血清LDL-C摄取的机制尚不清楚。研究表明,饮食干预治疗高脂血症时首先引起的是LDL-R活性的增高而抑制脏胆固醇合成[9]。但据本实验可以认为,运动对LDL-R的调节过程与单纯饮食治疗高脂血症时由于外源性胆固醇降低,通过下调作用的解除而增加LDL-R合成[9]不完全相同。我们推测,高脂膳食大鼠运动所致LDL-R活性增高可能与以下因素有关:(1)细胞内FC的调节。运动可能通过某种途径增加了肝细胞内胆固醇合成胆酸的排出而降低FC的浓度,通过“氧化固醇-细胞核酸结合蛋白-胆固醇反应性成分系统”的反馈调节[13],使LDL-R基因转录增加,LDL-R结合活性随之增加;(2)其他非细胞内FC因素的影响。如胰岛素可增加LDL-R mRNA的生成[12]和培养细胞的LDL-R活性[14]。耐力运动是否可通过提高肝细胞对胰岛素的敏感性,进而增进LDL-R mRNA的表达,使LDL-R数目增加?其调节的确切机制还不明了。
, 百拇医药
另外,我们还观察到高脂负荷后的不同干预形式对LDL-R的影响存在一定程度上的差异。单纯饮食干预并没有明显影响LDL-R活性,而运动结合饮食干预则具显著影响,二者间还存在显著差异。
*“健力宝”运动医学青年科学研究基金资助。
**北京职工医学院生理教研室。
参考文献
1. 张勇,等.单纯肥胖症脂质代谢紊乱的运动防治Ⅰ.有氧运动对饮食诱导单纯性肥胖大鼠脂蛋白代谢的影响.中国运动医学杂志1998;17(2):117-120
2.Zollner N, Tato F. Fatty acid composition of the diet: impact on serum lipids and atherosclerosis. Clin Invest.1992;10:968-1009
, 百拇医药
3. Browm MS, Goldstein J. A receptor-mediated pathway for cholesterol homoestasis. Science. 1986;232:34-47
4. Bermardis LL, Patterson DB. Correlation between“Lee Indes” and careass fat content in weanling and adult female rats with hypothalamic lesions. J Endocrinol. 1968;40:527-528
5. Schumaker VN.Sequetial fletation ultracentrifugation. Method in Enzyme. 1986:128:155
6. Mcfarlane AS. Efficient trace-labellingof proteins with iodine.Nature. 1958;182:53
, 百拇医药
7. Rudling MJ,Peterson CO.LDL receptors in bovine tissues assayed as the heparin-sensitive binding of 125Ⅰ-labelled in homogenations: relation between in the fetus and post term. Biochim Biophys Acta. 1985;836:96-104
8. 姜传仓,蔡海江,范乐明.高胆固醇血症大鼠 LDL受体与ApoA-ImRNA的水平变化及苯甲酸雌二醇对其的影响.中国病理生理杂志.1995;11(3):234-237
9. Connor WE, Connor SL. Diet, atherosclerosis, and fish oil. Adv Intern Med. 1990;35:139-171
, http://www.100md.com
10. Stone NJ. Diet, lipids and coronary heart disease. Endo Meta Clin Nor Am. 1990;19:321-329
11. Smith VR, Osborne TF, Goldstein JT. et al. Identification of sterol regulatory element in low density lipoprotein receptor gene.J Biol Chem. 1990;265:2306
12. Seelbach JD and Kris-Etheroton PM. Effect of vigorous treadmill exercise on plasma lipoproteins and hepatic lipoprotein production in Zucker rats.Atherosclerosis. 1985;57:53-64
13. 刘国庆.脂蛋白受体脂蛋白代谢酶的现代研究.见蔡海江主编.动脉粥样硬化——基础与临床,南京:江苏科技出版社,1996
14. Young IR, Stout RW. Effects of insulin and glucose on the cells of the arterial wall. Interaction of insulin with dibutyryl cyclic AMP and low density lipoprotein in arterial cells.Diabet Metab. 1987;13:301-306
(1997.06.15收稿), http://www.100md.com